واکنش اکسایش کاهش (ردوکس) – به زبان ساده
کاربردهای واکنش اکسایش کاهش را میتوان از گذشتههای بسیار دور و در اولین استفادههای انسان از آهن جستجو کرد. در حقیقت، فلزی که انسان برای ساخت ابزارها از آن استفاده میکرد، از طریق حرارت دادن سنگ معدنهای مس و آهن همچون کوپریت و هماتیت با فرمولهای و در حضور کربن بدست میآمد.
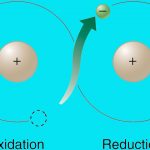
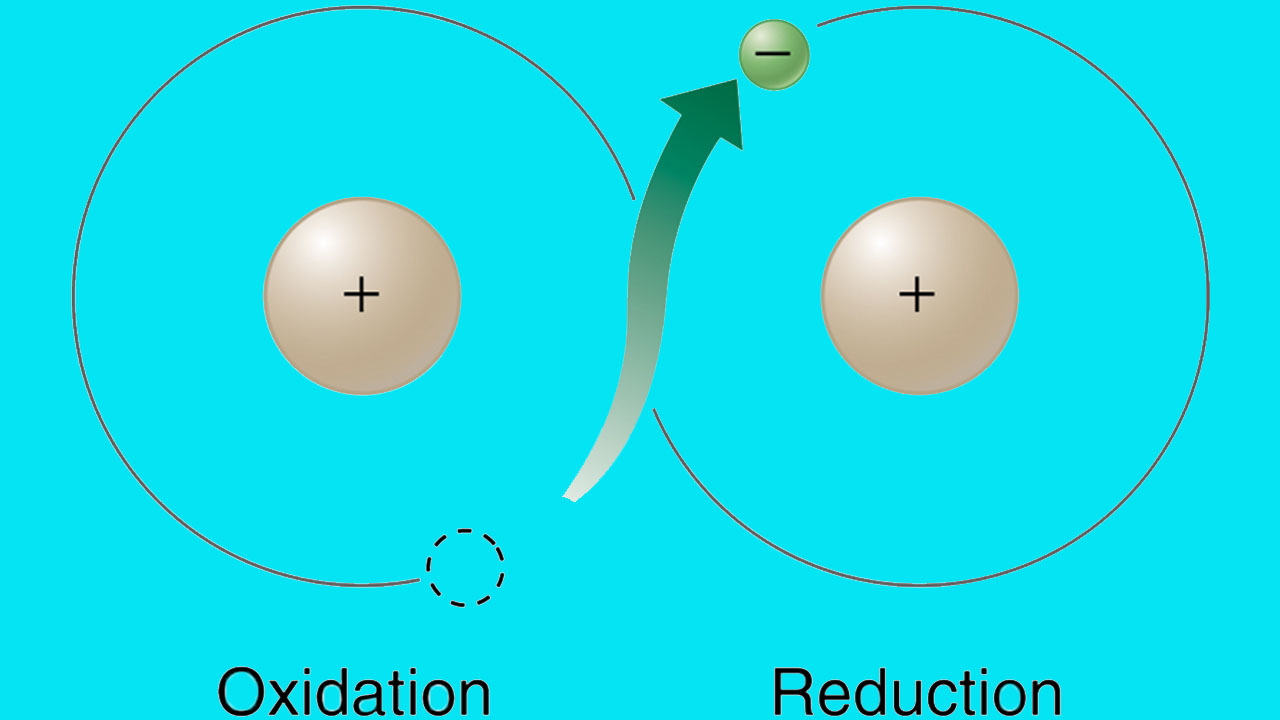
مقدمه
از زمانهای گذشته، آهن، بیشترین کاربرد را در میان فلزات داشته است و به طور عمده از طریق حرارت دادن هماتیت در حضور کربن و به کمک «کورههای بلند» (Blast Furnace) به تولید میرسید. واکنش سادهشده برای این فرآیند در زیر آورده شده است:
در واکنش بالا، میتوان اینگونه فرض کرد که گاز مونواکسید کربن، اکسیژن را از هماتیت میگیرد تا دیاکسید کربن و آهن تولید کند. واکنشی که در آن یک ماده، اتم اکسیژن جذب میکند موسوم به واکنش اکسایش است.
به همین شکل، واکنشی که در آن، مادهای اکسیژن از دست میدهد را کاهش مینامند. در واکنش بالا، مونواکسید کربن اکسایش و هماتیت کاهش پیدا میکنند. اکسایش و کاهش باید همواره همزمان اتفاق بیافتند و به چنین واکنشهایی، واکنش اکسایش کاهش یا ردوکس میگویند.

اکسیژن موجود در هماتیت را میتوان به کمک شعلهور ساختن مخلوط خرد شده هماتیت و آلومینیوم نیز حذف کرد. این واکنش به صورت انفجاری رخ میدهد و گرمای بسیار زیادی آزاد میکند که موجب ذوب شدن آهن میشود. از این نوع واکنش برای تولید آهن مذاب در جوشکاری ریلهای راهآهن بهره میگیرند.
محدودیتهای تعریف ساده واکنش اکسایش کاهش
تعریف واکنش اکسایش و کاهش به کمک انتقال اتم اکسیژن، با محدودیت همراه است و نیاز به تعریفی گستردهتر داریم. با استفاده از تعریفی گستردهتر، بسیاری از واکنشها در محلولهای آبی را حتی زمانی که اکسیژنی وجود ندارد، میتوان به صورت واکنش اکسایش کاهش توصیف کرد.
تغییر در عدد اکسایش
فرض کنید که معادله واکنش قبل را دوباره بنویسیم و اینبار، عدد اکسایش هر عنصر را در دو طرف معادله یادداشت کنیم.
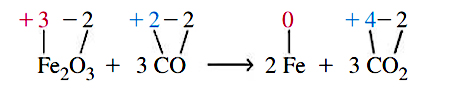
ملاحظه میکنید که عدد اکسایش اکسیژن در هر دو طرف این واکنش برابر با است اما عدد اکسایش تغییر میکند و از به صفر میرسد. همچنین، عدد اکسایش کربن نیز عوض میشود و از به میرسد. در نتیجه میتوانیم واکنش اکسایش کاهش را به صورت تغییر در عدد اکسایش بیان کنیم. با این تعریف، در یک فرآیند اکسایش، عدد اکسایش برخی عناصر افزایش مییابند و در واکنشهای کاهشی، شاهد کاهش عدد اکسایش خواهیم بود.
با وجود اینکه واکنش اکسایش کاهش را به تغییر عدد اکسایش یک عنصر نسبت میدهیم، اما یک واکنش اکسایش و کاهش، شامل تمامی اجزای شرکتکننده در واکنش میشود. بنابراین، در واکنش بالا، کل ترکیب کاهش مییابد، نه فقط عنصر آهن و به همین شکل، کل اکسید خواهد شد.
مثال
نشان دهید کدامیک از واکنشهای زیر نوعی از واکنش اکسایش کاهش است.
واکنش اول: عدد اکسایش منگنز از به کاهش پیدا میکند. در نتیجه به کاهش مییابد. عدد اکسایش اکسیژن نیز در طول واکنش، و به همین شکل، عدد اکسایش هیدروژن، باقی میماند. عدد اکسایش برای کلر از به صفر افزایش پیدا میکند و در نتیجه، به اکسید میشود. واکنش اول، از نوع واکنش اکسایش کاهش است.
واکنش دوم: عدد اکسایش هیدروژن در هر دو طرف واکنش، مقداری برابر با دارد و این عدد برای اکسیژن نیز به طور ثابت، برابر با است. همچنین، با بررسی این عدد برای فسفر، میبینیم که در هر دو طرف، این عدد مقداری برابر با دارد. در نتیجه، در کل واکنش دوم، تغییری در عدد اکسایش نمیبینیم و این واکنش از نوع واکنش اکسایش کاهش نیست و در حقیقت، نوعی واکنش اسید و باز به شمار میآید.
نتیجهگیری
از آنجایی که بسیاری از واکنشهای اکسایش کاهش (ردوکس) شامل و یا ترکیبات یونی نامحلول هستند، به سادگی ممکن است واکنش اکسایش کاهش را با یک واکنش اسید و باز یا تشکیل رسوب اشتباه بگیریم. برای جلوگیری از این اشتباه باید تعریف هر واکنش را به خوبی بلد باشیم. واکنش رسوبی عبارتست از ترکیب یونها در محلول، برای تولید یک رسوب نامحلول. واکنش اسید و باز شامل انتقال پروتون است درحالیکه انتقال الکترون و تغییر عدد اکسایش را در واکنش اکسایش کاهش خواهیم داشت.
واکنش اکسایش کاهش و نیمواکنشها
واکنشی که در تصویر زیر نشان داده شده ، نوعی از واکنش اکسایش کاهش است. واکنش شیمیایی آن را در پایین ملاحظه میکنید:
با بررسی عدد اکسایش میتوانیم نشان دهیم که واکنش بالا به عنوان نوعی از واکنشهای اکسایش کاهش شناخته میشود اما یک راه کاربردی نیز برای این کار وجود دارد. فرض کنید که این واکنش، شامل دو «نیمواکنش» (Half-Reaction) باشد به گونهای که هر دو واکنش اکسایش و کاهش در یک زمان انجام شوند. واکنش کلی، مجموع دو نیمواکنش است. نیمواکنشهای اکسایش و کاهش و واکنش کلی را میتوان به صورت زیر نشان داد:
نیمواکنش اکسایش:
نیمواکنش کاهش:
واکنش کلی:
در نیمواکنش اکسایش، اکسید میشود. عدد اکسایش آن از به افزایش پیدا میکند. این تغییر متناظر با از دست دادن دو الکترون از هر اتم روی است. در نیمواکنش کاهش، کاهش مییابد و عدد اکسایش آن از به صفر میرسد. این تغییر، متناظر با اضافه شدن دو الکترون به یون است. در نتیجه، برای جمعبندی مطالب گفته شده خواهیم داشت:
- اکسایش (اکسیداسیون)، فرآیندی است که در آن، عدد اکسایش برخی از عناصر با از دست دادن الکترون، افزایش مییابد. در واکنشهای اکسایش، الکترونها در طرف راست نیمواکنش ظاهر میشوند.
- کاهش (احیا)، فرآیندی است که عدد اکسایش عناصر با گرفتن الکترون، کاهش مییابد. الکترونها نیز در طرف چپ نیمواکنشها ظاهر میشوند.
- نیمواکنشهای اکسایش کاهش باید همزمان اتفاق بیافتند و تعداد کل الکترونها در اکسیداسیون باید با تعداد کل الکترونها در کاهش برابر باشند.

واکنش اکسایش کاهش (ردوکس) با واکنش اسید و باز، در انتقال یک ذره اساسی و کوچک مشترک هستند. در واکنش اسید و باز، پروتونها و در واکنش اکسایش کاهش، الکترونها انتقال پیدا میکنند. البته واکنشهای اسید و باز را به راحتی میتوان تشخیص داد چراکه اتمهای هیدروژن و پروتون به طور صریح در معادله موازنه شده نوشته میشوند. اما تعیین واکنش اکسایش کاهش بسیار دشوارتر خواهد بود چراکه الکترونها مخفی هستند. زمانی که نیمواکنشها را برای واکنش اکسایش کاهش مینویسیم، الکترونها به طور صریح نمایش داده میشوند و ویژگی اصلی واکنش اکسایش کاهش، یعنی انتقال الکترونها به چشم میآید.
اکسایش و کاهش آب و الکترولیز
الکترولیز آب به فرآیند تجزیه آب به گازهای هیدروژن و اکسیژن از طریق عبور یک جریان الکتریکی میگویند.
واکنش اکسایش و کاهش آب
در آب خالص، در بخش کاتد با بار منفی، کاهش رخ میدهد که در آن، الکترون کاتد به کاتیون هیدروژن داده میشود تا گاز هیدروژن را تشکیل دهد که نیمواکنش موازنهشده آن به صورت زیر است:
در بخش آند با بار مثبت، واکنش اکسایش رخ میدهد که در نهایت به آند، الکترون داده خواهد شد و گاز اکسیژن آزاد میشود و واکنش آن در زیر آورده شده است:
در نهایت، واکنش کلی به صورت زیر نوشته خواهد شد:
اگر مطلب بالا برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- قانون هس — به زبان ساده
- اکسیژن چیست؟ — از صفر تا صد
^^













بسیار روان و خوب توضیح دادید خیلی ممنون از سایت فرادرس
همه واکنش های سوختن با اکسیژن اکسایش_ کاهش است
خیلی مفید بود ممنون، ولی کاش یه بخشی رو به مطالب اضافه کنید که بگه پیش نیاز مطالعه این مقاله چی هست، مثلا برای فهم این مطلب اول باید عدد اکسایش رو فهمید.❤
بسیار روان و خوب توصیح داده شده بود واقعا ممنونم 🙂
من این معادلات اصلا متوجه نمیشم و دارم یه مقاله مینویسم که خیلی به اینا نیاز دارم