میکروتوبول چیست – به زبان ساده + ساختار و وظیفه پروتئین های اسکلت سلولی
هسته، غشای پلاسمایی و سیتوپلاسم سه بخش اصلی سلولهای یوکاریوتی است. هسته از غشای دو لایه لیپیدی تشکیل شده است که ماده ژنتیکی سلول را از سیتوپلاسم جدا میکند. ساختار کلی غشای هسته شبیه غشای پلاسمایی سلول است اما پروتئینهای متفاوتی دارد. هسته محل همانندسازی و رونویسی DNA است. غشای پلاسمی بخشی که محتویان داخل سلول را از محیط اطراف جدا میکند. ساختار اصلی غشا از دو لایه فسفولیپید تشکیل شده است که ناقلهای پروتئینی و گیرندههای انتقال پیام بین آنها قرار میگیرند. سیتوپلاسم مادهای ژلهای از نمک، آب و ترکیبات آلی است و فضای بین غشای پلاسمایی و هسته را پر میکند. اندامکها و اسکلت سلولی در این بخش قرار دارند. شبکه اندوپلاسمی، میتوکندری، دستگاه گلژی، لیزوزوم و ریبوزومها اندامکهای سلولی هستند. وظیفه اندامکها سنتز مواد آلی و تولید انرژی است. اسکلت سلولی ساختاری پروتئینی است که وظیفه شکل سلول را تعیین میکند. میکروتوبول یکی از رشتههای پروتئینی اسکلت سلولی است.


میکروتوبولها ساختارهای استوانهای توخالی هستند که پروتئینهای کروی تشکیل میشوند. این فیلامنتهای اسکلت سلولی در حرکت وزیکولهای سیتوپلاسمی بین اندامکها، تشکیل دوک تقسیم، حرکت تاژک و مژکهای یوکاریوتی نقش دارند. در ابتدای این مطلب از مجله فرادرس نحوه سازمانیافتگی میکروتوبول ها و نقش آنها در سلول را بررسی میکنیم و در ادامه ساختار پروتئینهای دیگر اسکلت سلولی را توضیح میدهیم.
میکروتوبول چیست؟
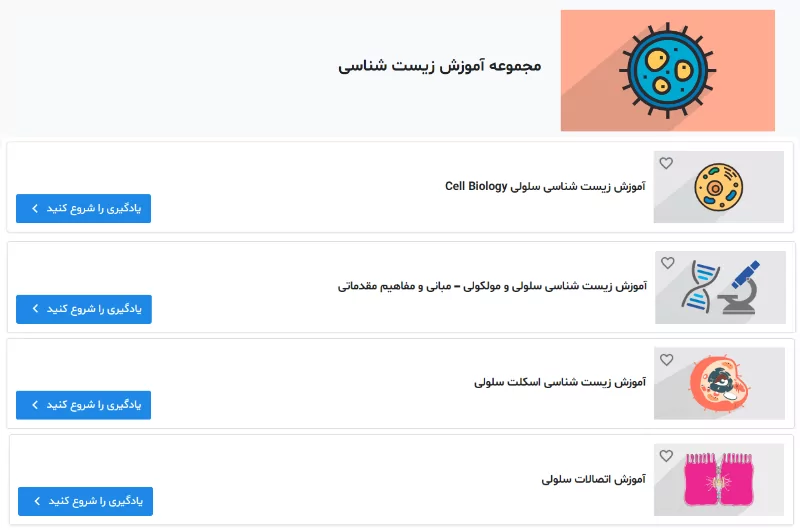
میکروتوبولها رشتههای لولهای شکل اسکلت سلولی با قطری حدود ۲۵ نانومتر هستند. این رشتهها از زیرواحدهای پروتئینی به نام توبولین تشکیل شدهاند. توبولینها از زیرواحدهای تقریبا شبیه هم آلفا و بتا توبولین تشکیل میشود. رشتههای میکروتوبول بخشی از اسکلت سلولی هستند و به حرکت سلول، تقسیم سلولی و انتقال وزیکولها بین اندامکها کمک میکنند. برای تشکیل فیلامنتهای میکروتوبول، توبولینها کنار هم قرار میگیرند و رشتههای پروتوفیلامنت خطی ایجاد میکنند. ۱۳ پروتوفیلامنت کنار هم قرار میگیرند و استوانهای توخالی ایجاد میکنند که به آن فیلامنت میکروتوبول گفته میشود.
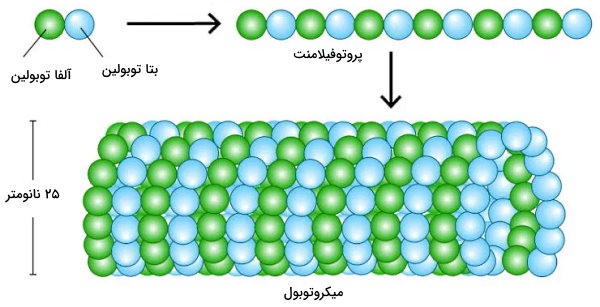
میکروتوبولها یک انتهای مثبت و یک انتهای منفی دارند. به همین دلیل به آنها رشتههای قطبی گفته میشود. سرعت اضافه شدن دیمرهای توبولین به انتهای مثبت زیاد و به انتهای منفی کم است. انتهای منفی میکروتوبولها در «مرکز سازماندهی میکروتوبول» (Microtubule Organizing Centers | MTOCs) قرار دارد. در هر زیرواحد توبولین جایگاه اتصال یک GTP است. GTP متصل به بتا توبولین در حین پلیمریزاسیون یا کمی پس از آن به GDP هیدرولیز میشود. هیدرولیز GTP منجر به تغییر کنفورماسین بتا توبولین و کاهش تمایل آن به آلفا توبولین میشود. در نتیجه آلفا و بتا توبولین از هم و از میکروتوبول جدا میشوند. GTP-توبولینها به انتهای مثبت اضافه میشود و GDP-توبولینها از انتهای منفی جدا میشوند. اگر سرعت اضافه شدن GTP-توبولینها به انتهای مثبت بیشتر باشد طول میکروتوبول افزایش مییابد.
سانتروزوم چیست؟
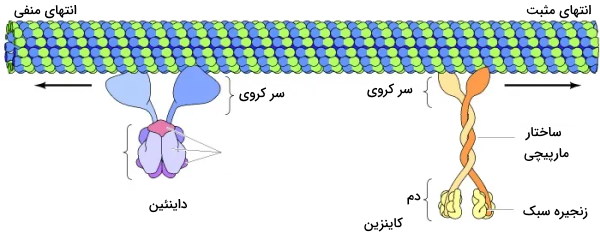
سانتروزوم مرکز سازماندهی میکروتوبولها در سلولهای جانوری است که در اینترفاز چرخه سلولی کنار هسته قرار دارد. هر سانتروزوم از دو سانتریول عمود بر هم و گاما توبولینها تشکیل میشود. از کنار هم قرار گرفتن گاما توبولینها حلقهای تشکیل میشود که هسته اولیه تشکیل فیلامنتهای میکروتوبول است.
پروتئین های همراه میکروتوبول
پایداری میکروتوبولها در سلول بهوسیله دخالت پروتئینهای دیگر تغییر میکند. «پروتئینهای همراه میکروتوبول» (Microtubule-Associated Proteins | MAPs) گروهی از پروتئینهای سیتوپلاسمی هستند که به میکروتوبول متصل میشوند و پایداری آن را افزایش میدهند. افزایش پایداری میکروتوبولها به حفظ شکل و قطبیت آنها کمک میکند. فعالیت MAPs بهوسیله کینازها کنترل میشود. کینازها با اضافه کردن گروههای فسفات به MAPs این پروتئينها را از میکروتوبول جدا میکنند. tau یکی از پروتئینهای همراه میکروتوبول در آکسون نورونها است. این پروتئین رشد میکروتوبولها را افزایش میدهد و میکروتوبولها را به هم متصل میکند. در بیماری آلزایمر پروتئینهای tau از میکروتوبولها جدا میشود و تودههای پروتئینی تشکیل میدهد.
موتور پروتئینهای میکروتوبول چیست؟
میکروتوبولها در حرکت سلولها، حرکت وزیکولها، حرکت اندامکها در سیتوپلاسم، حرکت کروموزومها در میتوز و حرکت مژک و تاژک نقش دارند. اما حرکت میکروتوبولها به موتورپروتئینها وابسته است. موتور پروتئینها با هیدرولیز ATP انرژی لازم برای حرکات سلولی را فراهم میکنند. کاینزینها و دانئینها دو گروه اصلی موتورپروتئینها هستند.
- داینئین: داینئین پروتئین بسیار بزرگی است که از دو یا سه زنجیره سنگین و تعداد زیادی زنجیره سبک و حدواسط تشکیل شده است. زنجیره سنگین اسن پروتئین ساختار کروی تشکیل میدهد که جایگاه اتصال و هیدرولیز ATP است. این پروتئینها در جهت انتهای منفی پروتئینها حرکت میکنند. انتهای منفی میکروتوبولها نزدیک سانتروزوم و سانتروزوم نزدیک هسته است. در نتیجه داینئینها وزیکولها و اندامکها را در جهت هسته حرکت میدهند.
- کاینزین: کاینزین از دو زنجیره سنگین و دو زنجیره سبک تشکیل شده است. زنجیرههای سنگین این مولکول از آلفا هلیکسهایی تشکیل شده است که دور هم میپیچند و «ساختار مارپیچی» (Coiled-Coil) تشکیل میدهند. در انتهای این مارپیج سر کروی قرار دارد. این بخش انتهای آمینی کاینزین جایگاه ATPase مولکول است. زنجیرههای سبک دم این مولکول را تشکیل میدهند. این بخش به عناصری متصل میشود که روی میکروتوبول حرکت میکنند. این پروتئینها در جهت انتهای مثبت میکروتوبول حرکت میکنند. انتهای مثبت میکروتوبولها به سمت غشای سلولی است. در نتیجه کاینزینها وزیکولها و اندامکها را از مرکز سلول دور میکند.
میکروتوبول سانتریول
سانتریولها دو ساختار استوانهای شکل تو خالی کنار هسته سلولهای جانوری هستند. قطر سانتریولها حدود ۲۵۰ و طول آنها حدود ۵۰۰ نانومتر است. شکل کلی این ساختارهای را میتوان زیر میکروسکوپ نوری مشاهده کرد اما برررسی دقیق آنها نیاز به میکروسکوپ الکترونی دارد. از ۹ فیلامنت سهزیرواحدی میکروتوبول (A و B و C) تشکیل شدهاند. میکروتوبول A سمت مرکز سانتریول، میکورتوبول C در لبه خارجی و میکروتوبول B بین میکورتوبول A و C قرار دارد.
میکروتوبول A یک حلقه کامل تشکیل می دهد و از ۱۳ پروتوفیلامنت تشکیل شده است. اما میکروتوبولهای A و C کامل نیستند و چند پروتوفیلامنت آنها با زیرواحد کناری مشترک است. میکروتوبولهای C بهوسیله پروتئینها به میکروتوبولهای A کناری متصل میشود. داخل استوانه سانتریول یک داربست پروتئینی وجود دارد. این داربست شبیه چرخ با پروتئین میلهای مرکزی و پروتئینهای شعاعی است که به پروتئینهای A متصل میشود.
میکروتوبول تاژک
تاژک ساختاری است که به حرکت سلولهای پروکاریوتی و یوکاریوتی کمک میکند. تاژک پروکاریوتها از زیرواحدهای پروتئینی فلاژلین و تاژک یوکاریوتها از میکروتوبول تشکیل شده است. تاژک یوکاریوتها از جسم پایه و آکسونم تشکیل شده است. جسم پایه در سیتوپلاسم سلول قرار دارد و از سانتریولها تشکیل شده است. آکسونما بخش خارجی و متحرک تاژک است که از یک لایه غشای پلاسمایی، سیتوپلاسم و اسکلت پروتئینی تشکیل میشود. در غشای آکسونما تعداد زیادی گیرنده پروتئینی وجود دارد که با مولکولهای اطراف برهمکنش میدهد و به حرکت تاژک کمک میکند.
اسکلت داخلی تاژک یوکاریوتها از ۹ فیلامنت دوزیرواحدی میکروتوبولها (A و B) تشکیل شده است. میکروتوبول A این ساختار حلقهای کامل از ۱۳ پروتوفیلامنت است. اما میکروتوبول B کامل نیست و چند پروتوفیلامنت مشترک با میکروتوبول A دارد. میکروتوبولهای A بهوسیله پروتئینهای «نکسین» (Nexin) به میکروتوبولهای B متصل میشوند. پروتئینهای داینئین که بین میکروتوبولهای A و B قرار دارد به حرکت میکروتوبولها و تاژک کمک میکند. سر داینئینها به میکروتوبول B و انتهای آن به میکروتوبولهای A متصل میشود. در مرکز این ساختار دو رشته میکروتوبولی کامل وجود دارد که بهوسیله پروتئینها به هم وصل میشوند. پروتئینهای شعاعی میکروتوبولهای مرکزی را به میکروتوبولهای A متصل میکنند.
میکروتوبول های دوک
در این بخش از مطلب قصد داریم آرایش میکروتوبولها در زمان تقسیم میتوز و میوز و نقش آنها در جدا شدن کروموزومها را توضیح دهیم. اما تشکیل دوک و جدا شدن کروموزومها تنها اتفاق تقسیم سلولی نیست. اگر به اطلاعات بیشتری در مورد تقسیم سلولی و مراحل آن نیاز دارید، مشاهده فیلمهای آموزشی فرادرس که در رابطه با این مباحث تهیه شده است، به شما پیشنهاد میشود.
- فیلم آموزش چرخه سلولی و مسیرهای پیام رسانی سلول فرادرس
- فیلم آموزش تقسیم سلولی، چرخه سلولی، میتوز و میوز در زیست شناسی رایگان فرادرس
دوک تقسیم ساختاری میکروتوبولی است که در تقسیم سلولی به قرار گرفتن کروموزومها در مرکز سلول و جدا شدن آنها از هم کمک میکند. در اینترفاز چرخه سلولی یک نسخه جدید از سانتروزومها تشکیل میشود که تا شروع میتوز کنار هم قرار دارند. با شروع میتوز دو سانتروزوم از هم جدا میشوند و در قطبهای سلول قرار میگیرند. به علاوه میکروتوبولهای اسکلت سلولی به زیرواحدهای توبولین تبدلیل میشوند و این زیرواحدها در ساختار دوک تقسیم شرکت میکنند. دوک تقسیم بین دو سانتروزوم سلول تشکیل میشود.
در اولین مرحله تشکیل دوک تقسیم ساختار ستارهای در اطراف سانتروزومها تشکیل میشود که مرکز آن سانتروزوم و شعاعهای آن رشتههای میکروتوبول است. رشتههای کینهتوکوری، رشتههای قطبی و رشتههای ستارهای میکروتوبولهای هستند که از سانتروزومها خارج میشود. رشتههای کینهتوکوری و رشتههای قطبی در تشکیل دوک تقسیم شرکت میکنند. رشتههای کینهتوکوری به پروتئینهای کینهتوکور در سانترومر کروموزومهای متصل میشوند. رشتههای قطبی به کروموزومها متصل نمیشوند. دو رشته قطبی که از سانتروزومهای دو قطب خارج میشوند با هم همپوشانی دارند. رشتههای ستاره از سانترومر به سمت غشای سلولی تشکیل میشوند.
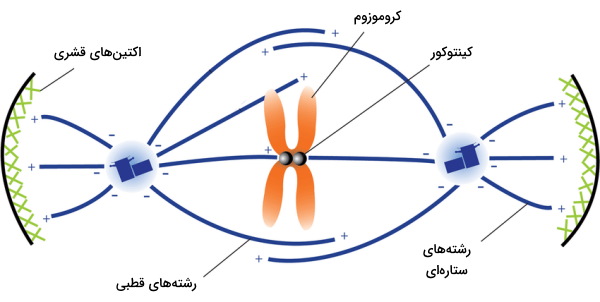
کروموزومها آنافاز با حرکت میکروتوبولهای دوک تقسیم از هم جدا میشوند. ابتدا کروموزومها بهوسیله پروتئینهای داینئین به سمت منفی میکروتوبول حرکت میکنند. همزمان با حرکت کروموزومها، طول رشتههای کینهتوکور کاهش مییابد. در ادامه با افزایش طول رشتههای قطبی، سانتروزومها از هم جدا میشوند. حرکت کاینزینها روی بخشی از رشتههای قطبی که همپوشانی دارند به جدا شدن سانتروزومها کمک میکند.
سایر رشته های اسکلت سلولی
اسکلت سلولی ساختاری از پروتئینهای رشتهای در سلولهای یوکاریوتی است. این ساختار داربستی برای سازماندهی اندامکها ایجاد میکند و در تعیین شکل، حرکت سلولها و حرکت وزیکولهای سیتوپلاسمی بین اندامکها نقش دارد. اسکلت سلولی ساختاری پویا است و آرایش رشتههای پروتئینی آن بر اساس نیاز سلول تغییر میکند. میکروتوبول ها یکی از فیلامنتهای اسکلت سلولی هستند که در بخشهای قبلی بررسی کردیم. اکتینها و رشتههای حدواسط پروتئینهای دیگر اسکلت سلولی هستند که در انتقال وزیکولهای بین اندامکها و حفظ ساختار سلول نقش دارند. این رشتهها بهوسیله پروتئینهای مختلف به غشای پلاسمایی متصل میشوند. اگر به یادگیری بیشتر در مورد اجزا، ساختار و عملکرد اسکلت سلولی علاقه دارید، دیدن فیلم آموزش اسکلت سلولی فرادرس به شما پیشنهاد میشود.
فیلامنت اکتین
فیلامنتهای اکتین از پلیمریزاسیون پروتئینهای اکتین کروی (G-اکتین) تشکیل میشود. قطر این رشتهها حدود ۷ نانومتر و طول آنها چند میکرومتر است. این رشتهها شبکهای زیر غشای پلاسمایی تشکیل میدهند که افزایش پایداری سلول در برابر فشارهای مکانیکی، حرکت سلول و حفظ شکل سلول کمک میکند. در هر G-اکتین از دو جایگاه اتصال به G-اکتینهای دیگر و یک جایگاه اتصال به ATP وجود دارد. زیرواحدهای G-اکتین با زاویه حدود ۱۶۶ درجه کنار هم قرار میگیرند. به همین دلیل فیلامنت اکتین شکل مارپیچی دارد. رشتههای اکتین مثل میکروتوبول دو قطبی است و سرعت اضافه شدن زیرواحدهای G-اکتین به سر مثبت آن بیشتر از سر منفی آن است. G-اکتین-ATP به انتهای مثبت اضافه و G-اکتین-ADP از انتهای منفی جدا میشود.
پروتئینهای اتصالی اکتین اتصال و جدا شدن G-اکتینها را تنظیم میکنند. کوفیلین، پروفیلین و APR2/3 سه پروتئین اتصالی به امتین هستند. کوفیلین سرعت جدا شدن G-اکتینها از انتهای منفی را افزایش میدهد. پروفیلین جدا شدن ADP از G-اکتین را تحریک میکند. در نتیجه G-اکتین-ATP بیشتری برای تشکیل فیلامنتها در سلول وجود دارد. پروتئین APR2/3 هسته اولیه فیلامنتهای اکتین را تشکیل میدهد. فیلامنتهای اکتین در سلول ساختارهای سهبعدی «دستهای» (Bundles) و شبکهای تشکیل میدهند.
- ساختار دستهای: در بعضی از ساختارهای دستهای فیلامنتهای اکتین موازی و با فاصله کم کنار هم قرار میگیرند. انتهای مثبت و منفی فیلامنتها در این ساختار همجهت است. F-اکتینها به وسیله پروتئینهای اتصالی به اکتین ازجمله فیمبرین به هم متصل میشوند. این دستهها اسکلت سلولی بیرونزدگیهای غشای پلاسمایی ازجمله میکروویلیها را تشکیل میدهند. اما در بعضی از ساختارهای دستهای بین فیلامنتهای اکتین فاصله بیشتری وجود دارد. فیلامنتها در این ساختار بهوسیله دیمرهای پروتئین آلفا اکتینین به هم متصل میشوند. اندازه بزرگتر این پروتئین سبب افزایش فاصله بین رشتههای اکتین میشود. دستههای اکتین حلقه انقباضی میتوز از این نوع است. فاصله زیاد بین فیلامنتها در این ساختار فضای کافی برای حرکت موتور پروتئینهای میوزین را فراهم میکند.
- ساختار شبکهای: در ساختارهای شبکهای فیلامنتهای اکتین بهوسیله پروتئینهای بزرگ ازجمله فیلامین کنار هم قرار میگیرند. فیلامین یکی از پروتئینهای اتصالی به اکتین است که در تشکیل شبکههای اکتینی نقش دارد. دیمرهای این پروتئین ساختار V شکلی تشکیل میدهند که اکتینها را با زاویه قائمه به هم متصل میکنند.
اتصال اکتین به غشای پلاسمایی
رشتههای اکتین شبکهای پروتئینی زیر غشای پلاسمایی سلول تشکیل میدهند. این شبکه نقش مهمی در شکل و حرکت سلول دارد. گلبولهای قرمز کی از بهترین نمونهها برای بررسی اتصال شبکه اکتینی به غشای پلاسمایی است. هسته و سایر اندامکها در این سلولها وجود ندارد و اسکلت سلولی آنها فقط از فیلامنتهای اکتین تشکیل شده است. اسپکترین یکی از پروتئینهایی است که اکتینهای اسکلت سلولی گلبولهای قرمز را به غشای پلاسمایی متصل میکند. این پروتئین تترامری است که از دو زنجیره آلفا و دو زنجیره بتا تشکیل میشود.
آنکرین یکی دیگر از پروتئینهای اسکلت سلولی گلبول قرمز است. این پروتئین به اسپکترین و پروتئین باند۳ در غشای اریتروسیتها متصل میشود. پروتئین ۴٫۱ یکی دیگر از پروتئينهای اسکلت سلولی گلبولهای قرمز است که به محل اتصال اسپکترین به اکتین و دومین سیتوپلاسمی گلیکوفورین در غشای پلاسمایی متصل میشود.
پروتئینهای مشابه اسپکترین، آنکرین و پروتئین ۴٫۱، رشتههای اکتین را در سلولهای دیگر به غشای سلولی متصل میکند. برای مثال پروتئینهای ERM همتای پروتئین ۴٫۱ در اکثر سلولهای بدن هستند و فیلامین همتای اسپکترین در پلاکتها است. دیستروفین همتای اسپکترین و یکی از مهمترین پروتئینهای اسکلت سلولی ماهیچهها است. جهش در جهشهای این پروتئین منجر به به دیستروفی عضلانی «دوشن» (Duchenne's) و «بکر» (Becker's) میشود.
برخلاف اسکلت سلولی یکدست گلبولهای قرمز، رشتههای اکتین در بیشتر سلولهای دیگر در به بخشهایی از غشا متصل میشود که با سلولهای دیگر یا ماتریکس خارج سلولی در ارتباط است. برای مثال فیبروبلاستها بهوسیله پروتسینهای عرض غشایی اکتین به ماتریکس خارج سلولی و دومینهای سیتوپلاسمی آن به پروتئینهای اتصالی اکتین متصل میشود. رشتههای اکتین این بخش از اسکلت سلولی بهوسیله پروتئینهای آلفا اکتینین به هم و به کمک پروتئینهای تالین و وینکولین به غشای پلاسمایی متصل میشوند.
ساختار اکتین در زوائد سیتوپلاسمی
در سطح بسیاری از سلولها زوائد سیتوپلاسمی وجود دارد که در حرکت سلولها، فاگوسیتوز و جذب مواد غذایی نقش دارند. ساختار بیشتر این زوائد را رشتههای اکتین مشخص میکند. میکروولیها زوائدی شبیه انگشتان دست در سطح سلولهای اپیتلیال روده هستند که سطح روده برای جذب مواد را ۱۰ تا ۲۰ برابر افزایش میدهند. رشتههای اکتین در میکروویلی بهوسیله پروتئینهای ویلین به هم متصل میشوند و ساختار دستهای تشکیل میدهند. این رشتهها بهوسیله پروتئین کالمودولین به غشای پلاسمایی متصل میشوند و میوزین I در حرکت آنها نقش دارد. انتهای سیتوپلاسمی این رشتهها بهوسیله اسپکترین به شبکه اکتینی زیر غشای پلاسمای متصل میشود.
میکروویلیها زوائد ثابت غشای پلاسمایی هستند. سودوپودیا (پای کاذب)، لاملیپودیا و فیوپودیا زوائید سیتوپلاسمی با اسکلت اکتینی هستند که در پاسخ به تحریک محیطی تشکیل میشوند. شبکه اکتینی سودوپودیا از شبکه اکتینی در پاسخ به آنتیژنها تشکیل میشود و در فاگوسیتوز نقش دارد. اسکلت سلولی لاملیپودیا مثل سودوپودیا از اکتینهای شبکهای تشکیل شده است که زوائد صفحهای شکل تشکیل میدهند. اما اسکلت سلولی فیلوپودیا از اکتینهای دستهای تشکیل شده است.
موتور پروتئین اکتین
میوزینها، موتورپروتئینهای اکتین هستند. این پروتئین از دو زنجیره سنگین و چهار زنجیره سبک تشکیل شده است که به سه ناحیه سر، گردن و دم تقسیم میشوند. انتهای آمینی زنجیرههای سنگین ساختار کروی دارند و ناحیه سر را تشکیل میدهند. دم کربوکسیلی دو زنجیره سبک ساختار مارپیچی تشکیل میدهند. دو زنجیره سبک در ناحیه سر و دو زنجیره سبک در ناحیه گردن قرار دارند و جایگاه تنظیمی میوزین هستند. ناحیه سر جایگاه اتصال به اکتین و جایگاه ATPase قرار دارد. جایگاه ATPase با هیدرولیز ATP به ADP انرژی لازم برای حرکت اکتین را فراهم میکند.
میوزینها (به جز میوزین VI) به سمت سر مثبت اکتین حرکت میکنند. ناحیه گردن سر را به دم متصل و نیروی ایجاد شده در سر را به دم منتقل می کند. ناحیه دم با میوزینهای دیگر و اندامکها یا وزیکولهایی متصل میشود که بین بخشهای مختلف سلولی منتقل میشوند. این پروتئینها در انقباض ماهیچهها، تقسیم سلولی، حرکت وزیکولها و حرکت سلول به رشتههای اکتین کمک میکنند.
نقش اکتین و میوزین در انقباض ماهیچه
انقباض ویژگی اختصاصی بافتهای ماهیچه قلبی، اسکلتی و صاف است که پیشتر هم در مجله فرادرس راجع به آن صحبت کرده بودیم. انقباض ماهیچهها به ساختار اسکلتی این سلولها و برهمکنش رشتههای اکتین و میوزین بستگی دارد. اسکلت سلولی ماهیچههای اسکلتی و قلبی شبیه است و با اسکلت سلولی ماهیچههای صاف تفاوت دارد. در این بخش، اسکلت سلولی ماهیچههای صاف و قلبی را بررسی میکنیم.
ماهیچه اسکلتی از دستههای فیبر ماهیچهای تشکیل شده است. بیشتر سیتوپلاسم فیبرهای ماهیچهای به میوفیبریلها اختصاص داده شده است. میوفیبریلها ساختاری استوانهای از فیلامنتهای ضخیم میوزین و فیلامنتهای نازک اکتین هستند. هر میوفیبریل از واحدهایی به نام سارکومر تشکیل شده است که محدوده آن با پروتئینهای خط Z مشخص میشود. پروتئینهای اکتین و میوزین با آرایش موازی بین دو خط Z قرار دارند. در بخشهای نزدیک خط Z این پروتئینها همپوشانی دارند اما ناحیه مرکزی سارکومر فقط فیلامنتهای میوزین II قرار دارند. دم میوزینها در مرکزی سارکومر به پروتئینهای خط M متصل میشود و سر میوزینها سمت خط Z قرار دارد. انتهای مثبت رشتههای اکتین در دو طرف سارکومر به پروتئینهای خط Z متصل میشوند و انتهای مرکزی آنها آزاد است. تیتین و نبولین پروتئینهای دیگر اسکلت سلولی ماهیچهها هستند. تیتن پروتئین بزرگی است که خط Z را به خط M وصل و از کشیدگی زیاد ماهیچه جلوگیری میکند. نبولین پروتئینهای تنظیمی همراه اکتین هستند.
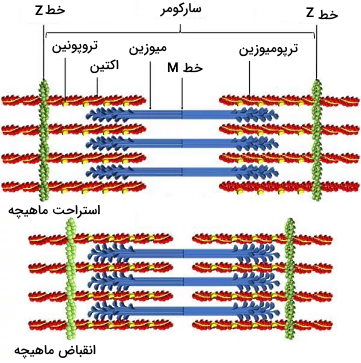
انقباض ماهیچه با اتصال سر میوزین (بدون ATP) به اکتین شروع میشود. اتصال ATP به سر میوزین کنفورماسیون سر میوزین را تغییر میدهد و سر از اکتین جدا میشود. هیدرولیز ATP سبب تغییر کنفورماسیون و عقب رفتن (به سمت خط Z) سر میوزین میشود. ADP و Pi به سر میوزین متصل باقی میماند و سر میوزین در جایگاه جدید به اکتین متصل میشود. پس از اتصال سر میوزین به اکتین ADP و Pi جدا میشوند، سر میوزین به کنفورماسیون اولیه برمیگردد و رشتههای اکتین را به سمت خط M میکشد.
تروپونین و تروپومیوزین دو پروتئین دیگر اسکلت سلولی ماهیچهها هستند که در تنظیم انقباض نقش دارند. تروپومیوزین پروتئینی رشتهای است که به رشتههای اکتین متصل میشود. تروپونین به تروپومیوزین متصل میشود و از زیرواحدهای تروپونین C، تروپونین I و تروپونین T تشکیل شده است. تروپونین C به یون کلسیم و تروپونین T به تروپومیوزین متصل میشود و تروپونین I نقش مهاری دارد. در پاسخ به تحریک سیستم عصبی خروج یون کلسیم از شبکه اندوپلاسمی به سیتولاسم افزایش مییابد. یون کلسیم به تروپونین C متصل میشود. تغییر کنفورماسیون این پروتئین جایگاه اتصال اکتین به میوزین را آشکار میکند و سر میوزین به اکتین متصل میشود.
نقش اکتین و میوزین در تقسیم سلولی
تقسیم سیتوپلاسم سلولهای جانوری در مرحله سیتوکینز به برهمکنش رشتههای اکتین و میوزین بستگی دارد. زیر غشای پلاسمایی بخش مرکزی سلول کمربند انقباضی از فیلامنتهای اکتین و میوزین II تشکیل میشود. حرکت سر میوزین روی رشتههای اکتین، غشای پلاسمایی را در مرکز سلول جمع میکند و در نهایت دو سلول از هم جدا میشوند. پس از شدن سلولها کمربند فیلامنتهای کمربند انقباضی پراکنده میشوند. تشکیل کمربند انقباضی بهوسیله آنزیم کیناز زنجیره سبک میوزین تنظیم میشود. افزایش کلسیم در سلول سبب فعال شدن پروتئین کالمودولین میشود و کالمودولین کیناز زنجیره سبک میوزین را فعال میکند. آنزیم کیناز زنجیره سبک میوزین را فسفوریله میکند و میوزین به اکتین متصل میشود.
نقش اکتین و میوزین در حرکت وزیکول ها
میوزین I یکی از موتورپروتئینهایی است که در انتقال وزیکولها و اندامکهای سلولی نقش دارد. اندازه این پروتئین بسیار کوچکتر از میوزین II است و دیمر تشکیل نمیدهد. این پروتئین از یک سر کروی و دم تشکیل شده است. ناحیه سر به اکتین و ناحیه دم آن به وزیکولها یا اندامکها متصل میشود. حرکت سر میوزین روی رشتههای اکتین وزیکولها یا اندامکها بین بخشهای مختلف سلول را حرکت میهد.
نقش اکتین و میوزین در حرکت سلول
خزیدن حرکت پایه بسیاری از سلولها است. حرکت آمیب، حرکت سلولهای جنینی حین تکامل، حرکت گلبولهای سفید در بافت عفونی، پخش شدن سلولهای توموری در متاستاز، حرکت فاگوسیتها و گسترش سلولهای عصبی حین تکامل از این نوع است و با مکانیسم مشابهی انجام میشود. خزیدن در سه مرحله انجام می شود. در مرحله اول پای کاذب، لاملیپودیا یا میکروپودیا تشکیل میشود. در مرحله دوم زوائید سیتوپلاسمی به ماتریکس اطراف منصل میشود و در مرحله سوم اتصالات قبلی جدا و اتصالات جدید با ماتریکس تشکیل می شود.
فیلامنت حدواسط
قطر فیلامنتهای حدواسط از میکروتوبول ها کمتر و از اکتینها کمتر است. این فیلامنتها برخلاف اکتین و میکروتوبول در حرکت سلولی نقش ندارند و پایداری ساختار سلول را افزایش میدهند. فیلامنتهای حدواسط از پروتئینهای متنوعی تشکیل شدهاند و بر اساس توالی آمینواسیدی به شش گروه تقسیم میشوند. جدول زیر انواع فیلامنتهای حدواسط را نشان میدهد.
| گروه | پروتئین | وزن (کیلودالتون) | بافت |
| گروه I | کراتین اسیدی | ۴۰ تا ۶۰ | سلولهای اپیتلیال |
| گروه II | کراتین بازی و خنثی | ۵۰ تا ۷۰ | سلولهای اپیتلیال |
| گروه III | ویمنتین | ۵۴ | فیبروبلاستها و گلبولهای سفید |
| دسمین | ۵۳ | سلولهای ماهیچهای | |
| فیبریلهای اسیدی گلیال | ۵۱ | سلولهای گلیال | |
| پریفرین | ۵۷ | نورونهای سیستم عصبی محیطی | |
| گروه IV | فیلامنت عصبی L (سبک) | ۶۷ | نورونها |
| فیلامنت عصبی M (متوسط) | ۱۵۰ | نورونها | |
| فیلامنت عصبی H (سنگین) | ۲۰۰ | نورونها | |
| آلفا اینترنکسین | ۶۶ | نورونها | |
| گروه V | لامینینهای هسته | ۶۰ تا ۷۵ | هسته تمام سلولها |
| گروه VI | نستین | ۲۰۰ | سلولهای بنیادی سیستم عصبی مرکزی |
گروه I و II کراتینهای سلولهای اپتلیال هستند. گروه I از ۱۵ نوع کراتین اسیدی و گروه II از ۱۵ نوع کراتین بازی و خنثی تشکیل شده است. در هر سلول اپیتلیال حداقل یک پروتئین اسیدی با یک پروتئین بازی یا خنثی متصل میشود و فیلامنتهای حدواسط اسکلت سلولی را تشکیل میدهد. بعضی از فیلامنتهای کراتین ساختار مو، ناخن و شاخ را میسازد. فیلامنتهای دسمین غشای پروتئینهای خط Z سارکومر را به غشای پلاسمایی ماهیچه اسکلتی و قلبی متصل میکند. لامینینها به جای اسکلت سلولی در اسکلت هستهای نقش دارند. لامینینها شبکه پروتئینی زیر غشای هسته تشکیل میدهند.
تمام فیلامنتهای حدواسط از یک آلفا هلیکس مرکزی (حدود ۳۱۰ آمینواسید) با دو سر آمین و کربوکسیل تشکیل شدهاند. آلفا هلیکس بخش مشترک این فیلامنتها است. سرها بخشهای متغیری هستند که فعالیت فیلامنت را مشخص میکنند و ساختار دوم آن بین گروهها تفاوت دارد. اولین مرحله تشکیل فیلامنتهای حدواسط تشکیل ساختار مارپیچی بین ناحیه آلفا هلیکس دو زنجیره پلیپپتیدی و تشکیل دیمر است. در مرحله بعدی دیمرها به شکل موازی کنار هم قرار میدهند و تترامر تشکیل میدهند. در تترامرها انتهای آمین هر دیمر کنار موازی انتهای کربوکسیل دیمر دیگر قرار میگیرد. در مرحله بعدی ابتدای سر هر تترامر کنار دم تترامر دیگر قرار میگیرد و پروتوفیلامنت حدواسط تشکیل میشود. در مرحله آخر پروتوفیلامنتها کنار هم قرار میگیرند و فیلامنتهای حدواسط تشکیل میشود. هر فیلامنت حدواسط حداقل از ۸ پروتوفیلامنت تشکیل شده است. فیلامنتهای حدواسط از زنجیرههای پلیپپتیدی شبیه هم (همودایمر) یا زنجیرههای پلیپپتیدی متفاوت (هترودایمر) تشکیل می شوند.
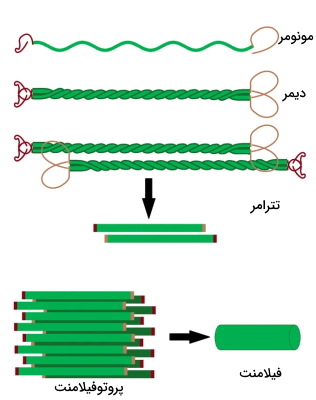
فیلامنتهای حدواسط برخلاف فیلامنتهای اکتین و میکروتوبولها انتهای مثبت و منفی ندارند و پایدارتر هستند. کنار هم قرار گرفتن و جدا شدن این رشتهها بهوسیله فسفوریلاسیون و دفسفوریلاسیون تنظیم میشود. برای مثال فسفوریلاسیون لامینینها در تقسیم میتوز سبب جدا شدن لامینینها از هم و از بههم ریختن ساختار غشای هسته میشود.
ساختار فیلامنت های حدواسط در سلول
فیلامنتهای حدواسط در سیتوپلاسم داربستی تشکیل میدهند که اجزای اسکلت سلولی را به هم متصل میکند و اندامکها را سازماندهی میکند. کراتین و ویمنتین فیلامنتهایی هستند که به هسته و غشای پلاسمایی سلول متصل میشود و هسته را در محل خود نگه میدارد. رشتههای کراتین سلولهای اپیتیال در اتصالات دسموزومی و همیدسموزومی به غشای پلاسمایی متصل میشود. اتصالات دسموزومی بین غشای دو سلول کنار هم و اتصالات همیدسموزومی بین غشای سلول و ماتریکس خارج سلولی ایجاد میشود. در اتصالات دسموزومی کراتین بهوسیله پروتئینهای دسموپلاکین به پلاک پروتئینی بخش سیتوپلاسمی غشا متصل میشود. در اتصالات همیدسموزومی فیلامنتهای کراتین بهوسیله پروتئینهای پلکتین به اینتگرینهای غشا متصل میشود.
چطور با سلول و ساختارهای آن آشنا شویم؟
سلول کوچکترین واحد سازنده تمام موجودات زنده است که از مولکولهای زیستی تشکیل میشود. ساختارهای سلولی نقش مهمی در رشد، انتقال ترکیبات بین سلولی، شکل سلول و حرکت سلولها در بخشهای مختلف دارند. برای آشنایی با این ساختارها و عملکرد آنها ابتدا باید بدانیم سلول از چه بخشهایی تشکیل شده است و هر بخش چه وظیفه دارد. در مرحله بعد باید بدانیم ساختارهای سلولی چگونه با برقراری ارتباط به انجام فعالیتهایی مثل ترشح هورمونها کمک میکنند. نکته مهم دیگر این است که سلولها چطور با هم اتصال برقرار میکنند و بافتهای پرسلولی را تشکیل میدهند. اگر به یادگیری بیشتر در مورد سلول و ساختارهای سلولی علاقهمند هستید، مشاهده فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است، به شما پیشنهاد میشود.
- فیلم آموزش زیست شناسی سلولی فرادرس
- فیلم آموزش زیست شناسی سلولی و مولکولی مبانی و مفاهیم مقدماتی فرادرس
- فیلم آموزش زیست شناسی اسکلت سلولی فرادرس
- فیلم آموزش اتصالات سلولی فرادرس
سوالات متدوال
در این بخش از مطلب مجله فرادرس به تعدادی از سوالات متداول پیرامون میکروتوبول پاسخ میدهیم.
نقش میکروتوبول ها در کنترل سرطان چیست؟
بعضی از داروهای ضدسرطان به توبولینها متصل میشوند و تشکیل دوک میتوزی را مهار میکنند. در نتیجه تقسیم متوقف و سلول آپوپتوز میشود.
میکروتوبول تاژک چیست؟
اسکلت سلولی مژک شبیه تاژک است و از ۹ فیلامنت ۲تایی میکروتوبول محیطی و دو میکروتوبول مرکزی تشکیل شده میشود.