جرم اتمی میانگین چیست؟ – به زبان ساده + فرمول و مثال
«جرم اتمی میانگین» (Average Atomic Mass)، میانگین جرم اتمی ایزوتوپهای پایدار یک عنصر است که اندازه آن به درصد فراوانی ایزوتوپ بستگی دارد و واحد آن است. در این مطلب روش بهدست آوردن جرم اتمی میانگین را یاد میگیرید و با فرمول و کاربردهای آن و همچنین روشهای دقیق اندازهگیری جرم اتمی آشنا میشوید.
جرم اتمی
شاید با تعریف جرم اتمی عنصرها در شیمی پایه دهم آشنا شده باشید. به طور کلی برای اندازهگیری جرم اجسام گوناگون بسته به اندازه آن به ابزار اندازهگیری متفاوتی نیاز داریم. برای اندازهگیری جرم اتمها باید از مقیاس جرم نسبی استفاده کنیم.
تعداد الکترونها، پروتونها و نوترونهای موجود در یک اتم، جرم یک اتم را مشخص میکنند. دانستن جرم اتمی عناصر در کارهای آزمایشگاهی از اهمیت بالایی برخوردار است. اتمها ذرات بسیار کوچکی هستند و کوچکترین ذره غباری که چشم انسان بدون کمک سایر ابزار میتواند تشخیص دهد حاوی اتم است!
روشن است که وزن کردن یک اتم برای بهدست آوردن جرم اتمی آن امکانپذیر نیست، اما میتوان جرم یک اتم را نسبت به اتم دیگر به صورت تجربی تعیین کرد. نخستین گام برای بهدست آوردن جرم اتمی یک عنصر این است که مقداری به جرم اتم عنصری معین اختصاص دهیم تا بتوان از آن به عنوان استاندارد استفاده کرد.
بر اساس توافق بینالمللی، جرم اتمی که همچنین وزن اتمی هم نامیده میشود، جرم یک اتم است که با واحد جرم اتمی تعریف میشود. یک واحد جرمی اتمی یا برابر با یکدوازدهم جرم اتم کربن-۱۲ تعریف شده است. کربن-۱۲ ایزوتوپ کربنی است که شش پروتون و شش نوترون دارد. قراردادن جرم اتمی کربن-۱۲ برابر با استانداردی برای اندازهگیری جرم اتمی سایر عناصر فراهم میکند.
برای نمونه، آزمایشها نشان دادهاند که بهطور میانگین یک اتم هیدروژن تنها ۸٫۴ درصد یک اتم کربن-۱۲ جرم دارد. بنابرین اگر جرم یک اتم کربن-۱۲ دقیقاً باشد، جرم اتمی هیدروژن با یک نسبت ساده برابر است با:
بهطور مشابه آزمایشها نشان دادهاند که جرم اتمی اکسیژن و برای آهن است. بنابراین، اگرچه نمیدانیم جرم اتمی میانگین اتم آهن چقدر است ولی میتوانیم متوجه شویم که جرم آن تقریباً ۵۶ برابر یک اتم هیدروژن است. بیشتر عنصرهای طبیعی و پایدار، بیش از یک ایزوتوپ دارند. ایزوتوپهای یک عنصر عدد اتمی یکسان ولی جرمهای متفاوتی دارند. جرم اتمی به صورت میانگینی از جرم ایزوتوپهای مختلف آن عنصر تعریف میشود.
جرم اتمی میانگین چیست ؟
جرم اتمی میانگین، میانگین جرم همه ایزوتوپهای یک عنصر است. اگر دقت کرده باشید در جدولهای جرم اتمی عنصرها خواهید دید که جرم اتمی کربن نوشته نشده بلکه است. دلیل این تفاوت این است که بیشتر عنصرهای طبیعی مانند کربن بیش از یک ایزوتوپ دارند. به همین علت دانشمندان جرم اتمی را به صورت میانگینی از جرم اتمی همه ایزوتوپهای آن عنصر گزارش میکنند که به جرم اتمی میانگین معروف است.
جرم اتمی بسیاری از عنصرها بهطور دقیق تا پنج یا شش رقم با معنا مشخص شدهاست. با این حال، در محاسبات جرم اتمی تنها تا چهار رقم اعشار استفاده میشود. همچنین هنگام بحث در مورد جرم اتمی عنصرها از واژه «میانگین» استفاده نمیکنند و بهطور خلاصه جرم اتمی بیان میشود.

فرمول جرم اتمی میانگین
برای بهدست آوردن جرم اتمی میانگین از درصد فراوانی و جرم اتمی ایزوتوپهای آن عنصر استفاده میکنند که رابطه آن در زیر آورده شده است.
= جرم اتمی میانگین
- : درصد فروانی طبیعی ایزتوپ
- : جرم اتمی ایزوتوپ
مثال اول محاسبه جرم اتمی میانگین
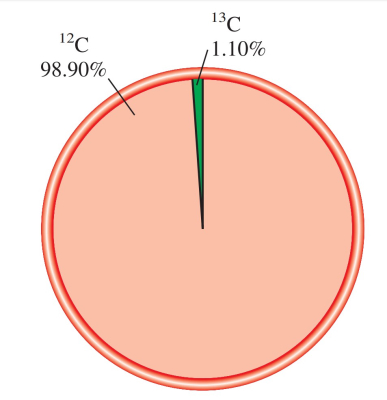
درصد فراوانی کربن-۱۲ و کربن-۱۳ به ترتیب برابر با ۹۸٫۹۰ و ۱٫۱۰ درصد است. جرم اتمی کربن-۱۳ برابر با اندازهگیری شده است.
پاسخ: میانگین جرم اتمی کربن برابر است با:
نکته: در محاسبات، درصدها باید به کسر تبدیل شوند؛ یعنی ۹۸٫۹۰ درصد به ۰٫۹۸۹۰ تبدیل میشود.
باید توجه داشته باشید که وقتی گفته میشود جرم اتمی کربن است به مقدار جرم اتمی میانگین اشاره دارد. در صورت بررسی تکتک عنصرهای کربن با کربنی به جرم یا مواجه میشویم، ولی هرگز کربنی را با جرم اتمی پیدا نمیکنیم.

مثال دوم محاسبه جرم اتمی میانگین
مس از پرکاربردترین و قدیمیترین فلزاتی است که انسان کشف و از آن استفاده میکند. این فلز در ساخت سکهها و کابلهای برق به کار میرود. جرم اتمی (برحسب ) دو ایزوتوپ پایدار این عنصر یعنی با ۶۹٫۰۹ درصد فراوانی و با ۳۰٫۹۱ درصد فراوانی به ترتیب ۶۲٫۹۳ و ۶۴٫۹۲۷۸ است. جرم اتمی میانگین آن را محاسبه کنید.
پاسخ: ضرب جرم هر ایزوتوپ در کسر فراوانی، سهم آن ایزوتوپ در جرم اتمی میانگین را نشان میدهد. ابتدا باید درصدهای فراوانی به کسر تبدیل، یعنی تقسیم به ۱۰۰ شوند.
درصد فراوانی هر ایزوتوپ در جرم اتمی آن ضرب و سپس باید با یکدیگر جمع شوند.
| ایزوتوپ | درصد فراوانی | جرم اتمی |
|---|---|---|
| ۶۹٫۰۹ | ۶۲٫۹۳ | |
| ۳۰٫۹۱ | ۶۴٫۹۲۷۸ | |
| جرم اتمی میانگین | ۶۳٫۵۵ | |
نکته: جرم اتمی بر اساس میانگین جرم ایزوتوپهای پایدار (غیر پرتوزا) آن عنصر محاسبه میشود.
مفهوم مول و جرم مولی
جرم اتمی تنها مقیاسی نسبی از جرم عنصرها ارائه میدهد. به دلیل جرم بسیار کم اتمها و اینکه در محاسبات، نمونهها به صورت ماکروسکوپی هستند به واحدی ویژه برای تعریف تعداد بیشتری از اتمها نیاز است تا درک آن راحتتر باشد.
در شیمی، اتمها و مولکولها با مقیاسی به نام «مول» (mole | mol) اندازهگیری میشوند. در سیستم مول چنین تعریف شده است:
تعداد اتمهایی که در ۱۲ گرم از ایزوتوپ کربن-۱۲ موجود است. تعداد واقعی اتم در ایزوتوپ کربن-۱۲ که به عدد آووگادرو معروف است به صورت نمایش داده میٰشود.
در محاسبات، این عدد به صورت گرد شده استفاده میشود که برابر است با:
پس وقتی میگویم ۱ مول آهن داریم یعنی اتم آهن داریم.

جرم مولی
همانطور که دیدیم در واقع یک مول اتم کربن، ۱۲ گرم است. به این جرم، «جرم مولی» (Molar Mass) میگویند. جرم مولی از نظر عددی با جرم اتمی برابر است. با این تعریف، برای مثال خواهیم داشت:
| عنصر | جرم اتمی | جرم مولی (گرم) |
|---|---|---|
| سدیم | 22٫99 | 22٫99 |
| فسفر | 30٫97 | 30٫97 |
با دانستن جرم مولی و استفاده از عدد آووگادرو میتوانیم جرم یک اتم را بر حسب گرم بهدست آوریم. در زیر جرم یک اتم کربن محاسبه شدهاست.
جرم مولکولی
با درک جرم اتمی میتوانیم جرم مولکولی را نیز به راحتی محاسبه کنیم. در واقع جرم مولکولی که همچنین وزن مولکولی نیز نامیده میشود مجموع جرمهای اتمی مولکول است. برای مثال جرم مولکولی آب که از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده برابر با ۱۸٫۰۲ است.
(۲×جرم اتمی هیدروژن)+(۱×جرم اتمی اکسیژن)
مثال محاسبه جرم مولکولی
کافئین ماده شیمیایی طبیعی است که تأثیرات نشاطآوری دارد و در قهوه، چای، برخی نوشابههای گازدار، کاکائو یافت میشود. جرم مولکولی آن را بهدست آورید.
پاسخ: کافئین از ۸ اتم کربن، ۱۰ هیدروژن، ۴ نیتروژن و ۲ اکسیژن تشکیل شده است. جرم مولکولی آن برابر است با:
جرم اتمی عناصر جدول تناوبی
در جدول زیر جرم اتمی تمام عناصر جدول تناوبی فهرست شده است. بر اساس جرم اتمی، هیدروژن سبکترین و «هاسیوم» (Hassium) سنگینترین عنصرهای پایدار موجود هستند.

محاسبه جرم اتمی میانگین با طیف سنجی جرمی
برای تعیین جرم اتمی و مولکولی از دستگاهی به نام طیفسنج جرمی (Mass Spectrometer) استفاده میکنند. در حال حاضر روش طیفسنج جرمی، دقیقترین روش اندازهگیری برای جرم اتم است. در شکل زیر طرحوارهای از این دستگاه نمایش داده شده است.
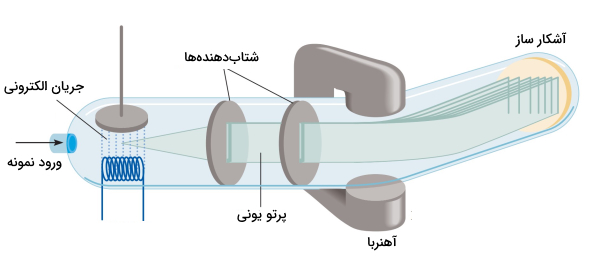
در روش طیفسنجی جرمی، در ابتدا که نمونه مایع در دستگاه قرار میگیرد با گرم شدن به صورت گاز درمیآید سپس توسط جریان پرانرژی از الکترونها بمباران میشود. اتمها و مولکولها، در حالت گازی هنگام برخورد با الکترونها، با از دست دادن یک الکترون به یونهای مثبت تبدیل میشوند. این یونها با بار و جرم توسط صفحات شتابدهنده، شتاب میگیرند و دو صفحه آهنربا با ایجاد میدانی مغناطیسی باعث انحراف یونها میشوند.
یونها با توجه به نسبت بار به جرم ، مسیرهای متفاوتی را طی میکنند. هرچه این نسبت بزرگتر باشد انحراف کمتری رخ میدهد یعنی سنگینترین یونها با کمترین مقدار منحرف میشوند. در نتیجه، یونهایی با بار برابر ولی جرم متفاوت از یکدیگر جدا میشوند.
با توجه به میزان انحراف هر یون، جرم اتمی آن تعیین میشود. در پایان، با برخورد هر یون به صفحه آشکارساز، برای هر نوع یون جریان متفاوتی ثبت میشود. مقدار جریان تولیدی نسبت مستقیمی با تعداد یونها دارد و از این راه میتوان فراوانی نسبی ایزوتوپها را تعیین کرد.
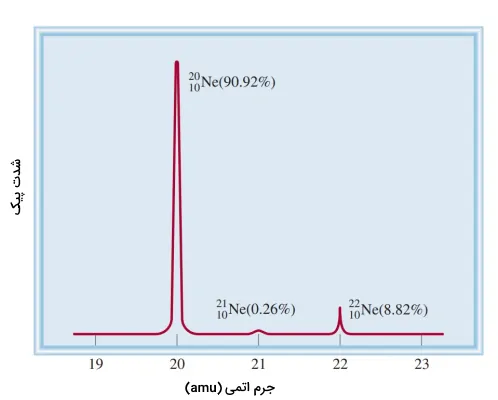
در اندازهگیریهای اولیه برای ایزوتوپهای نئون نتایج زیر بهدست آمد.
| ایزوتوپ | جرم اتمی | درصد فراوانی |
| نئون-۲۰ | ۱۹٫۹۹۲۴ | ۹۰٫۹۲ |
| نئون-۲۲ | ۲۱٫۹۹۱۴ | ۸٫۸۲ |
با پیشرفتهتر شدن و افزایش حساسیت طیفسنجهای جرم، مشخص شد که نئون سه ایزوتوپ پایدار دارد. سومین ایزوتوپ این عنصر، جرمی اتمی برابر با ۲۰٫۹۹۴۰ و درصد فراوانی ۰٫۲۵۷ دارد، به عبارتی از هر ۱۰۰۰۰ اتم تنها ۲۶ عدد از آن نئون-۲۱ است.
مراحل جداسازی ایزوتوپ های کلر با استفاده از طیف سنجی جرمی
کلر دو ایزوتوپ با درصد فراوانی و با درصد فراوانی به نسبت تقریباً ۳ به ۱ دارد.

مراحل جداسازی:
- نمونه گاز کلر وارد دستگاه طیفسنج جرم میشود.
- جریان قدرتمندی از الکترونها، مولکولهای کلر را به اتم تفکیک میکند.
- اتمهای تفکیک شده با از دست دادن یک الکترون به یونهای تبدیل میشوند.
- سپس شتاب کاتیونهای کلر با رسیدن به صفحات شتابدهنده افزایش پیدا میکند.
- با رسیدن پرتو یونهای کلر به میدان مغناطیسی ایجاد شده توسط آهنربای دستگاه، این یونها بر اساس نسبت جرم به بار از مسیر منحرف میشوند. یونهای سبکتر انحراف بیشتری نسبت به یونهای سنگینتر دارند.
- انحراف نسبی یونها توسط آشکارساز اندازهگیری میشود و از آن برای تعیین جرم یونها استفاده میکنند.
- فراوانی ایزوتوپها به صورت پیکهایی مجزا نمایش داده میشود.
سوالات متداول
در پایان به برخی از پرسشهای رایج در مورد جرم اتمی میانگین پاسخ داده شده است.
تفاوت جرم اتمی و عدد جرمی چیست؟
عدد جرمی: تعداد پروتون و نوترونهای یک اتم است.
تعداد پروتون + تعداد نوترون = عدد جرمی
جرم اتمی: جرم یک اتم را بیان میکند که واحد آن تعریف شده است
اتمها از اجزای مختلفی تشکیل شدهاند که به طور معمول به الکترون، پروتون و نوترون تقسیم میشوند. الکترون و پروتون خواص شیمیایی اتم را تعیین میکنند ولی نوترونها تقریباً هیچ تأثیری بر خواص شیمیایی اتم ندارند، اما بر وزن اتم تأثیر میگذارند.
تفاوت جرم اتمی میانگین و جرم اتمی نسبی چیست؟
جرم اتمی نسبی و میانگین هر دو بر اساس جرم اتمی محاسبه میشوند. تفاوت این دو عدد تنها به شرایط آنها بستگی دارد. جرم اتمی نسبی عددی استاندارد است که توسط اتحادیه بین المللی شیمی محض و کاربردی (آیوپاک) مشخص میشود اما جرم اتمی میانگین فقط برای یک نمونه معین درست است. این عدد میتواند بسته به شرایط زمین در دورههای مختلف و با تغییر نسبت ایزوتوپهای یک عنصر تغییر کند.
آزمون جرم اتمی میانگین
۱. واحد جرم اتمی (amu) بر اساس کدام معیار تعریف شده است و دلیل انتخاب این معیار برای مقایسه جرم اتمها چیست؟
واحد amu معادل جرم یک پروتون انتخاب شده تا اندازهگیریها سادهتر گردد.
واحد amu به عنوان یکدوازدهم جرم اتم هیدروژن تعریف شده است تا عناصر سبک راحتتر مقایسه شوند.
واحد amu برابر جمع جرم پروتون و نوترون یک اتم فرضی است تا جامع باشد.
واحد amu به عنوان یکدوازدهم جرم اتم کربن-۱۲ تعریف شده زیرا کربن-۱۲ استاندارد دقیق و قابل عملی است.
واحد amu به عنوان یکدوازدهم جرم اتم کربن-۱۲ تعریف شده زیرا کربن-۱۲ به عنوان یک عنصر با ایزوتوپ پایدار، مرجعی دقیق و عملی برای مقایسه جرم اتمها فراهم میکند. انتخاب هیدروژن مناسب نیست چون ایزوتوپهای متنوع و رفتار متفاوتی دارد. تعریف amu بر اساس جرم یک پروتون یا مجموع جرم پروتون و نوترون، جامعیت یا دقت کافی نسبت به استاندارد کربن-۱۲ ندارد و در مقایسههای شیمیایی رایج نیست. انتخاب کربن-۱۲ اطمینان میدهد که مقیاس برای همه عناصر جهانی و در آزمایشگاهها قابل استفاده است.
۲. با توجه به نقش پروتونها و نوترونها، تفاوت عدد جرمی و جرم اتمی یک عنصر چیست؟
عدد جرمی میانگین وزن ایزوتوپها را نشان میدهد در حالی که جرم اتمی فقط جرم سنگینترین ایزوتوپ است.
عدد جرمی معیاری برای جرم اتمی نسبی است و تفاوتی با جرم اتمی ندارد.
عدد جرمی فقط به تعداد پروتون یک اتم اشاره دارد ولی جرم اتمی شامل کل جرم نمونه عنصر است.
عدد جرمی مجموع تعداد پروتونها و نوترونها است اما جرم اتمی مقدار واقعی جرم اتم بر حسب amu است.
عدد جرمی همان جمع تعداد پروتونها و نوترونهای یک اتم منفرد است و یک عدد صحیح محسوب میشود، در حالی که جرم اتمی بیانگر جرم واقعی اتم بر حسب amu بوده و معمولا عدد اعشاری است چون میانگینی بر اساس ایزوتوپهای مختلف عنصر است. پاسخ «عدد جرمی مجموع تعداد پروتونها و نوترونها است اما جرم اتمی مقدار واقعی جرم اتم بر حسب amu است» از این نظر درست است که تفاوت مفهومی و نقش هر یک را با توجه به پروتون و نوترون روشن میکند.
۳. برای محاسبه جرم اتمی میانگین عنصری با سه ایزوتوپ با درصد فراوانیهای مختلف، چه روشی باید به کار برد؟
جمع درصد فراوانی هر ایزوتوپ را تقسیم بر سه کنیم.
کمترین جرم ایزوتوپها را انتخاب کنیم.
بیشترین درصد فراوانی را ملاک محاسبه قرار دهیم.
جرم هر ایزوتوپ را با درصد فراوانی آن ضرب و سپس مجموع این مقادیر را محاسبه کنیم.
برای به دست آوردن جرم اتمی میانگین یک عنصر چند ایزوتوپی، باید عدد جرم هر ایزوتوپ را در درصد فراوانی آن ضرب کرد و مجموع این حاصلها را محاسبه نمود.
۴. برای تعیین فراوانی ایزوتوپها و محاسبه جرم اتمی نئون با استفاده از جدول حاصل طیفسنج جرمی، چه روشی مناسب است؟
جمعکردن جرم پیکها و تقسیم بر تعداد ایزوتوپها
نادیدهگرفتن پیکها و فقط استفاده از عدد جرمی اصلی
استفاده مستقیم از بیشترین پیک بهعنوان جرم اتمی
استفاده از نسبت پیکها برای محاسبه درصد فراوانی و ضرب هر فراوانی در جرم همان ایزوتوپ
برای تعیین فراوانی ایزوتوپها و محاسبه جرم اتمی نئون باید از «نسبت پیکها برای محاسبه درصد فراوانی و ضرب هر فراوانی در جرم همان ایزوتوپ» استفاده کرد. این روش دقیقا مطابق توضیح طیفسنجی جرمی است که در آن هر پیک نشاندهنده یک ایزوتوپ با فراوانی مشخص است و حاصلضرب فراوانی هر پیک در جرم ایزوتوپ مربوط، به محاسبه میانگین وزنی (جرم اتمی میانگین) منجر میشود.
۵. عدد آووگادرو چه نقشی در تعریف مول در شیمی دارد؟
عدد آووگادرو تعداد اتمهای موجود در یک مول ماده را مشخص میکند.
عدد آووگادرو واحد اندازهگیری انرژی است.
عدد آووگادرو تفاوت ایزوتوپها را بیان میکند.
عدد آووگادرو جرم یک اتم منفرد را نشان میدهد.
در دانش شیمی، عدد آووگادرو مشخص میکند که یک مول از هر عنصر شامل چند اتم است. این تعداد برابر با عدد آووگادرو است. به این ترتیب، عدد آووگادرو ابزاری است که کمک میکند مقیاس بسیار کوچک اتمی را به واحدی قابل اندازهگیری برای آزمایشگاه تبدیل کنیم.













عالی بود
واقعا بهترین مجله ایران هستید. ممنونم ازتون