اسید و باز چیست – به زبان ساده
در مباحث پیشین «مجله فرادرس» در خصوص خواص اسید و باز مطالبی را بیان کردیم. اسید و باز عباراتی نسبی هستند و در حقیقت، یک مولکول را بدون در نظر گرفتن سایر شرایط، نمیتوان یک اسید نامید. به طور مثال، هیدروژن کلرید گازی مولکول بسیار پایداری است که تا وقتی به سیستمی شامل آن، ذرهای اضافه نشود، هیچ رفتار اسیدی یا بازی از خود نشان نمیدهد. اگر آب را به سیستم اضافه کنیم، HCl به سادگی با آب وارد واکنش میشود و یونهای و را تولید میکند. در این مطلب قصد داریم تا به بررسی اسیدها و بازها و تعاریف، نظریهها و مباحث مربوط به آنها بپردازیم.
- میآموزید اسید و باز چیست و چه تعاریفی برای این مواد وجود دارد.
- با اسید و باز آرنیوس و یون هیدرونیوم آشنا میشوید.
- می توانید اسید و باز لوری برونستد را در واکنشهای مختلف تشخیص دهید.
- با مفهوم اسید و باز لوییس آشنا شده و آنها را در ترکیبات کمپلکس تشخیص میدهید.
- یاد میگیرید آمفوتر و واکنش خنثی شدن چیست.
- میتوانید ثابت تفکیک اسید و باز و مقدار pH را محاسبه کنید.


اسید و باز چیست؟
سه دستهبندی کلی برای اسیدها و بازها در نظر گرفته میشود. تعریف آرنیوس از اسید بیان میکند که اسیدها در محلول تولید میکنند و در بازها نیز یون به تولید میرسد. بعد از توسعه این نظریه در سال ۱۸۸۳ توسط آرنیوس، دو نظریه عمومی دیگر نیز معرفی شدند. این نظریهها، نظریه «برونستد-لوری» (Brønsted-Lowry) و لوییس بودند. در این متن، ابتدا اسید و باز آرنیوس و برونستد لوری را بررسی میکنیم و سپس به طور مجزا به بررسی مفهوم اسید و باز لوییس میپردازیم.
نظریه اسید و باز آرنیوس
در سال ۱۸۸۴، دانشمند سوئدی، «سوانت آرنیوس» (Svante Arrhenius) دو دستهبندی اصلی را برای ترکیبات ارائه داد که همان اسیدها و بازها بودند. این ترکیبات زمانی که در محلولی آبی حل شوند، یونهای مخصوصی در این محلولها آزاد خواهند شد. اسید آرنیوس به ترکیبی میگویند که با اضافه شدن به آب، غلظت یونهای را افزایش میدهند.
این یونها در ترکیب با مولکول آب، یون هیدرونیوم را تشکیل میدهند. پیشنهاد می کنیم برای آشنایی بیشتر با این نظریه، فیلم آموزش تئوری آرنیوس در شیمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
چنین فرآیندی را به کمک یک معادله شیمیایی نشان میدهند که در آن، در طرف واکنشدهنده نشان داده شده است. واکنش زیر را در نظر بگیرید:
در این واکنش، هیدروکلریک اسید به طور کامل در زمان انحلال در آب به یون هیدروژن و کلر تفکیک میشود و در نتیجه، یونهای را در محلول آزاد میکند. تشکیل یون هیدرونیوم در محلول به صورت زیر است:
نظریه آرنیوس که سادهترین توصیف برای اسیدها و بازها به شمار میآید، اسیدهایی همچون و و همچنین بازهای و را شامل میشود. به طور مثال، تفکیک کامل در آب، یونهای آزاد را تولید میکند.
این نظریه نحوه واکنش اسیدها و بازها با یکدیگر و تولید آب و نمک را توصیف میکند اما توضیحی برای موادی بدون یونهای هیدروکسید مثل و ارائه نمیکند که به هنگام انحلال در آب، محلولهای بازی تولید میکنند.
باز آرنیوس
باز آرنیوس به ترکیبی میگویند که به هنگام اضافه شدن به آب، غلظت یونهای را افزایش دهد. واکنش تفکیک آن را به صورت زیر نشان میدهند:
در این واکنش، به هنگام انحلال در آب، سدیم هیدروکسید به یونهای سدیم و هیدروکسید تفکیک میشود و به این ترتیب، یونهای در محلول آزاد میشوند. پس تا اینجا یاد گرفتیم که اسید آرنیوس به موادی میگویند که در محلول، یون هیدروژن آزاد کنند و باز آرنیوس نیز به موادی گفته میشود که سبب تولید یونهای هیدروکسید در محلول شوند.
عدم وجود یون های آزاد هیدروژن در آب
به دلیل وجود مقدار زیاد مولکولهای در محلولهای آبی، یونهای هیدروژن به صورت آزاد در آب وجود نخواهند داشت. یونهای هیدروژن در محلولهای آبی، چیزی بیش از هسته یک پروتون نیستند. با وجود اینکه آنها تنها یک واحد از بار مثبت را حمل میکنند اما این بار، حجم بسیار کوچکی از فضا را در مقایسه با کوچکترین اتم اشغال میکند. در اثر این اتقاق، چگالی بار مثبت بسیار زیادی خواهیم داشت که بخشهای منفی اتمها یا مولکولهای اطراف خود را جذب میکنند.
در خصوص آب، این جفتالکترونهای ناپیوندی اتم اکسیژن هستند که جذب میشوند. این پروتون کوچک توسط جفت الکترون ناپیوندی احاطه میشود و پیوندی را با آنها ایجاد میکند که در نهایت سبب ایجاد یون هیدرونیوم خواهد شد. علاوه بر این، مولکول آب در اینجا نقش بازی دارد و فرآورده ، اسید مزدوج آب به شمار میآید.
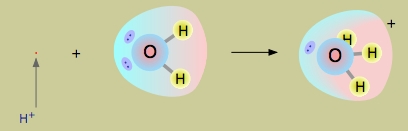
با وجود اینکه سایر یونهای حلشده، با مولکولهای آب پیوندهایی کم و بیش قوی تشکیل میدهند، اما برهمکنش و به قدری شدید است که نوشتن آن به صورت به خوبی آن را توصیف نمیکند اما این نوع نوشتار نیز صحیح است. فرمول توصیف دقیقتری از این حالت دارد بیانگر یک مولکول و همچنین اسید مزدوج آب است.
در متونی که مکانیسم گیرنده-پذیرنده پروتون اهمیت زیادی ندارد، شیمیدانها ترجیح میدهند تا از معادله برای نمایش واکنش اسیدها و بازها استفاده کنند. در نتیجه، به هنگام صحبت از یونهای هیدروژن میتوان از استفاده کرد اما باید به خاطر داشت که چنین یونهای آزادی را نمیتوان در محلولهای آبی پیدا کرد.
محدودیت های نظریه آرنیوس
نظریه آرنیوس برای اسیدها و بازها شامل محدودیتهای بیشتری نسبت به دو نظریه دیگر است. این نظریه بیان میکند برای اینکه مادهای، یونهای یا را آزاد کند باید شامل آن یونها باشد. با این وجود، این نظریه نمیتواند به توصیف باز ضعیف آمونیاک بپردازد که در حضور آب، یونهای هیدروکسید در محلول آزاد میکند اما خود شامل این یونها نیست.
هیدروکلریک اسید بوسیله هر یک از محلولهای سدیم هیدروکسید و آمونیاک خنثی میشود. در هر دو حالت، محلولی بیرنگ خواهیم داشت که با تبلور آنها، نمکهای سدیم کلرید یا آمونیوم کلرید بدست میآیند. چنین واکنشهایی بسیار به یکدیگر شبیه هستند و معادله کامل آنها در زیر آورده شده است.
در خصوص سدیم هیدروکسید و بر اساس نظریه آرنیوس، یونهای هیدروژن از اسید با یونهای هیدروکسید از سدیم هیدروکسید واکنش میدهند اما در خصوص آمونیاک، هیچ یون هیدروکسیدی وجود ندارد. میتوان اینگونه به مساله نگاه کرد که به هنگام واکنش آمونیاک با آب، در اثر انحلال، یونهای آمونیوم و هیدروکسید تولید میشوند:
واکنش بالا یک واکنش برگشتپذیر است و در محلول رقیق آمونیاک، حدود ۹۹ درصد آمونیاک به صورت مولکولهای آمونیاک وجود دارند. با این وجود، یونهای هیدروکسید هم خواهیم داشت تا بتوان برای تطابق با نظریه آرنیوس از آن استفاده کرد. این درحالیست که همین واکنش بین آمونیاک گازی و گاز هیدروژن کلرید نیز بوقوع میپیوندد.
در چنین حالتی، هیچ یون هیدروژن یا هیدروکسیدی در محلول وجود ندارد چراکه در حقیقت، محلولی نداریم. بر طبق نظریه آرنیوس، چنین واکنشی یک واکنش اسید باز به شمار نمیآید با وجود اینکه اگر این مواد در محلول قرار داشتند، همین فرآوردهها را تولید میکردند. به دلیل این نقص، به وجود نظریههای دیگری جهت توصیف رفتار اسیدها و بازها نیاز بود.
نظریه اسید و باز برونستد لوری
در سال 1923، «یوهانس نیکلاس برونستد» (Johannes Nicolaus Brønsted) و «توماس مارتین لوری» (Thomas Martin Lowry)، به طور مجزا تعاریفی از اسید و باز ارائه دادند که بر اساس توانایی ترکیبات برای دهندگی یا پذیرندگی پروتون (یونهای ) بود. در این نظریه، اسیدها را دهنده پروتون و بازها را پذیرنده پروتون در نظر میگیرند. ترکیبی که بر اساس تعریف برونستد لوری، رفتاری هم اسیدی و هم بازی داشته باشد، موسوم به آمفوتر است.
با این تعریف، یک گام نسبت به تعریف آرنیوس فراتر میرویم زیرا ماده برای اسید یا باز بودن نیازی ندارد تا متشکل از یونهای هیدروژن یا هیدروکسید باشد. معادله شیمیایی زیر را در نظر بگیرید:
در اینجا، هیدروکلریک اسید، دهنده پروتون و آمونیاک، پذیرنده پروتون خواهد بود که در نهایت، یونهای باردار آمونیوم و کلر به تولید میرسند. بنابراین، ، اسید لوری-برونستد (دهنده پروتون) و آمونیاک، باز لوری-برونستد خواهد بود. همچنین، به ، باز مزدوج اسید و به اسید مزدوج باز میگویند.
بنابراین بر طبق تعریف برونستد-لوری برای اسیدها بازها خواهیم داشت:
اسید برونستد-لوری دهنده پروتون (یون هیدروژن) و باز برونستند-لوری، پذیرنده پرتون (یون هیدروژن) است. در این نظریه، اسید به مادهای میگویند که - همچون اسید آرنیوس - پروتون آزاد کند و باز به مادهای میگویند که پذیرنده پروتون باشد. یک نمکِ بازی مانند ، با گرفتن پروتون از خودِ آب، یون هیدروکسید در آب تولید میکند تا ایجاد شود.
زمانیکه یک اسید برونستد تفکیک شود، غلظت یونهای هیدروژن در محلول افزایش پیدا میکند و با تفکیک یک باز برونستند (با گرفتن یک پروتون از حلال)، یون منفی هیدروکسید تولید خواهد شد. رابطه تفکیک اسید را به شکل زیر نشان میدهند.
رابطه ثابت یونش اسید:
به همین شکل، رابطه تفکیک باز و ثابت یونش آن نیز به ترتیب، در زیر آورده شده است:
اسید و باز مزدوج
یکی از نتایج رابطه تعادلی بالا این است که هر اسید (HA)، دارای یک باز مزدوج () خواهد بود و برعکس. به این خانواده از ترکیبات اسید و باز مزدوج گفته میشود. در اسیدها و بازها این تعادل با رابطه تعادلی تفکیک آب مرتبط است:
ثابت تعادل آب نیز از رابطه زیر بدست میآید:
میزان ثابت تعادل آب در دمای ۲۵ درجه سانتیگراد برابر با است.
اسید و باز قوی و ضعیف
اسیدهای قوی ترکیبات مولکولی هستند که به طور کامل در محلولهای آبی به یونهای و یک آنیون دیگر تفکیک میشوند. اسیدهای کمی به صورت قوی وجود دارند. سایر اسیدها را اسید ضعیف مینامند که به طور کامل در محلولهای آبی تفکیک نمیشوند. بنابراین، در صورت تفکیک کامل اسیدها و بازها به آنها اسید و باز قوی میگویند.
در روابط بالا، فلشهای یکطرفه نشانگر این هستند که واکنش به طور کامل انجام میشود به این معنی که محلول ۱ مولار در آب شامل غلظتهای یک مولار از و است و هیچ تفکیک نشدهای نخواهیم داشت.
به عکس، اسیدهایی ضعیف همچون استیک اسید و بازهایی ضعیف مانند آمونیاک، به طور جزئی در آب تفکیک میشوند که این تفکیک بستگی به غلظت آنها دارد و در بیشتر موارد به صورت مولکولهایی تفکیک نشده حضور دارند. در جدول زیر، نام برخی از اسیدهای قوی و ضعیف آورده شده است.
| مثال اسید قوی | مثال اسید ضعیف |
| ,,,,, | سایر اسیدها همچون ,,, |
اسیدهای قوی همچون در اثر تفکیک، «یونهای تماشاچی» (Spectator Ion) همچون به عنوان باز تولید میکنند درحالیکه در اسیدهای ضعیف، بازهای مزدوج ضعیف به تولید میرسند.
همچون اسیدها، بازهای قوی و ضعیف نیز بر اساس میزان تفکیک خود، دستهبندی میشوند. به طور مشابه، بازهای قوی به طور کامل در محلولهای آبی تفکیک میشوند و تعداد کمی از بازهای قوی وجود دارد. بازهای ضعیف نیز ترکیبات مولکولی هستند که یونش آنها به طور کامل صورت نمیگیرد. در جدول زیر، برخی از بازهای قوی و ضعیف آورده شدهاند.
| مثال باز قوی | مثال باز ضعیف |
| هیدروکسید فلزات گروه ۱ و ۲ در جدول تناوبی همچون ,,,, | سایر بازها مانند,, |
توجه داشته باشید که قدرت اسید و باز مزدوج به طور معکوس با قدرت اسید و باز والد آنها متناسب است. در حقیقت، هر اسید یا باز، یک باز یا اسید مزدوج نیز محسوب میشود. از این عبارات برای مشخص کردن اجزای محلول استفاده میشود. به طور مثال، استیک اسید، باز مزدوج آنیون استات (یک باز) است در حالیکه استات، باز مزدوج استیک اسید (یک اسید) به شمار میآید.
مفهوم اسید و باز لوییس
در بررسی اسیدها و بازها به نظریه سوم یعنی نظریه اسید و باز لوییس میرسیم. یکی از کاربردیترین نظریهها در خصوص اسیدها بازها را باید نظریه لوییس دانست که تعریف اسید باز را گسترش میدهد و آن را فراتر از تعریف برونستد-لوری و غلظت و ذکر میکند.
نظریه برونستد لوری کاربرد بسیاری در طول تاریخ برای شیمیدانها داشته است اما این نظریه، به طور مشخص به اسیدها و بازها به صورت دهنده و پذیرنده پروتون میپرداخت. در برخی موارد همچون در جامدات و گازها، نظریه برونستد-لوری کارایی لازم را نداشت. در سال 1923، «گیلبرت لوییس» (Gilbert Lewis) در دانشگاه برکلی، نظریهای جایگزین را برای توصیف اسیدها و بازها ارائه داد. این نظریه، توصیفی عمومی برای اسیدها و بازها بر اساس ساختار و پیوند آنها ارائه داد.
به کمک نظریه اسید و باز لوییس، دانشمندان واکنشهای گستردهتری را در زمینه اسیدها و بازها مورد بررسی قرار میدهند. نظریه لوییس به جای استفاده از مفهوم انتقال پروتون، از الکترون استفاده و بیان میکند یک اسید به ذرهای میگویند که یک جفتالکترون را بپذیرد و به ذرهای که یک جفتالکترون بدهد، باز میگویند. این تعریف در تصویر زیر به خوبی بیان شده است.
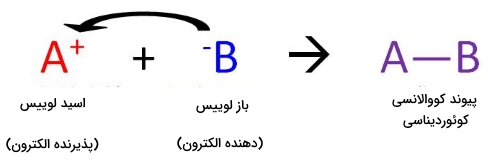
واکنش اسید و باز لوییس سبب ایحاد پیوند داتیو (پیوند کووالانسی کوئوردیناسی) میشود. این پیوند نوعی پیوند کووالانسی است که در آن، یک واکنشدهنده، جفتالکترون خود را به دیگری میدهد. در این حالت، باز لوییس، الکترونهای خود را به اسید لوییس میدهد. زمانی که این مواد با یکدیگر واکنش دهند، فرآورده حاصل را «ترکیب افزایشی» (Addition Compound) یا به طور معمول «اداکت» (Adduct) میگویند. بنابراین، اسید و باز لوییس به صورت زیر تعریف میشوند:
- اسید لوییس: ذرهای که جفتالکترون را دریافت میکند (الکتروفیل) و دارای اوربیتال خالی است.
- باز لوییس: ذرهای که جفتالکترون خود را اهدا میکند (نوکلئوفیل) شامل جفتالکترون ناپیوندی است.
اسید لوییس
همانطور که گفته شد، اسید لوویس پذیرنده جفتالکترون یعنی الکتروفیل است و الکترونها را جذب میکند. به هنگام تشکیل پیوند با باز، اسید از پایینترین اوربیتال مولکولی پرنشده (LUMO) استفاده میکند. برخی از موارد شامل اسید لوییس در زیر آورده شدهاند.
- ذرات مختلف، رفتاری به عنوان اسید لوییس دارند. تمامی کاتیونها اسید لوییس به شمار میآیند زیرا میتوانند پذیرای الکترون باشند.
- اتم، یون یا مولکولی که قاعده اکتت خود را تکمیل نکرده باشد، رفتاری همچون اسید لوییس خواهد داشت که از نمونههای آن میتوان به و اشاره کرد.
- مولکولهایی که اتم مرکزی آنها بتواند بیش از ۸ الکترون ظرفیت داشته باشد، پذیرنده الکترون خواهند بود و به این ترتیب به عنوان اسید لوییس شناخته میشوند. از نمونههای آن هم میتوان به و اشاره کرد.
- مولکولهایی همچون و که در آنها پیوندهایی چندگانه بین دو اتم با الکترونگاتیویهای مختلف برقرار است را میتوان به عنوان اسید لوییس در نظر گرفت.
باز لوییس
بازهای لوییس، دهنده جفتالکترون هستند. به این ترتیب، آنها را میتوان نوکلئوفیل نامید به این معنی که به کمک جفتالکترونهای ناپیوندی خود به بار مثبت «حمله» میکنند. بازهای لوییس از بالاترین اوربیتال مولکولی اشغال شده (HOMO) استفاده میکنند. بنابراین، اگر اتمی با جفتالکترون ناپیوندی داشته باشیم میتواند به عنوان باز لوییس عمل کند. هرکدام از آنیونهای زیر میتوانند الکترونهای خود را به یک اسید بدهند:
$$\begin {equation} O H^{-}\, C N ^{-}\, C H_{3} C O O^{-}\,\: N H_{3}\, H_{2} O\:\, C O\:end {equation}$$
در اثر برهمکنش HOMO در باز با LUMO در اسید، اوربیتالهای مولکولی پیوندی ایجاد میشوند. لازم به ذکر است که اسیدها و بازها در نظریه لوییس هردو دارای HOMO و LUMO هستند اما HOMO را برای بازها و LUMO را برای اسیدها در نظر میگیرند.
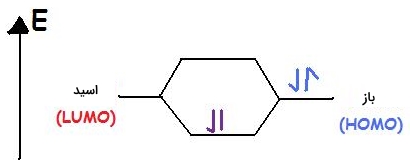
در تصویر زیر، بسیاری از اسیدها و بازهای لوییس نشان داده شدهاند:
کمپلکس ها و ترکیبات کوئوردیناسی
یونهای کمپلکس، یونهایی چنداتمی هستند که از یک اتم فلزی مرکزی تشکیل و سایر یونهای کوچکتر، در اطراف به آن متصل شدهاند. با نظریه برونستد-لوری نمیتوانیم نحوه تشکیل و واکنش آنها را توصیف کنیم اما نظریه اسید و باز لوویس، در این مورد به ما کمک میکند. به طور معمول، یک باز لوییس، لیگاند ترکیب کوئوردیناسی به شمار میآید و فلز، نقش اسید لوییس دارد.
یون آلومینیوم یک فلز و کاتیونی با لایه ظرفیت پر نشده است که یک اسید لوییس به شمار میآید. آب دارای جفتالکترون ناپیوندی و آنیون است و بنابراین، باز لوییس به شمار میآید.
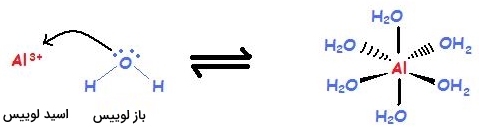
حالت دیگری که نظریه اسید و باز لوییس میتواند ترکیب حاصل را توصیف کند، واکنش آمونیاک با است.
به طور مشابه، اسید لوییس، یون روی و باز لوییس، آمونیاک است. توجه داشته باشید از آنجایی که هیچ یون هیدروژن یا هیدروکسیدی در واکنش بالا نداریم، نظریه اسید و باز برونستد-لوری نمیتواند واکنش بالا را توصیف کند. در حقیقت، عدم وجود این یونها در بسیاری از کمپلکسها، تعیین اسیدی یا بازی بودن ترکیب را با مشکل مواجه میکند که حل این مشکل به کمک نظریه لوییس برای اسیدها و بازها امکانپذیر است.
آمفوتر
اسیدها و بازها را به عنوان دو دسته جدا در نظر میگیرند اما موادی وجود دارند که رفتاری هم به صورت باز و هم به صورت اسید دارند. این خصوصیت را در آب بررسی کردیم و چنان خاصیتی در مولکول آب، آن را به یک آمفوتر تبدیل میکند. با دادن پروتون به باز، آب نقش اسید ایفا میکند و با پذیرش پروتون از یک اسید، نقش بازی خواهد داشت.
آب در نقش اسید:
آب در نقش باز:
اینکه یک مولکول آمفوتر، نقش اسید یا باز داشته باشد، به محیط قرارگیری آن مولکول وابسته است. آب در محیط اسیدی، نقش اسید ندارد و به طور مشابه، در محیط بازی، نقش باز نخواهد داشت. مولکولهای دیگری نیز میتوانند نقش آمفوتری داشته باشند. به طور مثال، واکنش زیر را در نظر بگیرید که در آن، آلومینیوم هیدروکسید نقش باز لوییس دارد:
اما در واکنش زیر، آلومینیوم هیدروکسید، یک اسید لوییس به شمار میآید.
در این دو مورد نیز رفتار آمفوتری مولکول، به محیط مولکول وابسته است.
خنثی شدن اسیدها و بازها
خاصیت ویژه اسیدها و بازها، توانایی آنها در خنثی کردن خواص یکدیگر است. در یک واکنش اسید باز (واکنش خنثی شدن)، یونهای از اسید و از باز با یکدیگر برای تشکیل مولکول آب واکنش میدهند. فرآورده دیگر واکنش خنثی شدن، ترکیبی یونی جامد موسوم به نمک است. بنابراین، شکل کلی یک واکنش اسید باز به صورت زیر است:
(جامد) نمک + (مایع) آب (محلول آبی) باز + (محلول آبی) اسید
تیتراسیون
از تیتراسیون برای تعیین غلظت اسیدها و بازها استفاده میشود. در نقطه تعادل، تعداد مولهای اسید با تعداد مولهای باز برابر است. این حالت نشان میدهد که واکنش، خنثی شده است. در ادامه به طور خلاصه، نحوه انجام محاسبات در تیتراسیون را بیان میکنیم. به طور مثال، هیدروکلریک اسید را با سدیم هیدروکسید طبق واکنش زیر تیتر میکنند.
به عنوان نمونه، برای تیتراسیون ۶۰ میلیلیتر از محلول به ۳۰ میلیلیتر محلول ۱ مولار سدیم هیدروکسید نیاز داریم. در این مثال، نیاز داریم تا غلظت را تعیین کنیم. میدانیم در نقطه تعادل، تعداد مولهای هیدروکلریک اسید و سدیم هیدروکسید با یکدیگر برابرند در نتیجه با استفاده از رابطه ، حاصلضرب غلظت در حجم را برای اسید و باز با یکدیگر برابر قرار میدهیم.
حجم باز × مولاریته باز = حجم اسید × مولاریته اسید
با جایگذاری دادهها در رابطه بالا، به رابطه زیر میرسیم:
بنابراین، غلظت هیدروکلریک اسید برابر با 0/5 مولار است.
ثابت تفکیک اسید
در بررسی نظریه برونستد-لوری برای اسیدها و بازها مختصری در خصوص اسیدها و بازهای قوی و ضعیف صحبت کردیم. «ثابت تفکیک اسید» (Acid Dissociation Constant) یا ، معیاری برای سنجش قدرت یک اسید در محلول به شمار میآید. در حقیقت، ثابت تعادل برای واکنش تفکیک یک اسید در محلول آبی است. فرق ثابت تعادل و ثابت یونش این است که ثابت یونش که یکی از انواع ثابت تعادل به شمار میرود، تنها برای واکنشهای اسید و باز در نظر گرفته میشود.
در واکنش تعادلی بالا، تغییر غلظتی در هیچیک از واکنشدهندهها و فرآوردهها نداریم. همچون سایر ثابتهای تعادل، مقدار را از طریق غلظت مولی (مولاریته) هرکدام از ذرات محلول در آب محاسبه میکنند. به این ترتیب، مقدار از رابطه زیر بدست میآید.
ثابت تفکیک اسید به طور معمول در اسیدهای ضعیف کاربرد دارد که در آب به طور کامل تفکیک نمیشوند زیرا فرض بر این است که اسیدهای قوی به طور کامل در آب یونیزه خواهند شد و بنابراین، میزان ثابت تفکیک اسید برای آنها عدد بسیار بزرگی خواهد بود.
Ka و pKa
به دلیل مقادیر مختلفی که اختیار میکند، مقیاسی لگاریتمی از ثابت تفکیک اسید، کاربرد بیشتری خواهد داشت. این مقیاس لگاریتمی به صورت رابطه زیر بیان میشود:
هرقدر میزان بزرگتر باشد، مقدار تفکیک آن کمتر است. یک اسید ضعیف مقادیری بین تا را اختیار میکند. اسیدهایی با مقادیر کمتر از ، اسیدهایی قوی به شمار میآیند. تصویر زیر تفکیک جزئی استیک اسید را به یونهای هیدروژن و استات نشان میدهد.

مثال محاسبه pKa
استیک اسید یک اسید ضعیف به شمار میآید که ثابت تفکیک آن برابر با است. مقدار استیک اسید را حساب کنید.
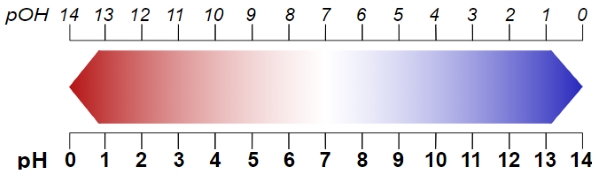
pH و pOH
واکنش خودیونش آب را در نظر بگیرید:
همانطور که در بالا نیز به آن اشاره شد، این واکنش، ثابت تعادل ویژه به صورت دارد که میتوان آن را به صورت زیر نوشت:
از آنجایی که یونهای هیدروژن و هیدروکسید با نسبت مولی ۱ به ۱ تفکیک میشوند،خواهیم داشت:
اگر از هریک از غلظتها لگاریتم منفی بگیریم، به روابط زیر میرسیم:
روابط بالا نشان میدهند که چرا مقدار pH آب خالص برابر با ۷ است. در این مقدار pH، غلظتهای یون هیدروژن و هیدروکسید با یکدیگر برابر هستند. همچنین، باید به رابطه زیر نیز توجه داشته باشیم:
از این رابطه برای پیدا کردن pH از روی pOH و غلظت یون هیدروژن از طریق غلظت یون هیدروکسید استفاده میشود.
فیلم آموزش اسیدها و بازها در شیمی عمومی
از آنجایی که شیمی عمومی یکی از مباحث پایه در علوم دانشگاهی به شمار میآید و همچنین به دلیل اهمیت مبحث اسیدها و بازها در این شاخه از شیمی، «فرادرس» اقدام به انتشار فیلم آموزش اسیدها و بازها در شیمی عمومی در قالب آموزشی ۳۱ دقیقهای کرده است که در ادامه به آن اشاره میکنیم.
در این آموزش، ابتدا آب و محلولهای اسیدی معرفی و تفکیک آب و معادلات مربوط به آن بررسی میشوند. در ادامه و پس از معرفی شناساگرها، اسیدها و بازهای قوی ضعیف بررسی خواهند شد و در انتها نیست نظریه لوییس در خصوص اسیدها و بازها مورد بررسی قرار میگیرد.













