ثابت تعادل چیست؟ – از صفر تا صد + فرمول ها
یک واکنش برگشتپذیر همانطور که از نامش پیداست، میتواند در هر دو مسیر رفت و برگشت انجام شود. در یک سیستم بسته، بیشتر واکنشها به لحاظ نظری برگشتپذیر هستند. این مفهوم، اساس تعریف یک عدد ثابت با نام «ثابت تعادل» (Equilibrium Constant) است. البته در برخی از موارد، اگر واکنشی به شدت تمایل به تشکیل واکنشدهندهها یا فرآوردهها داشته باشد، میتوان آن را به عنوان واکنش برگشتناپذیر طبقهبندی کرد. نماد این واکنش در فرمول شیمیایی، به صورت یک فلش دو طرفه ، به خوبی بیانگر این است که واکنشها میتوانند در جهت تولید فرآورده یا واکنشدهنده، انجام شوند. یکی از نمونههای واکنش برگشتپذیر، تشکیل «دیاکسید نیتروژن» از «دینیتروژن تترا اکسید» است:


فرض کنید مقادیری از گاز بیرنگ دینیتروژن تترا اکسید را در یک کپسول شیشهای وارد کنیم و آن را در دمای اتاق قرار بدهیم. با تحت نظر قرار دادن کپسول در طول زمان، مشاهده خواهیم کرد که رنگ گاز در کپسول به سمت رنگ زرد مایل به نارنجی میرود و تیرهتر میشود. این فرآیند، تا زمانی که تغییر رنگ آن ثابت شود، ادامه مییابد. میتوانیم غلظت گازهای دیاکسید نیتروژن و دینیتروژن تترا اکسید را به صورت نمودار غلظت بر حسب زمان رسم کنیم. این نمودار در تصویر زیر آورده شده است:
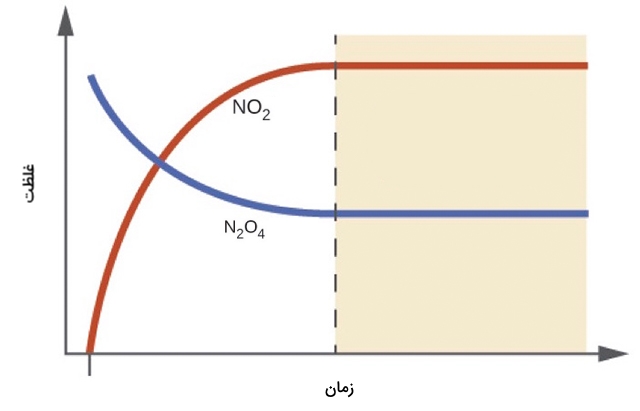
در ابتد، کپسول تنها شامل گاز است. با تبدیل گاز به غلظت گاز دیاکسید نیتروژن، تا یک مقدار مشخصی افزایش مییابد و سپس مقدار آن در طول زمان ثابت میماند. این افزایش در نمودار به صورت خطچین از بقیه نمودار جدا شده است. به طور مشابه، غلظت نیز با گذشت زمان کاهش مییابد تا به یک غلظت تعادلی با گاز دیاکسید نیتروژن برسد. زمانی که غلظتهای و در یک مقدار مشخصی ثابت شوند، واکنش به تعادل رسیده است.
تعادل دینامیک
تمامی واکنشها تمایل دارند تا به نقطهای برسند که فرآیندهای رفت و برگشت، با یک آهنگ و همزمان با یکدیگر اتفاق بیافتند. به دلیل اینکه آهنگ واکنشهای رفت و برگشت یکسان است، غلظت واکنشدهندهها و فرآوردهها در نقطه تعادل نیز یکسان خواهد بود.
ذکر این نکته لازم است که اگرچه غلظتها در نقطه تعادل یکسان هستند اما واکنش همچنان در حال انجام است. به همین علت در مواردی به این وضعیت، تعادل دینامیکی (پویا) نیز میگویند.

تعریف ثابت تعادل
میتوان بر اساس غلظت واکنشدهندههای مختلف یک واکنش که به تعادل رسیدهاند، مقداری را با نام ثابت تعادل تعریف کرد. این عدد را با ، و در مواردی با نشان میدهند. حرف در این عبارت بر «غلظت» (Concentration) دلالت دارد چراکه در حقیقت ثابت تعادل، بیانی برای غلظتهای تعادلی بر حسب مولار و دمای مشخصی است. ثابت تعادل به ما کمک میکند که بفهمیم که در یک واکنش در حالت تعادل، غلظت کدامیک از واکنشدهندهها یا فرآوردهها بیشتر است. همچنین به کمک این عبارت، حالت تعادلی یا غیرتعادلی یک واکنش را میتوان تعیین کرد.
نحوه محاسبه ثابت تعادل
واکنش تعادلی زیر را در نظر بگیرید:
اگر غلظت مولی هر یک از اجزای واکنشدهنده و فرآورده را داشته باشیم، ثابت تعادل از رابطه زیر بدست میآید:
در رابطه بالا:
- و : غلظتهای تعادلی واکنشدهندهها (بر حسب مولاریته)
- و : غلظتهای تعادلی فرآوردهها (بر حسب مولاریته )
- ، ، و : ضرایب استوکیومتری معادله موازنه شده (بر حسب مولاریته )

مبنای ترمودینامیکی برای عبارات ثابت تعادل
تعادل ترمودینامیکی با حداقل بودن انرژی آزاد برای کل سیستم مشخص میشود. برای سیستمهایی با دما و فشار ثابت، انرژی آزاد گیبس در پایینترین مقدار ممکن خود قرار دارد. در این حالت شیب نمودار انرژی آزاد بر حسب پیشرفت واکنش معادل صفر خواهد بود.
تغییر انرژی آزاد در سیستمهای چند جزئی، میتواند به صورت مجموع حاصل ضرب مقدار در پتاسیل شیمیایی هر جزء تعریف شود و انرژی آزاد گیبس مولی جزئی نام دارد. بنابراین پتانسیل شیمیایی هر جزء برابر است با:
ثابت تعادل شیمیایی میتواند به صورت زیر نوشته شود:
در معادله فوق
Reactant: واکنشدهنده (ها)
Product: فراورده (ها)
: ضریب استوکیومتری واکنشدهنده (ها)
ضریب استوکیومتری فراورده (ها)
بنابراین در تعادل داریم:
پتانسیل شیمیایی هر جزء از طریق اکتیویته آن به صورت زیر محاسبه میشود:
در معادله فوق
: پتانسیل شیمیایی استاندار هر جزء
: ثابت گازها و
: دما.
با فرض برابر بودن واکنشدهندهها و فراوردهها خواهیم داشت:
با مرتب کردن عبارات بالا داریم:
رابطه فوق ارتباط بین انرژی آزاد گیبس را با ضریب واکنش مقادیر اکتیویته در تعادل نشان میدهد.
معادل سازی عبارات سینتیکی و ترمودینامیکی برای ثابتهای تعادل
در تعادل، سرعت مسیر رفت واکنش با سرعت برگشت برابری میکند (مانند واکنش ساده هیدرولیز استر).
در رابطه بالا سرعتهای رفت (Forward) و برگشت (Backward) به صورت زیر محاسبه میشوند:
طبق نظریههای «پیتر واگ» (Peter Waage) و «کاتو گولدبرگ» (Cato Maximilian Guldberg) واکنشی در حالت تعادل قرار دارد که سرعت رفت با سرعت برگشت برابر باشد. در این شرایط، ثابت تعادل به صورت نسبت سرعت رفت به سرعت برگشت تعریف میشود:
در صورتیکه غلظت آب، ثابت در نظر گرفته شود رابطه فوق به شکل زیر در میآید:
ضریب غلظت ویژه دارای جهت بوده در حالیکه ثابت تعادل ترمودینامیکی همیشه بدون جهت است.
نکاتی در خصوص نحوه محاسبه ثابت تعادل
نکات مهمی را به هنگام محاسبه ثابت تعادل باید در نظر بگیرید. این نکات عبارتند از:
- تابعی از دما هم هست؛ به این معنی که این عبارت برای یک واکنش خاص در دمای ثابت، مقداری ثابت است اما با تغییر دما، میزان نیز تغییر میکند.
- جامدات خالص، همانند مایعات خالص که شامل حلالها نیز میشوند، در رابطه بالا قرار نمیگیرند.
- معمولا بدون واحد است.
- واکنش باید به صورت موازنه شده و با کمترین اعداد صحیح ممکن بازنویسی شود تا مقادیر درستی از بدست آید.
لازم به ذکر است در صورتیکه هر کدام از واکنشدهندهها یا فرآوردهها به صورت گاز باشند، ثابت تعادل را بر اساس فشار جزئی گاز مینویسیم. این نوع از نوشتار را با نمایش میدهیم تا از محاسبات ثابت تعادل بر حسب مولاریته جدا باشد.
اطلاعاتی که ثابت تعادل در اختیار ما قرار میدهد
مقدار در خصوص غلظت واکنشدهندهها و فرآوردهها در حالت تعادل، به ما اطلاعاتی میدهد که در زیر آورده شده است:
- مقادیر بیش از بیان میکند که در واکنش، میزان فرآورده در حالت تعادل بیشتر است.
- برای بسیار کم و در حدود یا کمتر، در واکنش تعادلی، میزان واکنشدهندهها بیشتر است.
- اگر بین و باشد، غلظتهای خوبی از هر دو ماده واکنشدهنده و فرآورده داریم.
با توجه به مطالب گفته شده میتوان به این نتیجه رسید که در خیلی بزرگ یا خیلی کوچک، به ترتیب تمایل واکنشِ در حال تعادل، به تولید فرآورده یا واکنشدهنده است.

حل چند مثال
برای فهم بهتر موضوع به بررسی و حل چند مثال میپردازیم:
به واکنش زیر بین گوگرد دیاکسید و اکسیژن توجه کنید:
این واکنش در دمای به حالت تعادل قرار دارد.
غلظتهای تعادلی هرکدام از واکنشدهندهها و فرآوردهها در زیر آورده شده است:
با حل رابطه زیر، میتوانیم میزان ثابت تعادل برای این واکنش را حساب کنیم:
باید توجه داشت که میزان در عبارت بالا بین و است به این معنی که غلظت خوبی از واکنشدهندهها و فرآوردهها در واکنش داریم.

استفاده از خارج قسمت واکنش برای پیشبینی تعادل واکنش
مفهوم «خارج قسمت واکنش» (Reaction Quotient) که با نشان داده میشود بیان میکند که اگر غلظتهایی به غیر از غلظتهای تعادلی داشته باشیم، میتوانیم با مقایسه عدد بدست آمده با ، پیشبینی کنیم که آیا واکنش در حال تعادل است یا خیر.
دیدیم که ثابت تعادل مثال قبل برای واکنش در دمای T برابر بود. حال اگر غلظتهای دیگری از واکنشدهندهها و فرآوردهها داشته باشیم که به شکل زیر باشد:
\begin{aligned}\left[\mathrm{SO}_{2}\right] &=3.6 \mathrm{M} \\\left[\mathrm{O}_{2}\right] &=0.087 \mathrm{M} \\\left[\mathrm{SO}_{3}\right] &=2.2 \mathrm{M} \end{aligned}
با محاسبه خارج قسمت واکنش خواهیم داشت:
\begin{aligned} Q &=\frac{\left[\mathrm{SO}_{3}\right]^{2}}{\left[\mathrm{SO}_{2}\right]^{2}\left[\mathrm{O}_{2}\right]} \\ &=\frac{[2.2]^{2}}{[3.6]^{2}[0.087]} \\ &=4.3 \end{aligned}
با توجه به میزان و برابری آن با ، واکنش در حال تعادل است.

پیشبینی جهت پیشرفت واکنش
با مقایسه مقادیر خارج قسمت واکنش و ثابت تعادل، میتوان جهت پیشرفت واکنش را تعیین کرد. بدین منظور، حالات مختلفی برای و پیش میآید که در زیر به بررسی آن میپردازیم:
- : در این حالت، سیستم در حال تعادل است و واکنش در هیچ جهتی پیش نمیرود.
- : غلضت واکنشدهندهها بیش از فرآوردهها است و واکنش تا رسیدن به تعادل ادامه پیدا میکند. با این شرایط، واکنش به سمت فرآوردهها در حرکت است.
- : در این شرایط، خارج قسمت واکنش از ثابت تعادل کمتر است. بنابراین در این شرایط نیز واکنش به سمت راست (تولید فرآورده) در حال پیشرفت است.
- : در این حالت، میزان فرآوردهها بیشتر از واکنشدهندهها است و در نتیجه واکنش به سمت چپ (تولید واکنش دهنده) پیش خواهد رفت.

ثابت تعادل فشار
تعادل در واکنشهای گازی معمولا با فشار جزئی توصیف میشود. در یک واکنش در حال تعادل، ثابت تعادل فشار عبارتست از نسبت فشار فرآوردهها به واکنشدهندهها:
برای واکنش بالا، ثابت تعادل از رابطه زیر حساب میشود:
در رابطه بالا، میتواند هریک از واحدهای فشار مانند اتمسفر یا بار را اختیار کند.
تبدیل ثابت تعادل به ثابت تعادل فشار
برای تبدیل به از رابطه زیر استفاده میکنیم:
یا
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش هایسیس HYSYS برای شبیه سازی فرایندهای شیمیایی
- لوازم آزمایشگاه شیمی — از صفر تا صد
- الکترولیت و هدایت الکتریکی — از صفر تا صد
^^













سلام
چرا مرتبه ی غلظت ها ضریب استوکیومتری مواد هست در صورت غیر تک مرحله ای بودن واکنش؟
سلام ممنون از مطالبتون
علت برابری ثابت تعادل آب با عدد ده به توان منفی ۱۴ چیه؟
با سلام؛
مقدار ثابت تعادل آب را میتوان با اندازهگیری غلظت یونهای هیدرونیوم یا هیدروکسید اندازه گرفت. غلظت این یونها با استفاده از pH آب که برابر با ۷ است به دست میآید. مقدار غلظت این یونها در دمای ۲۵ درجه سانتیگراد برابر با 10−7 است. از آنجا که ثابت تعادل آب برابر با ضرب غلظت این دو یون است، ثابت تعادل آب 10−14 میشود.
با تشکر از همراهی شما با مجله فرادرس
سلام ممنون از مطلب مفیدتون
اثبات ثابت تعادل رو بگید چرا غلظت ها به توان ضرایب رسیدند و چرا در انها ضرب نشده اند و اینکه ایا این فرمول بر اساس احتمال برخورد فراورده ها )احتمال انجام واکنش برگشت ) به احتمال برخورد واکنش دهنده ها است )احتمال انجام واکنش رفت) ؟
با سلام؛
اثبات این رابطه از طریق روابط لگاریتمی، ارتباط با انرژی آزاد گیبیس و اکتیویته امکانپذیر است و بهزودی اثبات آن در همین مطلب قرار داده خواهد شد.
با تشکر از همراهی شما با مجله فرادرس
سلام ،ثابت تعادل آب چنده ؟هرچی تو گوگل سرچ میکنم نیستش !!
Kw برابر است با 10 به توان منفی 14.
با سلام؛
برای آشنایی با ثابت تعادل آب میتوانید مطلب زیر را مطالعه کنید:
pH چیست؟ — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
ثابت سرعت میتونه بی نهایت باشه؟؟
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. پیشنهاد میکنیم برای آشنایی با سرعت واکنش و ثابت سرعت، مطلب «سرعت واکنش — به زبان ساده» را مطالعه کنید. در این مطلب میبینیم که ثابت سرعت به دما وابسته است و با افزایش دما، افزایش مییابد و حد بیشینه ثابت سرعت، زمانی است که دما به بینهایت برسد.
با تشکر
سلام مرسی واقعاً توضیحاتتون روان و به راحتی قابل فهم بود. موفق باشید.
با عرض سلام و تشکر از مطالب مفیدتون
آیا میتوان از عکس ثابت تعادل هم استفاده کرد؟و اینکه هیچ مفهومی هم داره؟
ممنون میشم پاسخ بدید
ایا در ثابت تعادل میشه بجای مولاریته از نرمالیته هم استفاده بشه؟
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. طبق تعریف، برای محاسبه ثابت تعادل باید از غلظت مولار استفاده شود.
با تشکر
عالی