مقایسه الکترونگاتیوی عناصر در جدول – به زبان ساده
الکترونگاتیوی تمایل یک اتم به جذب جفت الکترونهای پیوندی است. پیوندهای بین اتمها و مولکولها، چه قطبی باشند و چه ناقطبی، با کمیتی به نام الکترونگاتیوی مشخص میشوند. هرچه توانایی یک عنصر در جذب این الکترونها بیشتر باشد، میزان الکترونگاتیوی آن نیز بیشتر است. الکترونگاتیوی که یک مفهوم نسبی است مفهومی مهم در بررسی پیوند بین اتمها و نوع مولکولها به شمار میآید. در یک پیوند کووالانسی قطبی، الکترونها بیشتر به سمت عنصری با الکترونگاتیوی بالاتر متمایل هستند. بنابراین، اتم یا عنصر الکترونگاتیوتر دارای بار نسبی منفی است. در مقایسه الکترونگاتیوی عناصر متوجه میشویم الکترونگاتیوی در یک ردیف جدول از چپ به راست افزایش مییابد و در یک گروه از بالا به پایین کاهش میابد. در این مطلب از مجله فرادرس، درباره مقایسه الکترونگاتیوی عناصر جدول تناوبی و عوامل تأثیرگذار بر الکترونگاتیوی بیشتر میآموزیم و مثالهایی را برای درک بهتر این موضوع ارائه میکنیم.
- یاد خواهید گرفت که الکترونگاتیوی چگونه ماهیت پیوندهای شیمیایی را تعیین میکند.
- خواهید آموخت عوامل مؤثر بر مقدار الکترونگاتیوی هر عنصر کداماند.
- یاد میگیرید اختلاف الکترونگاتیوی چگونه نوع و قطبیت پیوند را مشخص میکند.
- با روابط قطری و استثناهای الکترونگاتیوی در جدول تناوبی آشنا میشوید.
- خواهید توانست مفهوم الکترونگاتیوی را از سایر ویژگیها مانند الکترونخواهی متمایز سازید.
- استفاده از مقیاس پاولینگ برای مقایسه تمایل عناصر به جذب الکترون را یاد خواهید گرفت.


ما در این مطلب به بررسی مقایسه الکترونگاتیوی عناصر در جدول تناوبی و رابطه آن با ویژگیهای اتمها میپردازیم، همچنین روشهای اندازهگیری و اهمیت این مقایسه را مورد بررسی قرار میدهیم. سپس روندهای الکترونگاتیوی در ردیفها و گروههای جدول تناوبی، روابط قطری و تاثیر این ویژگی بر نوع و قطبیت پیوندها نیز بررسی خواهند شد. در انتها تفاوتها و شباهتهای الکترونگاتیوی با الکترونخواهی و انرژی یونیزاسیون، و تاثیر عواملی همچون بار هسته، شعاع اتمی، و لایههای الکترونی را در این زمینه تحلیل میکنیم. با مطالعه این مطلب تا انتها با این پارامتر مهم و ویژگیهای آن آشنا شوید.
الکترونگاتیوی چیست؟
الکترونگاتیوی یک خاصیت شیمیایی مربوط به عناصر است که عبارت است از تمایل اتم به جذب الکترون. خاصیت الکترونگاتیوی به عوامل مختلفی بستگی دارد و این عوامل در هر اتم به ویژگیهای آن وابسته اند. این کمیت نشان میدهد که الکترونهای پیوند چگونه بین اتمهای درگیر توزیع شدهاند. این خاصیت یک مقدار نسبی است و به تنهایی و به صورت فیزیکی قابل اندازهگیری نیست. به عکس خاصیت الکترونگاتیوی، الکتروپوزتیوی میگویند. با افزایش الکترونگاتیوی، پراکندگی الکترونها و میزان بار نسبی اتمها نیز بیشتر خواهد بود. در ادامه به بررسی بیشتر الکترونگاتیوی و روش مقایسه الکترونگاتیوی عناصر بیشتر میپردازیم.
الکترونگاتیوی با خصلت نافلزی عناصر رابطهای مستقیم دارد.

مقایسه الکترونگاتیوی عناصر در جدول تناوبی
در قسمت قبل بیان کردیم که مقایسه الکترونگاتیوی عناصر، اطلاعات ارزشمندی را در اختیار ما قرار میدهد. برای مقایسهی میزان الکترونگاتیوی عناصر، ابتدا به یک دستهبندی جامع از عناصر بر اساس ویژگیهایشان نیاز داریم. کاملترین دستهبندی اتمها در جدول تناوبی عناصر ارائه شده است. در این جدول، عناصر بر اساس آرایش الکترونی آنها قرار گرفتهاند. به همین دلیل، جایگاه هر عنصر در جدول تناوبی میتواند اطلاعات مهمی درباره خواص شیمیایی و نوع پیوندهایی که اتم تشکیل میدهد، ارائه کند.
عناصر موجود در گروههای یکسان در جدول تناوبی، تعداد برابری از الکترونهای لایه آخر دارند. عناصر موجود در ردیفهای یکسان نیز تعداد برابری از لایههای الکترونی دارند. عدد اتمی مشخص شده در این جدول، نشاندهنده تعداد پروتونهای موجود در هسته این عناصر است. برای مطالعه بیشتر درباره آرایش الکترونی عناصر پیشنهاد میکنیم مطلب زیر از مجله فرادرس را مطاله کنید که به زبانی ساده این مفهوم و نحوه رسم آن را توضیح میدهد.
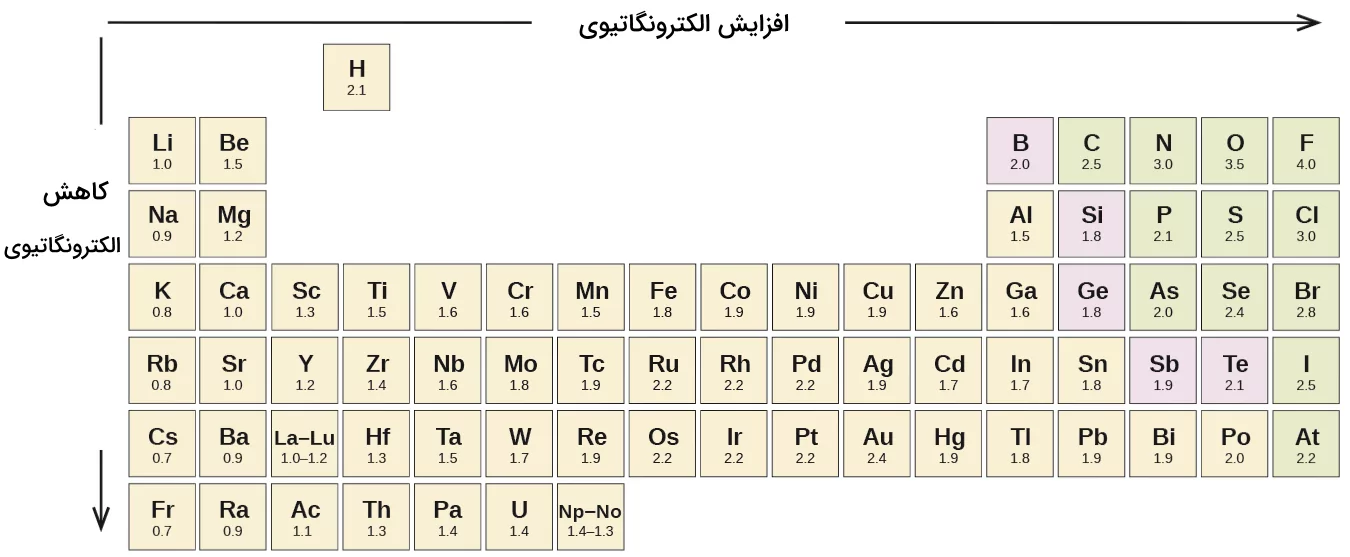
پیشتر توضیح دادیم که الکترونگاتیوی اتمها یک امر نسبی است و میزان تمایل آنها به جذب الکترونهای پیوند را نشان میدهد. الکترونهای والانس هر دو اتم همواره در پیوند شیمیایی درگیر هستند. پیوندهای شیمیایی اساس تشکیل ترکیبات از عناصر مختلفاند. در زمان تشکیل این پیوندها، برخی از عناصر، قدرت بیشتری در جذب الکترونهای پیوند دارند. بنابراین، یکی از اتمها نسبت به دیگری الکترونگاتیوتر است. در ادامه، تصویری برای توضیح بهتر این موضوع ارائه شده است. این تصویر میزان الکترونگاتیوی عناصر در جدول تناوبی را که توسط شیمیدان معروف «لینوس پاولینگ» ارائه شده، نشان میدهد.
میزان الکترونگاتیوی عناصر از چپ به راست در جدول تناوبی افزایش مییابد. همچنین، در مقایسه الکترونگاتیوی عناصر در یک گروه، مشاهده میکنیم این کمیت از بالا به پایین کاهش مییابد. این پدیده به دلیل تفاوت در بار هسته اتمها و تفاوت اندازه آنها است. بنابراین، عناصر بالای سمت راست جدول تناوبی بیشترین الکترونگاتیوی را دارند. اتم نافلز فلوئور در گوشه بالا و سمت راست جدول تناوبی، بیشترین میزان الکترونگاتیوی (EN = 4) و عناصر سزیم و فرانسیم با الکترونگاتیوی ۰٫۷۹ کمترین میزان الکترونگاتیوی را دارند. فلزها در جدول تناوبی کمتر الکترونگاتیو هستند و فلزات گروه ۱ کمترین میزان الکترونگاتیوی را در مقایسه با سایر عناصر دارند. این بدان معناست که فلوئور بیش از سایر اتمها به جذب الکترونهای پیوند تمایل دارد. در ادامه، از این مقادیر برای توضیح و تشخیص نوع پیوند تشکیلشده بین اتمها استفاده خواهیم کرد.
توجه داشته باشید که گروه گازهای نجیب در این تصویر آورده نشده است، زیرا این عناصر تمایلی به اشتراکگذاری الکترون با سایر اتمها ندارند.
یادگیری شیمی دروازدهم با فرادرس
مقایسه الکترونگاتیوی جدول عناصر یکی از مهمترین مباحثی است که در شیمی دوازدهم فراگرفته میشود. این مبحث به اطلاعات جامعی درباره نوع واکنشهای شیمیایی عناصر و ویژگیهای آنها نیز میپردازد. برای آموزش بیشتر درباره الکترونگاتیوی عناصر پیشنهاد میکنیم مجموعه فیلمهای آموزش پایه دوازدهم مخصوصا بخش شیمی ۳ بهره ببرید که با زبانی ساده ولی کاربردی این مباحث را توضیح می دهند. در این بخش آموزشی، همچنین میتوانید درباره انتقال الکترونی در واکنشها، عدد اکسایش و واکنشهای الکتروشیمیایی، مواد کووالانسی، یونی، مولکولی و فلزی و ویژگیهای آنها بیشتر بیاموزید.
همچنین برای مشاهده آموزشهای بیشتر، میتوانید از آموزشهای زیر در مجموعه فرادرس بهره ببرید.
- فیلم آموزش پیوند شیمیایی
- فیلم آموزش شیمی عمومی جامع و با مفاهیم کلیدی
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله
مقایسه الگوهای الکترونگاتیوی عناصر در جدول تناوبی
در قسمتهای قبل به این موضوع پرداخته شد که الکترونگاتیوی در یک ردیف جدول تناوبی از چپ به راست افزایش و در یک گروه از بالا به پایین کاهش مییابد. در ادامه هرکدام این مسائل را بیشتر بررسی میکنیم.
بررسی روند الکترونگاتیوی در یک ردیف جدول تناوبی
همانطور که قبلا اشاره شد میزان الکترونگاتیوی عناصر در یک ردیف افزایش مییابد. در ادامه این موضوع را بیشتر بررسی میکنیم. برای درک بیشتر این مسئله مولکول سدیم کلراید را درنظر بگیرید. سدیم و کلر هردو در ردیف ۳ جدول تناوبی قرار دارند.
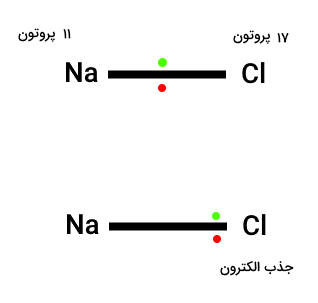
هر دو اتم سدیم و کلر الکترونهای پیوند هم سطح دارند. جفت الکترون پیوند برای هر دو اتم در لایههای 1s و 2s و 2p قرار میگیرد. با درنظر گرفتن هسته این عناصر درمییابیم هسته کلر ۱۷ پروتون و هسته هیدروژن ۱۱ پروتون دارد. به همین دلیل الکترونهای پیوند توسط پروتون های اتم کلر بیشتر کشیده میشوند. الکترونگاتیوی در یک ردیف به دلیل افزایش بار مثبت هسته اتم عناصر افزایش مییابد. این اتمها الکترونهای پیوند را با قدرت بیشتری جذب میکنند.
بررسی ترتیب الکترونگاتیوی عناصر در یک گروه جدول تناوبی
برای درک بهتر روند الکترونگاتیوی در یک گروه جدول تناوبی مولکول هیدروژن فلوئورید و هیدروژن کلراید را در نظر بگیرید.
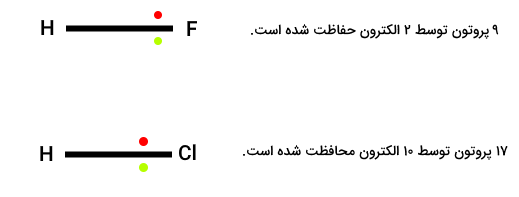
الکترونهای پیوند در مولکول هیدروژن فلوئورید در اتم فلوئور تنها در لایه 2s قرار میگیرد. اما در مولکول هیدروژن کلرید، این اتمها در تمامی لایههای 1s2s و 2p می توانند قرار بگیرند. در هر دو مورد میزان کششی از هسته اتمها بر الکترونها وجود دارد. اما در مورد هسته اتم کلر که الکترونها میتوانند در لایه سوم نیز قرار بگیرند در مقایسه با هسته اتم فلوئور که این الکترونها از لایه دوم فراتر نمیروند، تفاوت وجود دارد. از آنجا که لایه دوم به هسته اتم نزدیکتر است، قدرت کشش بیشتری روی الکترونهای این لایه نسبت به لایه سوم وجود دارد.
به همین ترتیب در حرکت از بالا به پایین گروههای جدول تناوبی، الکترونگاتیوی به دلیل اضافه شدن لایه های الکترونی اطراف هسته اتم، الکترونگاتیوی کاهش مییابد. در این روند، الکترونهای لایه آخر به ترتیب از بالا به پایین در یک گروه از هسته اتمها فاصله گرفته و اثر کششی پروتونها روی این الکترونها کاهش مییابد.
رابطه الکترونگاتیوی با ویژگیهای اتمها
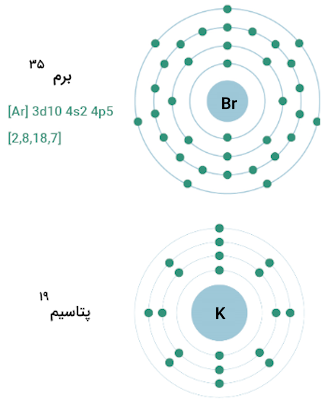
توضیح دادیم که الکترونگاتیوی هر عنصر با عددی مثبت مشخص میشود. عدد ارائه شده برای الکترونگاتیوی عناصر، ارتباط بسیار نزدیکی با عدد اتمی و شعاع اتمی دارد. برای مثال، پتاسیم الکترونگاتیوی برابر با ۰٫۸ دارد که الکترونگاتیوی کمی است. با توجه به اتم پتاسیم، مشاهده میکنیم که این اتم ۱۹ پروتون در هستهاش و ۴ لایه الکترونی دارد.
این بدان معناست که فاصله زیادی بین هسته این اتم با الکترونهای بیرونی لایه آخر آن وجود دارد. تصاویر زیر این موضوع را در رابطه با اتمهای پتاسیم (الکترونگاتیوی برابر با ۰٫۸) و برم (الکترونگاتیوی برابر با ۲٫۸) نشان میدهد.
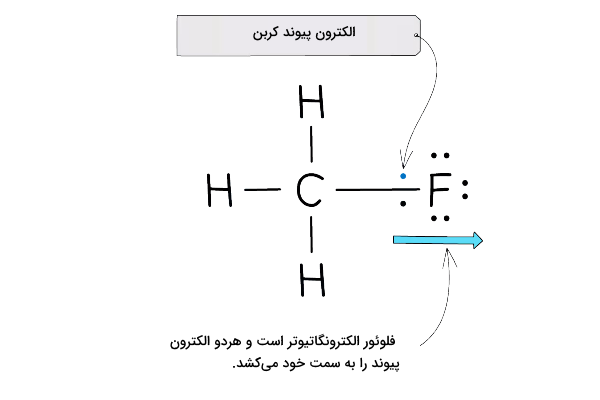
در جدول ارائهشده در قسمت قبل، مشاهده کردیم که فلوئور بالاترین الکترونگاتیوی را بین عناصر جدول تناوبی دارد. حال میخواهیم تأثیر این الکترونگاتیوی را بر الکترونهای پیوند فلوئور با سایر اتمها بررسی کنیم. برای مثال، مولکول را در نظر بگیرید. در این مولکول، اتم کربن با ۴ ظرفیت خود به سه اتم هیدروژن و یک اتم فلوئور متصل شده است. در پیوند بین اتم کربن و فلوئور، دو الکترون وجود دارد. به دلیل الکترونگاتیوی بالای اتم فلوئور، این اتم علاوه بر الکترون پیوند خود، الکترون کربن را نیز به سمت خود میکشد. این پدیده در تصویر زیر نشان داده شده است. الکترونگاتیوی کربن برابر با ۲٫۵ است.
روابط قطری و الکترونگاتیوی در جدول تناوبی
علاوه بر روند تغییرات الکترونگاتیوی در ردیف و گروه که توضیح دادیم، یک روند دیگر برای مقایسه الکترونگاتیوی عناصر نیز وجود دارد. در ابتدای ردیفهای ۲ و ۳ جدول تناوبی، در بسیاری از موارد، عنصر بالای گروه با عنصری در گروه بعدیاش شباهتهایی دارد.
سه مثال از این موارد در شکل زیر نشانداده شده است. توجه کنید که این شباهت ها به صورت قطری وجود دارند. این شباهتها دراتمهای کنار هم وجود ندارد.
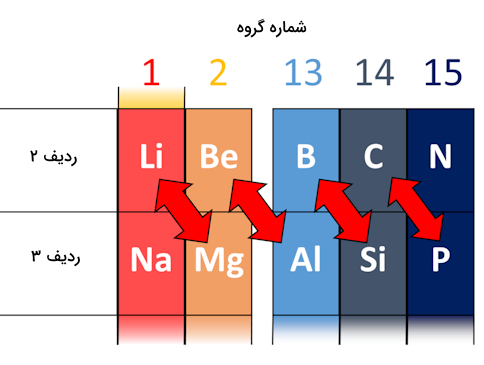
برای مثال عنصر بور که یک نافلز است با برخی از ویژگیهای عنصر سیلیسیم شباهتهایی دارد. برلیم نیز شباهتهایی با عنصر آلومینیوم دارد. همین ترتیب برای دو عنصر لیتیوم و منیزیم نیز وجود دارد. به این شباهتها روابط قطری در جدول تناوبی گفته میشود.
دلایل زیادی برای این موضوع وجود دارد. اما این دلایل بیشتر به روند تغییر الکترونگاتیوی در جدول تناوبی بستگی دارد. الکترونگاتیوی در حرکت به سمت راست جدول تناوبی افزایش مییابد. برای مثال در مقایسه الکترونگاتیوی عناصر بور و برلیم خواهیم دید الکترونگاتیوی این دو عنصر به یکدیگر نزدیک هستند. همچنین در مقایسه الکترونگاتیوی عناصر بور و آلومینیوم مشاهده میکنیم این مقادیر برای این دو عنصر نیز برابر ۰٫۵ است. با مقایسه الکترونگاتیوی عناصر آلومینیوم و برلیم مشاهده میکنیم هردوعنصر الکترونگاتیوی برابر ۱٫۵ دارند. به همین صورت، الکترونگاتیوی عناصر بور(۲) و سیلیسیم (۱٫۸) و همچنین عناصر لیتیوم(۱) و منیزیم (۱٫۲) نیز به یکدیگر بسیار نزدیک است.
این نزدیکی میزان الکترونگاتیوی در روابط قطری عناصر، بدان معناست که این عناصر تمایل به برقراری پیوند های مشابه هم دارند و این مسئله باعث میشود ویژگی های شیمیایی آنها مانند هم باشد.
عوامل تاثیرگذار بر الکترونگاتیوی
همانطور که اشاره شد الکترونگاتیوی یک عنصر مقداری نسبی است و به عوامل مختلفی بستگی دارد. این عوامل مواردی مانند بار هسته اتم، شعاع اتمی و حفاظت الکترونی در لایه آخر الکترونی اتم است. در ادامه ایم مقاله از مجله فرادرس، اثر این عوامل بر الکترونگاتیوی عناصر بررسی میشود.
اثر بار هسته اتم
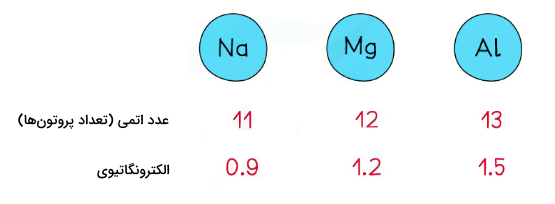
بار هسته اتم، میزان بار مثبتی است که در هسته اتم وجود دارد. این بار به دلیل وجود پروتونهای هسته اتم ایجاد میشود. اثر این عامل بر الکترونگاتیوی اتم به این شکل است که هرچه بار مثبت هسته اتم بیشتر باشد ، آن هسته قدرت بیشتری در جذب الکترون دارد. این اثر الکترونگاتیوی اتم را بیشتر میکند. یعنی هرچه بار هسته اتم بیشتر باشد، در مقایسه با عنصری با همان تعداد لایه الکترونی، الکترونگاتیوی بیشتری دارد.
در اتمهایی که چندین الکترون دارند، همهی الکترونهای اتم، تحت اثر کششی بار مثبت هسته قرار نمیگیرند. گاهی اوقات فاصله الکترونهای لایههای بیرونی اتمها انقدر از هسته زیاد است، که این کشش تاثیر آنچنانی بر این الکترونها نمیگذارد. بار مثبت هسته با افزایش عدد اتمی افزایش مییابد. در شکل زیر اثر بار مثبت هسته بر الکترونگاتیوی سه عنصر سدیم، منیزیم و آلومینیوم را مشاهده میکنید.
اثر شعاع اتمی بر الکترونگاتیوی
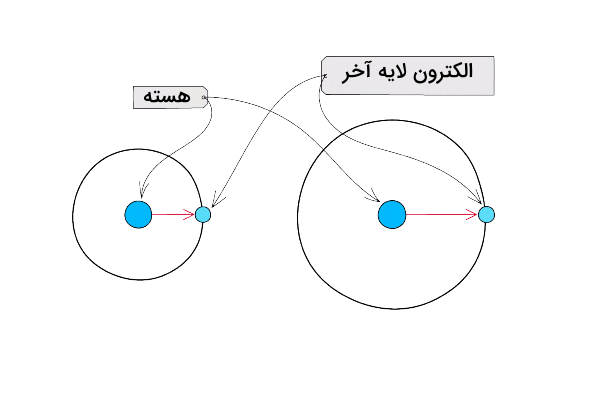
شعاع اتمی فاصله هسته یک اتم تا الکترونهای والانس آن است. به طور کلی، شعاع اتمی کوچکتر به معنی این است که الکترونها به هسته نزدیکتر هستند و هرچه الکترونها به هسته نزدیکتر باشند بیشتر توسط پروتونها جذب شده و الکترونگاتیوی بالاتری دارند . شعاع اتمی در جدول تناوبی در هر گروه از جدول تناوبی از بالا به پایین کمتر شده در نتیجه اثر بار هسته بر الکترونهای لایه آخر کم میشود. این پدیده باعث میشود الکترونها کمتر جذب هسته اتم شوند و الکترونگاتیوی کاهش بیابد.
قانون کولن
قانون کولن بیان میکند ارتباط بین شعاع اتمی و الکترونگاتیوی اتمها چگونه است. این قانون بیان میکند که نیروی بین دو بار الکترونی مستقیما با نسبت حاصلضرب بارها بر مربع شعاع، رابطه دارد.در نتیجه با کم شدن شعاع اتمی، نیروی بین دو بار و کشش الکترونی و الکترونگاتیوی افزایش مییابد. فرمول بیان شده این فرمول به شکل زیر است. در این فرمول، F نیروی بین بارها، q1 و q2 میزان بارهای جزئی، r فاصله و k ثابت کولن است.
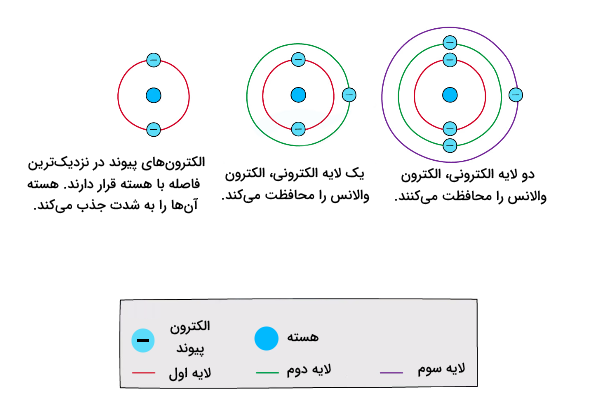
اثر پوششی لایههای درونی
الکترونهای لایههای درونی اتمها میتوانند الکترونهای لایههای بیرونی را از اثر بار مثبت هسته اتم حفظ کنند. هرچه این اثر بیشتر باشد، الکترونهای لایههای بیرونی کمتر توسط اتم جذب شده و الکترونگاتیوی کاهش مییابد. این اثر در اتمهایی با لایههای الکترونی بیشتر، تاثیرگذارتر است.
الکترونگاتیوی عناصر و نوع پیوند
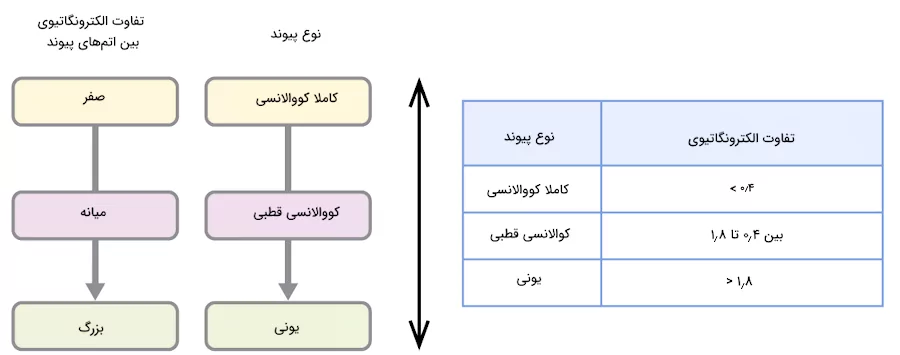
در قسمتهای قبل اشاره شد که مقایسه الکترونگاتیوی عناصر میتواند نوع پیوندهایی که اتم تشکیل میدهد را مشخص کند. میزان مطلق الکترونگاتیوی نسبی اتمهای یک پیوند میزانی از قطبیت مورد اننتظار پیوند را نشان می دهد. به همین ترتیب، نوع پیوند نیز مشخص می شود. اگر میزان این تفاوت خیلی کوچک یا صفر باشد، پیوند کووالانسی ناقطبی است. اگر این مقدار بزرگ باشد، پیوند کووالانسی قطبی یا پیوند یونی است. در ادامه تفاوت پیوند یونی و کووالانسی توضیح داده میشود.
برای مثال، میزان خالص الکترونگاتیوی بین اتمها در پیوندهای H-H، H-Cl و Na-Cl متفاوت است. این مقادیر برای ترکیب H-H برابر با صفر (ناقطبی)، برای پیوند H-Cl برابر با ۰٫۹ (قطبی) و برای پیوند Na-Cl برابر با ۲٫۱ (یونی) است. میزانی که الکترونها بین اتمهای پیوند تقسیم میشوند میتواند متفاوت باشد. این الکترونها ممکن است به میزن مساوی، با نسبتی متفاوت یا کاملا نابرابر توزیع شوند. تصویر زیر روابط بین الکترونگاتیوی و نوع پیوندها را نشان میدهد.
جدول بالا تخمینی از نوع رابطه اختلاف الکترونگاتیوی اتمها با پیوند بین آنها را نشان می دهد. در مورد این مقادیر استثناهایی وجود دارد. برای مثال اخلاف الکترونگاتیوی بین اتمهای هیدروژن و فلوئور ۱٫۹ است اما پیوند آنها کووالانسی قطبی است. همچنین اختلاف الکترونگاتیوی بین اتمهای منگنز و ید در مولکول MnI2 برابر با ۱٫۰ است اما پیوند بین آنها یونی محسوب میشود.
بهترین راهنما در تشخیص نوع پیوند بین اتمها، در نظر گرفتن نوع اتمهای پیوند و جایگاه نسبی آنها در جدول تناوبی است. پیوند بین اتمهای دو نافلز معمولا از نوع کووالانسی و پیوند بین دو اتم فلز و نافلز معمولا از نوع پیوند یونی است. برخی از ترکیبات هر دو نوع پیوند کووالانسی و یونی را دارند. اتمهای یونهای چند اتمی مانند ، و با پیوندهای کووالانسی کنار یکدیگر نگه داشته شدهاند. هرچند این یونهای چند اتمی با ترکیب شدن با یونهای بار مخالف بهوسیله پیوندهای یونی ترکیبات جدید تشکیل میدهند. برای مثال، پتاسیم نیترات که شامل کاتیون پتاسیم و یون چند اتمی نیترات است را درنظر بگیرید. پیوند بین اتمهای یون نیترات از نوع کووالانسی و پیوند بین یون نیترات و یون پتاسیم از نوع یونی است.
تعریف پیوند قطبی
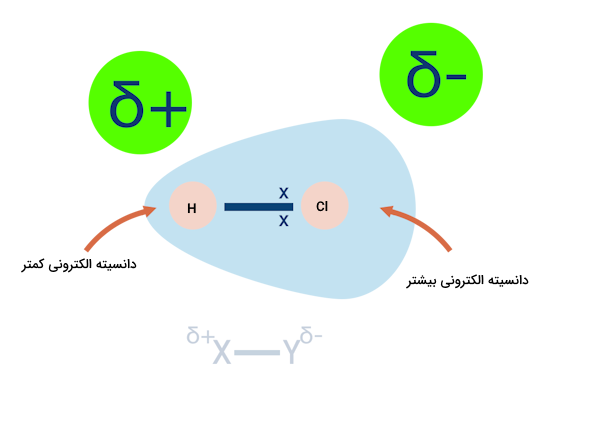
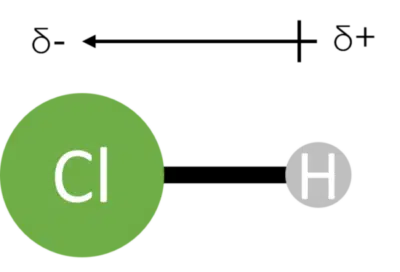
پیوند قطبی بین اتمها پیوندی است که در آن الکترونهای پیوند به طور یکسان اطراف اتمها تقسیم نشده اند. این پدیده باعث می شود یک اتم بار نسبی مثبت و یک اتم بار نسبی منفی داشته باشد. برای مثال در مولکول HCl بین دو اتم هیدروژن و کلر یک پیوند قطبی وجود دارد و اتم هیدروژن نسبتا مثبت و اتم کلر نسبتا منفی میشود.
برای درک بیشتر این مطلب مثال زیر را مطالعه کنید.
میزان قطبیت پیوند یکی از مهمترین عوامل تعیین ساختار پروتئین ها است. با استفاده از مقادیر الکترونگاتیوی ارائه شده در جدول تناوبی، ترکیبات زیر را به ترتیب افزایش قطبیت مرتب کنید. سپس اتمهای مثبت و منفی را با علامتهای و علامت گذاری کنید.
میزان الکترونگاتیوی عناصر را از جدول به دست آورده و اختلاف آنها را به صورت عدد صحیح مثبت می نویسیم. اتمی که الکترونگاتیوی بیشتر دارد، علامت منفی و اتمی که الکترونگاتیوی کمتر دارد علامت مثبت میگیرد.
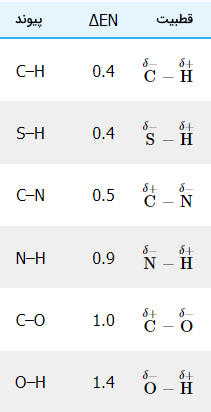
پیوندهای کووالانسی هنگامی تشکیل میشوند که الکترونهای پیوند توسط هسته دواتم درگیر در پیوند به میزان مساوی جذب شوند.
در اینگونه پیوندها میزان کشش هردو اتم دوطرف پیوند به یک اندازه است و توزیع الکترون اطراف هسته هردو اتم برابر است. این پیوندها معمولا در مولکولهایی با دو اتم یکسان تشکیل میشوند.
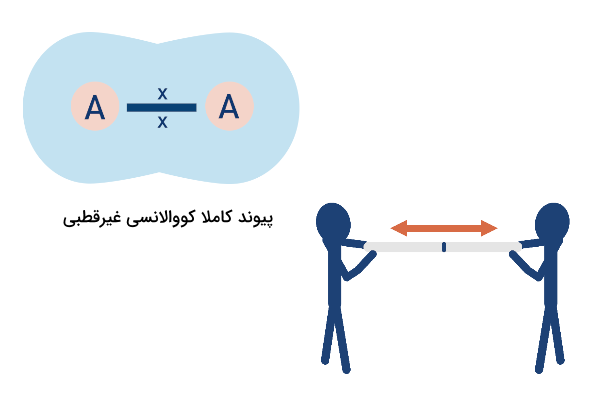
در پیوندهای قطبی این الکترونها به میزان نامساوی به اشتراک گذاشته میشوند به این دلیل که یکی از اتمها قدرت جذب الکترونی بیش از دیگری دارد. میزان قدرت اتم در جذب الکترونهای پیوند، خاصیت الکترونگاتیوی نام دارد. تفاوت در میزان الکترونگاتیوی مشخص میکند که یک پیوند تا چه حد قطبی است. در مولکولهای دواتمی با دو عنصر یکسان، تفاوت الکترونگاتیوی برابر با صفر و پیوند کاملا کووالانسی است. اگر تفاوت در میزان الکترونگاتیوی اتمهای پیوند بسیار زیاد باشد، درصورتی که یکی از اتمها فلز و دیگری نافلز باشد، پیوند بین آنها از نوع یونی است.
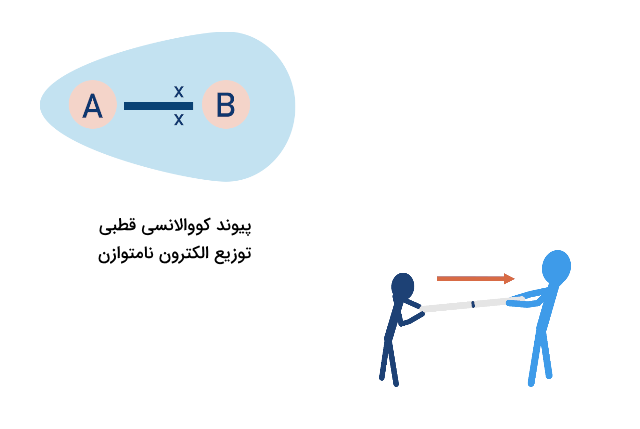
برای نشان دادن جهت قطبیت پیوند، یک فلش از بار جزئی مثبت به منفی رسم میشود.
قطبیت در مولکولهای دو و چند اتمی
در مولکولهایی با اتمهای غیرهمسان همواره باید امکان قطبیت مولکول با مقایسه الکترونگاتیوی آنها بررسی شود. در بررسی پیوند بین دو اتم ناهمسان، همواره الکترونها به اتمی که الکترونگاتیوتر است بیشتر تمایل دارند و به سمت آن کشیده میشوند. جهت و میزان قطبیت بین هر دو اتم در نهایت روی قطبیت نهایی اتم در مولکولهای چنداتمی تاثیر میگذارد. پیشتر اشاره کردیم که در پیوند بین دواتم، عنصری که الکترونگاتیوی بیشتری دارد بار جزئی منفی و اتمی که الکترونگاتیوی کمتر دارد بار جزئی مثبت دارد. همچنین در قسمت قبل آموختیم که چگونه با رسم فلشی از اتم مثبت به منفی، جهت قطبیت را در انواع پیوندها تعیین کنیم. تصویر زیر نشان دهنده این مباحث برای مولکول دواتمی HCl است.
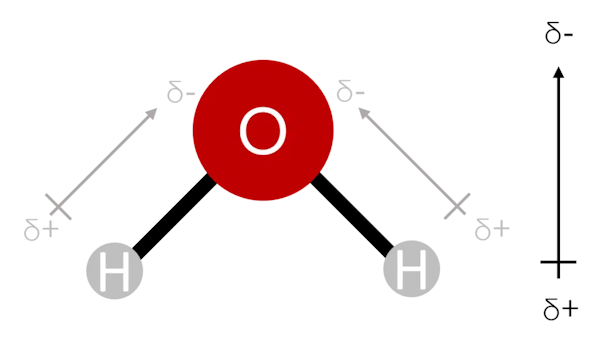
عوامل مختلفی میتوانند روی قطبیت کلی مولکولهای چند اتمی تاثیرگذار باشند. در مولکول های چند اتمی با عناصر متفاوت، وجود دوقطبی های مختلف بین هر دو اتم به شکل کلی هندسی مولکول بستگی دارد. اگر دوقطبیهای رسم شده در این مولکولها هم جهت باشند، جهت قطبیت مولکول از برایند این دوقطبیها به دست میاید. در شکل زیر که دوقطبیها و جهت قطبیت کلی مولکول آب ترسیم شده است، این موضوع به خوبی نشان داده میشود.
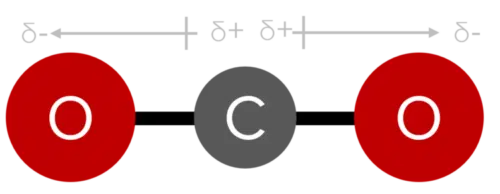
اگر فرم هندسی مولکول آب به درستی رسم نشود، این قطبیت به خوبی و درستی نشان داده نمیشوند. در ساختار خطی قطبیتهایی که خلاف جهت یکدیگر هستند اثر هم را خنثی میکنند و در آن صورت مولکول کلی قطبیت خاصی نخواهد داشت. مولکول کربن دی اکسید یکی از نمونههای این مورد است. جهت قطبیت پیوندهای بین اتمهای اکسیژن و کربن در دوجهت مخالف بوده و اثر یکدیگر را خنثی میکنند.
الکترونگاتیوی، الکترونخواهی و انرژی یونیزاسیون
تا اینجا آموختیم که الکترونگاتیوی خاصیتی مربوط به اتم و الکترونها است. سه پارامتر مهم در مورد هر عنصر در رابطه با تعامل آن با الکترون بیان میشود. این سه پارامتر، الکترونگاتیوی، الکترونخواهی (میل ترکیبی الکترونی) و انرژی یونیزهشدن (انرژی یونش) هستند. این پارامترها همگی به نوعی با از دست دادن و جذب الکترون توسط عناصر ارتباط دارند. در ادامه این مطلب از مجله فرادرس، الکترونگاتیوی عناصر را با این دو پارامتر دیگر مقایسه میکنیم.
مقایسه الکترونگاتیوی عناصر با الکترون میل ترکیبی
یکی از تعاریف مهم دیگری که در رابطه با خواص عناصر بیان میشود، کشش الکترونی یا میل ترکیبی الکترونی است. کشش الکترونی یک کمیت قابل اندازهگیری فیزیکی است. این کمیت با اندازهگیری انرژی آزادشده یا جذبشده هنگامی که یک اتم ایزوله گازی الکترون جذب میکند، بر حسب کیلوژول بر مول اندازهگیری میشود.
فرمول کلی این فرایند به شکل زیر است.
تفاوت الکترونگاتیوی با الکترون خواهی در این است که الکترونگاتیوی بیان میکند که یک اتم با چه شدتی الکترونهای پیوند را به سوی خود میکشد، این کمیت بدون بعد است و به تنهایی برای هر عنصر قابل اندازهگیری نیست. لینوس پاولینگ اولین مقادیر الکترونگاتیوی را با مقایسه میزان انرژی مورد نیاز برای شکستن انواع پیوند بهدست آورد. او بهطور قراردادی این مقادیر را نسبت به اتم فلوئور و مقدار الکترونگاتیوی ۴ این عنصر اندازهگیری کرد.
مقایسه الکترونگاتیوی عناصر با انرژی یونش
همانطور که توضیح داده شد، الکترونگاتیوی یک مفهوم نسبی است که بهتنهایی قابل اندازهگیری فیزیکی نیست. انرژی یونیزاسیون (یونی شدن) عناصر یک پارامتر فیزیکی و قابل اندازهگیری است. این انرژی، میزان انرژی است که باید به یک اتم ایزوله در حالت گازی منتقل شود تا یک الکترون از دست بدهد و بار مثبت بگیرد. این پارامتر نیز بر حسب کیلوژول بر مول بیان میشود و در واقع عکس پارامتر الکترونخواهی است. فرمول کلی این فرآیند به شکل زیر نوشته میشود.
میزان انرژی یونیزاسیون در ردیفهای جدول تناوبی از چپ به راست افزایش مییابد. این انرژی همچنین مانند الکترونگاتیوی در هر گروه جدول تناوبی از بالا به پایین کاهش مییابد. میزان انرژی یونش اول (از دست دادن اولین الکترون) با دومین و در صورت انجام سومین یونش در هر عنصر متفاوت است. این پدیده به علت وجود پوشش الکترونی در لایههای الکترونی داخلی عناصر است.
تعریف الکترونگاتیوی عناصر طبق مدل میلیکان
روبرت اندرو میلیکان، میزان الکترونگاتیوی خالص اتمها را با استفاده از دو تعریف ارائه شده در مورد الکترونخواهی و انرژی یونیزاسیون تعریف کرد. طبق مدل مولیکن، مقدار عددی اولین انرژی یونیزاسیون اتم و الکترون خواهی آن باید برابر با میزان تمایل اتم برای جذب الکترون برابر باشد. طبق این تعریف نیز فرمول زیر را ارائه کرد که در آن I میزان انرژی یونیزاسیون و A میزان الکترون خواهی آن است.
اندازهگیری الکترونگاتیوی
با اینکه بررسیهای انجامشده روی الکترونگاتیوی عناصر مربوط به زمانهای بسیار گذشته است، یکی از شیمیدانهای معروف قرنهای پیش به نام لینوس پاولینگ در سال ۱۹۳۲ مقیاسی برای اندازهگیری الکترونگاتیوی ارائه داد که تا به امروز در مقایسه الکترونگاتیوی عناصر استفاده میشود. این مقیاس، مقیاس پاولینگ نام گرفت. این مقیاس بر اساس تئوری پیوند والانس شکل گرفته است و به درک روابط بین خواص شیمیایی عناصر و سایر خواص اتمها کمک میکند. سپس این مقیاس بر اساس انرژی پیوند کووالانسی بین اتمها نیز تعریف شد. هرچند الکترونگاتیوی یک عنصر نمیتواند بهصورت جداگانه و به شکل فیزیکی برای هر عنصر اندازهگیری شود.
اهمیت مقایسه الکترونگاتیوی عناصر
گفتیم که مقایسه الکترونگاتیوی عناصر اطلاعات ارزشمندی را در اختیار ما قرار میدهد. با بررسی الکترونگاتیوی عناصر مختلف میتوانیم به دو عامل مهم پیببریم.
- پیشبینی این موضوع که اتم پیوند کووالانسی تشکیل میدهد یا پیوند یونی
- پیش بینی قطبی یا غیرقطبی بودن مولکول تشکیل شده
همانطور که قبلتر اشاره شد، با شناسایی نوع پیوندهایی که یک اتم میتواند تشکیل دهد، میتوان رفتارهای شیمیایی آن اتم را پیشبینی کرد. همچنین، با داشتن اطلاعات راجع به قطبی یا ناقطبی بودن مولکولها، میتوان در بسیاری از فرایندها هوشمندانهتر عمل کرد. برای مثال، قطبی یا ناقطبی بودن مولکولها تأثیر زیادی روی انحلالپذیری آنها در حلالهای مختلف قطبی یا ناقطبی میگذارد.
جمع بندی
الکترونگاتیوی، میزان تمایل یک عنصر یا اتم به جذب الکترونهای پیوند است. تمامی اتمها بجز گازهای نجیب خاصیت الکترونگاتیوی دارند. این خاصیت مشخص میکند که اتمها چه نوع پیوندی و با چه قدرتی تشکیل میدهند. همچنین الکترونگاتیوی میتواند یک سری از ویژگی های اتمها مانند انحلال پذیری آنها در حلالهای مختلف را نیز مشخص کند. روند تغییر این خاصیت در جدول تناوبی بدین شکل است که از چپ به راست زیاد شده و از بالا به پایین کاهش مییابد. فلوئور الکترونگاتیوترین اتم جدول تناوبی و سزیم و فرانسیم الکتروپوزتیوترین اتمهای جدول هستند.