عوامل موثر بر سرعت واکنش شیمیایی چیست؟ – به زبان ساده + محاسبات
واکنشهای شیمیایی با سرعتهای متفاوتی انجام میشوند و در هر موردی تعدادی عوامل موثر بر سرعت واکنش وجود دارد. از جمله مهمترین عوامل موثر یر سرعت واکنش شیمیایی میتوان به کاتالیزور، حلال و دما اشاره کرد. آشنایی با این عوامل و تاثیر هر کدام روی واکنش به افراد فعال در این حوزه کمک میکند تا کنترل بهتری روی آنها داشته باشند و در صورت لزوم با تغییر در این عوامل سرعت را کم یا زیاد کنند.
- یاد میگیرید چگونه سرعت واکنش شیمیایی را محاسبه کنید.
- با عوامل موثر بر نرخ واکنش و شیوه اثرگذاری هر یک از آنها آشنا میشوید.
- توانایی تعیین اثر دما، غلظت و فشار بر سرعت را پیدا میکنید.
- مهارت رسم و بررسی نمودار غلظت بر حسب زمان را کسب میکنید.
- یاد میگیرید نقش کاتالیزور و نور در افزایش نرخ واکنش چیست.
- با کاربرد قانون سرعت و تشخیص مرتبه واکنش در مسائل آشنا میشوید.


در این مطلب مجله فرادرس ابتدا با عوامل موثر بر سرعت واکنش شیمیایی آشنا میشویم و سپس دلیل و نوع تاثیر هر کدام را فرا میگیریم. همچنین مفهوم سرعت واکنش را مرور میکنیم و انواع واکنش را با توجه به سرعت آنها معرفی خواهیم کرد. در ادامه نیز به بررسی تعدادی مثال و حل تمرین میپردازیم که به درک ما از این مطلب کمک خواهند کرد.
سرعت واکنش شیمیایی چیست؟
«سرعت واکنش شیمیایی» (Chemical Reaction Rate) برابر با تغییر در غلظت واکنشدهندهها یا تغییر در غلظت محصولات به ازای واحد زمان است. بنابراین میتوان برای به دست آوردن غلظت یک واکنش، تغییرات غلظت را به ازای تغییرات زمان نوشت.
این رابطه را در زیر مشاهده میکنید.
مولفههای موجود در این رابطه بهصورت زیر تعریف میشوند.
- : سرعت واکنش که معمولا آن را با نمایش میدهند.
- : تغییرات ایجاد شده در غلظت واکنشدهنده یا محصولات.
- : مدت زمانی که واکنش در حال انجام است.
برای مثال واکنشی در دست داریم که همانطور که مشاهده میکنید در آن واکنشدهنده و به تولید محصول میانجامند.
برای بررسی سرعت این واکنش میتوان تغییرات هر کدام از واکنشدهندهها را بهصورت زیر در نظر گرفت. توجه داشته باشید که به دلیل مصرف واکنشدهنده در سمت چپ واکنش، در رابطه آنها باید علامت منفی حضور داشته باشد.
در این روابط منظور از تفاوت در غلظت واکنشدهنده از ابتدا تا انتهای واکنش است و میتوان آن را به شکل زیر نیز نشان داد.
برای نوشتن معادله سرعت وکنش شیمیایی باید ضرایب استوکیومتری موجود در واکنش موازنه شده آن را در نظر داشته باشیم. در مورد مثال بالا این ضرایب برابر با ۱ است. به مثال زیر توجه کنید.
با توجه به ضرایب استوکیومتری موجود در این واکنش، متوجه میشویم که مقدار واکنشدهنده با سرعت ۳ برابر بیشتر از واکنشدهنده ، مصرف میشود. برای پرهیز از ایجاد خطا این ضرایب در مخرج و در کنار تغییرات زمان، لحاظ میشوند تا شاهد به دست آمدن سرعت متفاوت برای هر واکنشدهنده نباشیم. این کار را به شکل زیر انجام میدهیم.
در حالت کلی اگر دو واکنشدهنده و دو محصول در واکنش با ضرایب استوکیومتری متفاوت حضور داشته باشند، میتوان برای نوشتن معادله سرعت واکنش از شیوه زیر بهره گرفت.
$$aA + bB \longrightarrow cC + dD \label{1} $$
توجه داشته باشید که برای به دست آوردن مقدار سرعت نیاز به در دست داشتن تمامی متغیرها نداریم و میتوان تنها از یک واکنشدهنده و ضریب استوکیومتری آن استفاده کرد. در نهایت نیز پاسخی که از واکنشدهندههای متفاوت به دست میآید، با یکدیگر برابر خواهد بود.
همچنین واکنشهای شیمیایی با سرعتهایی بسیار متفاوت صورت میگیرند. برخی با سرعت بسیار بالایی انجام میشوند و برخی نیاز به میلیونها سال دارند تا به تعادل برسند.
محاسبه سرعت واکنش شیمیایی
با توجه به روابطی که برای بیان سرعت واکنش شیمیایی آموختیم، میخواهیم مقدار آن را برای واکنش اکسایش آمونیاک به دست بیاوریم. این واکنش بهصورت موازنه شده در زیر آورده شده است.
سرعت تشکیل محصول برابر با ۰٫۲۷ مول بر لیتر در ثانیه است. با توجه به این مقدار، سرعت تشکیل آب و سرعت مصرف آمونیاک را در این واکنش به دست آورید.
پاسخ
برای به دست آوردن سرعت تشکیل آب، ابتدا باید رابطه استوکیومتری آب را با نیتروژن بدانیم. این رابطه را میتوان بهصورت زیر نوشت.
با توجه به اینکه سرعت تولید نیتروژن را در دست داریم، سرعت تولید آب را مانند زیر به دست میآوریم.
همچنین میدانیم که به ازای هر ۴ مول مصرفی آمونیاک، ۲ مول گاز نیتروژن به وجود میآيد. بنابراین سرعت مصرف آمونیاک برابر با مقدار زیر خواهد بود.
پیشنهاد میکنیم برای درک بهتر این فرمول و مفهوم آن، مطلب جمع بندی فصل دوم شیمی یازدهم را مطالعه کنید.
نمودار غلظت بر حسب زمان
یکی از سادهترین راههایی که میتوان از آن برای نمایش میزان مصرف واکنشدهنده و میزان تولید محصول استفاده کرد، رسم نمودار غلظت اجزای دخیل در واکنش بر حسب زمان است. از این نمودار میتوان برای به دست آوردن سرعت واکنش نیز بهره برد.
در زیر نمونهای از این نمودار را به همراه واکنش شیمیایی آن مشاهده میکنید.
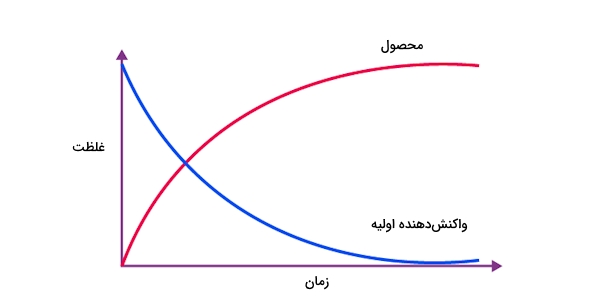
در این نمودار منحنی آبی مربوط به واکنشدهنده است زیرا در طول زمان از مقدار آن کاسته میشود. منحنی آبی نیز نشاندهنده محصول است که با گذر زمان به مقدار آن افزوده میشود.
عوامل موثر بر سرعت واکنش شیمیایی
در این بخش میخواهیم با عوامل موثر بر سرعت واکنش شیمیایی آشنا شویم. این عوامل شامل مواردی مانند زیر هستند.
- غلظت واکنشدهنده
- دما
- حالت فیزیکی واکنشدهندهها
- حلال
- کاتالیزور
یک واکنش شیمیایی در صورتی که موازنه شده باشد، به ما اطلاعات بسیاری در مورد مقدار واکنشدهنده و محصولات تولیدی میدهد اما نمیتوان از آن به سرعت واکنش پی برد.
این مورد را باید در سینتیک شیمیایی واکنش جستجو کرد. با مطالعه سینتیک واکنش میتوان به روشهایی برای کنترل واکنشهای شیمیایی دست پیدا کرد. در بخش پیش رو به انواع عوامل موثر بر سرعت واکنش شیمیایی میپردازیم.
تاثیر ماهیت واکنش
سرعت یک واکنش به میزان زیادی به نوع و ماهیت واکنش بستگی دارد. برخی از واکنشها بسیار سریع رخ میدهند و برخی دیگر برای رسیدن به تعادل به زمانی طولانی نیاز دارند. در این سرعت عواملی مانند حالت فیزیکی واکنشدهندهها، تعداد واکنشدهندهها و پیچیدگی واکنش دخیل هستند. بهطور کلی میتوان بیان کرد که سرعت واکنشها در مایع کمتر از گاز است. همچنین واکنشهایی که در فاز جامد انجام میشوند از واکنشهای مایع کندتر صورت میگیرند. موردی دیگری که میتوان به آن اشاره کرد اندازه واکنشدهندهها است. هرچه اندازه ذره واکنشدهنده کوچکتر باشد، واکنش با سرعت بیشتری پیشروی میکند.
برای مثل واکنش بین ترکیبات یونی و آب بسیار سریع رخ میدهد زیرا در این واکنش تنها تعویض یون رخ میدهد و این یونها پیش از این با حل شدن در آب از یکدیگر نیز جدا شدهاند. به واکنش زیر توجه کنید. در این واکنش با افزایش نقره نیترات به محول سدیم کلرید، بلافاصله شاهد تشکیل رسوب نقره کلرید هستیم.
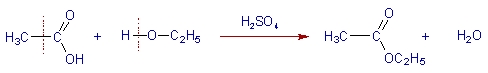
همانطور که مشاهده میکنید در این واکنش تنها تعویض یون نیاز است. از طرف دیگر انجام واکنش شیمیایی بین ترکیبات کووالانسی به آهستگی صورت میگیرد زیرا برای انجام آن باید انرژی کافی برای شکستن پیوندهای موجود در دسترس باشد. به واکنش موجود در تصویر زیر توجه کنید. استری شدن استیک اسید به آرامی صورت میگیرد زیرا پیوندهایی که با خطوط قرمز مشخص شدهاند باید شکسته شوند.
تاثیر غلظت
دو ترکیب تنها در صورتی میتوانند با یکدیگر وارد واکنش شوند که ذرههایی سازنده آنها اعم از مولکول، اتم و یون با هم در تماس قرار بگیرند. در صورتی که تماسی بین ذرات صورت نگیرد، سرعت واکنش برابر با صفر خواهد بود. عکس این قضیه نیز صدق میکند، یعنی هرچه برخورد ذرههای واکنشدهنده با یکدیگر در واحد زمان بیشتر باشد، واکنش بیشتر انجام میشود. بنابراین بهطور معمول با افزایش غلظت واکنشدهندهها، سرعت واکنش نیز افزایش مییابد. در این مورد مثالی را مورد بررسی قرار میدهیم.
کلسیم کربنات با فرمول شیمیایی در نتیجه واکنش با آلاینده گوگرد دیاکسید تخریب میشود. سرعت انجام این واکنش به مقدار گوگرد دیاکسید موجود در هوا بستگی دارد زیرا با بخار آب ترکیب میشود و اسید سولفوریک را طبق واکنش زیر به وجود میآورد.
سپس کلسیم کربنات با اسید سولفوریک بهصورت زیر وارد واکنش میشود که منجر به از بین رفتن آن خواهد شد.
بنابراین میتوان اینطور نتیجهگیری کرد که در محیطی که غلظت آلاینده گوگرد دیاکسید در آن بالاتر است، واکنش تخریب کلسیم کربنات با سرعت بیشتری انجام میشود.
تاثیر فشار
در صورتی که واکنشی در فاز گاز انجام شود، افزایش فشار باعث افزایش غلظت گازها میشود و آن نیز، همانطور که در بخش قبلی توضیح دادیم، به افزایش سرعت واکنش میانجامد. واکنش به سمتی پیش میرود که مولکولهای گازی کمتری حضور دارند و واکنش برگشت کاهش پیدا میکند. بنابراین میتوان اینطور جمعبندی کرد که فشار به دلیل تاثیری که روی غلظت اجزای واکنشدهنده میگذارد، میتواند باعث افزایش یا کاهش سرعت واکنش شود.
تاثیر دما
افزایش دمای یک سیستم به افزایش انرژی سینتیکی متوسط ذرههای سازنده آن منجر میشود. در نتیجه افزایش انرژی سینتیکی متوسط، ذرهها با سرعت بیشتری حرکت میکنند و در واحد زمان تعداد برخورد آنها نیز افزایش پیدا میکند و انرژی این برخورد نیز بالاتر است. تمام این موارد باعث افزایش در سرعت واکنش میشود. بنابراین میتوان گفت که افزایش دما باعث افزایش سرعت تقریبا تمامی واکنشها میشود. عکس این مورد نیز صادق است، یعنی سرعت واکنشها با کاهش دما، کاهشی را تجربه میکند.
مثال بسیار سادهای از این تاثیر روی سرعت واکنش، نگهداری مواد غذایی در یخچال است. قرار دادن مواد غذایی در یخچال سرعت رشد باکتریها را در غذا کاهش میدهد زیرا سرعت واکنشهای بیوشیمیایی تولیدکننده باکتری را کم میکند.
در سیستمی با بیش از یک واکنش ممکن، واکنشدهندهها میتوانند با تغییر شرایط، محصولات متنوعی را به وجود بیاورند. برای مثال، اتانول در حضور اسید سولفوریک و در دمای نزدیک به ۱۰۰ درجه سانتیگراد، دیاتیل اتر را مانند واکنش زیر به وجود میآورد.
همین واکنش در صورتی که در دمای ۱۸۰ درجه سانتیگراد انجام شود، محصول کاملا متفاوتی را به دست میدهد. محصول اصلی اتانول تحت چنین شرایطی اتیلن است. این واکنش را میتوانید در زیر مشاهده کنید.
در بسیاری موارد افزایش دمای واکنش به میزان ۱۰ درجه سانتیگراد میتواند سرعت را تا دو برابر افزایش دهد.
تاثیر فاز و سطح
زمانی که دو واکنشدهنده در فاز سیال مشابهی قرار داشته باشند، نسبت به زمانی که یک یا هر دو به حالت جامد باشند، ذرههای آنها با با یکدیگر برخورد بیشتری خواهد داشت. در صورتی که واکنشدهندهها بهصورت یکنواخت در محلولی همگن پخش شوند، تعداد برخوردهای آنها به دما و غلظت بستگی دارد.
با این حال در صورتی که واکنش ناهمگن باشد، واکنشدهندهها در دو فاز متفاوت حضور دارند و برخورد تنها در سطح مشترک بین دو فاز انجام میشود. در این صورت تعداد برخوردها نسبت به حالتی که واکنش همگن باشد، کاهش پیدا میکند و در نتیجه سرعت واکنش نیز کم میشود. در واکنشهای ناهمگن، سرعت واکنش به سطح فاز متراکمتر بستگی دارد.
تاثیر حلال
طبیعت حلال نیز میتواند روی سرعت واکنش ذرههای حلشونده تاثیر بگذارد. برای مثال محلول «سدیم استات» با «متیل یدید» وارد واکنش جانشینی میشود که طی آن دو محصول «متیل استات» و «سدیم یدید» به وجود میآید. این واکنش را در ادامه مشاهده میکنید.
این واکنش در حلالی آلی مانند دیمتیل فرمامید با فرمول شیمیایی نسبت به حلالی مانند متانول، با سرعتی ۱۰ میلیون برابر انجام میشود. توجه داشته باشید که هر دو این حلالها آلی هستند و ثابت دیالکتریک بسیار نزدیک به یکدیگر دارند. (ثابت دیالکتریک دیمتیل فرمامید برابر با ۳۶٫۷ و ثابت دیالکتریک متانول برابر با ۳۲٫۶ است.)
متانول میتواند با یونهای استات تشکیل پیوند هیدروژنی دهد در حالی که متیل فرمامید این قابلیت را ندارد. تشکیل این پیوند هیدروژنی در حلال متانول باعث کاهش واکنشپذیری اتمهای اکسیژن موجود در یون استات میشود و سرعت واکنش نیز کاهش پیدا میکند.
گرانروی حلال نیز نقش مهمی در تعیین سرعت واکنشهای شیمیایی دارد. در حلالهایی با گرانروی بالا، ذرههای حل شده با سرعت بسیار کمتری نسبت به حلالهایی با گرانروی پایینتر، پخش میشوند. این باعث میشود تعداد برخوردها در واحد زمان کاهش پیدا کند. بنابراین میتوان اینطور جعبندی کرد که سرعت بسیاری از واکنشها با افزایش گرانروی حلال، کاهش پیدا میکند.
تاثیر کاتالیزور
«کاتالیزور» (Catalyst) مادهای است که در واکنش شیمیایی شرکت میکند و سرعت آن را افزایش میدهد اما خود دستشخوش هیچ تغییر شیمیایی نمیشود. برای مثال واکنش تجزیه هیدروژن پراکسید را در حضور و غیاب کاتالیزورهای مختلف در نظر بگیرید. از آنجا که بیشتر کاتالیزورها به شدت انتخابگر هستند، معمولا محصول را با توجه به یکی از چندین واکنشی که امکان رخ دادن دارد، انتخاب و تعیین میکنند.
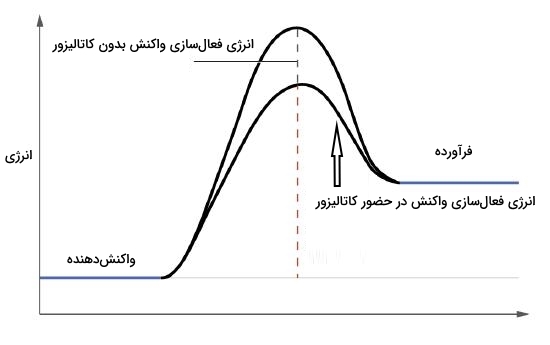
در بسیاری از واکنشهای مورد استفاده در صنایع، کاتالیزور حضور فعالی دارد. به دلیل افزایش سرعت حاصل از حضور کاتالیزور، طبق تخمینی جدید حدود ۳۰٪ از محصولات تولید شده در آمریکا و دیگر کشورهای صنعتی بهصورت مستقیم یا غیرمستقیم به دلیل حضور کاتالیزور است.
«انرژی فعالسازی» (Activation Energy) کمترین مقدار انرژی مورد نیاز برای واکنش شیمیایی است تا بتواند در مسیر خود پیش برود و تکمیل شود. هر چه انرژی فعالسازی واکنشی بالاتر باشد، تعداد مولکولهای واکنشدهنده کمتری توانایی عبور از قله انرژی و تبدیل شدن به محصول را دارند. کاتالیزور را میتوان به عنوان مادهای تعریف کرد که با کاهش مقدار انرژی فعالسازی یک واکنش، سرعت آن را بالا میبرد و خود نیز دست نخورده باقی میماند. کاتالیزور این کار را با ایجاد مسیری جایگزین یا تغییر مکانیسم واکنش انجام میدهد. این مسئله را میتوانید در تصویر بالا به خوبی مشاهده کنید.
تاثیر شدت نور
یکی دیگر از مواردی که روی سرعت واکنش شیمیایی اثر میگذارد، شدت و میزان نوری است که واکنش در آن انجام میشود. ذرههای واکنشدهنده با افزایش شدت نور، انرژی بیشتری به خود جذب میکنند که میتواند باعث افزایش سرعت واکنش شود. برای مثال واکنش فتوسنتز در حضور نور با سرعت بیشتری انجام میشود و همین دلیل رشد بهتر گیاه در حضور نور است.
با این حال برخی از واکنشهای فتوشیمیایی که در آنها رادیکال آزاد حضور دارد، چندان تحت تاثیر میزان نور قرار ندارند زیرا در این واکنشها حضور یک فوتون میتواند آغازگر تشکیل رادیکال آزاد باشد. این فرآيند میتواند باعث ایجاد زنجیرهای شود که در آن رادیکالهای آزاد بیشتری تولید میشوند و نیازی به حضور فوتونهای بیشتر ندارند.
تاثیر تابش الکترومغناطیسی
«تابش الکترومغناطیسی» (Electromagnetic Radiation) فرمی از انرژی است و حضور آن در واکنش شیمیایی میتواند باعث افزایش سرعت آن شود. دلیل این امر این است که میتواند به اجزای واکنشدهنده انرژی دهد و حرکت آنها را تسریع کند.
قانون سرعت و ثابت سرعت
«قانون سرعت» (Rate Law) معادلهای است که سرعت واکنش را به ثابت سرعت و غلظت واکنشدهندهها مرتبط میکند. بهطور کلی قانون سرعت را بهصورت زیر نمایش میدهند.
$$\text{Rate} = k[A]^s[B]^t \label{2} $$
با این حال عواملی دیگر نیز وجود دارند که میتوانند روی سرعت واکنش اثر بگذارند. از جمله این عوامل میتوان به دما و کاتالیزور اشاره کرد که در ادامه بهصورت مفصل به آنها خواهیم پرداخت. در مطالعه سرعت واکنشها، مرتبه واکنش از اهمیت بسیار بالایی برخوردار است که در بخش پیش رو به آن خواهیم پرداخت.
مرتبه واکنش
از روی سرعت واکنش میتوان به اطلاعاتی در مورد «مرتبه واکنش» (Reaction Order) دست پیدا کرد. از روی مرتبه واکنشها میتوان آنها را دستهبندی کرد و کار با آنها به این صورت تسهیل میشود. با در دست داشتن مرتبه واکنش میتوان به مواردی مانند قانون سرعت، واحد ثابت سرعت و نیمهعمر دسترسی پیدا کرد. در صورتی که قانون سرعت واکنشی به شکل زیر باشد، مجموع توانهای واکنشدهنده برابر با مرتبه آن خواهد بود.
$$\text{Rate} = k[A]^s[B]^t \label{4}$$
همانطور که مشاهده میکنید، مرتبه این واکنش برابر با است. نکته بسیار مهمی که باید در نظر داشت این است که گرچه میتوان از قانون سرعت به مرتبه واکنش رسید اما بهطور کلی بین مرتبه واکنش و ضرایب استوکیومتری در واکنش شیمیایی، هیچ رابطهای برقرار نیست.
همچنین مرتبه واکنش نمیتواند عددی منفی اما میتواند برابر با صفر باشد. در صورتی که واکنشی از مرتبه صفر باشد، به این معناست که تغییر غلظت واکنشدهندهها تاثیری روی سرعت واکنش نخواهد داشت. در این صورت میتوان واکنشدهندههایی را اضافه و برخی را حذف کرد و همچنان سرعت بدون تغییر باقی میماند.
مجموع و برابر با مرتبه واکنش است، اما هر کدام به تنهایی نیز مفهومی دارند. هر متغیر نشاندهنده مرتبه واکنش نسبت به واکنشدهندهای است که روی آن قرار دارد. یعنی در این مورد، واکنش نسبت به واکنشدهنده از مرتبه و نسبت به واکنشدهنده از مرتبه است.
برای مثال اگر مرتبه واکنش نسبت به واکنشدهنده برابر با ۲ و مرتبه واکنش نسبت به واکنشدهنده برابر با ۱ باشد، به این معناست که غلظت واکنشدهنده با ضریب ۱ و غلظت واکنشدهنده با ضریب ۲، کاهش پیدا میکند. در ادامه به برخی از مهمترین و پرتکرارترین مرتبههای واکنش اشاره میکنیم.
واکنش مرتبه صفر
همانطور که پیشتر گفتیم، در صورتی که واکنشی از مرتبه صفر باشد، تغییر غلظت واکنشدهندهها تاثیری روی سرعت نمیگذارد و میتوان قانون سرعت آن را بهصورت زیر نوشت.
با انتگرالگیری از این قانون و مرتب کردن آن، رابطه زیر به دست میآيد.
همچنین در این صورت واحد ثابت سرعت واکنش برابر با است.
واکنش مرتبه ۱
واکنشی که از مرتبه ۱ باشد، قانون سرعتی به شکل زیر خواهد داشت.
با انتگرالگیری از این قانون و مرتب کردن آن، رابطه زیر به دست میآيد.
در این مورد واحد ثابت سرعت واکنش برابر با است.
واکنش مرتبه ۲
برای واکنش مرتبه، قانون سرعت واکنش را بهصورت زیر مینویسیم.
با انتگرالگیری از این قانون و مرتب کردن آن، رابطه زیر به دست میآيد.
همچنین در این صورت واحد ثابت سرعت واکنش برابر با است.
نظریه برخورد چیست؟
برای درک بهتر سینتیک و عوامل موثر بر سرعت واکنش شیمیایی ابتدا باید بدانیم در یک واکنش در سطح مولکولی چه اتفاقی میافتد. طبق «نظریه برخورد» (Colission Theory) واکنش در صورتی انجام میشود که مولکولهای واکنشدهنده با یکدیگر برخوردهایی موثر انجام دهند. بنابراین در صورتی که این مولکولها در فضا جهتگیری مناسبی داشته باشند و تعداد برخوردها بیشتر باشد، برای واکنش مفید است.
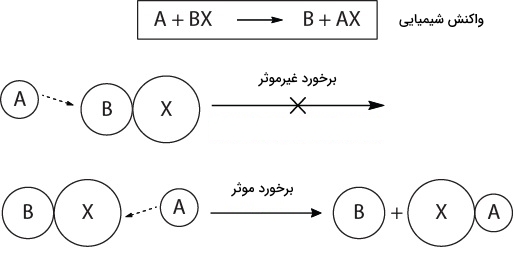
تنها در این صورت است که پیوندهای شیمیایی قبلی شکسته میشوند و پیوندهایی جدید به وجود میآيند و محصولات در دست خواهند بود. در تصویر زیر میتوانید نمونهای از برخورد موثر و غیرموثر را مشاهده کنید.
مثال و حل تمرین
تا اینجا با انواع عوامل موثر بر واکنش شیمیایی آشنا شدیم، در این بخش ابتدا تعدادی مثال را به همراه پاسخ تشریحی مورد بررسی قرار میدهیم و سپس به مرور چند تمرین چندگزینهای میپردازیم.
مثال
در این بخش به بررسی تعدادی مثال میپردازیم و در هر مورد پاسخ تشریحی مناسب را نیز ارائه میدهیم.
مثال اول
واکنشی بهصورت زیر در دسترس است.
$$H_2O \longrightarrow 2H_2+ O_2 \label{6}$$
قانون سرعت متناسب با آن را بنویسید و تعیین کنید از درجه چند است. در صورتی که مقدار ثابت سرعت واکنش و غلظت واکنشدهنده بهصورت زیر باشد، مقدار سرعت را به دست آورید.
پاسخ
قانون سرعت این واکنش را میتوان بهصورت زیر نوشت.
همانطور که مشاهده میکنید این واکنش از مرتبه ۱ است و با جایگذاری اعداد داده شده، مقدار سرعت بهصورت زیر به دست میآيد.
مثال دوم
افزایش سرعت واکنشهای شیمیایی چه اهمیتی دارد؟
پاسخ
افزایش سرعت واکنشهای شیمیایی به افزایش سرعت فرآیندهای شیمیایی میانجامد که بهخصوص در صنعت از اهمیت بالایی برخوردار است زیرا باعث صرفهجویی در زمان و هزینه میشود. به همین دلیل در بسیاری از صنایع از کاتالیزور برای افزایش بهرهوری استفاده میشود.
مثال سوم
عوامل محیطی به چه صورت روی واکنشهای شیمیایی با کاتالیزور آنزیمی تاثیر میگذارند؟
پاسخ
آنزیمها کاتالیزورهای زیستی هستند، به این معنی که باعث افزایش واکنشهای زیستی میشوند. این ترکیبات تحت تاثیر عواملی مانند دما، مقدار ، و غلظت مولکولها قرار میگیرند.
مثال چهارم
چطور میتوان با کنترل عوامل موثر بر واکنش شیمیایی، سرعت را افزایش داد؟
پاسخ
برای مثال میتوان دمای واکنش را در مقدار ثابتی تنظیم کرد. این افزایش دما سرعت واکنش را نیز افزایش میدهد. مثال دیگری از این مورد تقطیر محصولات واکنش بهصورت همزمان است، در این صورت برای تنظیم غلظت، واکنش با سرعت بیشتری پیشروی میکند.
مثال پنجم
افزایش سطح واکنشدهنده جامد باعث افزایش سرعت واکنش میشود. دلیل این پدیده چیست؟
پاسخ
دلیل این افزایش این است که مقدار بیشتری از ذرات در احاطه گاز یا مایع موجود در واکنش قرار میگیرند.
مثال ششم
بهصورت تجربی چطور میتوانیم به افزایش سرعت واکنشی پی ببریم؟
پاسخ
تغییر در سرعت واکنش میتواند به تغغیر در مقدار و جرم بینجامد. همچنین در صورت وجود گاز در محصولات، میتوان حجم گاز تولید شده را در نظر داشت.
مثال هفتم
آیا مرتبه یک واکنش میتواند صفر باشد؟
پاسخ
بله، یک واکنش میتواند از مرتبه صفر باشد. در این صورت با تغییر غلظت واکنشدهنده هیچ تغییری در سرعت واکنش مشاهده نمیشود. بنابراین در این مورد غلظت واکنشدهنده جزو عوامل موثر بر سرعت آن واکنش نیست.
حل تمرین
در این بخش تعدادی تمرین چندگزینهای را پیرامون عوامل موثر بر واکنش شیمیایی بررسی خواهیم کرد.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین نهم
تمرین و آزمون
تمرین دهم
تمرین و آزمون
تمرین یازدهم
تمرین و آزمون
سوالات متدوال
حال که با عوامل موثر بر سرعت واکنش آشنا شدیم، میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای موجود پیرامون آن پاسخ دهیم.
سرعت واکنش شیمیایی چیست؟
برای به دست آوردن سرعت واکنش شیمیایی تغییرات غلظت واکنشدهنده و محصولات را در طول زمان مورد بررسی قرار میدهیم.
عوامل موثر بر سرعت واکنش را نام ببرید.
از جمله عوامل موثر بر سرعت واکنش شیمیایی میتوان به دما، غلظت واکنشدهنده، فاز و سطح تماس واکنش، نوع حلال و حضور کاتالیزور اشاره کرد.
تاثیر تابش الکترومغناطیسی بر سرعت واکنش شیمیایی چگونه است؟
حضور تابش الکترومغناطیسی در واکنش شیمیایی میتواند باعث افزایش سرعت آن شود زیرا میتواند به اجزای واکنشدهنده انرژی دهد و حرکت آنها را تسریع کند.
تاثیر کاتالیزور بر سرعت واکنش شیمیایی چیست؟
کاتالیزور مادهای است که در واکنش شیمیایی شرکت میکند و سرعت آن را افزایش میدهد اما خود دستخوش هیچ تغییر شیمیایی نمیشود. این ماده با کاهش انرژی فعالسازی واکنش تاثیر خود را میگذارد.
نظریه برخورد چیست؟
طبق نظریه برخورد واکنش در صورتی انجام میشود که مولکولهای واکنشدهنده با یکدیگر برخوردهایی موثر انجام دهند. بنابراین در صورتی که این مولکولها در فضا جهتگیری مناسبی داشته باشند و تعداد برخوردها بیشتر باشد، بهتر است.
قانون سرعت واکنش چیست؟
قانون سرعت واکنش معادلهای است که سرعت واکنش را به ثابت سرعت و غلظت واکنشدهندهها مرتبط میکند.
جمعبندی
هدف از این مطلب مجله فرادرس آشنایی با انواع عوامل موثر بر واکنش شیمیایی بود. از جمله این عوامل میتوان به کاتالیزور واکنش، حلال موجود و دما اشاره کرد. هر کدام از این عوامل در شرایط متفاوت تاثیری بهخصوصی بر سرعت واکنش دارند و میتوان با کنترل آنها سرعت واکنش را دستکاری کرد. برای درک بهتر تاثیر هر کدام مروری نیز بر چیستی سرعت واکنش و نحوه اندازهگیری آن داشتیم و واکنشهای مختلف را با توجه به این موضوع دستهبندی کردیم. در نهایت نیز به حل تعدادی مثال و تمرین چندگزینهای پرداختیم تا درک خود را از این مفهوم عمق ببخشیم.












