تیتراسیون رسوبی – از صفر تا صد
در مطالب پیشین مجله فرادرس، روشهای مختلف تیتراسیون اعم از تیتراسیون اسیدباز و اکسایش و کاهش را بررسی کردیم. در این مطلب قصد داریم به بررسی تیتراسیون رسوبی بپردازیم. واکنشی که در آن، آنالیت و تیترانت، رسوباتی نامحلول تشکیل میدهند را میتوان به عنوان روشی برای تیتراسیون در نظر گرفت. به این روش تیتراسیون، «تیتراسیون رسوبی» (Precipitation Titration) میگویند.


یکی از اولین تیتراسیونهایی که در اوایل قرن هجدهم میلادی توسعه پیدا کرده، آنالیز و در پتاس بود. در این خصوص، کلسیم نیترات با فرمول به عنوان تیترانت استفاده میشد. با بهرهگیری از این تیترانت، رسوبات و به تولید میرسید. نقطه پایانی تیتراسیون نیز زمانی بود که با اضافه کردن تیترانت، رسوب اضافی تشکیل نمیشد. اهمیت تیتراسیون به عنوان یک روش تیترسنجی زمانی به اوج خود رسید که در قرن نوزدهم، روشهای مختلفی برای شناسایی یون نقره و یونهای هالید توسعه پیدا کردند.
تیتراسیون رسوبی چیست؟
برای بیان بهتر تیتراسیون رسوبی بهتر است آنرا به کمک یک مثال بیان کنیم. به عنوان نمونه، برای تعیین غلظت یون کلرید در محلولی مشخص، میتوان این محلول را با محلول نقره نیترات (با غلظت مشخص)، تیتر کنیم. واکنش شیمیایی آن به صورت زیر خواهد بود:
رسوب سفیدرنگ AgCl را به هنگام انجام تیتراسیون در انتهای ظرف آزمایش میتوان مشاهده کرد. مقدار یون نقرهای که در نقطه تعادل استفاده شده برابر با مقدار یون کلر است. برای محاسبه تعداد مولهای یونهای کلر یا نقره از تعریف مولاریته ( یا ) استفاده میکنیم. برای محاسبه حجم محلول اضافه شده یا غلظت مولی یون، مقدار متناظر هرکدام از یونها را باید داشته باشیم.
انواع تیتراسیون رسوبی
روشهای تیتراسیون رسوبی را به سه دسته کلی تیتراسیون به روش ولهارد، تیتراسیون به روش مور و تیتراسیون به روش فاجانس میتوان تقسیمبندی کرد که در ادامه به انواع تیتراسیوهای نامبرده خواهیم پرداخت.
تیتراسیون به روش ولهارد
این روش شامل تیتراسیون برمید، یدید و کلرید در محیطی اسیدی است. زمانی که یونهای کلرید با محلول اضافی از نقره نیترات واکنش میدهند، به نقره کلرید تبدیل میشوند. مقدار نقره نیترات اضافی نیز در مقابل محلول پتاسیم تیوسیانات تخمین زده میشود. زمانیکه تیوسیانات، تمامی نقره را مصرف کند، مقدار تیوسیانات اضافی را با یک معرف وارد واکنش میکنند. به هنگام واکنش با معرف فریک آمونیوم سولفات با فرمول ، کمپلکس فروس تیوسیانات تشکیل میشود. به تیتراسیونی که بر اساس واکنشی باشد که در آن یک کمپلکس تشکیل میشود، «تیتراسیون کمپلکسومتری» گفته میشود.
آمادهسازی مواد برای تیتراسیون ولهارد
برای انجام تیتراسیون به روش ولهارد در ابتدا باید نمونههای مورد نیاز را آماده کنیم. نمک سدیم کلرید را به هنگام تولید پنیر چدار به آن اضافه میکنند. در این مثال، پنیر به اصطلاح «شکسته» (Digested) میشود تا با آزاد کردن این نمک، غلظت یون کلرید بدست آید. برای انجام این عمل، پنیر را با نیتریک اسید و پتاسیم پرمنگنات وارد واکنش میکنیم و یونهای کلرید برای تشکیل رسوب با یونهای نقره اضافه شده، آزاد میشوند. برای این کار، مراحل زیر را پی میگیریم.
- پنیر را به قطعات کوچکی برش دهید و با یک ترازو، مقدار ۶ گرم از آنرا در یک ارلن با حجم ۵۰۰ میلیلیتر قرار دهید.
- به کمک پیپت، میزان ۵۰ میلیلیتر از محلول 0/1 مولار نقره نیترات، ۲۰ میلیلیتر نیتریک اسید غلیظ (با رعایت موارد ایمنی)، ۱۰۰ میلیلیتر آب مقطر و مقادیری «سنگ جوش» (Boiling Chip) اضافه کنید و محلول را تا زمان رسیدن به نقطه جوش در زیر هود حرارت دهید.
- به هنگام جوشیدن محلول، ۵ میلیلیتر محلول ۵ درصد پتاسیم پرمنگنات به آن اضافه کنید. اضافه کردن این ماده، بوی شدیدی ایجاد میکند و به همین دلیل باید این کار در زیر هود آزمایشگاه انجام بگیرد. جوشاندن را تا زمانی ادامه دهید که رنگ بنفش از بین برود و بعد از آن، دوباره ۵ میلیلیتر محلول پتاسیم پرمنگنات به آن محلول اضافه کنید. این فرآیند را تا زمانی ادامه دهید که میزان ۳۰ میلیلیتر پتاسیم پرمنگنات به محلول اضافه شده باشد و ذرات پنیر، به خوبی تجزیه شوند.
برای اینکه ببینید ذرات پنیر تجزیه شدهاند یا خیر، حرارت دادن را برای لحظاتی متوقف کنید. ذرات تجزیه نشده پنیر در سطح مایع شفاف شناور میشوند و رسوب سفیدرنگ نقره کلرید، در کف ظرف تهنشین خواهد شد. اگر همچنان مقادیر زیادی از پنیرهای تجزیه نشده وجود داشتند، فرآیند قبل را باید تا زمان تجزیه پنیرها ادامه دهید. - محلول را سرد و فیلتر کنید. مواد باقیمانده جامد را به کمک آب مقطر شستشو دهید. فیلترات (سیال عبوری از فیلتر) را تا حجم ۵۰۰ میلیلیتر در یک بالن حجمی تهیه کنید.

انجام تیتراسیون به روش ولهارد
برای انجام تیتراسیون ولهارد مراحل زیر را دنبال میکنیم:
- به کمک یک استوانه مدرج، میزان ۱۰۰ میلیلیتر از محلول پنیر را به درون یک ارلن منتقل کنید.
- میزان ۱ میلیلیتر از محلول فریک آمونیوم سولفات را به عنوان معرف به ظرف اضافه کنید.
- یونهای نقره واکنش نداده را با محلول 0/1 مولار پتاسیم تیوسیانات، تیتر کنید. نقطه پایانی، مشاهده رنگ قرمز تیره به دلیل وجود کمپلکس فریک تیوسیانات خواهد بود.
- این تیتراسیون را تا رسیدن به «نتایج نزدیک به هم» (Concordant Results) ادامه دهید.
تصویر زیر فرآیند تیتراسیون ولهارد را نشان میدهد. ظرف سمت چپ، قبل از رسیدن به نقطه پایانی تیتراسیون را نشان میدهد. اضافه کردن یونهای سبب تشکیل رسوب نقره تیوسیانات میشود و محلول را کدر میکند. در اینجا، به دلیل رنگ عصاره پنیر، رنگ محلول به رنگ زرد کمرنگ خواهد بود.
در ظرف میانی، تمامی یونهای آزاد نقره، توسط رسوب کردهاند. تنها مقدار کمی از اضافی سبب ایجاد کمپلکس قرمزرنگ با یونهای خواهد شد. در اثر این اتفاق، رنگ محلول به رنگ قرمز-نارنجی تبدیل میشود.
در ظرف سمت راست اگر اضافه کردن ادامه پیدا کند از نقطه پایانی عبور میکنیم. توجه داشته باشید که با مشاهده اولین تغییر رنگ به رنگ قرمز تیره، باید تیتراسیون را متوقف کنیم. برای مقایسه نیز بهتر است از یک محلول تیتر نشده به عنوان مرجع استفاده شود.

تیتراسیون به روش فاجانس
این روش از واکنش بین رسوب تشکیل شده و یک معرف بهره میگیرد. معرف «دیکلروفلورسئین» (Dichlorofluoroscein) به عنوان یک آنیون در محلول عمل میکند. در محلول کلرید، به دلیل وجود مقادیر اضافی از یون کلرید، لایهای اصلی از رسوب تشکیل میشود. لایه دوم، از طریق کاتیونهای سدیم ایجاد خواهد شد. پایان واکنش، همراه با یون نقره به صورت اضافی خواهد بود.
بنابراین، یون مثبت نقره، لایه اصلی خواهد بود که معرف را برای تشکیل لایه رسوب دوم، جذب میکند. رنگ معرف نیز بیانگر پایان واکنش خواهد بود که در ادامه، به شکل دقیقتری به این روش پرداخته میشود.
تیتراسیون به روش مور
در تیتراسیون به روش مور میتوانیم غلظت یون کلرید در محلول را به کمک تیتر کردن با نقره نیترات مشخص کنیم. زمانیکه به آرامی، نقره نیترات را به محلول اضافه کنیم، رسوبی از نقره کلرید، تشکیل میشود.
زمانی به نقطه پایانی تیتراسیون میرسیم که تمامی یونهای کلرید، رسوب کنند. یونهای نقره اضافی با یونهای کرومات (پتاسیم کرومات) در معرف واکنش و رسوب قرمز-قهوهای نقره کرومات را تشکیل میدهند.
از این روش میتوان برای تعیین غلظت یونهای کلرید در منابع مختلفی همچون آب دریا، رودخانه و مصب رودها استفاده کرد. برای توضیح بهتر این روش، آب دریا را در نظر میگیریم. میزان pH محلول نمونه باید بین 6/5-10 باشد. اگر محلول، اسیدی باشد از روشهای گراویمتری یا روش ولهارد باید استفاده شود.
تجهیزات آزمایشگاهی مورد نیاز برای تیتراسیون به روش مور
لوازم آزمایشگاهی مورد نیاز برای این نوع از تیتراسیون رسوبی عبارتند از:
- بورت و پایه
- پیپتهای ۱۰ و ۲۰ میلیلیتر
- بالن حجمی ۱۰۰ میلیلیتر
- ارلن مدرج (حجم ۲۵۰ میلیلیتر)
- مزور (استوانه مدرج) در حجمهای ۱۰ و ۱۰۰ میلیلیتر
روش انجام تیتراسیون مور
در ابتدا باید به آمادهسازی نمونه بپردازیم. در صورتیکه آب دریا شامل ناخالصیهای جامدی همچون ماسه باشد، قبل از استفاده باید به کمک فیلتراسیون، آنها را جدا کنیم. پس از آماده سازی، تیتراسیون را با انجام مراحل زیر، پی میگیریم:
- ۲۰ میلیلیتر از نمونه را به کمک پیپت، به بالن حجمی ۱۰۰ میلیلیتر اضافه و برای رقیق کردن نمونه، تا رسیدن به حجم مورد نظر، به آن آب مقطر اضافه کنید.
- ۱۰ میلیلیتر از این محلول رقیق را درون ارلن بریزید و ۵۰ میلیلیتر آب مقطر و ۱ میلیلیتر معرف کرومات به آن اضافه کنید.
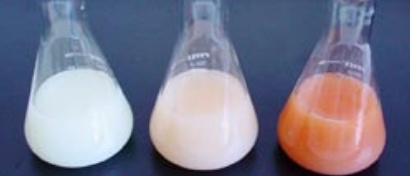
- نمونه را با محلول 0/1 مولار نقره نیترات، تیتر کنید. با وجود اینکه نقره نیترات تشکیل شده، رسوبی سفید رنگ است اما معرف کرومات، در ابتدا محلولی کدر به رنگ زرد لیمویی بدست میدهد که در تصویر زیر نشان داده شده است.

نقطه پایانی تیتراسیون را به هنگام ظهور رنگ قرمز-قهوهای نقره کرومات مشخص میکنند. این نقطه در تصویر زیر مشخص شده است. در ظرف سمت چپ، هنوز به نقطه پایانی نرسیدهایم. اضافه کردن یون نقره سبب تشکیل رسوب نقره کلرید و تشکیل محلولی کدر خواهد شد. در تصویر میانی، به نقطه پایانی تیتراسیون رسیدهایم که در آن، تمامی یونهای کلر رسوب کردهاند. مقادیر اضافی از یون نقره، با معرف کرومات، رسوب تشکیل میدهند و سبب ایجاد رنگ قرمز-قهوهای میشوند.
در تصویر زیر و ظرف سمت راست، اگر اضافه کردن یون نقره بعد از رسیدن به نقطه پایانی، ادامه پیدا کند، باز هم رسوب نقره کرومات خواهیم داشت که رنگ قرمز-قهوهای محلول، تیرهتر میشود. توجه داشته باشید زمانی که اولین آثار از رنگ قرمز-قهوهای را مشاهده کردید، باید تیتراسیون را متوقف کنید. برای تعیین بهتر نقطه پایانی بهتر است یک ظرف مرجع (به طور کامل تیتر نشده) را برای مقایسه و تغییر رنگ در اختیار داشته باشید.
انجام محاسبات در تیتراسیون مور
برای انجام محاسبات، مراحل زیر را در نظر بگیرید:
- حجم متوسط استفاده شده از نقره نیترات را مشخص کنید.
- تعداد مول نقرهنیترات را در واکنش محاسبه کنید.
- برای تعیین تعداد مول یونهای کلرید، از رابطه زیر کمک بگیرید:
- غلظت یونهای کلرید در محلول رقیق آب دریا را محاسبه کنید.
- غلظت یونهای کلرید در محلول اصلی (غلیظ) آب دریا را محاسبه کنید.
- غلظت سدیم کلرید در آب دریا را محاسبه کنید.
توجه داشته باشید که تیتراسیون به روش مور، بسیار به حضور یونهای برم و کلر در محلول حساس است و زمانیکه غلظت یون برم به همراه کلر در محلول زیاد باشد، نتایج دقیقی دقیقی بدست نمیدهد. با این وجود، در بسیاری از موارد همچون آب دریا، غلظت برمید قابل صرف نظر است. به همین دلیل از این روش برای تعیین غلظت کلی یونهای کلر و برم در محلول استفاده میشود. همچنین در مواردی که غلظت کلر را داشته باشیم و بتوان از آن صرف نظر کرد، از این روش برای تعیین غلظت یون برم بهره میگیریم.
نمودارهای تیتراسیون رسوبی
نمودارهای تیتراسیون رسوبی بر اساس تغییر غلظت تیترانت یا آنالیت (تیتراند) به عنوان تابعی از حجم تیترانت بیان میشوند. همانطور که در سایر روشهای تیتراسیون مطرح شد، در ابتدا نحوه محاسبه و رسم نمودارهای تیتراسیون را بیان میکنیم و در ادامه، نحوه رسم سریع نمودار با تخمینی دقیق را نشان میدهیم.
محاسبات نمودار تیتراسیون رسوبی
در این بخش نمودار تیتراسیون ۵۰ میلیلیتر از محلول 0/0500 مولار NaCl با محلول 0/100 مولار را بررسی میکنیم. در این مثال، واکنش به صورت زیر است:
با توجه به اینکه مقدار ثابت تعادل، عدد بسیار بزرگی است، فرض میکنیم که و به طور کامل وارد واکنش شوند.

مرحله اول: حجم مورد نیاز را برای رسیدن به نقطه تعادل (نقطه همارزی یا اکیوالان) حساب کنید. برای این کار، اولین مرحله، محاسبه حجم یون نقره مورد نیاز برای رسیدن به نقطه تعادل است. استوکیومتری واکنش بیان میکند که باید تعداد مول یون نقره با تعداد مول یون کلسیم برابر باشند. در نتیجه خواهیم داشت:
با حل رابطه برای حجم یون نقره به رابطه زیر میرسیم:
رابطه بالا نشان میدهد که برای رسیدن به نقطه تعادل، به ۲۵ میلیلیتر یون نقره نیاز داریم.
مرحله دوم: با تعیین غلظت سدیم کلریدِ شرکت نکرده در واکنش ، مقدار pCl قبل از نقطه تعادل را مشخص کنید.
پیش از نقطه تعادل، تیتراند (یون کلسیم)، به میزان اضافی وجود دارد. به طور مثال، غلظت که در واکنش شرکت نکرده، پس از اضافه کردن ۱۰ میلیلیتر یون نقره، برابر است با:
اگر از این عدد، لگاریتم منفی بگیریم، میزان pCl محاسبه میشود که برابر با 1/60 خواهد بود.
مرحله سوم: بمنظور تعیین غلظت یون کلسیم، میزان pCl را در نقطه تعادل به کمک در حساب کنید.
میدانیم که در نقطه تعادل تیتراسیون، غلظت یون نقره و کلسیم با یکدیگر برابرند. برای محاسبه غلظت یون کلسیم، از عبارت در نقره کلرید به صورت زیر استفاده میکنیم:
با حل رابطه فوق برای ، به عدد میرسیم که متناظر با pCl و برابر با 4/89 است.
مرحله چهارم: مقدار pCl را بعد از نقطه تعادل حساب کنید. برای این کار، در ابتدا، میزان نقره نیترات اضافه محاسبه میشود و در ادامه، غلظت یون کلسیم با استفاده از در بدست میآید.
بعد از نقطه تعادل، تیترانت به صورت اضافی و در آزمایش حضور دارد. همانطور که گفته شد، در ابتدا غلظت یون نقره اضافی را محاسبه میکنیم و در ادامه، با استفاده از ، غلظت یون کلر محاسبه خواهد شد. به طور مثال، بعد از اضافه کردن ۳۵ میلیلیتر تیترانت، خواهیم داشت:
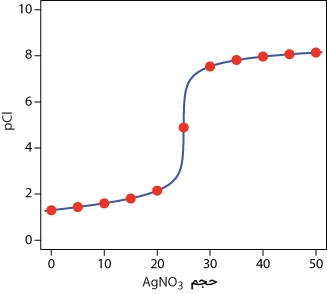
طبق توضیحات گفته شده در بالا، مقادیر مختلف از pCl یا pH را میتوان محاسبه کرد که این مقادیر در جدول زیر آورده شدهاند.
| حجم (میلیلیتر) | pCl | حجم (میلیلیتر) | pCl |
| 0/0 | 1/30 | 30 | 7/54 |
| 5/00 | 1/44 | 35 | 7/82 |
| 10/0 | 1/60 | 40 | 7/97 |
| 15/0 | 1/81 | 45 | 8/07 |
| 20/0 | 2/15 | 50 | 8/14 |
| 25/0 | 4/89 |
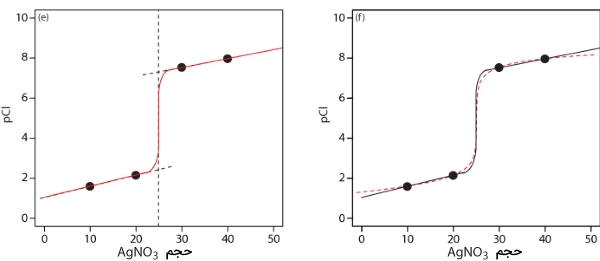
به کمک اعداد حاصل از جدول، به تصویر زیر دست پیدا میکنیم. در این تصویر، نقاط قرمز، از دادههای جدول بالا بدست آمده که به کمک خط آبیرنگ، نمودار تکمیل شده است.
رسم نمودار تیتراسیون رسوبی
برای درک رابطه بین نقطه تعادل تیتراسیون رسوبی و نقطه تعادل آن، باید تخمینی منطقی از نمودار دقیق تیتراسیون رسوبی را رسم کنیم. در این بخش، روشی ساده را برای رسم یک نمودار تیتراسیون رسوبی ارائه میکنیم. هدف ما از این کار، رسم سریع نمودار تیتراسیون رسوبی با بکارگیری حداقل محاسبات است. توجه داشته باشید که برای این کار از همان مثال بالا استفاده کردیم و به همین دلیل، برای مرور میتوانید از جدول و تصویر بالا کمک بگیرید. در نتیجه از تیتراسیون ۵۰ میلیلیتر محلول 0/0500 مولار سدیم کلرید با محلول ۰/1 مولار نقره نیترات استفاده میکنیم.
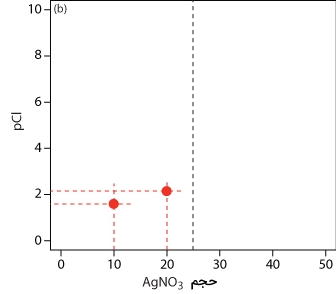
مراحل کار را با محاسبه حجم در نقطه تعادل نمودار تیتراسیون رسوبی آغاز میکنیم که پیشتر محاسبه شد و مقدار آن برابر با ۲۵ میلیلیتر بود. در ادامه، محورها را رسم میکنیم که در محور y، عبارت «pCl» و در محور x، حجم تیترانت را قرار میدهیم. برای مشخص کردن حجم نقطه تعادل، خطی عمودی و متناظر با حجم ۲۵ میلیلیتر نقره نیترات رسم میکنیم.

پیش از نقطه تعادل، یون کلسیم به صورت اضافی وجود دارد و pCl را به کمک غلظت یون کلسیمِ شرکت نکرده در واکنش، محاسبه میکنیم. همانطور که در بالا به آن اشاره کردیم، این محاسبات به صورت مستقیم انجام میگیرند. این محاسبات بعد از اضافه کردن ۱۰ و ۲۰ میلیلیتر نقره نیترات، به صورت نقاطی در نمودار زیر نمایش داده شدهاند. برای مشاهده مقادیر مربوطه کافی است به جدول بالا مراجعه کنید.
بعد از نقطه تعادل، یون نقره به میزان اضافی وجود دارد و غلظت یون کلسیم به کمک انحلالپذیری نقره کلرید مشخص میشود. این محاسبات نیز به طور مستقیم انجام میگیرند و نقاط مربوطه، بعد از اضافه کردن ۳۰ و ۴۰ میلیلیتر نقره نیترات در تصویر زیر آورده شدهاند.
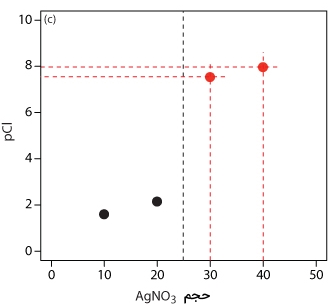
در ادامه، خط مستقیمی از میان دو جفت نقطه محاسبه شده در قبل، رسم میکنیم و آنها را تا برخورد به خط عمودی منتاظر با نقطه تعادل، امتداد میدهیم.

بعد از طی مراحل بالا، سه خط مستقیم خواهیم داشت. از روی این سه خط مستقیم، نمودار مناسبی رسم میکنیم. این نمودار در کنار نمودار اصلی در تصویر زیر نشان داده شده است. با مقایسه این دو نمودار، مشخص میشود که تخمین مناسبی برای رسم سریع نمودار تیتراسیون رسوبی انجام شده است. توجه داشته باشید که اگر نقاط قبل از نقطه تعادل، فاصله بیشتری از یکدیگر داشته باشند، تخمین دقیقتری خواهیم داشت. نمودار سمت چپ، نمودار رسم شده با تخمین سریع را نشان میدهد و در نمودار سمت راست، این نمودار با خط سیاه بر روی نمودار اصلی (خطچین قرمز) نشان داده شده است.
انتخاب و بررسی نقطه پایانی در تیتراسیون رسوبی
در ابتدای این آموزش اشاره کردیم که اولین تیتراسیون رسوبی از پایان تشکیل رسوب برای نمایش نقطه پایانی استفاده میکرد. در بهترین حالت، این روش، روش بسیار سختی است. پیش از آنکه تیتراسیون رسوبی به صورت عملی بکار گرفته شود، روشهای دیگری برای تعیین نقطه پایانی مورد نیاز بود.
پیدا کردن نقطه پایانی به کمک معرف
سه نوع معرف کلی برای تیتراسیونهای رسوبی وجود دارد که هرکدام شامل تغییر رنگ در نقطه پایانی یا نزدیک آن هستند. اولین نوع از معرفها، ذراتی هستند که با تیترانت تشکیل رسوب میدهند. به طور مثال، در تیتراسیون به روش مور، مقادیر کمی از به محلول تیتراند اضافه میشود. نقطه پایانی این تیتراسیون رسوبی نیز تشکیل رسوب قرمز-قهوهای خواهد بود.
از آنجایی که رنگ زردی را به محلول میدهد که سبب خطا در مشاهده نقطه پایانی میشود، تنها مقادیر کمی از را به محلول اضافه میکنند. در نتیجه این اتفاق، نقطه پایانی همواره بعد از نقطه تعادل بدست میآید. برای جبران این خطا، از یک ریجنت (با حداقل خطا) موسوم به بلانک (Reagent Blank) بمنظور تعیین حجم تیترانت مورد نیاز برای تغییر رنگ معرف استفاده میکنند.
اختلاف نقطه پایانی بلانک و تیتراند، نقطه پایانی تیتراسیون رسوبی را بدست میدهد. از آنجایی که یک باز ضعیف به شمار میآید، محلول تیتراند، قدری قلیایی خواهد بود. اگر pH بسیار اسیدی باشد، کرومات به جای ، به صورت وجود خواهد داشت که سبب تاخیر در مشاهده نقطه پایانی خواهد شد. علاوه بر این، میزان pH باید کمتر از ۱۰ باشد تا رسوب هیدروکسید نقره تشکیل نشود.
نوع دوم معرفها، کمپلکس رنگی با تیتراند یا تیترانت تشکیل میدهند. به طور مثال، در روش ولهارد، مقادیر کمی از را به محلول تیتراند اضافه میکنند. نقطه پایانی این تیتراسیون، تشکیل کمپلکس قرمز خواهد بود. این تیتراسیون باید در محیطی اسیدی انجام بگیرد تا رسوب تشکیل نشود.
نوع سوم معرفها از ذراتی استفاده میکنند که به هنگام جذب شدن به رسوب، تغییر رنگ میدهند. در «روش فاجانس» (Fajans Method)، به طور مثال از یون نقره به عنوان تیترانت بهره میگیرند و رنگ آنیونی دیکلروفلورسئین را به محلول تیتراند اضافه میکنند. پیش از نقطه پایانی، رسوب نقره کلرید، به دلیل وجود یون اضافی کلر، سطحی با بار منفی خواهد داشت.
از آنجایی که این رنگ آنیونی هم دارای بار منفی است، توسط رسوب دفع میشود و به رنگ سبز-زرد در محلول باقی میماند. بعد از نقطه پایانی، به دلیل جذب یون مثبت و اضافی نقره، سطح رسوب، بار مثبت پیدا میکند و در اینجا، دیکلروفلورسئین به سطح رسوب جذب میشود و رنگ آن به صورتی تغییر پیدا خواهد کرد. این تغییر رنگ معرف، بیانگر نقطه پایانی است.

پیدا کردن نقطه پایانی با روش پتانسیومتری
روش دیگر برای مشخص کردن نقطه پایانی، تیتراسیون پتانسیومتری است که در آن، تغییرات غلظت تیترانت یا آنالیت با استفاده از «الکترود یونگزین» (Ion Selective Electrode) ذکر میشود. در این روش، نقطه پایانی را به صورت رصد نمودار تیتراسیون پیدا میکنند.
کاربردهای کمی در تیتراسیون رسوبی
با وجود اینکه از تیتراسیون رسوبی به ندرت به عنوان روشی استاندارد یاد میکنند اما این روش همچنان به عنوان روشی تحلیلی برای ارزیابی سایر روشها بکار میرود. همانطور که مشاهده کردید، از یون نقره به طور معمول در تیتراسیون رسوبی بهره میگیرند. به تیتراسیونی که از یون نقره به عنوان تیترانت استفاده کنند، «تیتراسیون نقرهسنجی» (Argentometric Titration) میگویند. در جدول زیر، روشهای مختلف تیتراسیون رسوبی به همراه تیترانت و آنالیت آنها آورده شده است.
| آنالیت (تیتراند) | تیترانت | نقطه پایانی (روش) |
| ولهارد | ||
| مور یا فاجانس | ||
| ولهارد | ||
| مور یا فاجانس | ||
| ولهارد | ||
| ولهارد | ||
| ولهارد | ||
| ولهارد | ||
| فاجانس | ||
| ولهارد | ||
| ولهارد | ||
| ولهارد | ||
| ولهارد |
محاسبات کمی
روابط کمی بین تیتراند و تیترانت را به کمک استوکیومتری واکنش تیتراسیون تعیین میکنند. اگر از موازنه واکنش، اطلاعی نداشتید، استوکیومتری را به کمک فرمول رسوب پیدا میکنید. به طور مثال، در تشکیل رسوب ، هر مول از با دو مول از یون نقره وارد واکنش میشود.
مثال تیتراسیون رسوبی
مخلوطی شامل KCl و NaBr را با روش مور بررسی میکنیم. 0/3172 گرم از یک نمونه را در ۵۰ میلیلیتر آب حل میکنیم و تا رسیدن به نقطه پایانی و به کمک معرف تیتر میکنیم که به 36/85 میلیلیتر از محلول 0/1120 مولار نیاز دارد. تیتراسیون به صورت بلانک به 0/71 میلیلیتر تیترانت نیاز دارد تا به همان نقطه پایانی برسد. درصد وزنی (w/w) را برای KCl موجود در نمونه محاسبه کنید.
برای پیدا کردن تعداد مولهای تیترانت شرکت کننده در واکنش، باید تصحیحات ریجنت بلانک را انجام دهیم. در نتیجه، خواهیم داشت:
تیتر کردن با سبب تولید و میشود. در زمان تشکیل این رسوبات، هر مول از KCl، یک مول از و هر مول از NaBr، یک مول از را مصرف میکند. بنابراین خواهیم داشت:
در این سوال میخواهیم جرم را محاسبه کنیم، بنابراین، معادلات را بر اساس جرم مینویسیم:
تعداد مولهای بدست آمده را در رابطه بالا قرار میدهیم:
از آنجایی که این رابطه، ۲ مجهول یعنی جرمهای KCl و NaBr را دارد، به رابطه دیگری نیاز داریم تا شامل هر دو مجهول باشد. با توجه به اینکه نمونه، شامل هر دو ماده است، از یک رابطه ساده بهره میگیریم و یک مجهول را به دیگری مرتبط میکنیم.
نمونه شامل 0/262 گرم KCl است و بنابراین، درصد وزنی آن به شکل زیر محاسبه میشود:
$$\dfrac {\textrm {0.262 g KCl}} {\textrm{0.3172 g sample}} times100 = \textrm {82.6% w/w KCl}$$
لازم به ذکر است که آنالیز به کمک روش ولهارد به تیتراسیون برگشتی نیاز دارد که در مثال زیر به آن پرداخته شده است.
مثال برای تیتراسیون برگشتی
درصد وزنی در نمونهای با وزن 0/6712 گرم به کمک تیتراسیون ولهارد تعیین شده است. پس از اضافه کردن 50 میلیلیتر محلول 0/05619 مولار از و فرصت دادن به محلول برای تشکیل رسوب، با استفاده از تیتراسیون برگشتی، نقره باقیمانده با محلول 0/05322 مولار تیتر شد که برای رسیدن به نقطه پایانی، به 35/14 میلیلیتر محلول نیاز داشتیم. درصد وزنی (w/w) یون ید در نمونه را محاسبه کنید.
در این مثال تجزیه، دو رسوب داریم: و ، رسوب و و که رسوب را تشکیل میدهند. هر مول از ، یک مول از و هر مول از ، یک مول از را مصرف میکند. بنابراین خواهیم داشت:
با حل رابطه بالا برای تعداد مولهای ، به رابطهای برای محاسبه آن دست پیدا میکنیم:
$$\textrm{moles I}^-=\(\textrm{0.05619 M AgNO}_3)\times(\textrm{0.05000 L AgNO}_3)-(\textrm{0.05322 M KSCN})\times(\textrm{0.03514 L KSCN})$$
با محاسبه رابطه بالا، به عدد میرسیم که بیانگر تعداد مول در نمونه است. در نتیجه در نمونه برابر است با:
ارزیابی تیتراسیون رسوبی
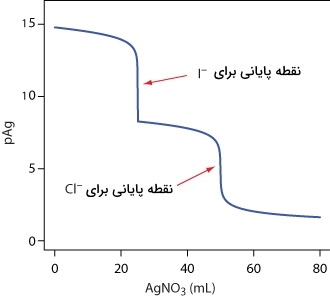
مقیاس آزمایش، دقت، حساسیت، زمان و هزینه تیتراسیون رسوبی همانند سایر روشهای تیتراسیون است. تیتراسیون رسوبی را میتوان در تجزیه مخلوطها به کار برد به شرط اینکه تغییر مشخصی در انحلالپذیری رسوبات داشته باشیم. تصویر زیر نمونهای از نمودار تیتراسیون برای مخلوط و با استفاده از به عنوان تیترانت است. در این نمودار، فلشهای قرمز نشاندهنده نقطه پایانی هستند. توجه داشته باشید که نقطه پایانی برای زودتر از اتفاق میافتد زیرا نسبت به انحلالپذیری کمتری دارد.













سلام آیا این واکنش در موهر برگشت پذیر است ؟ یعنی میتوان در نقطه پایانی نقره را جدا کنیم ؟
سلام
چرا نقره نیترات اول با کلر وارد واکنش میشه بعد با کرومات؟؟؟
و اینکه چرا نمیشه یونهای یدید و با روش موهر شناسایی کرد؟؟؟
سلام نتیجه ازمایش تتیراسون رسوبی به روش مور چی هستش ؟
با سلام؛
همانطور که در داخل متن نیز توضیح داده شده، در تیتراسیون به روش مور میتوان غلظت یون کلرید در محلول را به کمک تیتر کردن با نقره نیترات مشخص کرد. محاسبات و تجهیزات نیز در داخل همین متن آورده شدهاند.
با تشکر از همراهی شما با مجله فرادرس
سلام ببخشید نمودار تیتراسیون ولهارد چگونه است ؟
با سلام؛
روش ولهارد همانطور که در داخل متن ذکر شده است، روشی برای انجام تیتراسیون رسوبی است و نحوه رسم نمودار این تیتراسیون نیز در داخل متن ذکر شده است.
با تشکر از همراهی شما با مجله فرادرس
ایا سرعت در تیتراسیون فاجانس اهمیت دارد یا نه؟
خیلی کامل
با سلام؛
در منابع مختلف، راجع به سرعت، موضوعی عنوان نشده است.
با تشکر از همراهی شما با مجله فرادرس
حیف این تحقیق که منابع نداره
تغییر در مقدار کرومات پتاسیم مصرف شده چه تغییری در نقطه پایانی تیتراسیون داره؟ چرا؟