ایزوتوپ چیست؟ – توضیح و تعریف به زبان ساده
ایزوتوپ به عناصری گفته میشود که تعداد الکترون و پروتونهای یکسان اما نوترونهای متفاوتی دارند. ایزوتوپها نقش مهمی در تولید انرژی و انجام برخی از واکنشهای شیمیایی را دارند. در این مطلب از مجله فرادرس با مفهوم ایزوتوپ و محاسبات مربوط به آن آشنا میشویم و انواع و کاربردهای آن را میشناسیم.
- میآموزید ایزوتوپ چیست و چگونه نمایش داده میشود.
- با ایزوتوپهای پایدار و رادیواکتیو آشنا میشوید.
- فرآیند تشکیل ایزوتوپ و درصد فراوانی آنها را یاد میگیرید.
- با برخی از ایزوتوپهای مهم و کاربرد آنها آشنا میشوید.
- میتوانید جرم اتمی میانگین اتمها را محسابه کنید.
- با مفاهیمی چون ایزوتوپ اتم هیدروژن و زمانسنجی رادیومتری آشنا میشوید.


ایزوتوپ چیست؟
ایزوتوپ به عناصر شیمیایی میگویند که در هسته اتم خود، تعداد پروتون یکسان و تعداد نوترون متفاوت داشته باشد. به عبارت دیگر، ایزوتوپها به عناصری میگویند که تنها در تعداد نوترون با یکدیگر متفاوت باشند. به طور مثال، کربن ۱۲ و ۱۳ و ۱۴، همگی ایزوتوپهای کربن به شمار میآیند. کربن-۱۴ در مجموع ۸ نوترون و کربن-۱۳ در مجموع ۷ نوترون دارند. برای کربن-۱۲ نیز تعداد ۶ نوترون در هسته اتم آن ذکر شده است.
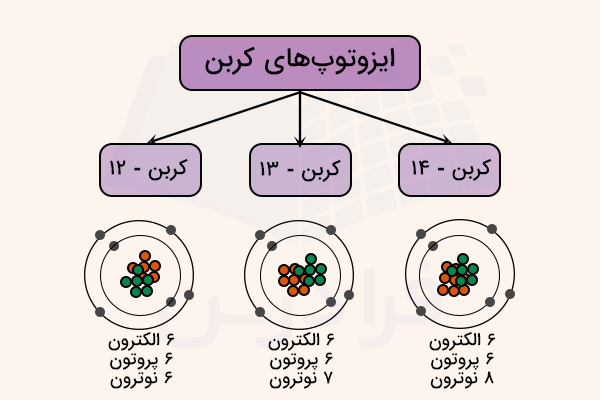
نحوه نمایش ایزوتوپ
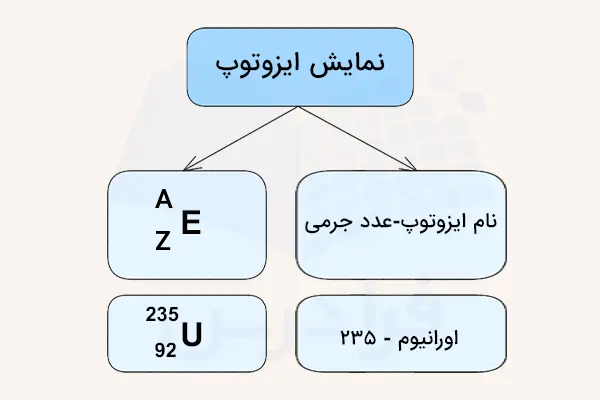
ایزوتوپها را به طور کلی بوسیله دو روش نشان میدهند. یکی از این روشها نوشتن نام فارسی عنصر به همراه عدد جرمی آن، و دیگری نوشتن نماد عنصر به همراه عدد اتمی و عدد جرمی آن در سمت چپ عنصر است. این روشها در ادامه معرفی شده است.
- روش اول: نوشتن به صورت «نام عنصر-عدد جرمی ایزوتوپ». به طور مثال، ایزوتوپ اورانیوم به صورت اورانیوم-۲۳۵ و اورانیوم-۲۳۹ نوشته میشود. البته این نوع نوشتار بیشتر در زبان انگلیسی کاربرد دارد و در زبان فارسی، نوشتن خط تیره مرسوم نیست اما بهتر است شکل استاندارد در نوشتن رعایت شود.
- روش دوم: نوشتن به صورت که در آن، A عدد جرمی، Z عدد اتمی و E نماد عنصر است. به طور مثال، اورانیوم-۲۳۵ را به صورت نشان میدهند. البته از آنجایی که «Z» به طور معمول به کمک نام عنصر مشخص میشود میتوان از نمایش آن صرفنظر کرد. به عنوان نمونه، کربن-۱۴ را به شکل نشان میدهند.
تعیین تعداد نوترون
تعداد کل نوترونهای یک ایزوتوپ را میتوان با کم کردن عدد اتمی عنصر از عدد جرمی آن مشخص کرد. به طور مثال، عدد جرمی کربن-۱۲ برابر با ۱۲ و عدد اتمی کربن نیز برابر با ۶ است، بنابراین، تعداد کل نوترونها در کربن-۱۲ برابر با ۶ خواهد بود.
ایزوتوپ های پایدار و رادیواکتیو
برخی از ایزوتوپها، هسته اتمی ناپایدار دارند که دچار «واپاشی پرتوزا» (Radioactive Decay) میشوند. چنین ایزوتوپهایی طبیعت پرتوزا دارند و بنابراین به آنها رادیو ایزوتوپ یا ایزوتوپ ناپایدار یا اتم پرتوزا نیز میگویند. از نمونههای ایزوتوپهای رادیواکتیو میتوان به کربن-۱۴، تریتیوم (هیدروژن-۳)، کلر-۳۶، اورانیوم-۲۳۵ و اورانیوم-۲۳۸ اشاره کرد.
برخی از ایزوتوپها نیمهعمر بالایی (از مرتبه صدها میلیون سال) دارند. این نوع از ایزوتوپها را ایزوتوپ پایدار یا نوکلید پایدار مینامند. ایزوتوپهایی همچون کربن-۱۲، کربن-۱۳، اکسیژن-۱۶، اکسیژن-۱۷ و اکسیژن-۱۸ از جمله ایزوتوپهای پایدار به شمار میآیند.
نوکلید دیرینه چیست؟
«نوکلید دیرینه» (Primordial Nuclide) به نوکلیدهایی میگویند که از زمان تشکیل منظومه شمسی وجود داشتهاند. از بین ۳۳۹ ایزوتوپ طبیعی موجود در طبیعت، ۲۸۶ ایزوتوپ به عنوان نوکلید دیرینه شناخته میشوند.
تشکیل ایزوتوپ
ایزوتوپها میتوانند به صورت طبیعی و از طریق واپاشی پرتوزای هسته یا به صورت مصنوعی از طریق بمباران هستههای پایدار توسط ذرات باردار به تولید برسند. این بمباران از طریق شتابدهندهها یا نوترون در یک راکتور هستهای انجام میشود.
درصد فراوانی ایزوتوپ
ایزوتوپهای یک عنصر، همگی با نسبتهای یکسان وجود ندارند. درصد فراوانی ایزوتوپ، درصد نسبی هر ایزوتوپ از یک عنصر در یک نمونه طبیعی از آن عنصر است. به طور مثال، جیوه دارای هفت ایزوتوپ طبیعی است و هرکدام، درصد فراوانی متفاوتی از ۰٫۱۴۶ تا ۲۹٫۸ درصد دارند.
برخی از ایزوتوپهای طبیعی و مصنوعی، ایزوتوپهایی رادیواکتیو هستند. همچنین، تمامی اتمهای سنگینتر از بیسموت، پرتوزا هستند. با این وجود، برخی از نوکلیدهای سبکتر نیز خاصیت رادیواکتیو دارند. به طور مثال، هیدروژن دارای دو ایزوتوپ پایدار اما ایزوتوپ سوم آن یعنی تریتیوم، پرتوزا است.
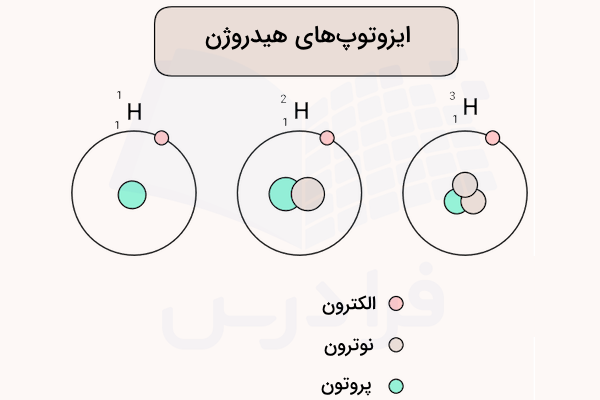
تعجبی ندارد که بین نمونههای مختلف، ایزوتوپهایی با درصد فراوانی مختلف وجود داشته باشد. اما این سوال بوجود میآید که چطور میتوان درصد فراوانی ایزوتوپها را محاسبه کرد. این کار از طریق طیفسنجی جرمی (اسپکترومتری جرمی) انجام میشود. در ادامه ایزوتوپهای هیدروژن مشخص شده است.
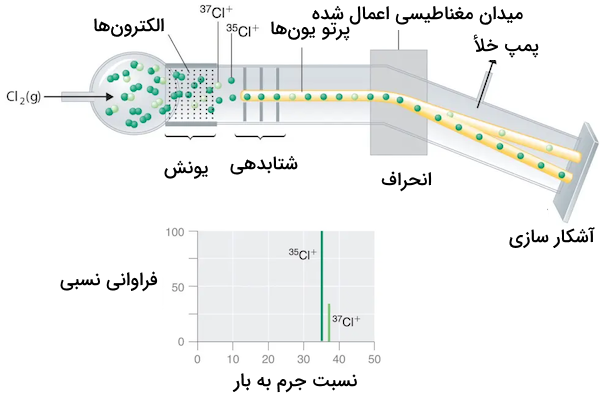
اندازه گیری درصد فراوانی
با وجود اینکه نمیتوان به طور مستقیم جرم یک اتم را اندازهگیری کرد، میتوانیم از طیفسنج جرمی بهره بگیریم که اندازهگیری نسبت جرم به بار را ممکن میسازد. در تصویر زیر، ورود گاز کلر به درون دستگاه اسپکترومتر نشان داده شده است. گاز کلر شامل چند ایزوتوپ است و این گاز توسط الکترونها بمباران و یونیزه میشود. یونش و جدایش الکترونها سبب تشکیل یونهای کلر خواهد شد. این یونها پس از شتابدهی، وارد یک میدان مغناطیسی میشوند و این میدان، سبب انحراف جهت حرکت یونها خواهد شد.
زاویه این انحراف به جرم ذره و قدرت میدان مغناطیسی بستگی دارد. ذرات سبکتر، بیشتر منحرف میشوند و بنابراین، انحراف بیشتری نسبت به خواهد داشت. همانطور که در تصویر مشاهده میکنید، در انتهای مسیر یونها، یک آشکارساز قرار گرفته است و هرقدر که شدت میدان مغناطیسی بیشتر شود، انحراف بیشتری را شاهد هستیم که در اثر این اتفاق، در انتهای مسیر، ذرات به طور کامل از یکدیگر جدا میشوند.
در نهایت، خروجی دستگاه، طیف جرمی بدست میدهد که محور عمودی، بیانگر درصد فراوانی و محور افقی، نشاندهنده نسبت جرم به بار است. نمودار نیز بر اساس پیک (قله) ایزوتوپ با بیشترین فراوانی، استاندارد (نرمالسازی) میشود. بنابراین اگر نسبت ۳ به ۱ (3:1) داشته باشیم، یعنی به ازای هر سه ذره خواهیم داشت و درصد فراوانی ایزوتوپ کلر به صورت ۷۵ درصد برای و ۲۵ درصد برای خواهد بود.
جرم اتمی میانگین
جرم اتمی میانگین، میانگین وزندار جرم ایزوتوپهای یک عنصر است که بر اساس درصد فراوانی طبیعی هر ایزوتوپ محاسبه میشود. بعد از اینکه جرمهای نسبی هر ایزوتوپ را به کمک دادههای طیفسنجی محاسبه کردیم، از اطلاعات بدست آمده جهت محاسبه جرم اتمی میانگین تمامی اتمهای یک عنصر استفاده میکنیم. برای بدست آوردن جرم اتمی میانگین، از رابطه زیر بهره میگیریم:
در رابطه بالا «» کسر فراوانی ایزوتوپ و «» بیانگر عدد جرمی است. جرم اتمی میانگین محاسبه شده با این روش را میتوان در زیر نماد هر عنصر شیمیایی در جدول تناوبی مشاهده کرد. در ادامه، مثالی برای محاسبه جرم اتمی میانگین مطرح میکنیم.
مثال محاسبه جرم اتمی میانگین
جرم اتمی میانگین برای نئون را محاسبه کنید. این عنصر، ۳ ایزوتوپ دارد که درصد فراوانی به همراه یکای جرم اتمی (amu) در زیر آورده شده است.
با توجه به اینکه در صورت سوال، نام عنصر ذکر شده است، جواب نهایی را میتوان با نگاه به جدول تناوبی، کنترل کرد. از آنجایی که ایزوتوپ نئون-۲۰ بیشترین درصد فراوانی را دارد، باید بیشترین تاثیر را نیز بر جرم اتمی میانگین داشته باشد. بنابراین، جواب نهایی باید عددی نزدیک به جرم نئون-۲۰ بدست آید.
با جایگذاری اعداد در فرمول بالا، به عدد برای جرم اتمی میانگین نئون میرسیم. همچنین، با نگاهی به گروه ۱۸ جدول تناوبی یعنی گروه گازهای نجیب، خواهیم دید که جرم اتمی میانگین برای نئون، برابر با ذکر شده که به عدد بدست آمده بسیار نزدیک است.

برخی از ایزوتوپ های مهم
در جدول زیر، نام برخی عناصر و ایزوتوپهای آنها نمایش داده شده است.
| عدد اتمی | نام | درصد فراوانی |
| 1 | هیدروژن-1 | 99/98 |
| هیدروژن-۲ (دوتریوم) | 0/115 | |
| هیدروژن-۳ (تریتیوم) | فراوانی مشخصی برای آن ذکر نمیشود. | |
| ۳ | لیتیم-6 | 7/59 |
| لیتیم-7 | 92/41 | |
| 6 | کربن-۱۲ | 98/93 |
| کربن-۱۳ | 1/07 | |
| کربن-۱۴ | فراوانی مشخصی برای آن ذکر نمیشود. | |
| 7 | نیتروژن-۱۴ | 99/632 |
| نیتروژن-۱۵ | 0/368 | |
| 8 | اکسیژن-۱۶ | 99/757 |
| اکسیژن-۱۷ | 0/038 | |
| اکسیژن-۱۸ | 0/205 | |
| 17 | کلر-۳۵ | 75/78 |
| کلر-۳۷ | 24/22 |
کاربرد ایزوتوپ ها چیست؟
ایزوتوپها کاربردهای زیادی دارند. همچنین، خواص شیمیایی آنها با یکدیگر تفاوتی ندارند اما خواص فیزیکی آنها با یکدیگر متفاوت هستند و علاوه بر این، خواص هستهای متفاوتی نیز دارند. به همین دلیل، کاربردهای متفاوتی را بر اساس خواص متفاوت (فیزیکی، شیمیایی و هستهای) برای آن ذکر میکنند و میتوان خواص آنها را بر اساس خواص فیزیکی و شیمیایی و خواص هستهای طبقهبندی کرد که در ادامه به توضیح آنها خواهیم پرداخت.
کاربرد ایزوتوپ بر اساس خواص فیزیکی و شیمیایی
خواص فیزیکی ایزوتوپها به دلیل ساختار هستهای آنها متغیر است اما در خصوص خواص شیمیایی، تغییرات زیادی را شاهد نیستیم. بیشترین کاربردها بر اساس این خواص در ادامه ذکر شدهاند.
نشان گذاری رادیوایزوتوپی
«نشانگذاری ایزوتوپی» (Isotopic Labelling) از جمله کاربردهای معمول ایزوتوپها به شمار میآید و در این روش، از ایزوتوپهای غیرمعمول به عنوان مارکر (Marker) در واکنشهای شیمیایی بهره میگیرند. به طور کلی، اتمهای عناصر را نمیتوان به راحتی از یکدیگر تشخیص داد. این روش به کمک طیفسنجی جرمی یا طیفسنجی مادون قرمز امکانپذیر است. پرتوزایی ایزوتوپهای رادیواکتیو بمنظور شناسایی واکنشدهندههای مختلف، مورد استفاده قرار میگیرد.
زمان سنجی رادیومتری
روش «زمانسنجی رادیومتری» (Radiometric Dating) نیز مشابه نشانگذاری ایزوتوپی است. این روش همچنین در مطالعه فرآیندهای شیمیایی کاربرد دارد.
کاربرد ایزوتوپ بر اساس خواص هسته ای
از آنجایی که ایزوتوپها در تعداد نوترون با یکدیگر تفاوت دارند، خواص هستهای متفاوتی نیز از خود بروز میدهند که همین امر سبب تغییر در خواص فیزیکی آنها نیز میشود. از جمله کاربردهای اصلی ایزوتوپها در روشهای طیفسنجی است. به طور مثال، طیفسنجی رزونانس مغناطیسی هسته (NMR) برای ایزوتوپهایی با اسپین هسته غیرصفر استفاده میشود.
یادگیری علوم هشتم با فرادرس
از آنجایی که شناخت ایزوتوپها و درک تفاوت آنها با عدد اتمی و جرمی، در دروس پایهای مورد توجه قرار میگیرد، فرادرس اقدام به انتشار فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی در قالب یک آموزش ۵ ساعته کرده است که در ادامه به توضیح دروس آن میپردازیم. این آموزش برای دانشآموزانی مناسب است که میخواهند بخش شیمی علوم هشتم خود را بهبود ببخشند.
در درس یکم از این دوره به مخلوطها و جداسازی مواد اختصاص دارد و پس از آشنایی با انواع مخلوطهای همگن و ناهمگن، به بررسی محلول، کلوئید، سوسپانسیون و همچنین شناساگرهای اسید و باز پرداخته میشود. انواع روشهای جداسازی مواد و بررسی انحلالپذیری مواد نیز در این درس مرور خواهد شد.
درس دوم و سوم به تعریف تغییرات فیزیکی و همچنین تغییرات شیمیایی اختصاص دارد و مثالهای این تغییرات بررسی میشوند. علاوه بر این، در درس سوم، واکنشهای گرماده و گرماگیر نیز مورد بررسی قرار میگیرند و کار در تغییرات شیمیایی و واکنش سوختن نیز از جمله موارد دیگر مطرح شده در این درس به شمار میآیند.
درس چهارم، ساختار اتم و همچنین مفاهیم اتم و مولکول بررسی خواهند شد و درس پنجم، با تعریف عنصرها و نماد شیمیایی آنها به همراه مدلهای اتمی، این مفاهیم را بهبود میبخشد. البته ایزوتوپ و کاربردهای آن نیز در این درس آموزش داده میشوند. در درس ششم نیز با انواع یونها و کاتیون و آنیون آشنا میشوید.
برخی سوالات متداول در خصوص ایزوتوپ
در ادامه، به طور ویژه به برخی از سوالات متداول در خصوص ایزوتوپها میپردازیم.
ایزوتوپ چیست؟
همانطور که در ابتدای متن گفته شد، ایزوتوپهای یک عنصر شیمیایی به گروهی از اتمها گفته میشود که عدد اتمی یکسان و عدد جرمی متفاوتی داشته باشند. این امر بدان معنی است که تمامی ایزوتوپهای یک عنصر در هسته اتم خود، تعداد پروتون و الکترون یکسانی دارند و تنها در تعداد نوترون با یکدیگر متفاوت هستند.
ایزوتوپ های هیدروژن را نام ببرید؟
هیدروژن دارای ۳ ایزوتوپ است که در ادامه به آنها اشاره خواهد شد:
- پروتیوم (هیدروژن-۱): این ایزوتوپ هیدروژن شامل ۱ پروتون و ۱ الکترون است و در هسته خود هیچ نوترونی ندارد.
- دوتریوم (هیدروژن-۲): در این ایزوتوپ، تعداد الکترون، پروتون و نوترون، برابر با ۱ است.
- تریتیوم (هیدروژن-۳): ایزوتوپ تریتیوم شامل ۱ پروتون، ۱ الکترون و ۲ نوترون است. علاوه بر این، همانطور که پیشتر هم اشاره شد، ایزوتوپ تریتیوم از جمله ایزوتوپهای پرتوزا به شمار میآید.
چند نمونه از کاربرد ایزوتوپ ها را نام ببرید؟
از جمله کاربردهای مهم ایزوتوپها باید به تعیین «امضای ایزوتوپی» (Isotopic Analysis) اشاره کرد که از طریق «تجزیه ایزوتوپی» (Isotope Analysis) صورت میگیرد. این کار از طریق طیفسنجی جرمی انجام میشود.
مکانیسم واکنش شیمیایی را میتوان به کمک «جانشینی ایزوتوپی» (Isotopic Substitution) مشخص کرد. همچنین، تغییر در سرعت واکنش را میتوان بر اساس «اثر ایزوتوپ جنبشی» (Kinetic Isotope Effect) اندازهگیری کرد.
علاوه بر این، از ایزوتوپها میتوان برای تغیین غلظت بسیاری از عناصر استفاده کرد. این کار به کمک «رقیقسازی ایزوتوپی» (Isotope Dilution) انجام میگیرد.
آزمون سنجش یادگیری
۱. براساس ویژگیهای هستهای، ایزوتوپ چیست؟
اتمهایی با تعداد پروتون و نوترون یکسان
اتمهایی با تعداد پروتون برابر اما نوترون متفاوت
اتمهایی با تعداد الکترون و نوترون یکسان
اتمهایی با عدد اتمی و عدد جرمی کاملا برابر
تعریف ایزوتوپ براساس ویژگی هستهای این است که اتمهایی از یک عنصر هستند که تعداد پروتونهایشان برابر اما تعداد نوترونهای آنها متفاوت است. تمام ایزوتوپهای یک عنصر، عدد اتمی یکسان (یعنی تعداد پروتونهای ثابت) دارند و فقط در تعداد نوترونها با یکدیگر تفاوت دارند.
۲. کدام گزینه بیانگر دو روش معمول نمایش ایزوتوپها و تفاوت آنها است؟
یکی بر اساس رنگبندی عناصر و دیگری با شکل هندسی هسته نمایش داده میشود که اولی برای علوم، دومی برای آموزش است.
نمایش با نام عنصر و عدد جرمی و نیز نمایش با عدد جرمی و عدد اتمی کنار نماد عنصر تفاوت دارند. یکی فقط نام و عدد، دیگری فرمول کامل نشان میدهد.
نمایش ایزوتوپها در همه کشورها یکسان است و تفاوت فقط در نام عناصر وجود دارد.
در یک روش فقط از علامت عنصر استفاده میشود و در روش دیگر فقط از عدد جرمی بدون عدد اتمی درج میگردد.
دو روش استاندارد نمایش ایزوتوپها شامل نوشتن نام عنصر همراه عدد جرمی (مثل اورانیوم-۲۳۵) و همچنین قراردادن عدد جرمی و عدد اتمی کنار نماد شیمیایی عنصر (مانند ) است. روش اول صرفا نام عنصر و جرم را میآورد، اما روش دوم فرمول کامل با اعداد اتمی و جرمی را کنار نماد عنصر نشان میدهد.
۳. فرض کنید عدد جرمی و عدد اتمی یک ایزوتوپ مشخص شده است. کدام روش برای بهدست آوردن تعداد نوترونها درست است؟
عدد اتمی را تقسیم بر عدد جرمی کنیم.
عدد اتمی را از عدد جرمی کم کنیم.
عدد اتمی و عدد جرمی را جمع کنیم.
عدد جرمی را دو برابر کنیم.
برای یافتن تعداد نوترونهای یک ایزوتوپ باید «عدد اتمی را از عدد جرمی کم کنیم» زیرا عدد جرمی مجموع پروتون و نوترون است و عدد اتمی فقط تعداد پروتون را نشان میدهد. پس با کم کردن عدد اتمی از عدد جرمی، تنها تعداد نوترونها باقی میماند.
۴. کدام تفاوت اساسی میان ایزوتوپ پایدار و رادیوایزوتوپ (ایزوتوپ ناپایدار) میتواند کاربرد آنها را در علوم و صنعت تعیین کند؟
ایزوتوپ ناپایدار (رادیوایزوتوپ) به علت پایداری زیاد در سازوکارهای طبیعی نقش دارد و ایزوتوپ پایدار تنها در فرایندهای هستهای مصنوعی قابل استفاده است.
ایزوتوپ پایدار معمولا برای مطالعه ساختار مواد بدون ایجاد تغییر در نمونه به کار میرود، در حالی که رادیوایزوتوپ به علت واپاشی پرتوزا میتواند در ردیابی، سنسنجی و پزشکی کاربرد داشته باشد.
هر دو نوع ایزوتوپ فقط در پژوهش شیمیایی و اندازهگیری غلظت عناصر استفاده میشوند و پایداری تاثیری روی کاربرد ندارد.
ایزوتوپهای پایدار و ناپایدار هر دو فقط در طیفسنجی نوری کاربرد دارند و تفاوت آنها فقط در عدد جرمی است.
ایزوتوپ پایدار چون واپاشی پرتوزا ندارد، بدون تاثیر بر ساختار و خصوصیات نمونه برای بررسی تازمان بلندمدت و مطالعه ترکیب مواد مناسب است. در مقابل، رادیوایزوتوپ به دلیل ناپایداری و انتشار پرتوزا، در کاربردهایی مانند ردیابی مواد، سنسنجی رادیومتری و برخی درمانهای پزشکی اهمیت دارد.













سلام ممنون از مطالبتون.
فقط یک اشتباهی رخ داده، در قسمت نحوه نمایش ایزوتوپ، روش دوم، جای Z و A در نماد شیمیایی عنصرE باید جابهجا شود. عدد جرمی(A) باید سمت چپ بالا و عدد اتمی(Z)سمت چپ پایین باشد. تشکر
با سلام؛
مورد ذکر شده اصلاح و بازنویسی شد.
با تشکر از همراهی شما با مجله فرادرس
فیدبک:
راستش کمی مبهم و از ابتدا سخت توضیح داده شده. شبیه متن کتابهای درسی مدرسه
دمای کراکینگ پنتان برچه اساسی بالاتر ازپروپان است
سلام. مفید بود. بسیار سپاس گزارم.