واکنش حذفی – به زبان ساده
واکنش حذفی نوعی از واکنشهای آلی به شمار میآید که در آن، دو گروه جانشینی (استخلافی)، در مکانیسمهای تکمرحلهای یا دومرحلهای، از مولکول حذف میشوند. مکانیسم تکمرحلهای را با نام و مکانیسم دومرحلهای را با نام میشناسند. توجه داشته باشید که اعداد در نام مکانیسم، به تعداد مراحل ارتباطی ندارند بلکه مرتبط با سینتیک واکنش هستند. ، دو مولکولی (مرتبه دوم) و ، تکمولکولی (مرتبه اول) است.

مقدمه
واکنش حذفی در محلهایی اتفاق میافتد که جدا از گروه کربونیل یا سایر گروههای «الکترون کِشنده» (Electron Withdrawing) هستند. این نوع از واکنش حذفی را میتوان با دو مکانیسم توضیح داد.
این مکانیسمها میتوانند در یک مرحله «همزمان» (Concerted) صورت گیرند یا اینکه در دو مرحله انجام شوند. همانطور که گفته شد، این مکانیسمها را با نام و میشناسند.
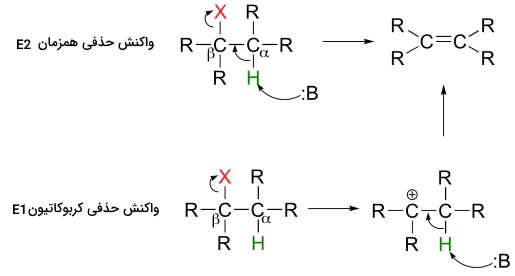
چنین مکانیسمهایی در آزمایشگاههای شیمی آلی اهمیت بسیاری دارند اما در بیوشیمی کمتر دیده میشوند. در ادامه این مطلب به بررسی مکانیسمهای واکنش حذفی میپردازیم. لازم به ذکر است که انجام هر مکانیسم به ماهیت گروههای R - یعنی آلکیل هالید نوع اول، دوم، سوم و ... - و همچنین، مشخصات باز، بستگی دارد.
واکنش های E1 و E2 در آزمایشگاه
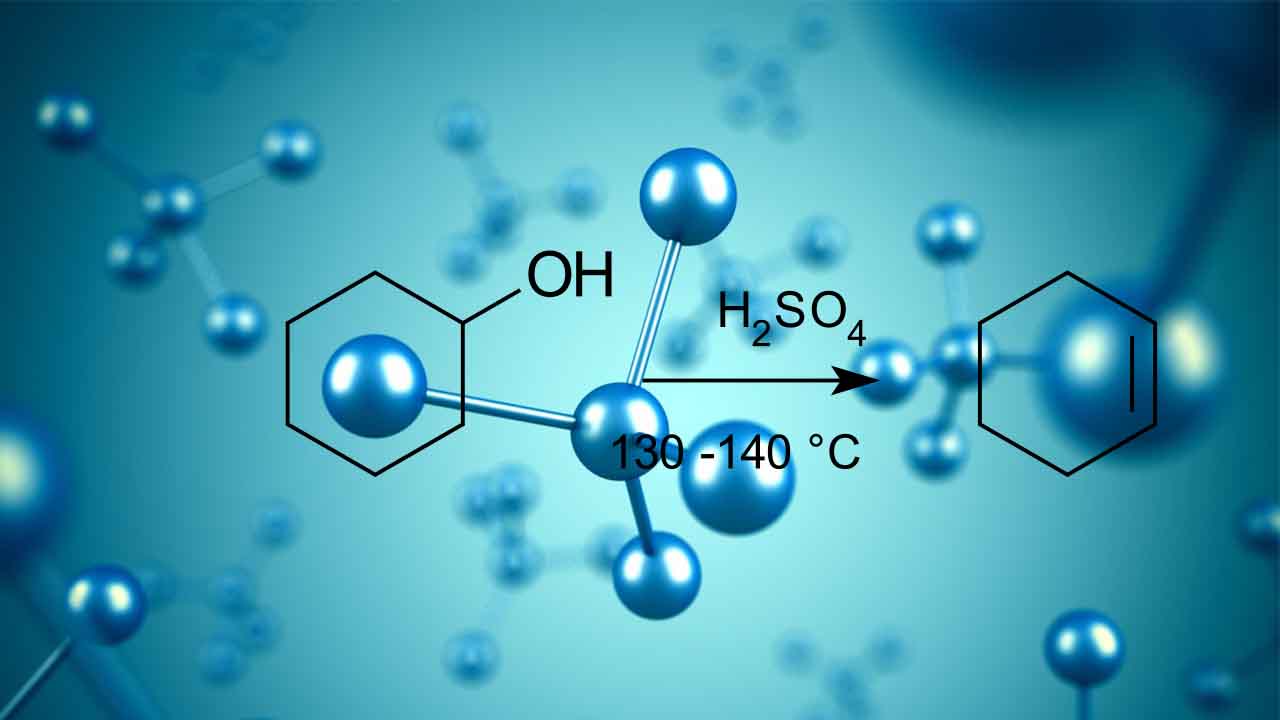
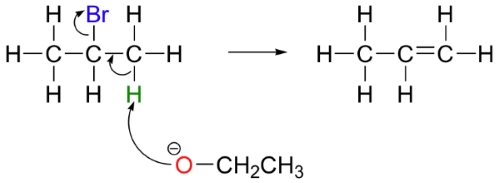
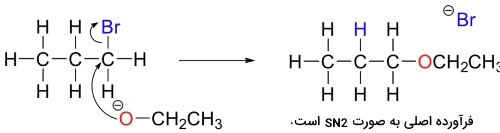
واکنش حذفی در آزمایشگاه با بازهایی نسبتا قوی همچون آلکوکسیدها (الکلهای پروتونگیری شده) انجام میگیرند. به طور مثال، برای تولید پروپن، ۲-بروموپروپان با اتوکسید طبق تصویر زیر واکنش میدهد.
پروپن، تنها فرآورده این واکنش نیست بلکه اتوکسید در مواقعی به هنگام واکنش در نقش یک نوکلئوفیل ظاهر میشود.
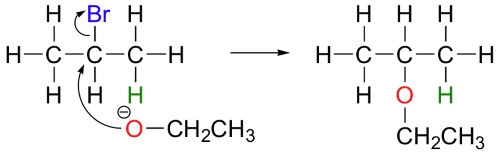
در آزمایشگاههای شیمی آلی، شیمیدانهایی که واکنشهای غیرآنزیمی جانشینی هستهدوستی یا واکنش حذفی را انجام میدهند باید به رقابت بین این دو واکنش آگاهی داشته باشند چراکه بازها میتوانند نوکلئوفیل یا برعکس باشند. با این وجود، با انتخاب دقیق ریجنت مورد نظر، میتوان به خوبی جهت واکنش را مشخص کرد. الکتروفیلهای کربن نوع اول همچون ۱-بروموپروپان، تمایل بیشتری به انجام واکنشهای جانشینی از طریق مکانیسم دارند و به نسبت، تمایل کمتری به مکانیسم نشان میدهند چراکه در کربن الکتروفیل، هیچ ممانعتی وجود ندارد و هدف خوبی برای یک نوکلئوفیل به شمار میآید.
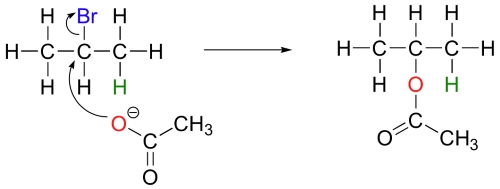
در این نوع از ترکیبات، مکانیسمهای و به دلیل ناپایداری نسبی کربوکاتیونهای نوع اول، انجام نمیگیرند. همچنین، طبیعت ذرات غنی از الکترون نیز اهمیت دارند. به طور مثال، استات، نوعی باز ضعیف به شمار میآید اما یک هستهدوست مناسب است و در واکنش با ۲-بروموپروپان، به عنوان یک نوکلئوفیل عمل میکند.
اگر بخواهیم واکنش را به جای واکنش جانشینی، به سمت یک واکنش حذفی سوق دهیم، معمولا از حرارت استفاده میکنیم. زیرا واکنش حذفی سبب افزایش تعداد مولکولها میشود و بنابراین، آنتروپی را افزایش میدهد. با افزایش آنتروپی، چنین واکنشهایی در دمای بالا انجام میگیرند. واکنشهای جانشینی به طور معمول شامل تغییرات آنتروپی زیاد نیستند. بنابراین اگر نیاز به داشته باشیم، واکنش باید در پایینترین دمایی انجام شود که در آن، سرعتی قابل قبول داشته باشیم.
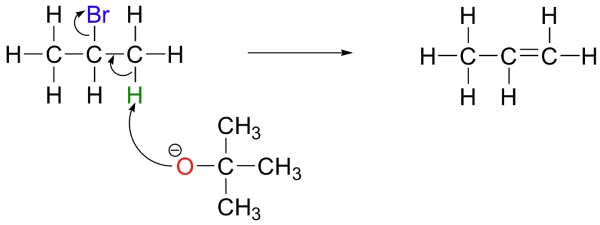
همچنین، میتوانیم از یک باز قوی با ممانعت فضایی همچون ترت-بوتواکسید استفاده کنیم. حالت تودهای این ترکیب، کار اکسیژن را برای رسیدن به کربن، یا به عبارت دیگر، رسیدن به نقش نوکلئوفیلی دشوار میکند. در این شرایط، باز به جای کربن الکتروفیل، یک پروتون را حذف میکند چراکه دسترسی به آن سادهتر است.
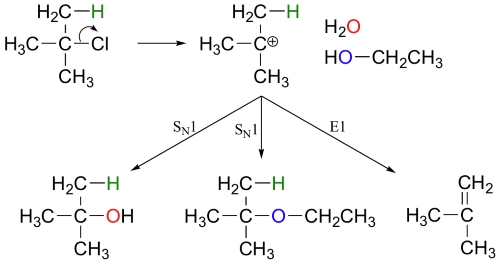
شرایط انجام واکنشهای ، مشابه با شرایط واکنش است. در حقیقت، واکنشهای و به طور معمول به صورت همزمان اتفاق میافتند. در این شرایط، بعد از تشکیل کربوکاتیون واسط، مخلوطی از فرآوردههای حاصل از مکانیسمهای جانشینی و حذفی تشکیل میشود.
به طور مثال، زمانیکه ترت-بوتیل کلرید، در مخلوطی از آب و اتانول، همزده شود، مخلوطی از فرآورده یعنی ۲-متیلپروپان-۲-اول و ترت-بوتیل اتیل اتر به همراه فرآورده یعنی ۲-متیلپروپان خواهیم داشت. درصورتیکه نیاز به واکنش حذفی داشته باشیم، از حرارت بهره میگیریم.
مثال برای رقابت بین واکنش حذفی و جانشینی هسته دوست
واکنش آبگیری سیکلوهگزانول و تشکیل سیکلوهگزن در محیط کاتالیستی اسیدی فسفریک اسید، از جمله تبدیلات گروههای عاملی به شمار میآید که به طور معمول در آزمایشگاههای شیمی آلی مورد استفاده قرار میگیرد. در این واکنش، به هیچ حلالی نیاز نداریم. مایع خالص سیکلوهگزانول به همراه قطرات کمی از فسفریک اسید غلیظ مخلوط میشود.
برای اینکه این واکنش تعادلی را به جهت دلخواه هدایت کنیم، به هنگام تشکیل سیکلوهگزن، از طریق تقطیر، فرآورده را از واکنش خارج میکنیم تا طبق اصل لوشاتلیه، جهت پیشرفت واکنش به طرف تشکیل سیکلوهگزن باشد. نقطه جوش سیکلوهگزن برابر با 83 درجه سانتیگراد و به طور ویژهای پایینتر از سایر مواد موجود در محلول است.
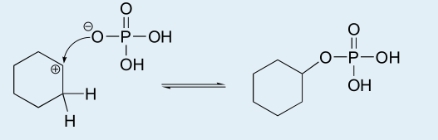
هر فسفات سیکلوهگزیل که ممکن است به هنگام رقابت واکنش تشکیل شود، در داخل ظرف آزمایش باقی میماند و در نهایت، با گذشت زمان به سیکلوهگزن تبدیل میشود.
مکانیسم سنتز سیکلوهگزن و همچنین مکانیسم تشکیل فسفات سیکلوهگزیل را رسم کنید.
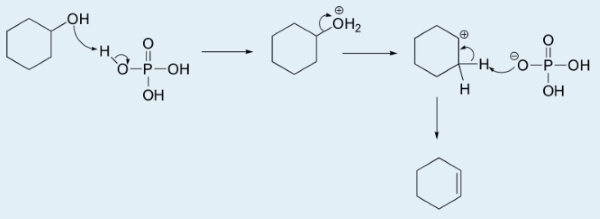
اگر فسفات، به جای باز، در نقش یک هستهدوست (نوکلئوفیل) ظاهر شود و به کربوکاتیون حمله کند، فسفات سیکلوهگزیل خواهیم داشت.
جهت گزینی واکنش حذفی
در ادامه، رقابت بین واکنش حذفی و جانشینی هستهدوست را کنار میگذاریم و بر روی «جهتگزینی» (Regioselectivity) در واکنش حذفی تمرکز میکنیم.
در بسیاری از موارد، واکنش حذفی منجر به تولید یک ایزومر یا ایزومر فضایی میشود. از نمونههای این واکنش میتوان به فرآورده حذفی در واکنش ۲-کلروپنتان اشاره کرد.
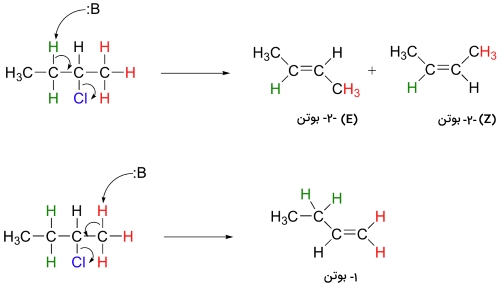
این واکنش، هم «مکانویژه» (Regiospecific) و هم «فضاویژه» (Stereospecific) است. به طور کلی، آلکنهایی که در آنها گروههای آلکیل بیشتری به پیوند دوگانه کربن متصل شده باشند (Substituted Alkene)، پایداری بیشتری نیز خواهند داشت. به همین دلیل در مثال بالا، مخلوط فرآورده، بیشتر شامل ۲-بوتن خواهد بود تا ۱-بوتن. این مورد، جنبه «مکانشیمیایی» (Regiochemical) خروجی واکنش خواهد بود که به «قانون زایتسف» (Zaitsev's Rule) معروف است. علاوه بر این، ایزومرهای ترانس (E) آلکن، پایداری بیشتری نسبت به ایزومرهای سیس (Z) دارند و به همین دلیل، میتوان پیشبینی کرد که فرآورده E بیشتری در مقایسه با Z خواهیم داشت.
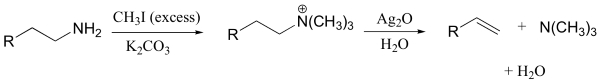
«واکنش حذفی هافمن» (Hoffman Eliminattion) واکنشی است که به مطالعه واکنش حذفی میپردازد و در آن، گروه ترککننده، یک آمین نوع چهارم است. توجه داشته باشید که در اینجا، هیچ پروتونی بر روی آمین نوع چهارم وجود ندارد که بتواند بازِ موجود در واکنش را پروتونه (پروتوندهی) کند.
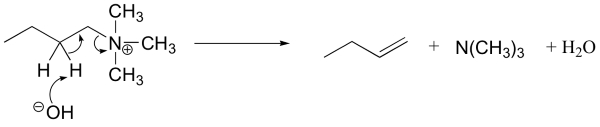
در عمل، آمین نوع چهارم را به کمک فرآوری آمین نوع اول یا دوم به همراه مقادیر اضافه از متیل یدید و باز ضعیف تولید میکنند. به طور مثال، اکسید نقره در آب، یون هیدروکسید را تولید میکند. تحت این شرایط، رقابت کمی بین واکنشها وجود دارد.
واکنش حذفی E2
این واکنش حذفی دو مولکولی در سال ۱۹۲۰ ارائه شد. برخلاف واکنش ، واکنش ، دو گروه جانشین را از طریق اضافه کردن یک باز قوی حذف و یک آلکن تولید میکند. واکنشهای به طور معمول همراه با آلکیل هالیدهای نوع دوم و سوم دیده میشوند. سرعت این واکنشها از سینتیک مرتبه دوم پیروی میکنند و به باز و آلکیل هالید وابسته هستند. در این نوع از واکنشها به یک «گروه ترککننده» (Leaving Group) مناسب نیاز داریم چراکه در مرحله تعیین کننده سرعت، نقش دارد. گروه ترککننده باید به صورت «همصفحه» (Coplanar) باشد تا پیوند پای تشکیل دهند. کربنها نیز از حالت هیبرید به تبدیل میشوند.
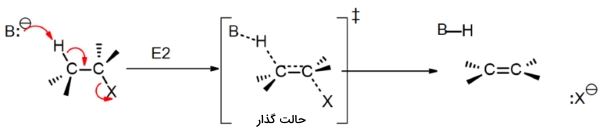
در این واکنش، بیانگر باز و بیانگر گروه ترککننده و به طور معمول، یک هالوژن است. تنها یک حالت گذار وجود دارد که واکنش را به صورت تکمرحلهای نشان میدهد. باز یک پیوند با هیدروژن تشکیل میدهد و پیوند پای ایجاد میشود. در ادامه، پیوند شروع به شکستن میکند. در بیشتر واکنشها نیاز داریم تا این موارد همگی در یک صفحه انجام بگیرند و زاویه بین گروه ترککننده و برابر با ۱۸۰ درجه باشد.
جمع بندی واکنش حذفی E2
به طور خلاصه، برای اینکه یک واکنش انجام بگیرد، به موارد زیر نیاز داریم:
- وجود یک باز، بویژه برای آلکیلهالیدهای نوع اول بسیار ضروری است.
- هر دو گروه ترککننده (H و X)، باید در یک صفحه قرار داشته باشند. این امر سبب تشکیل پیوند دوگانه در طول واکنش میشود. در تصویر بالا میبینید که هر دو گروه ترککننده در یک صفحه قرار دارند.
- بر اساس قانون زایتسف، آلکنهایی که گروههای آلکیل بیشتری به آنها متصل شده باشند، به میزان بیشتری در واکنش، تولید میشوند.
- اگر یک باز با ممانعت فضایی، سبب تولید آلکنی با تعداد گروه آلکیل متصل کمتری شود، قانون هافمن مورد بررسی قرار میگیرد.
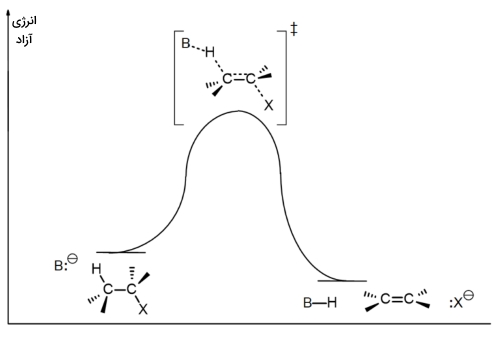
در تصویر زیر، دیاگرام انرژی آزاد برای یک واکنش نشان داده شده که بیانگر واکنشی همزمان است.
نکات مهم مربوط به واکنش حذفی E2
در زیر، اصلیترین نکات مربوط به واکنش حذفی آورده شده است:
- این واکنش به طور معمول از یک باز قوی به همراه یک آلکیل هالید استفاده میکند.
- آلکیل هالیدهای نوع اول و دوم و سوم، همگی واکنشدهندههای موثری هستند که در بیشتر موارد، آلکیل هالید نوع سوم، راحتتر واکنش میدهد. برای کاهش رقابت بین واکنش و در زمان بکارگیری آلکیل هالید نوع اول، از یک باز استخلافی همچون استفاده میشود.
- H و X هردو باید در حالت ۱۸۰ درجه موسوم به «Antiperiplanar» در یک صفحه نسبت به یکدیگر وجود داشته باشند.
- تا زمانی که از یک باز با ممانعت فضایی همچون استفاده نکرده باشیم، قانون زایتسف برقرار است و بر این اساس، آلکنی که گروههای متیل بیشتری به پیوند دوگانه آن متصل شده باشند، پایداری بیشتری دارد.
واکنش حذفی E1
واکنش حذفی تکمولکولی ()، واکنشی است که در آن، بر اثر حذف ، پیوند دوگانه تشکیل میشود. این واکنش، مشابه با واکنش جانشینی تکمولکولی () است چراکه مرحله تعیین کننده سرعت، با از دست دادن گروه ترککننده و تشکیل کربوکاتیون واسط همراه خواهد بود. از آنجایی که مرحله آهسته تعیین کننده سرعت واکنش، تنها یک واکنشدهنده را شامل میشود، واکنش از نوع تکمولکولی و مرتبه اول به شمار میآید. با توجه به اینکه این واکنشها، دارای رفتاری مشابه هستند، در نتیجه، با یکدیگر رقابت دارند.
در بسیاری از موارد، این واکنشها به طور همزمان اتفاق میافتند و از یک واکنش، فرآوردههای متفاوتی خواهیم داشت. با این وجود، درصورتیکه شرایط آزمایش را به صورت گرم یا سرد انتخاب کنیم، تولید بیشتری از یک نوع فرآورده، امکانپذیر خواهد بود.
واکنش کلی
واکنش شامل پروتونگیری از هیدروژن نزدیک کربوکاتیون (معمولا یک اتم کربن دورتر یا در محل بتا) و تشکیل یک آلکن است. برای انجام چنین واکنشی، به یک باز نیاز داریم. برای سادهسازی ارائه مدل این واکنش، حرف «B»، نشانگر باز و عبارت «LG» بیانگر گروه ترککننده هالوژن است.
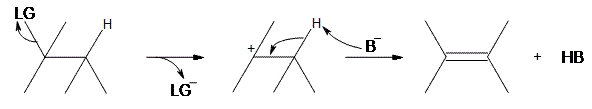
همانطور که در بالا مشاهده میکنید، مرحله اول شامل ترک LG است و از آنجایی که الکترون را به همراه پیوند خود از مولکول خارج میکند، کربن متصل به آن، یک الکترون از دست میدهد و به کربوکاتیون تبدیل میشود. زمانیکه که این تبدیل انجام شود، یک باز ، در محل بتا، یک پروتون از ماده واسط میگیرد و الکترون خود را به پیوند کربن-کربن مجاور میدهد.
برخلاف واکنش که نیاز داریم پروتون به صورت «anti» نسبت به گروه ترککننده قرار داشته باشد، در واکنش ، تنها به یک هیدروژن در همسایگی نیاز داریم زیرا گروه ترک کننده، پیش از آن، مولکول را ترک کرده است. فرآورده نهایی، یک آلکن به همراه فرآورده فرعی HB خواهد بود.
واکنش پذیری در E1
با توجه به اینکه واکنشهای سبب تشکیل کربوکاتیون واسط میشوند، قوانین موجود در واکنشهای در اینجا نیز صدق میکنند.
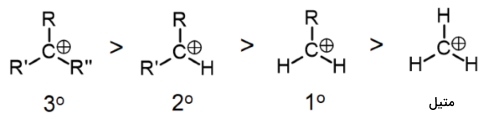
همانطور که انتظار میرفت، کربوکاتیون نوع سوم نسبت به سایر کربوکاتیونها و گروه متیل، واکنشپذیری بیشتری دارد. به طور کلی، تنها زمانی کربوکاتیونهای نوع اول و متیل در این نوع واکنش شرکت میکنند که راهی برای آرایش مجدد کربوکاتیون بمنظور حرکت دادن بار مثبت به کربن مجاور وجود داشته باشد. کربنهای نوع دوم و سوم، کربوکاتیونهای پایدارتری را تولید خواهند کرد و به همین دلیل، این تبدیل، سریعتر انجام میگیرد.
کربوکاتیونهای نوع دوم میتوانند در مسیر واکنش حذفی حضور پیدا کنند که این امر به طور معمول به حضور یک باز قوی نیاز دارد. اضافه کردن یک باز ضعیف، برای واکنش مناسب نیست و واکنش را به سمت سوق میدهد. لازم به ذکر است، محیط واکنش نیز بر مسیر آن تاثیرگذار است. حلالهای قطبی پروتونی بمنظور ایجاد ممانعت برای نوکلئوفیلها بکار گرفته میشوند و در نتیجه آن، شرایط نامساعدی را برای انجام واکنشهای یا فراهم میکنند.
آبگیری از الکل های نوع دوم و سوم
در ادامه نگاهی به مکانیسم «حلالکافت» (Solovolysis) در طول واکنش سیکلوهگزانول در محیط اسیدی (سولفوریک اسید) خواهیم داشت.
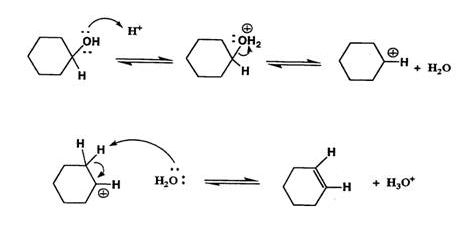
- مرحله اول: گروه OH روی سیکلوهگزانول به کمک آبدهی میشود که با نشان داده شده است. با این کار، OH به تبدیل میشود که گروه ترککننده بهتری خواهد بود.
- مرحله دوم: با پروتوناسیون (پروتوندهی) OH، در مرحله «ناهمکافت» (Heterolysis)، با ترک مولکول ، الکترونها نیز از مولکول جدا میشوند و کربوکاتیون واسط ایجاد خواهد شد.
- مرحله سوم: یک مولکول دیگر آب برای پروتونگیری کربن بتا وارد میشود که در ادامه، الکترون خود را به پیوند کربن-کربن مجاور میدهد. کربنها به طور مجدد از به هیبرید میشوند و در نتیجه، پیوند پای بین آنها ایجاد خواهد شد.
مکانیسم آلکیل هالیدها در واکنش E1
این مکانیسم از جمله کاربردهای رایج واکنش در سنتز آلکنها به شمار میآید.
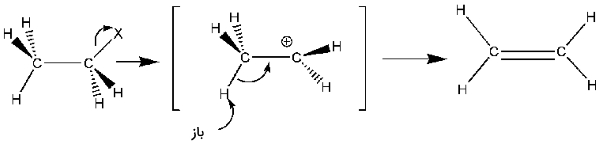
بار دیگر، دو مرحله اصلی را در مکانیسم مشاهده میکنیم.
- گروه ترککننده، مولکول را به همراه الکترونهای خود ترک میکند و یک کربوکاتیون واسط تشکیل میدهد.
- یک باز، کربن بتا را دپروتونه میکند تا پیوند پای تشکیل شود.
شیمی فضایی و مکان گزینی در واکنش حذفی E2
در برخی موارد، به جای یک فرآورده، مخلوطی از فرآوردهها تولید میشوند. این مورد زمانی انجام میگیرد که کربوکاتیون، ۲ یا بیشتر کربن برای پروتوندهی داشته باشد. در بیشتر موارد، یک فرآورده، یعنی پایدارترین آلکین، فرآورده اصلی خواهد بود. در این خصوص، قانون زایتسف بیان میکند زمانیکه بیش از یک فرآورده تشکیل شود، آلکنی که گروههای آلکیل متصل به اتم کربن بیشتری در پیوند دوگانه داشته باشد، فرآورده عمده خواهد بود.
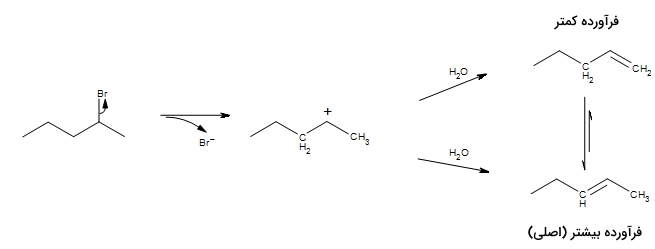
در این مثال، دو مسیر محتمل را برای واکنش مشاهده میکنید. در یکی از این مسیرها، متیل سمت راست، و در مسیر دیگر، گروه سمت چپ پروتونگیری میشود. هر دو حالت امکانپذیر است اما فرآورده عمده، فرآورده بالایی یعنی پنت-۲-اِن خواهد بود.
بر اساس قانون زایتسف، پروتونگیری در کربن با «بیشترین استخلاف» (Most Substituted) انجام میگیرد تا آلکن پایدارتری به تولید برسد. در عمل، فرآورده پنت-۲-اِن به صورت مخلوطی از ایزومرهای سیس و ترانس به تولید میرسد که به دلیل پایداری بیشتر ایزومر ترانس، فرآورده معمولتری نیز خواهد بود.
نکات مهم مربوط به واکنش حذفی E1
نکات مهم و ویژگیهای اصلی واکنش حذفی عبارتند از:
- به طور معمول از یک باز ضعیف (ROH) به همراه یک آلکیل هالید استفاده میشود یا اینکه از یک الکل در حضور یا بهره میگیریم.
- تنها آلکیلهالیدهای نوع دوم یا سوم، واکنشدهندههای موثری هستند و بکارگیری نوع سوم، از بقیه سادهتر است. برای کاهش رقابت با واکنش باید از حرارت پایین استفاده کنیم.
- این واکنش، فضاگزین نیست و بنابراین، مخلوطی از ایزومرهای سیس و ترانس خواهیم داشت.
- قانون زایتسف در این واکنش صدق میکند.












