عنصر مس و کاربردهای آن – از صفر تا صد
مس، عنصری با نماد و عدد اتمی ۲۹ در جدول تناوبی عناصر است. از خواص این فلز میتوان به چکشخواری و رسانایی بالای حرارتی و الکتریکی اشاره کرد. یک سطح خالص این فلز، رنگی صورتی نارنجی دارد. از مس به عنوان هادی گرما و الکتریسیته یاد میشود و علاوه بر این، برای تولید آلیاژهای فلزی همچون نقره استرلینگ، «کوپرونیکل» (Cupronickel) در ضرب سکه و «کنستانتن» (Constantan) در ساخت «کرنشسنج» (Strain Gauges) از این عنصر بهره میگیرند.


لازم به ذکر است که این فلز با عناصری همچون روی، قلع، نیکل و آلومینیوم، به سادگی تشکیل آلیاژ میدهد. البته این فلزات بمنظور افزایش استحکام و مقاومت در برابر خوردگی به آلیاژ اضافه میشوند که بر رنگ نهایی محصول نیز تاثیرگذارند. استفاده از این فلز، بیشتر در سیمهای برق کاربرد دارد.
تولید سالانه مس
بیشترین تولید سالانه این فلز در اختیار کشور شیلی با 5/7 میلیون تن است. جدول زیر، تولید سالانه مس در کل دنیا و کشورهای دیگر را نشان میدهد.
| کل دنیا | 18/9 میلیون تن |
| شیلی | ۵/۷ میلیون تن |
| چین | ۱/8 میلیون تن |
| پرو | 1/6 میلیون تن |
| آمریکا | 1/8 میلیون تن |
| کنگو | 1 میلیون تن |
تولید مس
در حدود ۸۰ درصد مس دنیا به شکل سنگمعدنهایی است که این فلز در آنها به شکل سولفید معدنی وجود دارد. از آنجمله میتوان به «کالکوپیریت» (Chalcopyrite) با فرمول اشاره کرد که فروانترین سنگمعدن این فلز به شمار میآید. «بورنیت» (Bornite) با فرمول و «کالکوزیت» (Chalcocite) با فرمول از دیگر سنگ معدنهای این فلز هستند.
خوب است بدانید که این سنگ معدنها تنها 0/5 تا 2 درصد مس را در خود جای دادهاند. باقیمانده تولید اولیه این فلز، از سنگهای معدنی بدست میآید و این عنصر در آنها به صورت سیلیکات، سولفات، کربنات و اکسید وجود دارد که از طریق هوازدگی و اکسیداسیون سولفیدهای معدنی شکل گرفته است. در حدود ۳۰ درصد کل مس تولیدی، از بازیافت ثانویه و ضایعات آن بدست میآید. بیشتر معدنهای مس در شیلی، غرب آمریکا، کانادا، زامبیا، کنگو و روسیه واقع شده است. تولید این فلز از سه مرحله اصلی سرچشمه میگیرد: تغلیظ سنگ معدن، تبدیل سولفیدهای این فلز و دیگر ترکیبات به مس و خالصسازی مس.

پیشنهاد میکنیم برای درک بهتر ویژگیهای عنصر مس و کاربردهای آن، فیلم آموزش فرادرس که در ادامه آورده شده است را مشاهده کنید.
تغلیظ سنگ معدن
غنیسازی سنگ معدن به کمک روش «فلوتاسیون» (Flotation) انجام میشود. سنگ پودر شده با حلال آلی همچون نفت مخلوط میشود و سپس در تانکرهایی بزرگ با آب و دترجنتها مخلوط میشود.
هوای فشرده را به داخل مخلوط وارد میکنند و اجزای سبک سولفید این فلز، بالا میآیند و بر روی کف ایجاد شده شناور خواهند شد. رسهای سنگینتر و دیگر سیلیکاتها که در پایین تانکر تهنشین میشوند، موسوم به «گانگ» (Gangue) هستند. در نهایت، کف غنی از مس، از تانکر خارج خواهد شد.
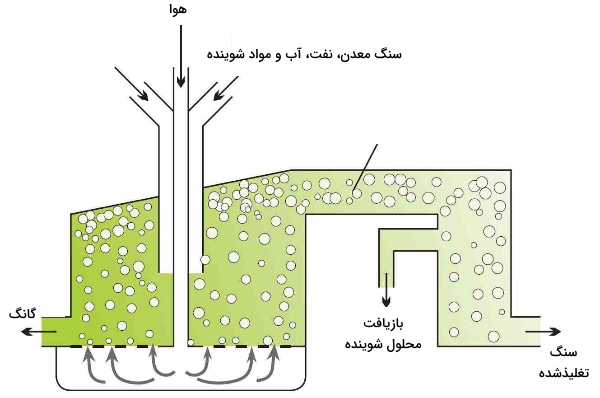
تبدیل سولفیدهای مس و دیگر ترکیبات
این تبدیل از طریق روشهای مختلفی به شرح زیر انجام میشود:
- سوزاندن (برشته کردن) سنگ معدن سولفید مس
- فرآيند شستشو (لیچینگ)
- روش باکتریایی
سوزاندن (برشته کردن) سنگ معدن سولفید مس
سنگ معدن غنی شده را با مقدار کافی هوا میسوزانند تا سولفید آهن را به آهن (II) اکسید تبدیل کنند.
مخلوط جامد را با کلسیم کربنات و ماسه (سیلیکا) مخلوط میکنند و تا دمای ۱۰۲۶ درجه سانتیگراد حرارت میدهند. آهن، سرباره سیلیکات را تشکیل میدهد و مس (I) سولفید ذوب میشود و در پایین کوره قرار میگیرد. به این ماده مذاب، «مات مس» (Copper Matte) میگویند.
در روشی جدیدتر که به «ایساسملت» (ISASMELT) موسوم است، سنگ تغلیظ شده، آهک و سیلیکا، به همراه یک سوخت جامد همچون زغالسنگ، ترکیب و گلولههایی را تشکیل میدهند. این گلولهها به داخل کوره فرستاده میشوند و در آنجا لولهای، گاز طبیعی (متان) به همراه نفت و هوای غنی از اکسیژن را به داخل کوره پمپ میکند. از لحاظ اقتصادی بهتر است که از اکسیژن خالص یا هوای غنی از اکسیژن به جای هوا استفاده شود چراکه با این کار، سرعت واکنشها افزایش مییابد و به تبع آن، کارخانههای کوچکتر با هزینه سوخت کمتر مورد استفاده قرار میگیرند. علاوه بر این، با استفاده از اکسیژن خالص، کنترل آلودگیها همچون دیاکسید گوگرد سادهتر خواهد شد.
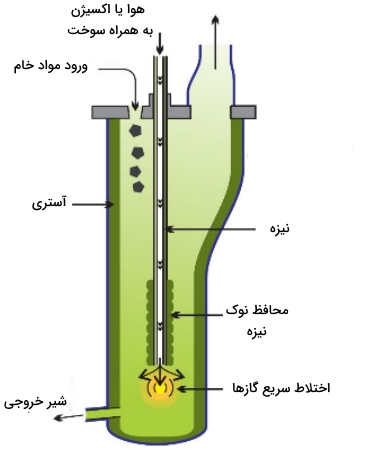
مخلوط حاصل، با سرعت زیادی به طرف پایین پمپ و سبب ایجاد جریان آشفته و سرعت بالای واکنش میشود. این فرآیند بازده بالایی دارد و مقادیر زیادی از مواد خام را میتوان از این طریق و با کورههایی نسبتا کوچک، فرآوری کرد. مات مس و سرباره به کوره دیگری برای تهنشینی و جداسازی منتقل میشوند. سپس، مات مس به کورهای دیگر وارد میشود و هوا یا هوای غنی از اکسیژن به داخل آن دمیده میشود تا این فلز تولید شود:
به طور معمول، دیاکسید گوگرد را در محل به سولفوریک اسید تبدیل میکنند. به مس تولیدی ناخالص، «مس جوشدار» (Blister Copper) میگویند. این ماده را حرارت میدهند تا ذوب شود و با تزریق هوای اضافی، گوگرد حذف خواهد شد. این امر با تزریق متان برای حذف اکسیژن همراه است. اگر همچنان مس ناخالص وجود داشته باشد، آن را به کمک «پالایش الکتریکی» (Electro-Refining)، خالصسازی میکنند.
فرآیند شستشو (لیچینگ)
به کمک شستشوی سنگمعدن با محلول مس (II) کلرید و آهن (III) کلرید، مس (I) کلرید بدست میآید:
برای اینکه مس (I) کلرید را در محلول حفظ کنند، سدیم کلرید به ترکیب اضافه میشود. در حضور یون اضافی کلرید، کمپلکس تشکیل خواهد شد که در آب، محلول است.
در نهایت، مس ناخالص را به کمک الکترولیز محلول بدست میآورند و مس (II) کلرید را نیز مجددا بازیافت میکنند:
روش باکتریایی
مقادیر قابل توجهی از این فلز تولیدی در ایالات متحده به کمک استفاده از باکتری بدست میآید. آبهای اسیدی به ضایعات معدنی مس اسپری میشوند. این ضایعات، حاوی مقادیر کمی از مس هستند. با گذر آب از سنگهای خرد شده، باکتریهایی موجب شکست سولفیدهای آهن به یونهای آهن (II) و آهن (III) میشوند. پس از آن، یون آهن (III)، یون سولفید مس را به سولفات اکسید میکند و یون مس (II) به صورت محلول باقی میماند. آب غنی از مس بازیافت میشود و مس فلزی به کمک فرآیند کاهشی بدست میآید:
خالصسازی
از هر روشی که برای استخراج این فلز استفاده شود، فرآیند نهایی خالصسازی به کمک الکترولیز صورت میگیرد. صفحات مس ناخالص به همراه ورقههایی از این فلز خالص، فولاد ضدزنگ یا تیتانیوم، در محلول مس (II) سولفات و سولفوریک اسید قوطهور میشوند. مس خالص یا ورقههای فولاد، کاتدِ سلول الکترولیز و صفحات ناخالص، آند سلول را تشکیل میدهند. این بدان معنی است که یونهای این فلز در آند تشکیل میشوند و به محلول راه پیدا میکنند. واکنشهای کاتد و آند در زیر آورده شدهاند:
آند:
کاتد:
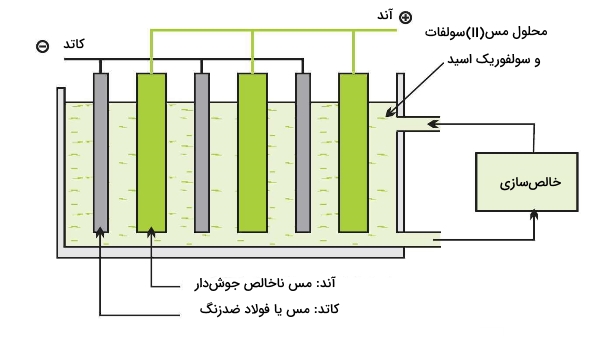
یونهایی که به طرف کاتد مهاجرت کردهاند، به مس خالص کاهش مییابند و در کاتد رسوب میکنند. با گذشت زمان، فلز خالص را از کاتد خارج میکنند. بسیاری از ناخالصیها در آند، همچون طلا، نقره، پلاتینیوم و قلع، در محلول الکترولیت، انحلالپذیر نیستند و در نتیجه بر روی کاتد رسوب نخواهند کرد و در پایین مخزن تهنشین میشوند. این مواد را از مخزن جدا و به واحدهای فرآوری ارسال میکنند. فلزات دیگر همچون آهن و نیکل، محلول هستند و در نتیجه باید به طور پیوسته، محلول الکترولیت، خالصسازی و از رسوب فلزات ناخواسته بر روی کاتد جلوگیری شود. با این روش، خلوصی برابر با 99/99 درصد خواهیم داشت. در نهایت، فلز خالص را به صورت شمشهایی برای استفاده کارخانجات تبدیل میکنند.
تولید ثانویه
این فلز و آلیاژهای آنرا که حاوی مقادیر زیادی از مس باشند، برای دستیابی به خلوص بیشتر، بازیافت میکنند. فلزات را به کمک حرارت دادن با هوای غنی از اکسیژن، ذوب میکنند. با این کار، بیشتر فلزات به جز مس و فلزات گرانبها اکسید میشوند و تشکیل سرباره میدهند که میتوان این سرباره را خارج کرد. روش ایساسملت که در بالا توضیح داده شد، معمولا برای تولید ثانویه این فلز بکار گرفته میشود. در نهایت، مس بدست آمده که خلوصی در حدود ۹۹ درصد دارد، به آند فرستاده میشود تا به کمک روش الکترولیتی ایساسملت، خالصسازی شود.
در حدود ۳۳ درصد مس تولیدی در دنیا از بازیافت این فلز بدست میآید. ۳۱ درصد از این مقدار توسط آمریکا و ۴۷ درصد آن از غرب اروپا تامین میشود. نیمی از این مقدار از ضایعات کارخانهها و نیمی دیگر از ضایعات کهنه همچون لولهها و سیمهای مسی بدست میآید.

آلیاژ مس چیست؟
در جدول زیر، آلیاژهای مهم این فلز آورده شدهاند:
| نام آلیاژ | عناصر ترکیب شده | موارد استفاده |
| برنج | روی | پیچ، سیم، لولهها، اتصالات الکتریکی، سازهای موسیقی و لوازم تزئینی |
| برنز | قلع | مجسمهها، اتصالات الکتریکی، فنر و سنجاق |
| فسفر برنز | قلع و فسفر | یاتاقان، فنر، سازهای کوبهای، سیمِ سازها |
| آلومینویم برنز | قلع، آلومینیوم، آهن، نیکل و برنز | ابزارها، قطعات موتور خودروها و هواپیماها |
| کوپرونیکل | نیکل، آهن، منگنز | سکه و ظروف |
| ورشو (نقره نیکلی) | روی و نیکل | کلید، سکه، سازهای بادی-برنجی |
خوب است بدانید که در ساخت سکههای یورو، از چهار نوع آلیاژ مختلف استفاده شده است. سکههای ۱-۵ سنتی، فولاد به همراه روکشی از این فلز هستند. سکههای ۱۰ تا ۵۰ سنتی، از ۸۹ درصد مس به همراه آلومینیوم، روی و قلع ساخته شدهاند و به همین ترتیب سکههای دیگر، آلیاژهای متفاوتی نیز دارند.
تحقیقات نشان دادهاند که باکتریها مدت زمان زیادی روی سطح این فلز دوام ندارند. همین امر، یکی از دلایل اصلی ساخت سازهای بادی-برنجی با آلیاژهای این فلز است زیرا با وجود اینکه این چنین سازهایی همواره با رطوبت دهان در تماس هستند اما جنس مواد تشکیلدهنده آنها نمیتوانند محل مناسبی برای رشد باکتریها و قارچها فراهم کنند.

چگالی مس
چگالی مس در دمای اتاق برابر با است که به کمک آلیاژهای مختلف، چگالی آن را تغییر میدهند.
ترکیبات
این فلز، ترکیبات متعددی را با اعداد اکسایش و تشکیل میدهد. این اعداد اکسایش به ترتیب موسوم به کوپرو و کوپریک هستند. ترکیبات مس، چه به صورت کمپلکس و چه به صورت «آلیفلزی» (Organometallic)، بسیاری از واکنشهای شیمیایی و بیولوژیکی را کاتالیز میکنند.
ترکیبات دوتایی
سادهترین ترکیبات این فلز، ترکیبات «دوتایی» (Binary) هستند. در ترکیبات دوتایی، تنها دو عنصر وجود دارد. از جمله این ترکیبات میتوان به اکسیدها، سولفیدها و هالیدها اشاره کرد. ترکیبات مختلفی از اکسیدهای کوپرو و کوپریک شناخته شدهاند. از میان سولفیدهای شناخته شده مس میتوان به مس (I) و مس (II) سولفید اشاره کرد. همچنین هالیدهای کوپرو با اتمهای کلر، برم و ید و هالیدهای کوپریک با اتمهای فلوئور، کلر و برم نیز از جمله ترکیبات شناخته شده مس به شمار میآیند.
کمپلکسها
این فلز، کمپلکسهای کوردینانسی با لیگاندها تشکیل میدهد. در محلولهای آبی، مس (II) به صورت حضور دارد. این کمپلکس، بیشترین سرعت تبادل آب را برای هر نوع کمپلکس آبی فلز واسطه دارد. در حقیقت، با این سرعت است که لیگاندهای آب متصل و منفصل می شوند. اضافه کردن سدیم هیدروکسید محلول در آب، رسوب جامد آبیرنگ مس (II) هیدروکسید را طبق واکنش زیر به همراه دارد:
بسیاری از اکسیآنیونها نیز کمپلکسهایی را تشکیل میدهند. این کمپلکسها عبارتند از :
- مس (II) استات با فرمول که در آن، نشاندهنده استات است.
- مس (II) نیترات
- مس (II) کربنات
در این میان، مس (II) سولفات، یک بلور آبی رنگ پنتاهیدرات (Pentahydrate) تشکیل میدهد. این ترکیب، از ترکیبات شناخته شده این فلز در آزمایشگاه است.
«پلیاولها» (Polyols) ترکیباتی هستند که بیش از یک گروه عاملی الکل دارند. این ترکیبات با نمکهای کوپریک، واکنش میدهند. به طور مثال، نمکهای این فلز به منظور آزمایش «قندهای کاهنده» (Reducing Sugars) مورد استفاده قرار میگیرند. آمینواسیدها «کمپلکسهای چنگاله» (Chelate Complex) با مس (II) تشکیل میدهند.

ترکیبات آلیفلزی
ترکیباتی که شامل پیوند مس-کربن هستند، به عنوان ترکیبات اورگانو مس (مس-آلی) شناخته میشوند. این ترکیبات، با اکسیژن به شدت واکنش و مس (I) اکسید را تشکیل میدهند که کاربردهای زیادی در شیمی دارد. همچنین، مس (I)، در حضور لیگاندهای آمین، کمپلکسهای ضعیفی با آلکنها و مونو اکسید کربن میسازد.
ترکیبات مس (III) و مس (IV)
مس (III) را بیشتر در اکسیدها میتوان مشاهده کرد. از نمونههای این ترکیب میتوان به جامد آبی-مشکی پتاسیم کوپرات با فرمول اشاره کرد. بیشترین ترکیبات مورد بررسی از مس (III) را باید در ابررساناهای کوپرات جستجو کرد. «ایتریم باریم مس اکسید» (Yttrium Barium Copper Oxide) با فرمول شامل مس (II) و مس (III) است. فلوراید نیز همچون اکسیدها، یک باز به شدت آنیونی به شمار میآید و به عنوان پایدارکننده یونهای فلزی با عدد اکسایش بالا شناخته میشود. فلورایدهای مس (III) و مس (IV) نیز با فرمولهای و به عنوان ترکیبات این فلز ذکر شدهاند.
کاربرد مس
جدول زیر بیشترین استفاده از این فلز را در مصارف مختلف نشان میدهد.
| کابرد | درصد |
| سیم برق | ۶۰ |
| لولهکشی و سقف | ۲۰ |
| ماشینکاری صنعتی | 15 |
این فلز را بیشتر به صورت خالص استفاده میکنند اما زمانی که سختی بیشتری نیاز باشد، از آلیاژهایی همچون برنج و برنز استفاده میکنند. در حدود دو قرن، از رنگهای حاوی این فلز برای بدنه قایقها استفاده میشد تا رشد گیاهان و جانوران دریایی روی بدنه این قایقها کنترل شود. مقدار کمی از این فلز را در کشاورزی برای آفتکشی و تامین مواد مغذی خاک بکار میگیرند. با وجود اینکه با این فلز میتوان ماشینکاری انجام داد اما از آلیاژهای آن به دلیل خاصیت بهتر در این خصوص استفاده میکنند.
سیم و کابل
با وجود رقابت بین مواد مختلف، همچنان استفاده از این فلز به عنوان هادی الکتریکی بهره میگیرند. البته این مورد در خصوص خطوط انتقال هوایی صدق نمیکند چراکه از آلومینیوم استفاده میشود. از سیمهای مسی در ژنراتورهای برق، خطوط توزیع و انتقال و بسیاری از مدارهای الکترونیکی بهره میگیرند. همانطور که در بالا به آن اشاره شد، بیش از نیمی از مس استخراج شده برای تولید سیم و کابلهای برق به مصرف میرسد.
ویژگیهای مس
از ویژگیهایی که سبب شده تا از این فلز در دستگاههای الکتریکی استفاده شود میتوان به رسانایی الکتریکی بالا، «مقاومت کششی» (Tensile Extrength)، چکشخواری، شکلپذیری، مقاومت در برابر خوردگی، هدایت بالای گرمایی، انبساط حرارتی کم و لحیمکاری اشاره کرد. در اواخر دهه ۱۹۶۰ تا اوایل دهه ۱۹۷۰، سیمکشی آلومینیومی، جای خود را در آمریکا به سیمکشی مسی داد اما به دلیل ایجاد آتشسوزی بسیار، استفاده از آلومینیوم در سیمکشی ساختمانها منسوخ شد.
الکترونیک
از این فلز به دلیل رسانایی بالا، در مدارهای مجتمع و بردهای مدار چاپی استفاده میشود. همچنین، در «هیتسینکها» (Heat Sinks) و مبدلهای حرارتی به دلیل قدرت انتقال حرارت بالا کاربرد دارد. آهنرباهای الکتریکی، لامپهای خلاء، لامپهای اشعه کاتدی، «مگنترونها» (Magnetron) در مایکروویو همگی از این فلز استفاده میکنند.
معماری
در معماری دوران باستان، از این فلز به عنوان مادهای بادوام، مقاوم در برابر خوردگی و ضد آب استفاده میشد. در بسیاری از سازههای قدیمی میتوان ردی از این فلز پیدا کرد. رنگ سبز حاصل از پتینهکاری از مدتها پیش نزد معماران جایگاه ویژه داشته است. در حقیقت، لایه نهایی در پتینهکاری، لایهای به شدت مقاوم در برابر خوردگی شناخته میشود که از لایههای زیرین خود به خوبی حفاظت میکند.

خاصیت ضد رسوب و ضد میکروب
این فلز، مادهای بیواستاتیک است به این معنی که بسیاری از باکتریها نمیتوانند روی آن رشد کنند. به همین دلیل از مدتها پیش برای حفاظت از کشتیها و جلوگیری از رشد باکتریها از مس استفاده میکردند.
برخی آلیاژهای این فلز، خواصی دارند که طیف گستردهای از میکروارگانیسمها را از بین میبرند. به طور مثال، آلیاژ مس 355، توانایی از یبن بردن 99/9 درصد از میکروبها را در کمتر از دو ساعت دارد.
کاربرد مس در پزشکی
از این فلز در درمان کمخونی استفاده میشود. این اتفاق زمانی رخ میدهد که افراد در رژیمهای غذایی خود، مقادیر زیادی از روی جای دهند. همچنین در دردهای مفصلی و ترمیم زخمها نیز از این فلز بهره میگیرند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی معدن و مواد
- آموزش ریخته گری و انجماد مواد فلزی
- استخراج طلا با سیانوراسیون — از صفر تا صد
- قانون هس — به زبان ساده
^^













ممنون از مطلب مفیدتون استفاده کردیم