قاعده اکتت یا هشت تایی در شیمی | به زبان ساده
قاعده اکتت (اوکتت) بیان میکند که اتمها زمانی در پایدارترین حالت خود هستند که لایه ظرفیت آنها با ۸ الکترون پر شده باشد. اساس قاعده اوکتت بر مبنای تمایل عناصر برای تشکیل پیوندهای شیمیایی و تکمیل لایه ظرفیت با ۸ الکترون است. البته به خاطر داشته باشید که قاعده اکتت را تنها میتوان در خصوص عناصر گروههای اصلی جدول تناوبی بکار برد.

مولکولهای هالوژنها، اکسیژن، نیتروژن و کربن همگی از قاعده اکتت پیروی میکنند. به طور کلی، عناصری که از این قانون تبعیت میکنند شامل عناصر دستههای s و p به همراه عناصر هیدروژن، هلیوم و لیتیوم هستند.
الکترونهای لایه ظرفیت را میتوان به کمک رسم ساختار لوویس شمارش کرد و الکترونهایی که بین دو اتم توسط پیوند کووالانسی به اشتراک گذاشته شدهاند را به طور جداگانه برای هر اتم شمارش میکنیم. قاعده اوکتت را میتوان با پیوند بین کربن و اکسیژن در مولکول دیاکسید کربن نشان داد. ساختار لوویس این مولکول را در تصویر زیر مشاهده میکنید. الکترونهای اشتراکی در تصویر زیر، لایه ظرفیت هر دو اتم اکسیژن و کربن را تکمیل می کنند.

مقدمه
در سال 1904، دانشمندی به نام «ریچارد آبگ» (Richard Abegg) قانونی را موسوم به «قانون آبگ» (Abegg's Rule) ارائه داد که بیان میکرد اختلاف بین بیشترین مقدار مثبت و منفی ظرفیت یک عنصر، برابر با عدد ۸ است. این قانون در سال 1916 توسط «گیلبرت لوویس» (Gilbert Lewis) مورد استفاده قرار گرفت تا بتواند قاعده اوکتت را در نظریه «اتم مکعبی» (Cubical Atom) خود ارائه دهد.
اتمها به گونهای در واکنش شرکت میکنند که در نهایت، به پایدارترین حالت خود برسند. زمانی که قاعده اکتت را به طور کامل در یک اتم داشته باشیم، اتم در پایدارترین حالت خود قرار دارند چراکه اوربیتالهای آن به طور کامل، پر شده هستند. اتمهایی با پایداری بیشتر، انرژی کمتری دارند و بنابراین، واکنشی که افزایش پایداری یک اتم را به همراه داشته باشد، آزاد شدن انرژی به شکل حرارت یا نور را در آن شاهد هستیم. در رابطه با قاعده اکتت میتوان موارد زیر را بیان کرد:
به طور معمول، دو الکترون با یکدیگر جفت میشوند و پیوندی را تشکیل میدهند که از نمونههای آن میتوان به مولکول اشاره کرد.
در بیشتر اتمها، تعداد ۸ الکترون در لایه ظرفیت وجود خواهد داشت که از آنجمله میتوان به آلکانی همچون متان با فرمول شیمیایی اشاره کرد. در تصویر زیر، نوع پیوندها در و را مشاهده میکنید.
تنها گازهای نجیب هستند که با هشت الکترون در لایه ظرفیت و پیروی از قاعده اکتت، بار خنثی دارند. سایر عناصر، زمانی که به صورت منفرد باشند و بخواهند قاعده اکتت را تکمیل کنند، باری غیر صفر خواهند داشت. نتیجه این دو مورد در خصوص قاعده اکتت، واکنشپذیری و نوع پیوندها را بین اتمها توضیح میدهد. در حقیقت، اتمها به دنبال این هستند که الکترونها را به گونهای به اشتراک بگذارند که علاوه بر رسیدن به پایداری، لایه ظرفیت خود را نیز با ۸ الکترون تکمیل کنند. در خصوص گازهای نجیب باید به این نکته اشاره کنیم که این گازها به طور معمول، ترکیبی تشکیل نمیدهند.

مثالهایی از قاعده اوکتت
در ادامه قصد داریم برای درک بهتر این قانون، مثالهای مختلفی را مطرح کنیم تا به کمک آن، درک بهتری از این قانون داشته باشیم.
مثال نمک NaCl
فرمول شیمیایی نمک خوراکی به صورت و نتیجه تشکیل پیوند یونی بین یونهای سدیم و کلر است. اگر فلز سدیم و گاز کلر را در شرایط مناسبی با یکدیگر ترکیب کنیم، تشکیل نمک خواهیم داشت. در این واکنش شیمیایی، سدیم یک الکترون از دست میدهد و اتم کلر، این الکترون را دریافت میکند. در چنین فرآیندی، مقادیر بسیار زیادی از نور و گرما آزاد خواهد شد. نمک حاصل، برخلاف عناصر سازنده خود، در واکنشهای انفجاری شرکت نمیکند. دلیل شرکت نکردن نمک در واکنشها به صورت انفجاری (آزاد شدن نور و گرمای زیاد) چیست؟
برای پاسخ به این سوال باید به قاعده اکتت رجوع کنیم. اتمها تمایل دارند تا به آرایش گاز نجیب قبل یا بعد از خود برسند تا در لایه ظرفیت خود، ۸ الکترون داشته باشند. اتم سدیم، ۱ الکترون ظرفیت دارد و بنابراین، با از دست دادن آن، آرایش الکترونی مشابه با نئون خواهد داشت. اتم کلر در لایه ظرفیت خود ۷ الکترون دارد و بنابراین، با دریافت یک الکترون، قاعده اکتت خود را تکمیل میکند.
البته توجه داشته باشید اگر اتم کلر، ۷ الکترون از دست میداد و اتم سدیم نیز تمام این الکترونها را جذب میکرد، به طور مجدد، هردو به آرایش گاز نجیب میرسیدند. البته در این شرایط، بار یونهای حاصل، بسیار بیشتر بود به گونهای که برای یونهای سدیم و کلر به ترتیب و داشتیم و این یونها بسیار ناپایدارتر از یونهای و هستند. خوب است بدانید که اتمهای خنثی یا اتمهایی با حداقل بار، بیشترین پایداری را دارند.

مثال منیزیم اکسید MgO
پیوند بین منیزم و اکسیژن در ترکیب منیزیم اکسید (Mg O)، پیوندی یونی ذکر میشود. اتم منیزیم به سادگی با از دست دادن ۲ الکترون به آرایش پایدار گاز نجیب نئون میرسد. به طور مشابه نیز اکسیژن برای تشکیل یون دو الکترون جذب میشود.
جاذبه الکترواستاتیک بین این دو یون، پیوندی یونی را نتیجه میدهد و در نهایت، هر دو اتم در مولکول MgO، آرایش الکترونی پایدار خواهند داشت.
موارد استثنا در قاعده اکتت
همانطور که در ابتدای متن به آن اشاره شد، قاعده اکتت در تمامی عناصر صدق نمیکند. این قانون در بیشتر موارد برای اتمها با عدد اتمی کمتر از ۲۰ کاربرد دارد اما موارد استثنا هم برای قاعده اکتت وجود خواهد داشت که از آنجمله میتوان به ترکیبات بور و آلومینیوم اشاره کرد. در ادامه قصد داریم تا به بررسی این موارد بپردازیم.
هیدروژن و لیتیوم
بسیاری از اتمها با عدد اتمی کمتر از ۲۰، ترکیباتی را تشکیل میدهند که از قاعده اکتت پیروی نمیکنند. به طور مثال، گاز نجیب هلیوم، در لایه خارجی خود، دو الکترون دارد. از آنجایی که هیچ زیرلایه نداریم، بعد از اوربیتال ، اوربیتال خواهیم داشت و در سطحِ ۱ انرژی، در نهایت، تنها ۲ الکترون خواهیم داشت.
هیدروژن نیز برای رسیدن به این نوع از آرایش الکترونی پایدار، تنها به یک الکترون نیاز دارد و برای این کار یا الکترونی را از طریق پیوند کووالانسی به اشتراک میگذارد یا به یون هیدرید تبدیل میشود. این درحالیست که لیتیوم با از دست دادن یک الکترون و تشکیل پیوند یونی با سایر عناصر به چنین آرایشی دست پیدا میکند. در هر یک از این ۲ مورد، عناصر هیدروژن و هلیوم در لایه ظرفیت خود ۲ الکترون با آرایش مشابه اتم هلیوم دارند.
بور و آلومینیوم
مولکولهایی نیز وجود دارند که برای تکمیل قاعده اکتت، الکترون کافی برای هر اتم ندارند. بور و آلومینیوم در گروه ۱۳، رفتار پیوندی متفاوتی را نشان میدهند. هر کدام از این اتمها در لایه ظرفیت خود ۳ الکترون دارند و درنتیجه میتوان پیشبینی کرد که این اتمها برای دریافت ۵ الکترون (به صورت الکترون اشتراکی)، پیوندهایی کووالانسی تشکیل دهند. با این وجود، ترکیبی وجود ندارد که در آن، اتم بور یا آلومینیوم، ۵ پیوند با عناصر دیگر تشکیل دهند. بنابراین نتیجه میگیریم که قانون اکتت ممکن است برای عناصر گروه ۱۳ مناسب نباشد.
مولکول بور تریفلوئورید را با فرمول شیمیایی در نظر بگیرید. این نوع پیوند را به راحتی میتوان با رسم ساختار لوویس نمایش داد. در این نوع از نمایش، هر الکترون ظرفیت را در بور به صورت کووالانسی با اتم فلوئور به اشتراک میگذاریم. در این ترکیب، اتم بور، ۶ الکترون ظرفیت پیدا میکند و قاعده اکتت در اتم فلوئور صدق میکند.

با مثالی که در بالا مطرح شد، ممکن است به این نتیجه برسیم که اتم برم، به جای قاعده اکتت، از قاعده ششتایی پیروی میکند. با این وجود، اتم بور با هیدروژن، یون پایدار را تشکیل میدهد که در آن، اتم بور، قاعده اکتت را تکمیل میکند. علاوه بر این، در واکنش با آمونیاک ، ترکیب پایدار را تشکیل میدهد. ساختار لوویس این مولکول بیان میکند که بور در این ترکیب، از قاعده اکتت پیروی میکند.

ترکیبات شامل آلومینیوم نیز روندی مشابه را دنبال میکنند. آلومینیوم تریکلرید ، آلومینیوم هیدرید و آلومینیوم هیدروکسید ، سه ظرفیت را برای آلومینیوم با ۶ الکترون ظرفیت در مولکول نشان میدهند. با این جود، پایداری یون آلومینیوم هیدرید بیان میکند که آلومینیوم از قاعده اکتت نیز پیروی میکند.
رادیکالهای آزاد
برخی از عناصر، به خصوص نیتروژن، ترکیباتی را تشکیل میدهند که قاعده اکتت در آنها صدق نمیکند. یکی از این ترکیبات، آنهایی هستند که تعداد الکترون با عدد فرد دارند. در قاعده اکتت نیاز داریم تا در اطراف هر اتم، ۸ الکترون وجود داشته باشد و مولکولی که تعداد فرد از الکترون داشته باشد، نمیتواند در این قانون صدق کند.
مولکولهایی که الکترون جفتنشده دارند، با نام رادیکال آزاد شناخته میشوند. با اینکه رادیکالهای آزاد، بسیار واکنشپذیر و ناپایدار هستند، اما برخی از آنها پایداری خود را حتی تا سالها حفظ میکنند. به ترکیباتی که اینگونه پایداری خود را حفظ میکنند، ترکیبات «فراپایدار» (Metastable) میگویند به این معنی که اگر به آنها زمان کافی داده شود، تجزیه میشوند یا در واکنش شرکت میکنند اما پایداری آنها زمان قابل توجهی را از چند روز تا چند سال شامل میشود.
مثالهایی از مولکولهای رادیکال آزاد
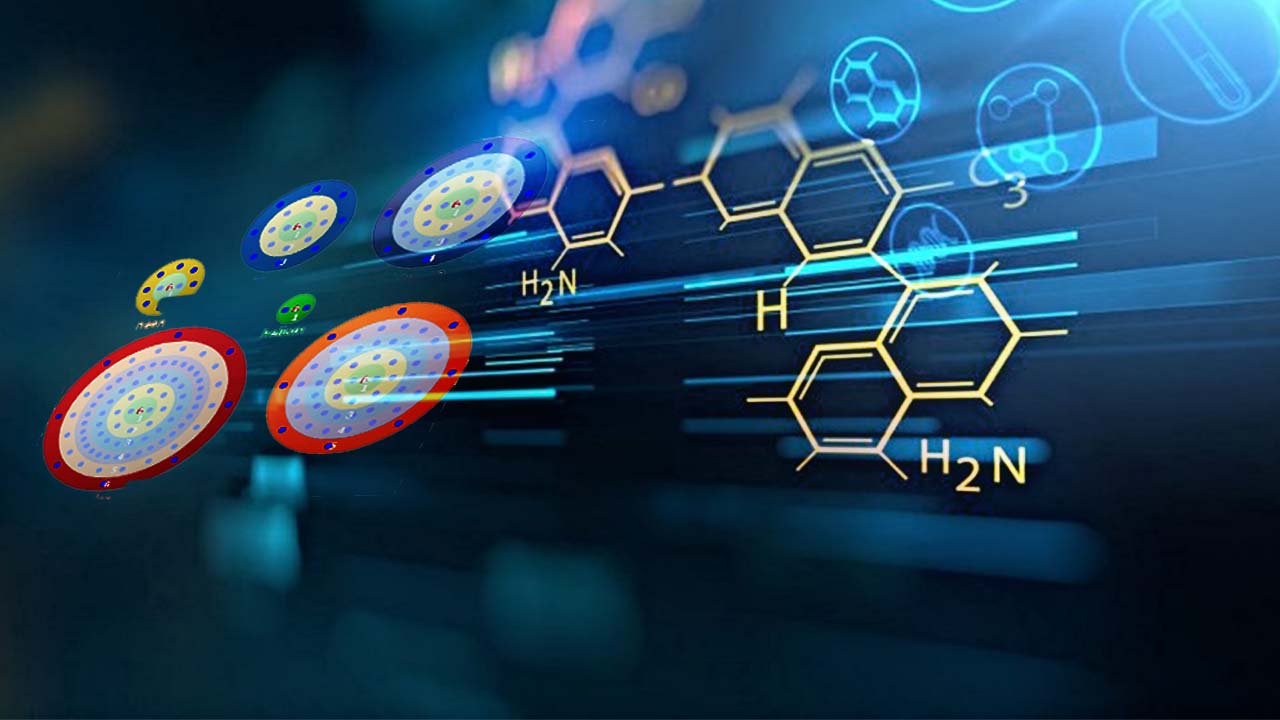
به یاد دارید که ساختار لوویس، تعداد کل الکترونهای ظرفیت را در اتمهای یک پیوند مشخص میکرد. فرمول نیتریک اکسید به صورت نوشته میشود. تعداد کل الکترونهای ظرفیت این ترکیب برابر با است. بنابراین، فارغ از تعداد الکترونهای اشتراکی بین اتمهای نیتروژن و اکسیژن، نیتروژن قاعده اکتت را رعایت نخواهد کرد. با فرض تکمیل قاعده اکتت توسط اکسیژن، نیتروژن دارای ۷ الکترون ظرفیت خواهد بود.
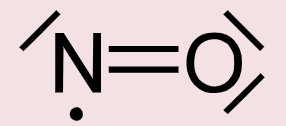
نیتریک اکسید، فرآورده فرعی حاصل از واکنشهای سوختن در موتور خودروها و تاسیسات نیروگاهی است. همچنین، در طبیعت نیز این ماده به دلیل تخلیه الکتریک ناشی از رعد و برق، تولید میشود.
دیاکسید نیتروژن، ترکیبی شیمیایی با فرمول است. در این ترکیب نیز، نیتروژن از اکتت پیروی نمیکند. تعداد کل الکترونهای ظرفیت برابر با است. به دلیل وجود الکترون جفتنشده، خاصیتی رادیکالی بر روی نیتروژن وجود دارد. دو اتم اکسیژن در این مولکول، از اکتت پیروی میکنند.

دیاکسید نیتروژن، مادهای واسط در سنتز صنعتی نیتریک اسید به شمار میآید که در هر سال، میلیونها تن از این ماده به تولید میرسد. این گاز، رنگی قرمز-قهوهای دارد و با داشتن بویی تند و تلخ، از آلایندههای اصلی هوا به شمار میآید.
انحراف از قاعده اکتت
یک «مولکول فوق والانس» (Hypervalent Molecule) به مولکولی میگویند که شامل یک یا چند عنصر از گروههای اصلی باشد و هر کدام در نتیجه پیوند، بیش از ۸ الکترون در لایه ظرفیت خود داشته باشند. فسفر پنتاکلرید ()، گوگرد هگزافلوئورید ()، کلر تریفلوئورید و یون تری یدید همگی نمونههایی از این مولکولهای هایپروالانس هستند.
در عناصر تناوب دوم جدول تناوبی، زیرلایه d نداریم و قاعده اکتت به صورت خواهد بود. در نتیجه، عناصر تناوب دوم به ویژه عناصر کربن، نیتروژن، اکسیژن و فلوئور، بدون استثنا از قاعده اکتت پیروی میکنند. در تصویر زیر، زاویه و طول پیوند در مولکول نشان داده شده است.
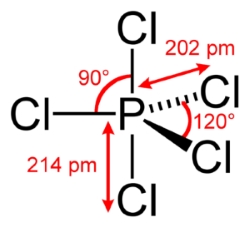
با این وجود، برخی عناصر تناوب سوم همچون سیلیکون (سیلیسیم)، فسفر، گوگرد و کلر، پیوندهایی با بیش از ۴ اتم تشکیل میدهند و در نتیجه، باید بیش از چهار جفت الکترون در وجود داشته باشد. این امر به دلیل وجود زیرلایه d امکانپذیر خواهد بود. با وجود اینکه انرژی اوربیتال خالی ، بیش از اوربیتال است، اما میزان این اختلاف کم خواهد بود و اوربیتالهای اضافی d، الکترون جذب میکنند.
بنابراین، اوربیتالهای d در پیوند با سایر اتمها شرکت میکنند و «اوکتت بسط یافته» (Expanded Octet) خواهیم داشت. از جمله مولکولهایی که در آنها، اتم مرکزی در تناوب سوم قرار داشته و شامل اوکتت بسط یافته باشند میتوان به فسفر پنتالدهید و گوگرد هگزافلوئورید اشاره کرد.
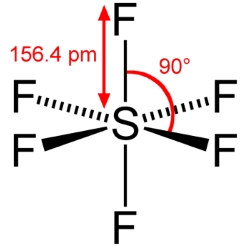
در اتمهای تناوب چهارم یا بالاتر، اوربیتالهای d بمنظور تامین جفتهای اشتراکی اضافی و بیشتر از اوکتت بکار میروند. انرژیهای نسبی انواع مختلف اوربیتالهای اتمی نشان میدهد که با افزایش عدد کوانتومی اصلی (n)، اختلاف انرژی بین سطوح و انرژی مورد نیاز برای این نوع از پیوندها، کاهش پیدا میکنند.













ممونون
سلام
یعنی اینکه اتمهایی که لایه ظرفیتشون 8 نیست دوست دارن به صورت یون باشن؟
سلام
بی زحمت میتونین بگین بار هر گروه چنده ؟
ممنون
سلام دوباره من آشنایی کاملی با جدول تناوبی آرایش الکترونی دارم . اگر میشه سه دلیل برای بیشتر شدن پایداری وقتی اتم ها تعداد الکترون هایش بعد از پیوند کووالانسی از قاعده اکتت را توضیح دهید
با تشکر
سلام خسته نباشید ببخشید یک سوالی داشتم این بود که چرا مولکول ها با اینکه اوکتت هستند دوست دارند بازم واکنش بدند و اوکتت بشند مثلا گاز نیتروژن رو در نظر بگیرید که یک گاز موکلولی با دو اتم هست و بینشون پیوند سه گانه هست و هر دو اتم مولکولش لایه ظرفیتش با اشترک الکترون پر شده و پایدار شدند اما سوالم اینه که چرا با اینکه پایدارند چه لزومی داره دوباره با یک عنصر دیگه واکنش بدند و پایدار بشند( چون هدف از واکنش بین عناصر این هست که در اخر پایدار بشند) ممنون می شم پاسخگو باشید.
سلام
عنصر کربن چی؟
چجوری به قاعده اکتت یا هشت تایی میرسه؟
سلام اگر میشه دلیل پایداری بیشتر اتم با افزایش تعداد الکترون ها را از قاعده اکتت را بصورت ساده توضیح بدهید ممنون می شوم
با سلام؛
با افزایش تعداد الکترونها، لزوما اتمها به پایداری نمیرسند. برای آشنایی بیشتر باید با مفاهیمی همچون اوربیتال و آرایش الکترونی آشنا باشید و روندهای تناوبی را در جدول تناوبی بشناسید. به همین دلیل، مطالعه مطالب زیر توصیه میشود.
گروه های جدول تناوبی (+ PDF و عکس فارسی)
جدول تناوبی و نحوه حفظ آن — به زبان ساده و کامل + دانلود PDF و عکس فارسی
با تشکر
با سلام؛
گاز نیتروژن با توجه به موارد گفته شده و انرژی پیوند برابر با ۹۴۶ کیلوژول بر مول، تقریبا واکنشپذیر نیست چراکه به پایداری رسیده است. با این وجود، پیشنهاد میکنیم برای اینکه واکنشپذیری را از نگاه ترمودینامیکی نیز بررسی کنید، مطالب زیر را برای مطالعه در نظر بگیرید.
انرژی آزاد گیبس — از صفر تا صد
فوگاسیته چیست؟ — به زبان ساده
پتانسیل شیمیایی — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس