انرژی درونی – از صفر تا صد
انرژی درونی ، انرژی میکروسکوپی موجود در ماده است که بوسیله حرکات نامنظم و تصادفی مولکولها تعریف میشود. علاوه بر این، انرژی درونی شامل انرژی پتانسیل بین این مولکولها و انرژی هستهای در اتمهای این مولکولها نیز میشود. انرژی درونی و انرژی حرارتی در متون پایه ترمودینامیک بسیار به یکدیگر شبیه هستند، گرچه این دو انرژی با یکدیگر تفاوت دارند زیرا انرژی درونی چیزی بیش از متوسط انرژی جنبشی مولکولها را شامل میشود. درک این تفاوت، اهمیت بسیار زیادی دارد زیرا انرژی پتانسیل بین مولکولها و اتمها به جهت فهم تغییرات فاز، واکنشهای شیمیایی، هستهای و بسیاری از پدیدههای میکروسکوپی مهم است.
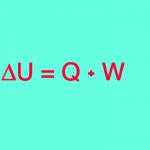
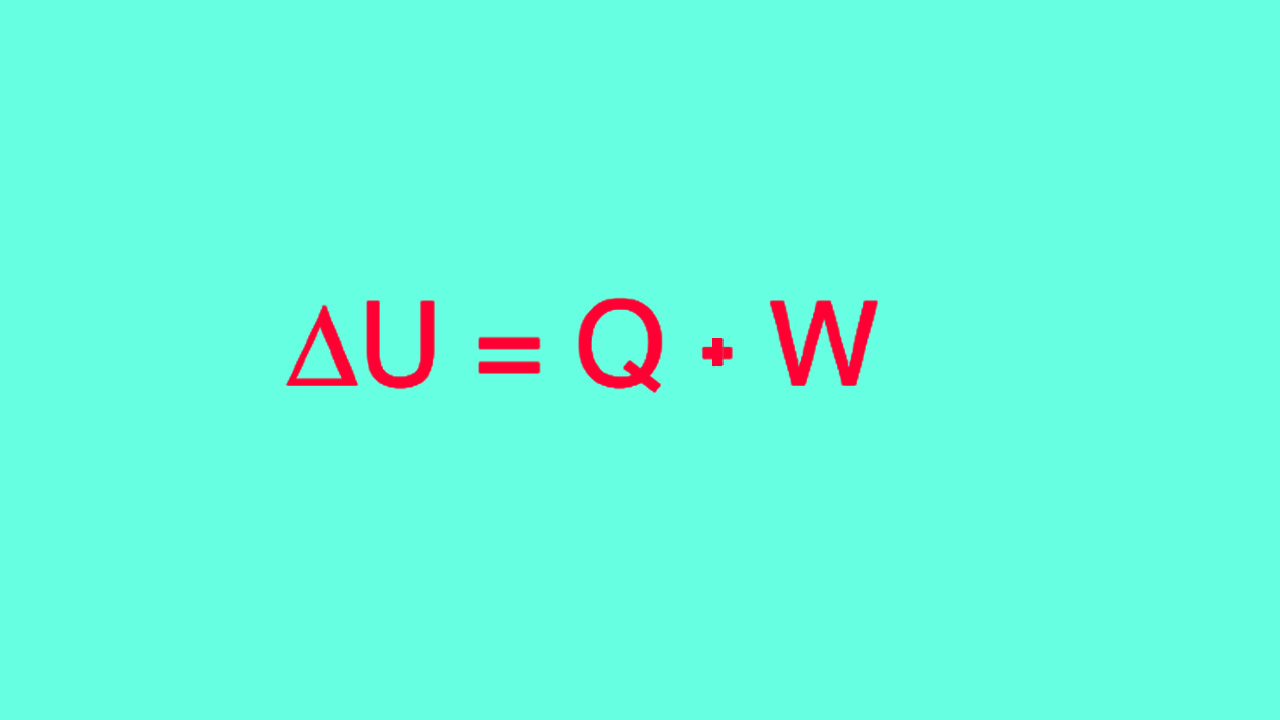
مقدمه
تمامی اشیا در فضا شامل انرژیها ماکروسکوپی و میکروسکوپی هستند. با وجود اینکه این انرژیها، مفاهیم بسیار نزدیکی دارند، اما تفاوت اصلی آنها این است که انرژی میکروسکوپی قابل مشاهده نیست. به طور مثال، یک لیوان آب بر روی میز، هیچ انرژی ماکروسکوپی ندارد اما در مقیاس میکروسکوپی، این لیوان آب در حقیقت، جرمی شامل مولکولهایی است که با سرعت بیش از صدها متر بر ثانیه در حال حرکت هستند.
قانون اول ترمودینامیک بیان میکند که انرژی داخلی یک سیستم را میتوان با انجام کار بر روی آن، افزایش یا کاهش حرارت یا ترکیبی از این دو مورد، تغییر داد. اگر سیستم، عایق باشد، با محیط اطراف خود برهمکنشی ندارد و این امر بدان معنی است که تغییری در انرژی درونی نخواهیم داشت.
انرژی داخلی یک نوع «تابع حالت» (State Function) است به این معنی که مقدار آن به مسیر فرآیند بستگی ندارد. علاوه بر این، انرژی درونی را به صورت یک پتانسیل ترمودینامیکی نیز توصیف میکنند و روابط مربوط به سایر پتانسیلهای ترمودینامیکی، به کمک انرژی درونی تعریف میشوند. در ترمودینامیک، به ندرت تمامی انرژیهای ذاتی در یک سیستم را در نظر میگیرند. در حقیقت، این انرژیها را میتوان به صورت حرکات میکروسکوپی ذرات سیستم به شکلهای «انتقالی» (Translational)، دورانی و ارتعاشی به همراه انرژی پتانسیل همراه با نیروهای میکروسکوپی شامل پیوندهای شیمیایی توصیف کرد. در مکانیک آماری، انرژی درونی، متوسط آنسامبل مجموع انرژیهای جنبشی و پتانسیل میکروسکوپی یک سیستم است.
واحد انرژی در SI، ژول است. در برخی موارد از از انرژی درونی ویژه استفاده میکنند که واحدهای آن به ترتیب برای جرم سیستم و مقدار ماده (انرژی درونی مولی) به صورت و تعریف میشود.

توابع کاردینال
انرژی درونی ، ترمودینامیک یک سیستم را با زبان انرژی بیان میکند. به عنوان یک تابع حالت، شناسههای آن به صورت «متغیرهای مقداری» (Extensive Variables) از حالت هستند. در کنار انرژی درونی، دیگر تابع حالت کاردینال (اصلی) در یک سیستم ترمودینامیکی، آنتروپی است. هر تابع کاردینال، «تابعی یکنوا» (Monotonic Function) از متغیرهای طبیعی یا کانونیک (متعارفی) خود است که هرکدام، معادلاتی اساسی را بدست میدهند. به طور مثال، ، خود شامل تمامی اطلاعات ترمودینامیکی یک سیستم است.
معادلات اساسی برای دو تابع کاردینال را میتوان به یکدیگر تبدیل کرد. به طور مثال، این کار با حل برای و رسیدن به امکانپذیر خواهد بود. در مقابل، برای اثبات معادلات اساسی برای سایر پتانسیلهای ترمودینامیکی، نیاز به استفاده از «تبدیلات لژاندر» (Legendre Transforms) داریم.
تعریف انرژی درونی
انرژی درونی یک سیستم به کمک جمع زدن انتقال انرژیهای ماکروسکوپی که سبب تغییر حالت سیستم از حالت مرجع به حالت جدید میشوند، قابل محاسبه است:
انرژی داخلی (درونی) را میتوان به صورت مجموع انرژیهای جنبشی و پتانسیل میکروسکوپی به صورت زیر نوشت:
انرژی جنبشی میکروسکوپی، شامل مجموع حرکات اجزای کل سیستم است که میتوان آن را به صورت حرکت اتمها، مولکولها، هسته اتم، الکترونها یا ذرات دیگر در نظر گرفت. انرژی پتانسیل میکروسکوپی نیز شامل پیوندهای شیمیایی و نیروهای فیزیکی در سیستم همچون نیروی الکتریسیته القایی یا ممان دوقطبی مغناطیسی است. همانطور که پیشتر نیز اشاره شد، انرژی درونی، یک خاصیت مقداری است و به اندازه سیستم یا مقدار ماده حاوی آن بستگی دارد.
در دماهای بالاتر از صفر مطلق، انرژیهای جنبشی و پتانسیل میکروسکوپی، به طور پیوسته به یکدیگر تبدیل میشوند اما مجموع آنها در یک سیستم عایق، ثابت میماند. از نگاه ترمودینامیک کلاسیک، در دمای صفر درجه، انرژی جنبشی از بین میرود و کل انرژی سیستم، تنها شامل انرژی پتانسیل است. با این وجود، مکانیک کوانتوم بیان میکند که حتی در دمای صفر مطلق، ذرات دارای انرژی حرکتی موسوم به «انرژی نقطه صفر» (Zero Point Energy) هستند.
تغییرات انرژی درونی
در یک سیستم بسته، که در آن، انتقال ماده نخواهیم داشت، تغییرات انرژی درونی به دلیل انتقال حرارت و کار انجام میشود. کار سیستم را نیز میتوان به دو مفهوم کار حاصل از تغییرات فشار و حجم (کار فشار-حجم) و کار ناشی از سایر موارد دیگر تعریف کرد که تغییری در حجم سیستم نمیدهند همچون اصطکاک و «قطبش الکتریکی» (Electrical Polarization). این نوع از کار با نام کار «همحجم» (Isochoric) قابل تعریف است.
$$$\Delta U = Q + W _ {\text {pressure -volume }} + W _ {\text {isochoric }}$$
زمانی که یک سیستم بسته، انرژی دریافت کند، این انرژی موجب افزایش انرژی داخلی خواهد شد و بین انرژیهای پتانسیل و جنبشی میکروسکوپی توزیع میشود. به طور کلی، علم ترمودینامیک، این توزیع را بررسی نمیکند.
مکانیسم دوم برای تغییر انرژی درونی یک سیستم بسته، انجام کار بر روی آن است. این کار میتواند به صورت مکانیکی با تغییر فشار و حجم یا اینکه حاصل سایر آشفتگیها همچون انتقال جریان الکتریکی به سیستم باشد.
اگر یک سیستم بسته نداشته باشیم، مکانیسم سومی که میتواند موجب تغییر انرژی درونی باشد، «انتقال ماده» (Matter Transfer) به سیستم است. این افزایش انرژی درونی که با نشان داده میشود را میتوان به کار و حرارت تقسیم کرد. اگر سیستم به گونهای تنظیم شده باشد که حرارت و کار در مسیرهایی جداگانه و مستقل از انتقال ماده، در سیستم تغییر کنند، رابطه انرژی درونی به شکل زیر خواهد بود:
در صورتیکه سیستم در اثر حرارت، دچار تغییر (تبدیل) فاز همچون ذوب یا تبخیر شود، دمای سیستم تا تبدیل کامل، دچار تغییر نخواهد شد. به انرژی که در این حالت به سیستم داده میشود که در اثر آن، تغییر دمایی صورت نمیگیرد، انرژی نهان یا «گرمای نهان» (Latent Heat) میگویند.

انرژی درونی گاز ایدهآل
یک گاز ایدهآل، گازی است که ذرات آن به شکل نقاطی در نظر گرفته میشوند که با یکدیگر برخوردهایی الاستیک دارند و حجم ظرف حاوی خود را به گونهای پر میکنند که مسیر آزاد بین برخوردها، بسیار بیشتر از قطر ذرات باشند. چنین سیستمهایی را میتوان به تقریب خوبی برای توصیف گازهای تکاتمی همچون هلیوم و سایر گازهای نجیب در نظر گرفت. در اینجا، انرژی جنبشی، تنها شامل انرژی انتقالی اتمهای منفرد است. ذرات تکاتمی، دوران یا ارتعاش ندارند و فقط در دماهای بسیار شدید، به سطوح بالاتر انرژی میرسند.
بنابراین، تغییرات انرژی داخلی یک گاز ایدهآل را میتوان تنها با تغییرات انرژی جنبشی توصیف کرد. در تعریفی ساده، انرژی جنبشی، همان انرژی درونی یک گاز کامل است و تنها به فشار، حجم و دمای ترمودینامیکی بستگی دارد. به عبارت دیگر، انرژی داخلی یک گاز ایدهآل، به جرم (تعداد مول) و دمای آن وابسته است.
در این رابطه، ، ظرفیت حرارتی مولی گاز در حجم ثابت ذکر میشود. انرژی داخلی را میتوان به صورت تابعی از سه خاصیت مقداری یعنی آنتروپی، حجم و جرم، به صورت زیر نوشت:
در رابطه بالا، عدد ثابت مثبت و ، ثابت جهانی گازها است.
انرژی داخلی در یک سیستم بسته ترمودینامیکی
برای سیستمی که تنها در فرآیندهای ترمودینامیکی شرکت میکند، یعنی سیستم بستهای که تنها میتواند گرما و کار مبادله کند، انرژی داخلی به صورت زیر تعریف میشود که این رابطه را میتوان بیانی از قانون اول ترمودینامیک دانست:
این رابطه را میتوان بر اساس سایر پارامترهای ترمودینامیکی نوشت. به طور مثال، کار مکانیکی انجام شده بر روی یک سیستم را برای یک سیال غیر ویسکوز به فشار و حجم مرتبط میشود که فشار، خاصیتی شدتی و حجم، خاصیتی مقداری دارد.
این رابطه، جهتِ کار را تعریف میکند که از سیستم به طرف محیط و با علامت منفی است. با در نظر گرفتن جهت انتقال حرارت به طرف سیال و فرض فرآیند برگشتپذیر، رابطه گرما به صورت زیر تعریف خواهد شد که در آن، T دما و S، آنتروپی است:
در نتیجه، تغییرات انرژی درونی به صورت زیر تعریف خواهد شد:

تغییرات انرژی درونی بر اثر دما و حجم
رابطه زیر برای مرتبط ساختن تغییرات انرژی درونی به تغییرات دما و حجم در نظر گرفته میشود. این رابطه زمانی کاربرد دارد که معادله حالت مشخص باشد:
اگر گاز ایدهآل داشته باشیم، ثابت میشود که . این عبارت نشان میدهد که انرژی درونی یک گاز ایدهآل را میتوان به صورت تابعی نوشت که تنها به دما وابسته باشد.
اثبات رابطه
با نوشتن معادله حالت برای گازهای ایدهآل و با حل آن برای فشار خواهیم داشت:
با جایگذاری این رابطه در معادله انرژی درونی به رابطه زیر میرسیم:
با مشتقگیری از فشار بر مبنای دما و جایگذاری آن در رابطه اصلی خواهیم داشت:
تغییرات انرژی درونی بر اثر تغییرات دما و فشار
زمانی که سیالات یا جامدات را بررسی میکنیم، بهتر است تا از رابطهای کمک بگیریم که تغییرات دما و فشار را لحاظ کند. این رابطه به صورت زیر تعریف میشود:
فرض میشود که بر اساس رابطه زیر، ظرفیت حرارتی در فشار ثابت، مرتبط با ظرفیت حرارتی در حجم ثابت است:
اثبات رابطه
مشتق جزئی فشار نسبت به دما در حجم ثابت را میتوان به شکل ضریب انبساط حرارتی و با رابطه زیر تعریف کرد:
همچنین، تراکمپذیری همدما به شکل زیر تعریف میشود:
رابطه زیر را در نظر میگیریم:
با توجه به اینکه تغییرات حجم نداریم، رابطه بالا را مساوی با صفر قرار میدهیم و با حل آن برای ، به رابطه زیر میرسیم:
با جایگذاری دو معادله فوق در رابطه زیر، به رابطه مربوط به تغییرات انرژی درونی در اثر تغییرات دما و فشار میرسیم:

انرژی درونی سیستمهای چند جزئی
علاوه بر اینکه در رابطه اصلی انرژی درونی، عبارات آنتروپی و حجم را نیز قرار دادیم، میتوان عبارات مربوط به تعداد اجزای شیمیایی را نیز دخیل کرد که در این رابطه، مقادیر مولی جزء در سیستم است:
همانطور که پیشتر نیز به آن اشاره شد، انرژی درونی، یک تابع مقداری از متغیرهای مقداری آنتروپی، حجم و است. انرژی درونی را میتوان به صورت تابع همگن درجه اول نوشت:
در این رابطه، عبارتی است که تغییر (رشد) سیستم را توصیف میکند. رابطه دیفرانسیلی انرژی داخلی به صورت زیر خواهد بود:
در این رابطه، ، پتانسیل شیمیایی جزء در سیستم است و از رابطه زیر بدست میآید. لازم به ذکر است که پتانسیل شیمیایی نیز از جمله خواص شدتی به شمار میرود:
تحت شرایط دما و فشار ثابت، با توجه به خاصیت مقداری و متغیرهای مستقل آن، به کمک قضیه تابع همگن اویلر، با انتگرالگیری از به رابطه زیر برای انرژی درونی میرسیم:
در رابطه بالا، مجموع اجزای سیستم به انرژی آزاد گیبس تعریف میشود:
برای یک سیستم تکجزئی، پتانسیل شیمیایی با انرژی گیبس هر مقدار از ماده (اجزا یا مولها) برابر است.

انرژی درونی در محیط الاستیک
برای یک محیط الاستیک، عبارت انرژی مکانیکی در رابطه انرژی درونی، بوسیله مولفههای تنش و کرنش در فرآیندهای الاستیکی توصیف میشود. به کمک قاعده جمعزنی انیشتین برای تانسورها، به رابطه زیر برای انرژی درونی میرسیم:
با استفاده از قضیه اویلر خواهیم داشت:
برای مادهای به شکل الاستیک خطی، تنش و کرنش طبق رابطه زیر به یکدیگر مرتبط میشوند:
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش ترمودینامیک مهندسی شیمی
- گاز واقعی (حقیقی) — از صفر تا صد
- فوگاسیته چیست؟ — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^












