استوکیومتری گازها – به زبان ساده
مطالعه رفتار شیمیایی گازها شاید به عنوان یکی از بنیادیترین مطالعات در شیمی محسوب شود. آنتوان لاوازیه فرانسوی که او را به نام پدر شیمی مدرن میشناسند، با کارهای علمی که در خصوص گازها خصوصا استوکیومتری گازها انجام داد، شیمی را از یک علم کیفی به یک علم کمی تبدیل کرد. او قانون پایستگی ماده را کشف، نقش اکسیژن در واکنشهای سوختن را تعیین و علاوه بر آن، ترکیب هوا را مشخص کرد. همچنین، تنفس انسان را بر اساس واکنشهای شیمیایی توضیح داد. در این آموزش قصد داریم تا در خصوص استوکیومتری گازها و مسائل استوکیومتری مربوطه صحبت کنیم که نتیجه فعالیتهای چنین دانشمندانی است.
مقدمهای بر استوکیومتری گازها
استوکیومتری گازها یا به طور کل استوکیومتری را باید پاسخی برای نوعی از سوالات شیمی دانست که شامل عبارت «چه مقدار؟» هستند. این سوال را میتوان به کمک جرم مواد یا حجم محلولها پاسخ داد. البته روش دیگری هم برای پاسخ به این سوال وجود دارد و آن، حجم گازها است. میتوان به کمک قانون گازهای ایدهآل، فشار، حجم، دما و تعداد مولهای گاز را به یکدیگر مرتبط کرد.
در چنین شرایطی، قانون گازهای ایدهآل را با جرم مولی و چگالی گاز ترکیب میکنیم تا به این سوالات پاسخ دهیم. برای اینکار نیاز به شناخت مخلوط گازها داریم و میبایست مقادیر مواد را در واکنشهای گازی محاسبه کنیم. در این آموزش، با معرفی مباحث مختلف و حل مثالهای مربوط به آن، استوکیومتری گازها یا به عبارت دیگر، مسائلِ مقداری در محاسبات شیمی مورد بررسی قرار میگیرند.
چگالی گازها
میدانیم که چگالی عبارتست از نسبت جرم به حجم و همین رابطه برای گازها نیز صادق است:
بنابراین، در مسائل استوکیومتری گازها اگر بتوانیم حجم گازها را تعیین کنیم، تعیین چگالی آنها کار سادهای خواهد بود. همچنین، از چگالی یک گاز میتوان برای تعیین جرم مولی و به دنبال آن، تعیین نوع گاز استفاده کرد. همانطور که در بالا نیز به آن اشاره شد، به کمک قانون گازهای ایدهآل، رابطهای بدست میآوریم که چگالی یک گاز را به حجم آن در مسائل مربوط به استوکیومتری گازها نسبت دهد. این رابطه را در مثال زیر بررسی خواهیم کرد.

مثال 1
به کمک رابطه ، فرمولی برای دانسیته گازها به صورت g/L بدست بیاورید.
دو طرف معادله را در جرم مولی ضرب میکنیم. از آنجایی که واحد جرم مولی به صورت g/mol است، واحد گرم که به آن نیاز داشتیم در فرمول پدیدار میشود.
حال، این معادله را در مثالی دیگر ارزشیابی میکنیم:
دانسیته گازی در دمای 17 درجه سانتیگراد و فشار برابر با است. جرم مولی گاز را محاسبه و نوع آنرا تعیین کنید.
با توجه به مقدار عددی جرم مولی، این گاز، گاز هیدروژن است. توجه داشته باشید که در این مثال، فشار و دما، هر دو ذکر شده بودند زیرا تعداد مولهای یک گاز - و به دنبال آن، جرم گاز - در یک لیتر، با دما و فشار تغییر میکند. به همین دلیل در بیشتر موارد، چگالی گازها در شرایط STP گزارش میشود.
مثال 2
سیکلوپروپان، گازی است که در گذشته به همراه اکسیژن به عنوان گاز بیهوشی مورد استفاده قرار میگرفت. این گاز به لحاظ جرمی شامل 85/7 درصد کربن و 14/3 درصد هیدروژن است. فرمول تجربی این گاز را پیدا کنید. اگر 1/56 گرم سیکلوپروپان در فشار 0/984 اتمسفر و دمای 50 درجه سانتیگراد، حجمی برابر با یک لیتر را اشغال کند، فرمول مولکولی سیکلوپروپان چه خواهد بود؟
در ابتدا، فرمول تجربی گاز را به کمک روش بالا محاسبه میکنیم. مقدار 100 گرم را فرض کنید و به کمک آن، مقادیر عناصر را به گرم تبدیل و سپس، تعداد مولهای کربن و هیدروژن را در 100 گرم سیکلوپروپان پیدا کنید. حال باید تعداد مولها به کمترین عدد محاسبه شده تقسیم شود. با این کار، تعداد مولهای کربن به تعداد مولهای هیدروژن مرتبط خواهند شد. در مرحله آخر نیز توجه داشته باشید که کوچکترین نسبت صحیح، فرمول تجربی خواهد بود:
با توجه به اعداد بدست آمده، در مییابیم که فرمول تجربی، خواهد بود. جرم حاصل از فرمول تجربی (EM) نیز برابر با 14/03 خواهد بود. در ادامه، به کمک رابطه مثال قبل، چگالی را محاسبه میکنیم:
جرم مولی یک گاز
از کاربردهای دیگر رابطه گاز ایدهآل، تعیین جرم مولی است. بنا به تعریف، جرم مولی یک ماده، نسبت جرم ماده (گرم) به تعداد مولهای آن ذکر میشود.
از رابطه بالا میتوان برای محاسبه جرم مولی گازها به کمک مقادیر فشار، حجم، دما و جرم گاز کمک گرفت.
مثال: تعیین جرم مولی یک مایع فرار
جرم مولی یک مایع فرار را به کمک مراحل زیر میتوان محاسبه کرد:
- حرارت دادن نمونه مایع در بالون حجمی دربسته، که سوراخی روی دهانه آن ایجاد شده باشد. این کار موجب خروج گاز خواهد شد.
- زمانی تمامی مایع به گاز تبدیل شد، حرارت دادن را به سرعت متوقف میکنیم. در این زمان، نمونه در فشار محیط، تنها توسط گاز، پر شده است.
- با عایق کردن بالون حجمی، به گاز فرصت میدهیم تا میعان کند. در ادامه، وزن نهایی بالون را اندازهگیری میکنیم تا به کمک آن، جرم نمونه مشخص شود.

به کمک دستورالعمل بالا، جرم نمونهای از گاز کلروفرم در دمای 99/6 درجه سانتیگراد و حجم 129 سانتیمتر مکعب، برابر با 0/494 گرم اندازهگیری شده که در این شرایط، فشار اتمسفری برابر با 742/1 میلیمتر جیوه ذکر شده است. مقدار تقریبی جرم مولی کلروفرم را محاسبه کنید.
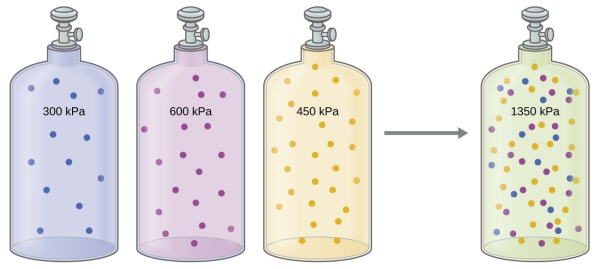
فشار مخلوط گازها: قانون دالتون
در محاسبات استوکیومتری گازها و به طور کلی، تا زمانی که گازها در یک مخلوط گازی با یکدیگر وارد واکنش نشوند، تاثیری بر فشار یکدیگر نخواهند داشت. به عبارت دیگر، هر گاز در یک مخلوط گازی، همان فشاری را خواهد داشت که به تنهایی در یک مخزن جدا ایجاد میکند.
به این فشاری که هر گاز در یک مخلوط داراست، «فشار جزئی» (Partial Pressure) میگویند. از این خاصیت، در استوکیومتری گازها و قانونی موسوم به قانون فشارهای جزئی دالتون استفاده میشود. این قانون بیان میکند که فشار کلی یک مخلوط گاز ایدهآل، با مجموع فشارهای جزئی آن برابر است. رابطه قانون فشارهای جزئی دالتون به صورت زیر است:
کسر مولی
دانستن رابطه کسر مولی در استوکیومتری گازها بسیار پراهمیت است. فشار جزئی گاز A نیز به کمک کسر مولی، به فشار کل در یک مخلوط گازی مرتبط میشود. رابطه کسر مولی، به صورت زیر تعریف شده است. در این رابطه یا ، نمادی برای کسر مولی خواهد بود:
در رابطه بالا، ، و به ترتیب، فشار جزئی، کسر مولی و تعداد مولهای گاز A خواهند بود.
مثال
یک مخلوط گازی شامل 2/83 مول گاز اکسیژن و 8/41 مول گاز نیتروس اکسید و فشار کل مخلوط برابر با 192 کیلوپاسکال است.
- کسر مولی و را حساب کنید.
- فشار جزئی این دو گاز را حساب کنید.
محاسبات برای :
محاسبات برای :
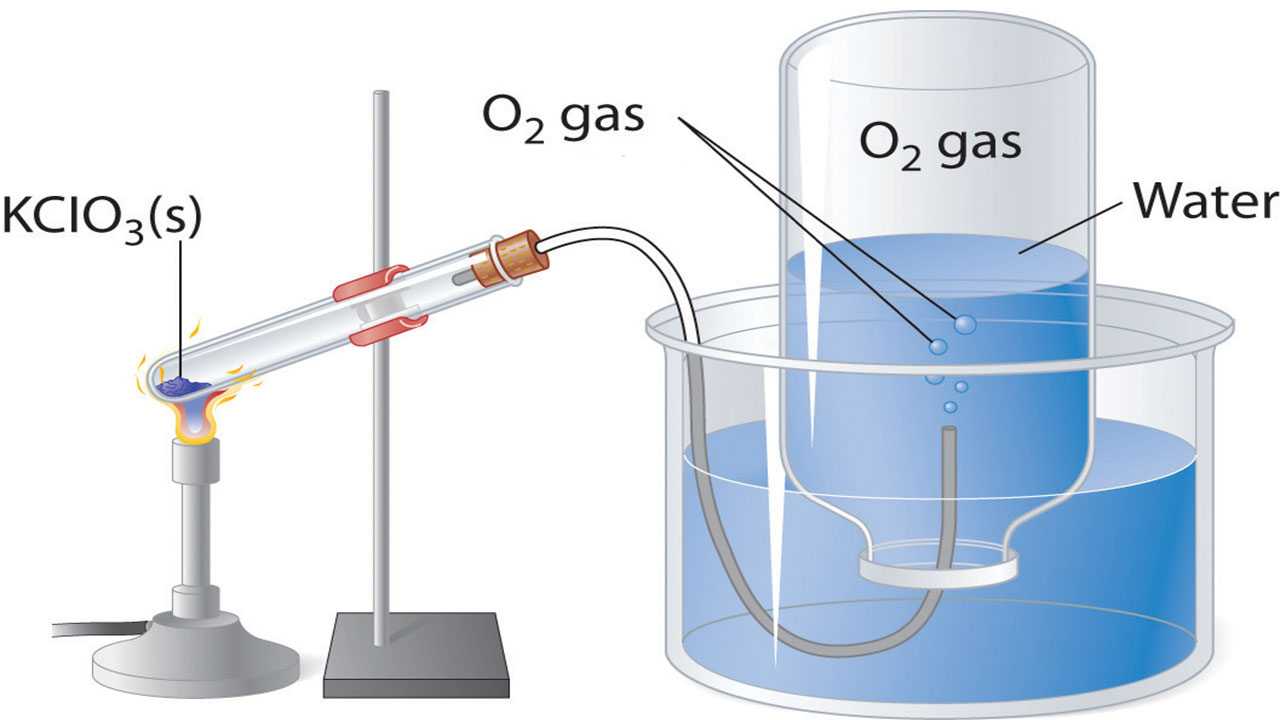
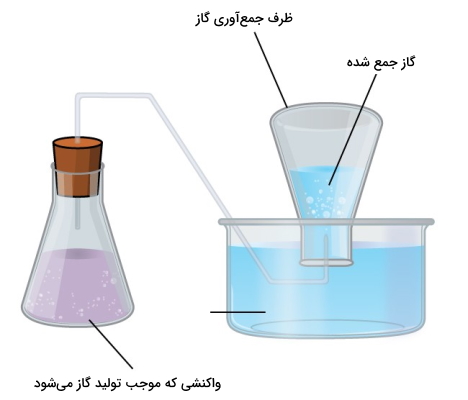
جمعآوری گاز بالای آب
گازهایی که با آب واکنش نمیدهند را به کمک یک راه ساده میتوان جمعآوری کرد. برای این کار، محفظهای را به طور وارونه و طبق تصویر زیر، در یک ظرف آب فرو میبرند. فشار گاز داخل محفظه را با بالا و پایین بردن آن میتوان با فشار هوای اطراف، برابر کرد. زمانی که سطح آب در داخل و خارج محفظه برابر شود، فشار گاز با فشار اتمسفری برابر خواهد بود و این مورد به کمک یک فشارسنج (بارومتر) قابل اندازهگیری است.
البته در استوکیومتری گازها عامل دیگری را نیز باید به هنگام اندازهگیری فشار گاز با این روش در نظر گرفت. آب تبخیر خواهد شد و همواره بخار آبی بالای ظرف آب خواهیم داشت. همزمان با جمع شدن گاز، بالای آب، فشاری معادل مجموع فشارهای جزئی گاز و بخار آب بوجود میآید. بنابراین، فشار گاز خالص، برابر با فشار کل منهای فشار بخار آب خواهد بود. این فشار به فشار گاز خشک معروف است. فشار بخار آب نیز به دمای آن بستگی دارد.
مثال
اگر 0/2 لیتر آرگون، در بالای آب با دمای 26 درجه سانتیگراد و فشار جمع آوری شود، مقدار فشار جزئی آرگون را محاسبه کنید.
بر اساس قانون دالتون، فشار کل ، برابر با مجموع فشار جزئی آرگون و فشار بخار آب خواهد بود.
با بازآرایی رابطه فوق و حل آن برای فشار آرگون، خواهیم داشت:
با مراجعه به جداول فشار بخار در مییابیم که فشار بخار آب در دمای 26 درجه سانتیگراد برابر با است. بنابراین، فشار جزئی آرگون به کمک رابطه زیر محاسبه خواهد شد:
محاسبات کمی و استوکیومتری گازها
همانطور که در ابتدای متن نیز به آن اشاره شد، استوکیومتری شیمیایی به توضیح روابط کمی (مقداری) بین واکنشدهندهها و فرآوردهها میپردازد. تا اینجای آموزش، مقادیر واکنشدهنده و فرآوردهها را به کمک جرم جامدات و حجم آنها را به همراه مولاریته محلولها اندازهگیری کردیم. لازم به ذکر است که در مسائل استوکیومتری گازها اگر حجم، فشار و دمای یک گاز را داشته باشیم، به کمک قانون گازهای ایدهآل، تعداد مول موجود را میتوانیم محاسبه کنیم. همچنین، اگر بدانیم که چند مول گاز داریم، حجم گاز در هر دما و فشاری قابل اندازهگیری خواهد بود.
بازنگری در قانون آووگادرو
برخی اوقات از قانونی در استوکیومتری گازها میتوان استفاده کرد که در جامدها و محلولها وجود ندارد. این قانون بیان میکند که تمامی گازهایی که رفتار ایدهآل از خود نشان میدهند، در دما، فشار و در نتیجه حجم برابر، تعداد مولکول یکسانی خواهند داشت. در نتیجه، نسبت حجم گازهای شرکت کننده در یک واکنش شیمیایی با نسبتهای استوکیومتری آنها برابر خواهد بود.
قانون آووگادرو بیان میکند که حجم گازها به طور مستقیم با تعداد مولهای آن متناسب است. این قانون را میتوان به واکنشهای شیمیایی نیز نسبت داد به اینصورت که گازها با نسبتهای ساده حجمی با یکدیگر ترکیب میشوند و واکنش میدهند. این پدیده را در قانون نسبتهای حجمی گیلوساک نیز بررسی کردیم. به طور مثال، گازهای نیتروژن و هیدروژن در واکنش زیر، تولید آمونیاک میکنند:
توصیف این قانون، در تصویر زیر قابل ملاحظه است.
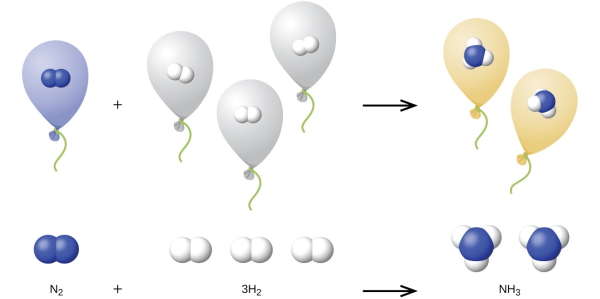
مثال 1
از گاز پروپان در اجاق گازهای خوراکپزی استفاده میشود. چه میزان اکسیژن در دمای 25 درجه سانتیگراد و فشار نیاز داریم تا با 2/7 لیتر گاز پروپان در همان دما و فشار وارد واکنش شود. فرض کنید واکنش به طور کامل انجام شود.
واکنش موازنه شده سوختن پروپان در زیر آورده شده است. این واکنش بیان میکند که ۱ حجم از پروپان با ۵ حجم از گاز اکسیژن واکنش میدهد تا ۳ حجم گاز دیاکسید کربن و ۴ حجم آب تولید شود.
بنابراین خواهیم داشت:
در نتیجه، 13/5 لیتر گاز اکسیژن برای واکنش با 2/7 لیتر پروپان مورد نیاز خواهد بود.
مثال ۲
آمونیاک مادهای صنعتی است که به عنوان کود شیمیایی نیز مورد استفاده قرار میگیرد. فرض کنید که حجمی برابر با 683 میلیارد فوت مکعب در دمای ۲۵ درجه سانتیگراد و فشار ۱ اتمسفر تولید شده باشد. چه حجم از گاز هیدروژن تحت همین شرایط برای واکنش با نیتروژن مورد نیاز است تا این مقدار آمونیاک به تولید برسد.
واکنش بالا نشان میدهد که ۱ حجم از نیتروژن با ۳ حجم از هیدروژن وارد واکنش میشود تا ۲ حجم آمونیاک به تولید برسد. در نتیجه، نسبت ۳ به ۲ را برای محاسبات استوکیومتری گازها باید در نظر گرفت:
مثال ۳
در صورت واکنش 8/88 گرم با مقدار اضافی هیدروکلریک اسید در دمای 27 درجه سانتیگراد و فشار ، چه حجم گاز هیدروژن به تولید میرسد.
برای اینکه جرم گالیم را به حجم گاز هیدروژن تبدیل کنیم، باید مراحل زیر طی شود:
حجم گاز هیدرژون تعداد مول گاز هیدروژن تعداد مول گالیم جرم گالیم
حال، از قانون گازهای ایدهآل برای حل قسمت آخر استفاده میکنیم:
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- گاز واقعی (حقیقی) — از صفر تا صد
- قانون بویل — به زبان ساده
^^













سلام وتشکر از زحمات شمااستدعا دارم ازحضورتان با توجه به ژرف اندیشی عمیقتا در صورت امکان مسایلی از قبیل مقدار اکسیژن موردنیاز برحسب لیترجهت سوزاندن مقدار n% درصد از کربن موجود در فولادمذاب نیزحل کنید بازهم تشکر ازشما