قانون بویل — به زبان ساده
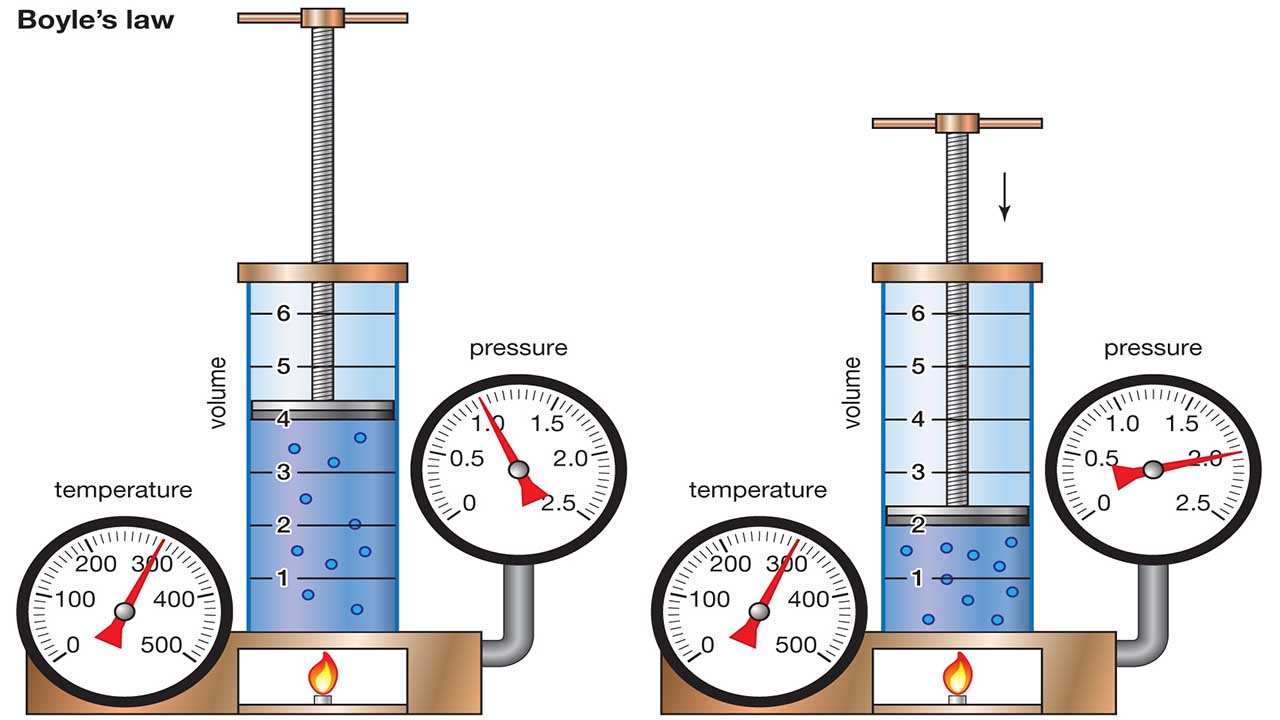
قانون بویل که آن را به عنوان قانون بویل-ماریوت نیز میشناسند، یک قانون آزمایشگاهی است که بیان میکند چگونه فشار یک گاز به هنگام کاهش حجم یک محفظه گازی افزایش پیدا میکند. تعریف امروزی قانون بویل را به صورت زیر تعریف میکنند:
اگر دما و مقدار گاز در یک سیستم بسته تغییری نداشته باشند، فشار مطلق یک گاز ایدهآل به طور عکس با حجم اشغال شده توسط آن متناسب است.
رابرت بویل، شیمیدان انگلیسی به عنوان یکی از بنیانگذاران شیمی آزمایشگاهی مدرن شناخته میشود. او کشف کرد که با افزایش دو برابری فشار یک نمونه گاز محبوس و ثابت نگهداشتن دما، حجم گاز نصف خواهد شد. در حقیقت یک رابطه معکوس بین دو متغیر فشار و حجم بدست آمد که هرگاه یکی از مقادیر افزایش پیدا میکرد، دیگری رو به کاهش بود.
توضیح قانون بویل به صورت فیزیکی
اما به طور فیزیکی چه اتفاقی میافتد؟ مولکولهای گاز در فاصله معینی از هم در حرکت هستند. افزایش فشار سبب میشود تا مولکولهای گاز به یکدیگر نزدیک شوند که این امر موجب کاهش حجم خواهد بود.
به طور عکس، اگر فشار کاهش پیدا کند، گازها برای حرکت در فضا، آزادی بیشتری خواهند داشت.

در حقیقت، تعریف قانون بویل در ریاضی به این صورت است که حاصلضرب فشار در حجم، عددی ثابت خواهد بود که آن را به شکل رابطه زیر میتوان نوشت که در این رابطه، $$P$$ و $$V$$ به ترتیب بیانگر فشار و حجم هستند.
$$P \times V = k$$
$$k$$ عددی ثابت است و مقدار آن تنها به جرم و دمای گاز بستگی دارد. اگر در یک آزمایش، تغییرات حجم و فشار یک گاز را در دمایی ثابت اندازهگیری و نمودار آن را رسم کنیم، نموداری به شکل زیر خواهیم داشت:
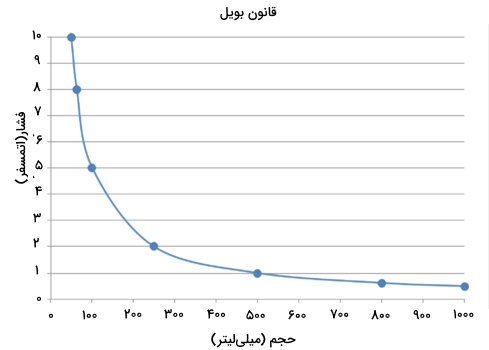
از قانون بویل میتوان برای مقایسه تغییرات شرایط برای یک گاز استفاده کرد. اگر فشار و حجم اولیه یک گاز قبل از تغییر را به ترتیب با $$P_1$$ و $$T_1$$ نشان دهیم، رابطه ریاضی قانون بویل به شکل زیر خواهد بود:
$$P_1 \times V_1 = P_2 \times V_2$$
تاریخچه قانون بویل
این قانون را رابرت بویل در سال 1662 به چاپ رساند. او نشان داد که حجم هوای به دام افتاده توسط یک مایع در لولهای $$J$$ شکل، متناسب با فشار تولیدی در بخش بلند لوله، کاهش پیدا میکند. در حقیقت، هوای به دام افتاده رفتاری همچون فنر از خود نشان داد و نیرویی بر خلاف فشار اعمال شده بوجود آورد. بویل این پدیده را «فنر هوا» (Spring of The Air) نامید و نتایج خود را در یک مقاله به چاپ رساند. اختلاف ارتفاع بین دو ستون جیوهای برابر با 76 سانتیمتر بود که متناظر با 1 اتمسفر ذکر و حجم هوا به کمک طول ستون هوا و قطر لوله استوانهای محاسبه شد.
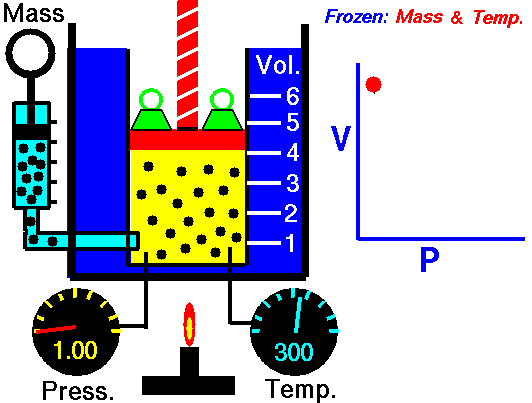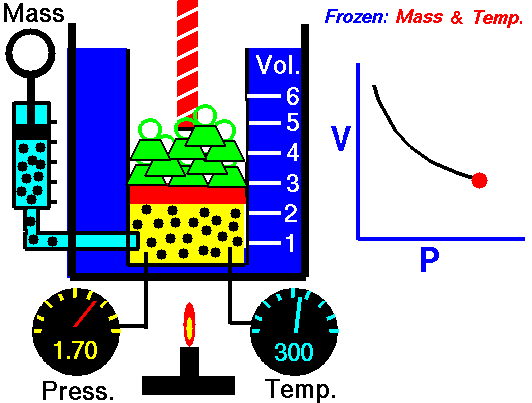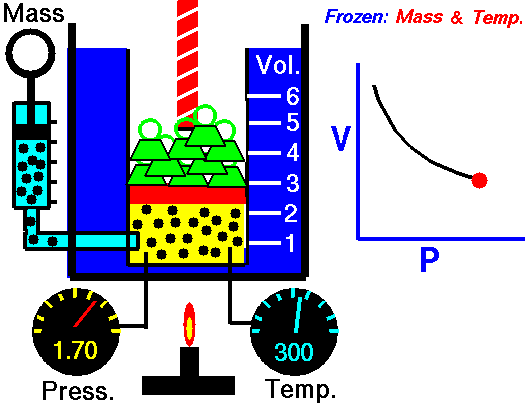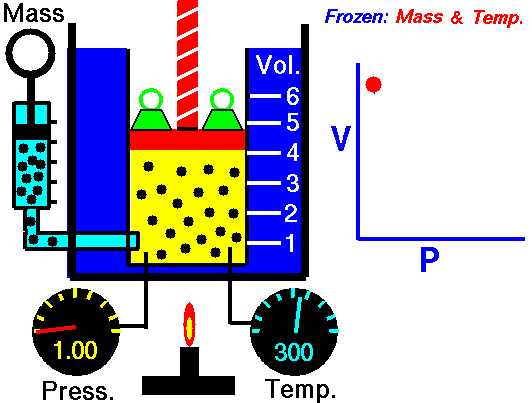
به یاد داشته باشید که این روابط تنها در زمانی قابل استفاده هستند که دما و تعداد مولکولها ثابت باشند.
رابطه بین نظریه سینتیک و گازهای ایدهآل
بیشتر گازها در دما و فشار معمول، رفتاری همانند یک گاز ایدهآل دارند. فناوری قرن هفدهم نتوانست شرایط آزمایش را برای دماهای بسیار کم یا فشارهای بسیار زیاد فراهم کند. در نتیجه، قانون بویل زمانی که به شکل یک مقاله علمی به چاپ رسید، هیچ انحرافی از خود نشان نداد. با پیشرفت فناوری، شرایط برای دماهای پایین و فشارهای بالا فراهم و انحرافهایی از رفتار گاز ایدهآل در این قانون دیده شد به طوریکه روابط بین فشار و حجم را میتوان تنها با نظریه گاز ایدهآل به طور دقیق توضیح داد. این انحراف از رفتار گاز ایدهآل با ضریبی به نام «ضریب تراکمپذیری» (Compressibility Factor) بیان میشود.
بویل و ماریوت به طور جداگانه این قانون را به کمک آزمایشهای مختلف بدست آوردند. قانون بویل را به طور نظری و بر اساس فرض حضور اتمها و مولکولها و فرضیاتی مبتنی بر حرکت و برخوردهای الاستیک که در نظریه جنبشی گازها آمده است هم میتوان بدست آورد. البته قبول این فرضیات در آن زمان توسط برخی دانشمندان امکانپذیر نبود. لازم به ذکر است که «دانیل برنولی» (Daniel Bernoulli) در خلال سالهای 1737 تا 1738، قانون بویل را با بکارگیری قوانین حرکت نیوتون در سطح مولکولی بدست آورد اما تا سال 1845 به آن توجهی نشد.
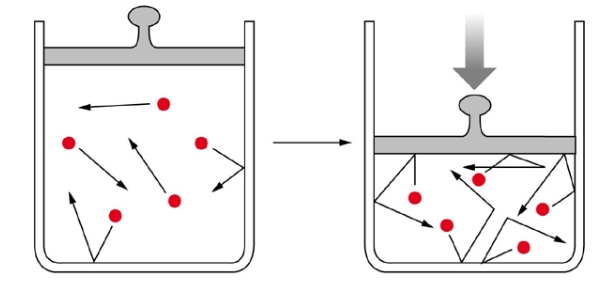
معادله قانون بویل
همانطور که در بالا هم اشاره شد، معادله قانون بویل بیان میکند که حاصلضرب مقدار فشار در حجم، عدد ثابتی است و به صورت رابطه زیر بیان میشود:
$$P V = k$$
قوانین بویل، شارل و «گیلوساک» (Gay-Lussac) سبب بوجود آمدن «قانون ترکیبی گازها» (Combined Gas Law) شد. سه قانون گفته شده به همراه اصل آووگادرو را میتوان به صورت تعمیم یافته تحت عنوان قانون گاز ایدهآل ارائه کرد.
مثال
نمونهای از گاز اکسیژن، حجمی برابر با $$425 ml$$ و فشاری معادل $$387 kPa$$ دارد. به این گاز فرصت میدهند تا حجم آن در یک پیستون تا $$1.75 L$$ افزایش پیدا کند. فشار جدید را بر اثر این افزایش حجم پیدا کنید.
حل
دادههای مساله:
$$\begin{array} { l } { P _ { 1 } = 387\ \mathrm { kPa } } \\ { V _ { 1 } = 425 \mathrm\ { mL } } \\ { V _ { 2 } = 1.75\ \mathrm { L } = 1750 \mathrm\ { mL } } \end{array}$$
برای حل از رابطه زیر استفاده میکنیم:
$$P_1 \times V_1 = P_2 \times V_2$$
با بازآرایی رابطه و حل آن برای $$P_2$$، به جواب میرسیم:
$$P _ { 2 } = \frac { 387 \mathrm { kPa } \times 425 \mathrm { mL } } { 1750 \mathrm { mL } } = 94.0 \mathrm { kPa }$$
توجه کنید که حجم در حدود ۴ برابر مقدار اولیه خود افزایش پیدا کرده و به همین ترتیب، فشار به یکچهارم مقدار اولیه رسیده است. به یاد داشته باشید که از هر واحد حجم و فشار میتوانید استفاده کنید به شرطی که تا آخر حل مساله، همان واحد را بکار بگیرید.
درک سیستم تنفس انسان با قانون بویل
از قانون بویل برای توضیح نحوه چگونگی عملکرد سیستم تنفسی انسان استفاده میشود. در حقیقت، به کمک قانون بویل میتوان توضیح داد که کاهش یا افزایش حجم در ریهها چگونه موجب افزایش یا کاهش فشار هوا در آنها میشود. این مورد، یک اختلاف فشار بین فشار هوای درون ریهها و فشار هوای محیط ایجاد میکند. این اختلاف فشار موجب حرکت هوا از ناحیه پرفشار به طرف ناحیه کمفشار و در نهایت انجام دم و بازدم خواهد بود.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شبیه سازی فرایندهای پالایشگاهی با Aspen HYSYS
- اصل لوشاتلیه — به زبان ساده
- سرعت واکنش — به زبان ساده
^^










