استرها – به زبان ساده
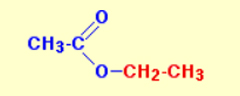
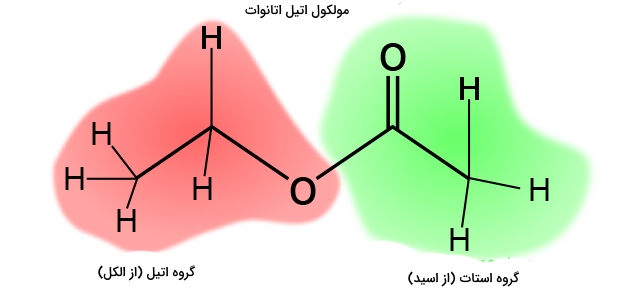
استرها مشتقاتی از کربوکسیلیک اسیدها هستند. یک کربوکسیلیک اسید شامل گروه عاملی است. در استرها به جای هیدروژنِ متصل به گروه عاملی کربوکسیل، یک گروه کربنی قرار دارد. این گروه کربنی میتواند یک گروه آلکیل، مانند متیل یا اتیل، یا شامل حلقه بنزنی، مانند فنیل باشد. معمولترین نوع استر، اتیل اتانوئات است و در این حالت، هیدروژنِ گروه با یک گروه اتیل جایگزین شده است. فرمول این استر را در تصویر زیر میبینید:
گلیسیریدها، که استرِ اسیدهای چرب گلیسرول هستند، نقش مهمی در بیولوژی ایفا میکنند. استرها با جرم مولکولی پایین معمولا در عطرها استفاده میشوند. فسفو استرها ساختار اصلی مولکول DNA را تشکیل میدهند. نیتراتهای استر، مانند نیتروگلیسیرین، خاصیتی انفجاری دارند در حالیکه پلی استرها بیشتر در مواد پلاستیکی یافت میشوند. استرها معمولا بویی شیرین دارند و حلالهایی قوی به حساب میآیند که در ساخت پلاستیکها، مواد براق کننده و رزینها کاربرد دارند.
چربیها و روغنها
چربیهای حیوانی و گیاهی، استرهای پیچیدهای هستند. تفاوت اصلی در میان «چربیها» (Fats) و «روغنها» (Oils) در نقطه ذوب استرهای آنها است. اگر نقطه ذوب کمتر از دمای اتاق باشد، ماده مورد نظر به حالت مایع قرار دارد و نام روغن به آن اطلاق میشود.
به عکس، اگر نقطه ذوب، بالاتر از دمای اتاق باشد، ماده در حالت جامد و موسوم به چربی است.

مقدمهای بر ساختار چربیها و روغنها
استرها از کربوکسیلیک اسیدها و الکلها بدست میآیند. در ترکیب این دو ماده، یک مولکول آب حذف و یک استر تشکیل میشود. در ابتدا با یک مثال ساده شروع میکنیم. در مثال زیر، اتیل اتانوات از واکنش اتانول و اتانوئیک اسید بوجود میآید.
در تصویر زیر، نوع نوشتار مولکول اتانول به طوری است که سبب تفهیم حذف مولکول آب و تولید محصول نهایی شود:
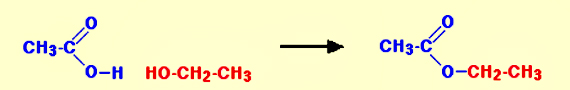
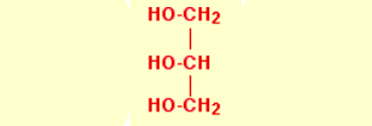
در مثال بعدی، یک الکل پیچیدهتر اضافه میکنیم که شامل بیش از یک گروه OH است. در زیر تصویر مولکول گلیسرول را مشاهده میکنید (نوع نمایش این مولکول نیز مانند تصویر قبل به گونهای نوشته شده که در ادامه، توضیح بهتری برای روند واکنش باشد):
در تهیه یک استر با اتانوییک اسید، میتوان سه گروه اتانوات به آن اضافه کرد:
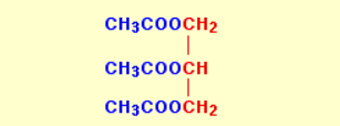
اگر این روش را به همین شکل ادامه دهیم و طول زنجیر کربنی را افزایش دهیم، مانند تصویر زیر، چربی خواهیم داشت:

اسید استفاده شده در تصویر بالا ، یک اسید چرب با نام استئاریک اسید است. این اسید در واکنش با الکل سبب تولید مادهای با نام گلیسرول تری استئارات میشود.
خواص فیزیکی استر ها
نقطه جوش استرها بسیار نزدیک به نقطه جوش آلدهیدها و کتونها با تعداد اتم کربن یکسان است. این مواد به دلیل داشتن مولکولهای قطبی، نیروهای دو قطبی دو قطبی و واندروالس را شامل میشوند. البته این ویژگیها عاملی نیست تا استرها در ترکیب خود پیوند هیدروژنی داشته باشند و به همین دلیل نقطه جوش پایینی نسبت به اسیدها با اتم کربن یکسان دارند.
| مولکلول | نوع | نقطه جوش (سانتیگراد) |
| استر | 77/1 | |
| کربوکسیلیک اسید | 164 |
انحلال پذیری استرها در آب
استرهای کوچک به خوبی در آب حل میشوند ولی هرقدر طول زنجیر کربنی افزایش یابد، میزان حلالیت آنها در آب کاهش پیدا میکند. دلیل انحلالپذیری استرها در این است که اگرچه این مولکولها نمیتوانند با یکدیگر پیوند هیدروژنی تشکیل دهند اما تشکیل این پیوند با مولکولهای آب امکانپذیر است. به همین منظور، یک اتم هیدروژن در مولکول آب، به خوبی به یکی از جفت اتمهای اکسیژن برای برقراری پیوند هیدروژنی جذب میشود. به این پیوند، نیروهای واندروالس و دوقطبی - دوقطبی را نیز اضافه کنید. این برهمکنشها سبب آزاد کردن انرژی میشود که برای جدا کردن مولکولهای استر و آب، قبل از مخلوط شدن کافی است.
با افزایش طول زنجیر کربنی، بخش هیدروکربنی استرها وارد عمل میشوند. با اعمال فشار در بین مولکولهای آب، این زنجیرهای کربنی، پیوندهای هیدروژنی مولکولهای آب را از بین میبرند اما جایگزین مناسبی برای آن ارائه نمیکنند. در نتیجه، انرژی لازم برای تشکیل پیوند با مولکولهای آب فراهم نمیشود که کاهش حلشوندگی در آب را به همراه دارد.

ساختار استرها
استرها به دلیل داشتن گروه عاملی کربونیل، زاویه پیوندی 120 درجه برای پیوندهای و دارند. بر خلاف آمیدها، استرها از لحاظ ساختاری، گروههای عاملی انعطافپذیری هستند. این انعطافپذیری و همچنین قطبیتِ کمِ مولکولهای آن، بیشتر در خواص فیزیکی نمود دارد که در نتیجه مولکلولهایی با استحکام کم - به همراه نقطه ذوب پایین - و فرارتر از آمیدهای منتاظر با خود هستند.
هیدروژنهای آلفا - هیدروژنهای متصل به گروه کربونیل - در حدود 25 است. این امر سبب میشود تا استرها تنها در حضور بازهای بسیار قوی، خاصیت اسیدی از خود نشان دهند.
شناسایی استرها
با توجه به اینکه این مواد فرار هستند، توسط کروماتوگرافی گازی به راحتی شناسایی میشوند. اسپکتروسکوپی اشعه فروسرخ برای استرها شامل یک پیک در دامنه 1730-1750 «بر سانتیمتر» که این پیک به گروه عاملی متصل به کربونیل وابسته است. به طور مثال، یک حلقه بنزنی یا یک پیوند دوگانه در همسایگی گروه کربونیل، این عدد را تا 30 بر سانتیمتر کاهش میدهد.
کاربرد استرها
این مواد در طبیعت به فور یافت میشوند و در صنعت بسیار کاربرد دارند. استرها عامل بوی میوههایی همچون سیب، گلابی، موز، آناناس و توتفرنگی هستند. سالانه میلیونها تن پلی استر در دنیا به طور صنعتی از استرها تولید میشود. همچنین به دلیل بوی این مواد، از آنها در عطرها و اسانسها استفاده میکنند. علاوه بر این، بسیاری از پلیمرها دارای پیوندهای استری هستند.

استریفیکاسیون
به طور کلی به واکنش یک الکل با اسید و تولید استر، «استری شدن» (Esterification) میگویند. در ابتدای متن توضیحاتی اجمالی در خصوص استری شدن ارائه شد اما در ادامه به تفضیل به این فرآیند خواهیم پرداخت:
استریفیکاسیون کربوکسیلیک اسید با الکلها
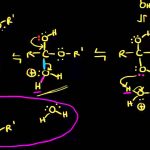
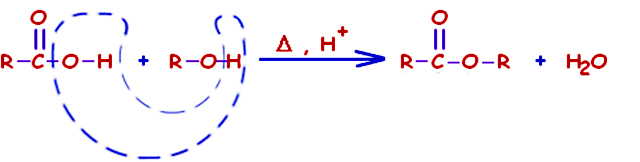
واکنش کلی در این فرآیند که به استریفیکاسیون فیشر معروف است، شامل واکنش کربوکسیلیک اسید با الکل و آبگیری (دهیدراته شدن) است.
$
ثابت تعادل برای این واکنش و در حضور استری همچون اتیل استات در حدود ۵ است. به طور معمول در این نوع واکنشها، از سولفوریک اسید به عنوان کاتالیزور بهره میگیرند. از آنجایی که این واکنش به شدت برگشتپذیر است، برای بهبود آن از اصل لوشاتلیه استفاده میشود که برای این دسته از واکنشها بصورت زیر توصیه شده است:
- الکل با مقادیر زیاد به عنوان حلال در نظر گرفته شود.
- از عوامل دهیدراته کننده استفاده شود. در این میان، سولفوریک اسید علاوه بر کاتالیز کردن واکنش، آب تولیدی را نیز از واکنش جدا میکند.
- با استفاده از ابزارهای فیزیکی همچون تقطیر، آب جداسازی شود.
روش دیگر برای دهیدراته کردن مخلوطها، استفاده از «واکنش میتسونبو» (Mitsunobu Reaction) است که در زیر آورده شده است:
$
در این واکنش از تری فنیل فسفین با فرمول استفاده میشود.
در مقیاس کم میتوان با استفاده از «دیآزو متان» (Diazomethane)، ترکیبات کربوکسیلیک اسیدها را به استر تبدیل کرد. استفاده از در مقیاس بزرگ، خطرناک و پرهزینه شناخته شده است:
$
استریفیکاسیون کربوکسیلیک اسیدها با اپوکسیدها
از این واکنش در تولید رزینِ وینیل استر استفاده میشود:
$
واکنش با آسیل کلرید و اسید انیدرید
الکلها در واکنش با آسیل کلریدها و اسید انیدریدها، استر تولید میکنند. در تصویر زیر این دو واکنش به ترتیب آورده شدهاند:
روش بالا در تولید آزمایشگاهی استرها کاربرد دارد و در مقیاس بیشتر، صرفه اقتصادی ندارد.
واکنش ترنس استریفیکاسیون
«واکنش ترنس استریفیکاسیون» (Transesterification) که به تبادل استری نیز معروف است، شامل تبدیل یک استر به استر دیگر است و در حضور اسید، کاتالیز میشود:
$
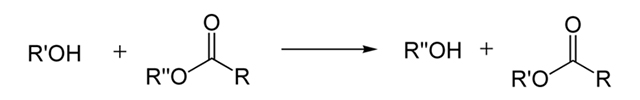
این واکنش در تولید اسیدهای چرب استری و الکلها بکار میرود. برای بیان سادهتر این واکنش، میتوان فرمول کلی زیر را در نظر گرفت:
استر نوع دیگر + الکل نوع دیگر استر + الکل
تصویر زیر در توضیح رابطه کلی بالا آورده شده است:
اضافه کردن کربوکسیلیک اسیدها به آلکنها و آلکینها
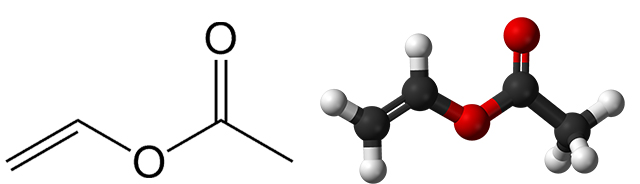
اتیلن، استیک اسید و اکسیژن در حضور کاتالیزگرها با پایه پالادیوم، با یکدیگر واکنش میدهند و تولید «وینیل استات» (Vinyl Acetate) میکنند:
$
واکنشها
استرها با ذرات هسته دوست در گروه کربونیل واکنش میدهند. کربونیل یک گروه الکتروندوست ضعیف است اما توسط آمینها، آلکوکسیدها، هیدریدها و ترکیبات اورگانولیتیومی مورد حمله قرار میگیرند. گروههای ذکر شده همگی هستهدوستهای قوی هستند. پیوندهای در همسایگی کربونیل، خاصیت اسیدی ضعیفی دارند و در واکنش با بازهای قوی، پروتون از دست میدهند. واکنش ذکر شده سبب بروز واکنشهای میعانی (تراکمی) میشود.
هیدرولیز و صابونسازی
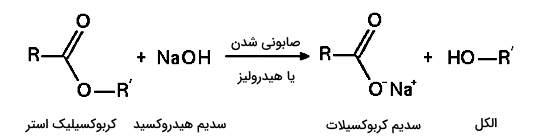
استری شدن یک واکنش برگشتپذیر است. استرها به کمک اسیدها و بازها در واکنشهای هیدرولیز شرکت میکنند. در حضور اسیدها، این واکنشها به عنوان واکنش برگشتی استریفیکاسیون فیشر عمل میکنند. در شرایط بازی، هیدروکسیدها به عنوان هسته دوست عمل میکنند و سبب خروج آلکوکسیدها میشوند. این واکنش که به «صابونی شدن» معروف است، فرآیند اصلی در صابونسازی است.
واکنشهای اکسایش و کاهش
استرها در مقایسه با آلدهیدها و کتونها در برابر کاهش مقاوماند. معرفی واکنشهای هیدروژنه کردن به کمک کاتالیزورها در اوایل قرن بیستم، سبب تولید الکلهای چرب از اسیدهای چرب استری شد:
$
در این واکنش معمولا از «کرومیت مس» به عنوان کاتالیزور استفاده میشود. در سنتزهای شیمیایی، لیتیوم آلومینیوم هیدرید به عنوان عامل کاهنده استرها و تبدیل به دو نوع الکل بکار میرود.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش زبان تخصصی مهندسی شیمی
- عدد اکسایش — به زبان ساده
- پلیمریزاسیون — به زبان ساده
^^













لطفا در مورد استر های صابونی شده کمی بیشتر توضیح بفرمائید واینکه چند مثال از تشکیل استر با الکل های مختلف و اسیدهای مختلف بیان بفرمائیدمتشکرم
واکنش استر سنگین با آب به چه صورت هست ؟
مطالب را خیلی خوب و ساده بیان می کنید.
موفق باشید
با سلام؛
خوشحالیم که مطالعه متلب برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
عالی اگر هم همراه با فیلم آموزشی باشه که خیلی خیلی بهتره
خسته هم نباشید
اگر مثل بقیه مقاله ها همراه با فیلم باشه خیلی میفید تره
ممنون از محتوای خوبتون
کل موضوع و واضح بیان کردنتان را دوست داشتم