هیدراتاسیون چیست؟ – در شیمی و به زبان ساده
هیدراتاسیون در شیمی به پیوستن مولکولهای آب به مولکول یک ماده دیگر گفته میشود. هیدراتاسیون با نامهای هیدراسیون، آبپوشی و تبلور نیز شناخته میشود. حلالپوشی نیز یکی از انواع هیدراتاسیون به شمار میرود. در نتیجه هیدراتاسیون ممکن است اسیدها، بازها یا ترکیبات آمفوتری به وجود بیاید. در این مطلب از مجله فرادرس توضیح میدهیم فرآیند هیدراتاسیون چیست و واکنشهای آن چگونه انجام میشوند.
- یاد خواهید گرفت هیدراتاسیون چیست و چگونه در شیمی رخ میدهد.
- خواهید آموخت هیدراتاسیون و هیدرولیز چه تفاوتهایی دارند.
- میآموزید سازوکارهای اصلی واکنش هیدراتاسیون و انواع آن چگونهاند.
- با روشهای عملی تعیین آب تبلور در هیدراتها آشنا میشوید.
- یاد میگیرید معیارهای علمی نامگذاری و فرمولنویسی هیدراتها چیست.
- خواهید توانست ساختار و ویژگیهای هیدراتهای آلی، معدنی و گازی را توضیح دهید.

در ابتدای این مطلب میآموزیم مفهوم هیدراتاسیون چیست و چه تفاوتی با هیدرولیز دارد. سپس واکنش هیدراسیون را بررسی کرده و انواع هیدراتاسیون مانند هیدراتاسیون مواد آلی و معدنی را بررسی میکنیم. همچنین، نامگذاری ترکیبات حاصل از هیدراتاسیون را توضیح داده و مفهوم عبارت آب هیدراتاسیون را میآموزیم. در ادامه، فرآیند هیدراتاسیون را در مقیاس مولکولی بررسی کرده و به توضیح محصول این فرآیند یعنی هیدراتها میپردازیم. در نهایت به بررسی مفهوم آنتالپی هیدراتاسیون و اهمیت این فرآیند میپردازیم. با مطالعه این مطلب تا انتها، میتوانید با این واکنش مهم و ویژگیهای آن آشنا شوید.
هیدراتاسیون چیست؟
هیدراتاسیون به فرآیند پیوستن مولکولهای آب به مولکول مواد دیگر گفته میشود. این فرآیند یکی از مهمترین فرآیندها در شیمی است که پایه و اساس سایر مباحث شیمی را تشکیل میدهد. به عکس فرآیند هیدراتاسیون، «دهیدراتاسیون» گفته میشود که در آن، مولکولهای آب به وسیله جذب گرما از محیط تبخیر شده و ساختار مولکول را ترک میکنند. به دهیدراتاسیون در شیمی، دهیدراته شدن نیز گفته میشود.
دلیل اهمیت این فرآیند این است که بسیاری از واکنشهای شیمیایی در حضور آب انجام میشوند. در نتیجه هیدراسیون ممکن است اسیدها، بازها یا ترکیبات آمفوتری تشکیل شوند. هیدراتاسیون زمانی امکانپذیر است که مولکولهای یک ماده که انرژی اضافی دارند در آب حضور داشته باشند. در این شرایط، آنها میتوانند بدون تخریب مولکول آب به آن متصل شوند.
با انجام فرآیند هیدراتاسیون، هیدراتها تشکیل میشوند. این مواد، بسته به تعداد مولکولهای آبی که به آنها متصل میشود، میتوانند خواص متفاوتی داشته باشند. برای مثال، فشار بخار آب، شکل شبکه بلوری و حلالیت این مواد بسته به تعداد مولکولهای آب متصل تغییر میکند.
یادگیری شیمی با فرادرس
در قسمت قبل آموختیم فرآیند هیدراتاسیون چیست. این فرآیند بسیار مهم، روش جذب آب توسط مولکولهای معدنی و آلی را بیان میکند. برای یادگیری این فرآیند باید ابتدا با مفاهیمی مانند ترکیب یونی، نیروهای بین مولکولی، پیوند کووالانسی و پیوند واندروالسی آشنا شوید. پیشنها میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس دبیرستان فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی دسترسی داشته باشید.
- فیلم آموزش شیمی ۱ پایه دهم فرادرس
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی ۲ پایه یازدهم رشته علوم تجربی و ریاضی و فیزیک فرادرس
تفاوت هیدراتاسیون و هیدرولیز چیست؟
در قسمت قبل آموختیم هیدراتاسیون چیست. تفاوت اصلی هیدراتاسیون و هیدرولیز این است که در هیدراتاسیون، مولکولهای آب تخریب و شکسته نمیشوند اما در هیدرولیز مولکول آب تجزیه میشود. در نتیجه فرآیند هیدراتاسیون، هیدراتهایی تشکیل میشوند که ترکیباتی با فرمول ثابت یا متغیر هستند.
در فرآیند هیدرولیز، بخش غیرآبی، به دو قسمت تقسیم میشود. برای تشخیص این واکنشها از یکدیگر باید به فرآوردههای واکنش دقت کنیم. در واکنشهای هیدراتاسیون، همراه فرآورده، مولکول آب به فرم جداگانه یا جزئی از مولکولهای ماده وجود خواهد داشت. برای مثال، اتانول که فرمول شیمیایی آن است، یکی از فرآوردههای واکنش هیدراتاسیون اتن است.
کریستال این هیدراتها اغلب از نوع نمک هستند و با استفاده از تعاملاتی مانند دوقطبی - دوقطبی، یون - دوقطبی، یا دهنده و گیرنده الکترون مشخص میشوند.
واکنش هیدراتاسیون
واکنش هیدراتاسیون نوعی واکنش شیمیایی است که در آن مولکول آب به عنوان یکی از واکنش دهندهها وارد واکنش میشود. یکی از رایجترین واکنشهای هیدراتاسیون، هیدراتاسیون آلکنها برای تولید الکلها است. برای مثال، اتن تحت واکنش هیدراتاسیون به اتانول تبدیل میشود.
در واقع تمامی واکنشهای هیدراتاسیون مواردی هستند که در آنها آب به ساختار یکی از ترکیبات اضافه میشود. یادگیری واکنشهای هیدراتاسیون اولین قدم در فهم این موضوع است که هیدراتاسیون چیست.
انواع هیدراتاسیون
دو روش برای انجام واکنش هیدراتاسیون وجود دارد که میتوان یکی را روش فیزیکی در نظر گرفت و دیگری را شیمیایی دانست. این روشها، اتصال با پیوند شیمیایی کووالانسی است که در مولکولهای آلی اتفاق میافتد و دیگری اتصال به وسیله پیوند بین مولکولی واندوالسی است که بیشتر در مواد معدنی اتفاق میافتد. در ادامه توضیح میدهیم هریک از انواع هیدراتاسیون چیست.
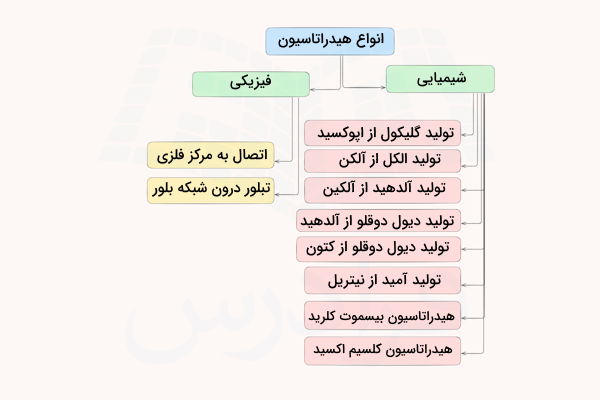
هیدراتاسیون فیزیکی
واکنش هیدراتاسیون فیزیکی واکنشی است که در آن مولکولهای آب به وسیله پیوندها و نیروهای واندروالسی یونها یا مولکولهای مواد را به دام میاندازند یا درون شبکه بلور آنها گیر میافتند. این روش هیدراتاسیون بیشتر در مولکولهای معدنی و نمکهای آبدار دیده میشود.
این روش هیدراتاسیون به وسیله اتصال به یک مرکز فلزی یا تبلور آب درون شبکه بلور انجام میشود. در ادامه توضیح میدهیم انواع هیدراتاسیون فیزیکی چیست.
اتصال به یک مرکز فلزی
این روش هیدراتاسیون را میتوان شیمیایی در نظر گرفت. در این روش مولکول آب به شکلی مستقیم به مرکز فلزی بلور متصل میشود. برای مثال نمک اپسوم (منیزیم سولفات) را در نظر بگیرید. ساختار این ترکیب بدون آب به شکل است.
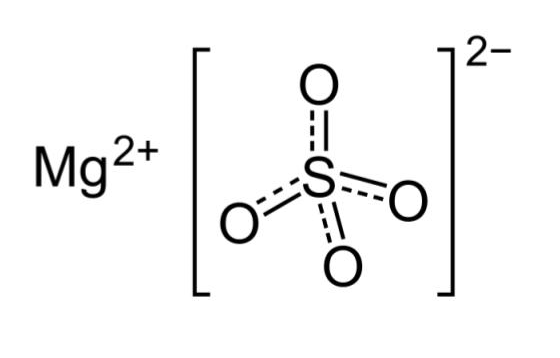
حال به شیوه اتصال مولکول آب به فلز شبکه بلور دقت کنید.
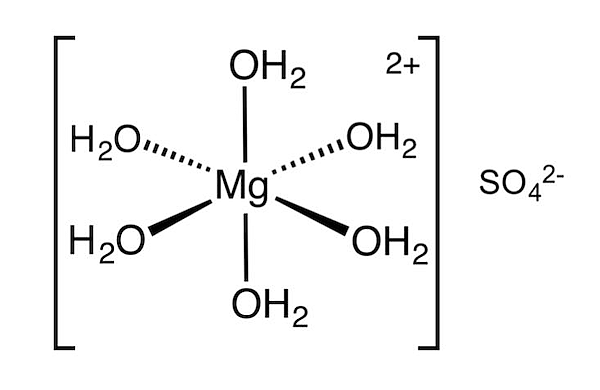
مشاهده میکنید که آب اطراف فلز مرکزی را احاطه کرده است. به جای اینکه در این ترکیب یون منیزیم و سولفات به هم متصل باشند، یک ترکیب از منیزیم و یون سولفات به صورت جداگانه قرار دارند.
تبلور آب درون شبکه بلور
این روش هیدراتاسیون با انجام یک پیوند هیدروژنی صورت میگیرد. در این روش به جای اینکه مولکول آب به مرکز فلزی متصل شود، به وسیله نیروهای بین مولکولی به اجزای سازنده ترکیب متصل میشود. در این روش، سر منفی آب که اتم اکسیژن است به موادی که بار جزئی یا کلی مثبت دارند متصل شده و سر مثبت مولکول آب که هیدروژن است به اتمهایی که بار جزئی یا کلی منفی دارند متصل میشود.
معمولا هیدراتهایی که آب درون شبکه کریستالی آنها قرار گرفته است، دارای مولکولهای آبی نیز هستند که مستقیما به مرکز فلزی متصل شدهاند. نمونهای از این نوع هیدرات، سولفات آهن هپتاهیدرات () است.
در این ساختار، شش مولکول آب به مرکز فلزی آهن متصل شدهاند. یک مولکول آب مستقیما به فلز متصل نیست و از طریق پیوند هیدروژنی به ترکیب کمپلکس فلزی و یون سولفات وصل شده است. به این نوع آب که مستقیما به مرکز فلزی وصل نیست و فقط از طریق نیروهای بین مولکولی در ساختار کریستالی قرار کرفته است، آب تبلور یا آب هیدراتاسیون گفته میشود. این ساختار در تصویر زیر مشخص شده است.
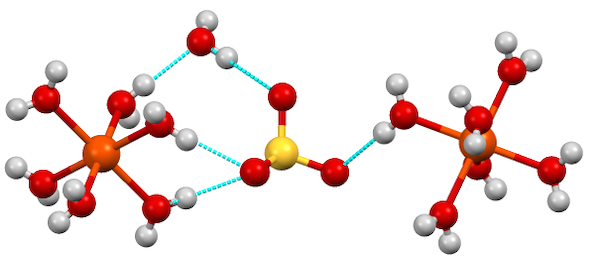
شش مولکول آب که با کرههای قرمز و سفید مشخص شدهاند، به اتم آهن که با رنگ نارنجی مشخص شده است متصل هستند. با این حال، یکی از مولکولهای آب به جای اتصال مستقیم به اتم فلزی، به سولفات و هیدروژن یکی دیگر از مولکولهای آب متصل است.
هیدراتاسیون شیمیایی
در شیمی آلی (شیمی هیدروکربنها) واکنش هیدراتاسیون به واکنشی گفته میشود که در آن، آب به مولکولهای آلی سیر نشده اضافه میشود. مولکولهای آلی سیر نشده مولکولهایی هستند که در آنها بین اتمهای کربن، پیوندهای دوگانه یا سهگانه وجود دارد. این واکنشها بر اساس نوع موادی که به یکدیگر تبدیل میشوند، دستهبندیهای مختلفی دارند. در ادامه میآموزیم دستهبندیها هیدراتاسیون شیمیایی چیست.
واکنش هیدراتاسیون اپوکسیدها
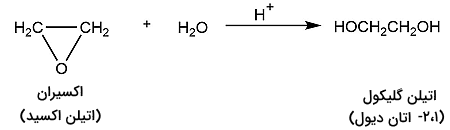
واکنش هیدراتاسیون اپوکسیدها واکنشی است که در آن یک ترکیب اپوکسید به گلیکول تبدیل میشود. سالانه، میلیونها تن از اتیلن گلیکول استفاده شده در صنایع مختلف به وسیله هیدراتاسیون مادهای به نام اکسیران تولید میشود. این ترکیب حلقوی با نام اتیلن اکسید نیز شناخته میشود.
این واکنش که در حضور کاتالسیت اسیدی انجام میشود به شکل زیر است.
هیدراتاسیون آلکن ها
از هیدراتاسیون آلکنها، میتوان ترکیبات الکلی تولید کرد. آلکنها ترکیباتی آلی با پیوند دوگانه بین برخی از اتمهای کربن هستند. فرمول شیمیایی کلی این ترکیبات به صورت است. در این واکنشها یک گروه عاملی هیدروکسیل (-OH) به اتم کربن با پیوند دوگانه متصل شده و یک یون هیدروژن نیز به اتم کربن دیگر پیوند دوگانه وصل میشود. این فرآیند به شدت گرماده است.
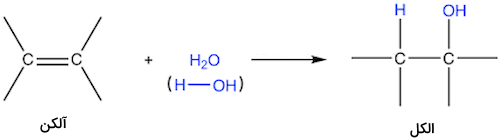
در قدم اول، مولکول آلکن به عنوان یک هسته دوست (نوکلئوفیل) عمل کردن و به یون هیدروژن حمله میکند. در قدم دوم، یک مولکول آب به اتم کربن دیگر متصل میشود. در این مرحله، اتم اکسیژن سه پیوند شیمیایی برقرار کرده و دارای بار مثبت است. سپس یک مولکول آب دیگر، یون هیدروژن را از این مولکول جدا کرده و واکنش کامل میشود. این واکنش ممکن است فرآوردههای جانبی بسیاری داشته باشد. برای مثال در تولید اتانول از این روش، دی اتیل اتر تولید میشود.
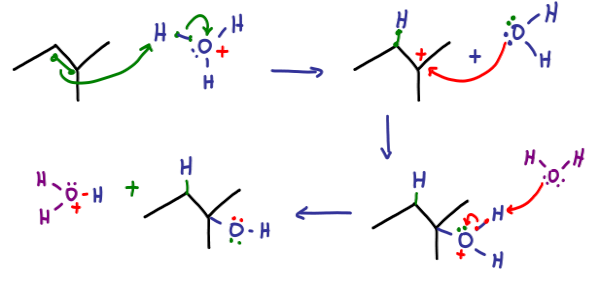
به همین علت انجام دادن این روش به شکلی مستقیم برای تولید الکلها به صرفه نیست و از موادی مانند سولفوریک اسید برای بهینه کردن این واکنش استفاده میشود. واکنش کلی این ترکیبات در حضور اسیدی قوی مانند سولفوریک اسید به شکل زیر است.
این واکنش بر اساس قائده مارکونیکف انجام میشود. یکی دیگر از مثالهای این نوع هیدراتاسیون، تولید ایزوپروپیل الکل از پروپن طبق واکنش زیر است.
هیدراتاسیون آلکینها
از واکنش هیدراتاسیون آلکینها موادی مانند آلدهیدها تولید میشود. برای مثال، از هیدراتاسیون استیلن (اتین)، ماده استالدهید تولید میشود. این واکنش که در حضور کاتالیست جیوه انجام میشود، به شکل زیر است.
تنها با افزایش یک مول آب به ترکیب یک آلکین در محیط اسیدی، دمای واکنش را ۳۳۳ کلوین بالا میبرد. از این واکنش، وینیل الکل به دست میآید. این وینیل الکل، سپس توتومری شده و ترکیبات کربونیلی مانند کتون یا آلدهید تولید میکند. کتونها زمانی تولید میشوند که مولکول آب به آلکینهای انتهایی اضافه شود. اما در صورت افزوده شدن مولکول آب به آلکینهای غیرانتهایی، آلدهید به وجود میآید.
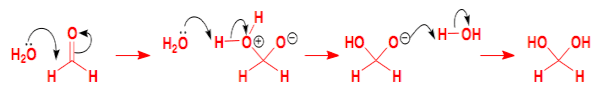
هیدراتاسیون آلدهیدها و کتونها
آلدهیدها و در برخی از مواد کتونها میتوانند تحت واکنشهای هیدراتاسیون، دیولهای دوقلو تولید کنند. این فرآیند به خصوص برای ماده فرمالدهید بسیار رایج است. در هیدراتاسیون فرمالدهید، دیهیدروکسی متان تولید میشود. این واکنش به شکل زیر انجام میشود.
نیتریلها
طی واکنش هیدراتاسیون نیتریلها، آمیدها تولید میشوند. این واکنش به شکل زیر است.
این واکنش در حضور کاتالیست انجامپذیر است. همچنین، آنزیمهایی برای تولید صنعتی آکریلآمید از استونیتریل طبق این روش استفاده میشود.
برخی از مواد معدنی نیز میتوانند به شکلی شیمیایی دچار واکنش هیدراتاسیون شوند. یکی از این مواد، آهک زنده (کلسیم اکسید) و دیگری بیسمون کلرید است. روش انجام این واکنشها را در ادامه توضیح میدهیم.
هیدراتاسیون بیسموت کلرید
افزایش آب به بیسموت کلرید یک واکنش شیمیایی است زیرا ترکیب بیسموت کلرید تغییر کرده و به بیسموت اکسیکلرید تبدیل میشود. این واکنش یک واکنش برگشت پذیر است و در حضور اسیدی مانند هیدروکلریک اسید میتواند محلول شفاف بیسموت کلرید تولید کند. معادله این واکنش به شکل زیر است.
هنگامی که آب با بیسموت کلرید در دمای زیر ۵۰ درجه سانتیگراد واکنش دهد، یک ماده واسطه به نام بیسموت کلرید مونو هیدرات با فرمول شیمیایی تشکیل میشود. تشکیل این ماده از نوع هیدراتاسیون فیزیکی و تشکیل بیسموت اکسی کلرید بدون آب یک واکنش هیدراتاسیون شیمیایی است.
هیدراتاسیون کلسیم اکسید
کلسیم اکسید که با نامه آهک زنده شناخته میشود و فرمول شیمیایی ان است میتواند طی واکنش هیدراتاسیون به کلسیم هیدروکسید (آهک مرده) تبدیل شود. معادله این واکنش به شکل زیر است.
نامگذاری ترکیبات هیدراتاسیون
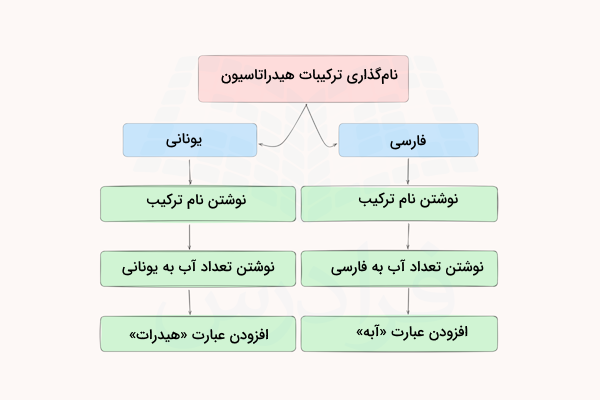
برای نامگذاری ترکیبات حاصل از هیدراتاسیون (هیدراتها) در سه مرحله ساده عمل میکنیم.
- نوشتن نام ترکیب
- افزودن پیوند بر اساس تعداد مولکول آب به زبان یونانی (مونو، دی، تری و ...)
- افزودن کلمه هیدرات
بر این اساس، نام ترکیب «سولفات مس پنتا هیدرات» و نام ترکیب «کبالت کلرید هگزا هیدرات» است. همچنین، میتوان به جای استفاده از کلمات یونانی و عبارت هیدرات، از عدد فارسی و کلمه «آبه» استفاده کرد. بدین ترتیب دو ترکیب ذکر شده «مس (II) سولفات ۵ آبه» و «کبالت (II) کلرید ۶ آبه» خواهند بود. نمودار زیر نشان میدهد روشهای نامگذاری محصولات هیدراتاسیون چیست.
هیدراتاسیون یونها
تا اینجا آموختیم هیدراتاسیون چیست و چه موادی تولید میکند. هنگامی که یک ترکیب یونی مانند سدیم کلرید در آب حل میشود، یونهای سدیم و کلر تحت فرآیند هیدراتاسیون قرار میگیرند. در این فرآیند، هر یون به شکلی جداکانه توسط مولکولهای آب احاطه میشود.
این فرآیند به دلیل قطبی بودن مولکولهای آب انجام میشود. اتم اکسیژن در مولکول آب دارای بار جزئی منفی و اتمهای هیدروژن دارای بار جزئی مثبت هستند. بدین ترتیب، سر اکسیژن مولکولهای آب به وسیله جاذبه الکترواستاتیکی به سمت یون سدیم نمک جذب میشود. به همین ترتیب، سر هیدروژنی و مثبت مولکول آب نیز توسط یونهای منفی کلر جذب میشوند.
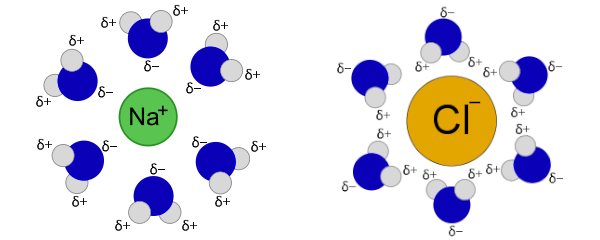
در این فرآیند، هر یون توسط چندین مولکول آب احاطه میشود و ساختاری کروی شکل را تشکیل میدهد که باعث انحلال ترکیب یونی در آب میشود. در شیمی، به این ساختار، پوسته هیدراتاسیون یا کره هیدراتاسیون گفته میشود.
آب هیدراتاسیون چیست؟
در ساختار بلور بسیاری از انواع نمکها، آب در نسبت مشخصی با نمک وجود دارد. به تعداد مولکولهای موجود در ساختار نمک، آب هیدراتاسیون یا آب تبلور گفته میشود.
برخی از نمکهای آب دوست هستند و رطوبت را از محیط اطراف خود به درون بلورها جذب میکنند. برای مثال، کلسیم کلرید خشک در شرایط معمولی ۶ مولکول آب را جذب میکند. در شیمی به این نوع ترکیبات آبدار گفته میشود. برای معرفی کردن اینکونه نمکها، اصطلاح آبدار یا x آبه (که x تعداد مولکولهای آب است) استفاده میشود. برای مثال به ترکیب ذکر شده، کلسیم کلرید آبدار یا کلسیم کلرید ۶ آبه گفته میشود.
به دست آوردن آب هیدراتاسیون به روش تجربی
هیدراتها با حرارت دیدن، آب هیدراتاسیون (آب تبلور) خود را از دست میدهند. با از دست دادن آب هیدراتاسیون، این ترکیبات جرم مشخصی را از دست میدهند که مربوط به مولکولهای آب از دست رفته است. یکی از روشهای تعیین اینکه محصول هیدراتاسیون چیست، اندازهگیری اختلاف جرم نمونه قبل و بعد حرارت دادن است.
میتوان از این اختلاف جرم با استفاده از جرم مولی ترکیب و جرم مولی آب، تعداد مولکولهای آب هیدراتاسیون موجود در ترکیبات را به دست آورد. برای رسیدن به جرم ماده خشک و بدون آب، فرآیند حرارت دادن باید چندین مرتبه تکرار شود. روش انجام این مراحل را با مثالی توضیح میدهیم.
مثال
مقادیر زیر با استفاده از حرارت دادن یک نمونه آبدار آلومینیویم نیترات با فرمول شیمیایی به دست آمده است.
- جرم ظرف تبخیر: ۵۲٫۶۷ گرم
- جرم ظرف تبخیر + نمک آبدار: ۵۶٫۴۲ گرم
- جرم ظرف تبخیر پس از حرارت دادن: ۵۴٫۸۰ گرم
فرمول مولکولی این ترکیب حاصل از هیدراتاسیون چیست؟ جرم مولی آلومینیوم نیترات خشک برابر با ۲۱۳ گرم بر مول و جرم مولی آب برابر با ۱۸ گرم بر مول است.
پاسخ
برای به دست وردن فرمول مولکولی این ترکیب، باید جرم نمک بدون آب و جرم آب از دست رفته را از مقادیر داده شده به دست آوریم. سپس این مقادیر را بر جر مولی این ترکیبات تقسیم کنیم.
جرم نمک بدون آب از تفریق مقادیر ظرف تبخیر خالی و پس از حرارت دادن به دست میآید. جرم آب از دست رفته با تفریق مقادیر ظرف حاوی نمک آبدار و ظرف پس از حرارت داده به دست میآید. پس خواهیم داشت:
۲٫۱۳= ۵۲٫۶۷ - ۵۴٫۸۰ = جرم نمک بدون آب
۱٫۶۲ = ۵۴٫۸۰ - ۵۶٫۴۲ = جرم آب از دست رفته
سپس این مقادیر را بر جرم مولی آنها تقسیم میکنیم تا مقدار مول آنها به دست آید.
۰٫۰۱ = ۲۱۳ ÷ ۲٫۱۳ = مول آلومینیوم نیترات خشک
۰٫۰۹ = ۱۸ ÷ ۱٫۶۲ = مول آب
سپس باید این مقادیر را بر مول به دست آمده کوچکتر یعنی (۰٬۰۱) تقسیم کنیم تا مقادیر نسبت این مواد به دست آید. تعداد مول آب ۹ برابر مول آلومینیم نیترات است پس n برابر با ۹ است و این مولکول آلومینیوم نیترات نونا هیدرات است.
بسیاری از واکنشهای مربوط به هیدراتها و واکنش هیدراتاسیون، به وسیله خواص ترکیبات یونی، بلور شناسی آنها، شکل ایزومری ترکیبات کمپلکس و ... توجیه میشود. پیشنهاد میکنیم برای آشنایی بیشتر با این خواص و مباحث و درک بهتر اینکه هیدراتاسیون چیست، فیلم آموزش «شیمی معدنی ۲» فرادرس که لینک آن در ادامه آمده است را مشاهده کنید.
هیدراتاسیون در مقیاس مولکولی
از برهمکنش مولکولهای حل شونده و حلال، یک محلول به وجود میآید. رایجترین حلال بین تمامی حلالهای موجود، آب است. با انتخاب آب به عنوان حلال، ذرات حل شونده دچار فرآیند هیدراتاسیون میشود. برای درک بهتر اینکه برهمکنشهای مربوط به فرآیند هیدراتاسیون در مقیاس مولکولی چیست، به مثال زیر دقت کنید.
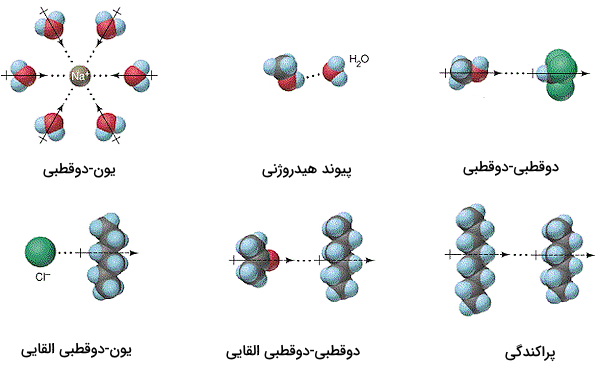
برای مثال، برهمکنش بین مولکولهای آب و یون سدیم در تصویر زیر نمایش داده شده است. این برهمکنش از نوع برهمکنش بین مولکولی یون - دوقطبی است. یونها در مقیاس مولکولی از تمامی جهات در فضای سهبعدی با مولکولهای آب برهمکنش دارند. همچنین، در این تصویر، برهمکنش دوقطبی - دو قطبی، یون - دوقطبی القایی و دوقطبی - دوقطبی القایی و پیوند هیدروژنی نیز نمایش داده شده است. در صورت عدم وجود این برهمکنشها، فرآیند انحلال به وسیله پراکندگی اتفاق میافتد.
هیدرات چیست؟
هیدرات در شیمی به مولکولی گفته میشود که درون ساختار خود مولکول آب دارد. آب موجود در این ترکیبات بهعنوان آبِ آبپوشی یا آبِ تبلور شناخته میشود. در واقع، بررسی هیدراتها به درک بهتر اینکه هیدراتاسیون چیست، کمک میکند.
آب، رایجترین مادهی شیمیایی روی زمین، بهصورت بخار آب در جو یافت میشود. برخی ترکیبات هنگام قرار گرفتن در معرض آب موجود در جو، میتوانند بهطور برگشتپذیر آن را روی سطح خود جذب کرده یا درون ساختار خود جای دهند. در این حالت، آب معمولا با کاتیون در ترکیبات یونی پیوند برقرار میکند.
هیدراتها معمولا دارای مقدار استوکیومتری از آب هستند. این بدان معناست که بهجای داشتن مقدار ناچیزی از آب، مقدار آب موجود در آنها بهقدری قابل توجه است که با مقدار دیگر عناصر موجود در ترکیب مقایسهپذیر است. آب خواص بسیار جالبی دارد و به همین دلیل است که از آن به عنوان حلال بسیاری از محلولها استفاده میشود. از این ویژگیها میتوان به ظرفیت گرمایی و کشش سطحی اشاره کرد. پیشنهاد میکنیم برای یادگیری بیشتر درباره آب و خواص آن، مطلب «آب در شیمی» مجله فرادرس که لینک آن در ادامه آورده شده است را مطالعه کنید.
فرمول هیدرات ها
فرمول کلی هیدراتها به شکل فرمول کلی ترکیب بدون آب به همراه تعداد مولکول آب است که به شکل زیر نوشته میشود.
در این فرمول AB نشان دهنده فرمول خشک (بدون آب) ترکیب است و (n) تعداد مولکولهای آب را نشان میدهد. برای به دست آوردن این فرمول برای نمکها، باید تعداد مولکول آب را با استفاده از آزمایش تبخیر و کاهش جرم به دست آوریم. با محاسبه جرم آب از دست رفته و جرم مولی آب و ترکیب بدون آب، میتوان نسبت مولی آب را به مولکول بدون آب به دست آورد. برای مثال، فرمول زیر نشان دهنده فرمول مولکولی منیزیم سولفات ۷ آبه است. این بدین معنی است که به ازای هر مول منیزم سولفات، ۷ مول آب وجود دارد.
مثال هیدراتها
برخی از مواد معدنی ابپوشیده (هیدراته) در ادامه به همراه فرمول مولکول آنها معرفی شدهاند.
- ژیپس
- بوراکس
- نمک اپسوم
- سدیم بیکربنات ۱۰ آبه
- سولفات مس
- کلرید کبالت

ویژگی هیدراتها
هیدراتها دارای تعداد مشخصی از مولکول آب با نسبت استوکیومتری مشخص نسبت به تعداد مولکول خشک ماده هستند. فرمول شیمیایی این مواد شامل جزء بی آب به همراه تعداد مشخصی از مولکول آب است. نام این ترکیبات میتواند به دو صورت بیان شود. یکی از این روشها نام ترکیب به همراه تعداد مولکول آب و عبارت «آبه» و روش دیگر نام ترکیب به همراه تعداد مولکول آب به یونانی و کلمه «هیدرات» است.
معمولا میتوان با گرم کردن یک هیدرات، آب تبلور آن را حذف کرد. ترکیب بیآب باقیمانده پس از جذب گرما، ساختار و بافت متفاوتی نسبت به هیدرات اولیه خواهد داشت و ممکن است رنگ آن نیز تغییر کند. برای مثال سولفات مس (II) بدون آب () که به رنگ سفید مایل به خاکستری است، در اثر جذب پنج مولکول آب به سولفات مس (II) پنتاهیدرات () تبدیل میشود که به رنگ آبی روشن دیده میشود. با بررسی این خواص میتوانیم بفهمیم اثر فرآیند هیدراتاسیون روی مواد چیست.

ویژگی های ترکیبات بی آب حاصل از هیدرات ها
تا اینجا اموختیم هیدراتاسیون چیست و به ترکیبات حاصل از این فرآیند هیدرات میگویند. همانطور که در قسمت قبل توضیح دادیم، برخی از ترکیبات آبدار را میتوان با حرارت دادن به حالت بدون آب تبدیل کرد. این مواد ویژگیهای عمومی خاصی دارند که در ادامه توضیح داده میشود. از این ویژگیها میتوان به بازگشتپذیری رنگ و انحلالپذیری بالا اشاره کرد.
انحلالپذیری بالا در آب
ترکیبات بیآب معمولا بهراحتی در آب حل میشوند. برای مثال، انحلالپذیری سولفات مس خشک در آب در دمای اتاق، برابر با ۲۰۱ گرم در هر لیتر است.
بازگشت رنگ در محلول
در قسمت قبل اشاره کردیم که رنگ پودر سولفات مس (II) ۵ آبه آبی رنگ است و رنگ سولفات مس خشک، سفید است. ممکن است با حرارت دادن به این نوع هیدراتها رنگ آنها تغییر کند. اما در صورت حل کردن دوباره این مواد در آب، دوباره رنگ هیدرات آنها پدیدار میشود.

پایداری در دمای اتاق
بیشتر هیدراتها در شرایط معمول پایدار هستند، اما برخی در شرایط خاص آب خود را از دست میدهند. با شناخت بهتر این ویژگیها و آزمایش آنها میتوانیم بفهمیم محصول هیدراتاسیون چیست.
پدیده های مرتبط با از دست دادن یا جذب آب
افلورسانس (Efflorescence)
وقتی فشار بخار آب در هیدرات از فشار بخار هوا بیشتر باشد، ترکیب آب خود را از دست داده و به فرم بیآب تبدیل میشود.
هیگروسکوپی (Hygroscopicity)
برخی ترکیبات آب را از هوا جذب میکنند. بهعنوان مثال، و بیآب اغلب برای خشککردن مایعات و گازها به کار میروند. این مواد به دسیکانت (Desiccant) یا نمگیر معروفاند.
دلیکوئسانس (Deliquescence)
برخی مواد مانند جامد چنان مقدار زیادی آب از هوا جذب میکنند که در آن حل شده و به محلول تبدیل میشوند. در آزمایشگاهها اگر درب ظرف سدیم هیدروکساید مدت زیادی باز بماند یا ظرف آن دارای نشتی باشد، به شکل کلوخههای سنگی تبدیل میشود.
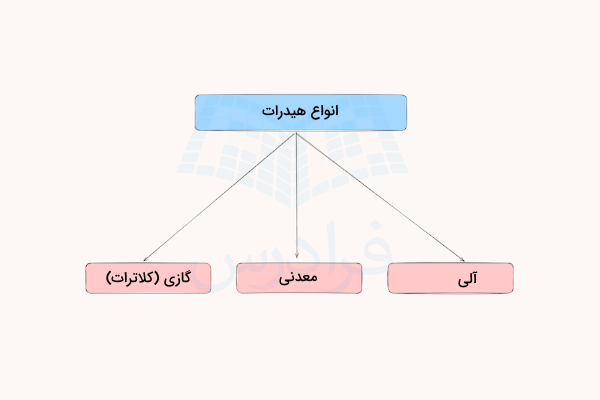
انواع هیدرات ها
به طور کلی، میتوان هیدراتها را به سه دسته هیدرات آلی، هیدرات معدنی و هیدرات گازی (کلاترات) تقسیم کرد. در ادامه هریک از این مواد را توضیح میدهیم.
هیدرات معدنی
هیدراتهای معدنی ترکیبات یونی هستند که درون ساختار خوب آب دارند. مولکول آب در این مواد میتواند به شکلی مستقیم به یون فلزی متصل شود یا درون ساختار بلوری به دام بیافتد. آب این ترکیبات با حرارت دادن بخار میشود و ماده بدون آب خشک باقی خواهد ماند. این بدین دلیل است که مولکولهای آب تنها با نیروهای بین مولکولی به ترکیبات یونی معدنی متصل هستند.
هیدرات آلی
هیدراتهای آلی با فرآیندهای هیدراتاسیون آلی (هیدراسیون) تشکیل میشوند. این ترکیبات به وسیله پیوند شیمیایی مولکولهای آب با کربنهای موجود در این ترکیبات تشکیل میشوند و این فرآیند یک واکنش شیمیایی به شمار میآید. با این وجود، برخی از هیدراتهای آلی نیز مانند هیدراتها معدنی میتوانند بدون تغییر مولکول اصلی بدون آب تشکیل شوند.
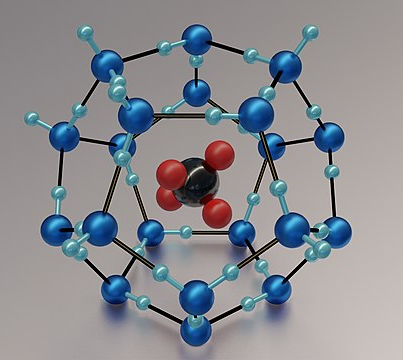
هیدرات گازی (کلاترات)
در هیدراتهای گازی، مولکول گاز که معمولا متان است، بین مولکولهای آب به دام میافتد. این ساختار مانند قفسی از مولکولهای آب (که به آن پذیرنده یا میزبان نیز گفته میشود) اطراف مولکول گاز را میگیرد. تصویر زیر نشاندهنده یک ساختار شبیهسازی شده از متان هیدرات است.
آنتالپی هیدراتاسیون چیست؟
آنتالپی آبپوشی، ، مقدار گرمای آزاد شده هنگام حل شدن یک مول از یون در مقدار زیادی آب برای تشکیل یک محلول رقیق است. واکنش شیمیایی کلی به شکل زیر است.
$$M^{z+}_{(g)} + mH_2O \rightarrow M^{z+}_{(aq)} \label{1}$$
در این واکنش نشاندهنده یونهایی هستند که توسط مولکولهای آب احاطه شدهاند. انرژی هیدراتاسیون تقریبی برخی از یونها در جدول زیر نمایش داده شده است.
| یون | آنتالپی هیدراتاسیون (کیلوژول بر مول) |
| ۴۰۶- | |
| ۱۱۳۰- | |
| ۱۹۲۱- | |
| ۴۶۶۵- | |
| ۵۰۵- | |
| ۴۴۳۰- | |
| ۳۶۳- |
با توجه به جدول بالا، میتوانیم میزان آنتالپی هیدراتاسیون سدیم کلرید را تخمین بزنیم. انرژی هیدراتاسیون یک تریب یونی از دو قسمت جدا نشدنی تشکیل شده است. اولین قسمت، انرژی آزاد شده حاصل از فرآیند تشکیل ترکیبات کئوردیناسی حلال و یونها است. این انرژی با نام انرژی لیگاند پوشی شناخته میشود. فرآیند مربوط به این انرژی به شکل زیر نشان داده میشود.
قسمت دوم انرژی هیدراتاسیون مربوط به پراکنده شدن یونهای آزاد یا یونهای هیدراته شده در حلال است. این انرژی با نام انرژی پراکندگی شناخته میشود. واکنش مربوط به این فرآیند به شکل زیر نمایش داده میشود.
در نهایت، انرژی آنتالپی هیدراتاسیون متشکل از جمع این دو مقدار انرژی است.
یادگیری شیمی عمومی با فرادرس
در این مطلب آموختیم فرآیند هیدراتاسیون چیست و چه انواعی دارد. از انجام فرایند هیدراتاسیون، محصولی به نام هیدرات تشکیل میشود. هیدراتها یکی از مهمترین ترکیباتی هستند که در شیمی آلی و معدنی بررسی میشوند و در صنعت از آنها استفاده گستردهای میشود. برای یادگیری ویژگیها و خواص این مواد باید با مواردی مانند ترکیبات کئوردیناسی، عدد کئوردیناسیون، ساختار بلوری مواد و ... آشنا شد. پیشنهاد می کنیم برای یادگیری این مسائل و مفاهیم، به مجموعه فیلم آموزش شیمی فرادرس از دروس کاربردی تا دانشگاهی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.

همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه شیمی معدنی و آلی دسترسی داشته باشید.
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
- فیلم آموزش شیمی آلی فلزی فرادرس
- فیلم آموزش شیمی معدنی ۱ فرادرس
اهمیت هیدراتاسیون
فرآیند هیدراتاسیون اهمیت بسیار زیادی در واکنشهای شیمیایی دارد. این اهمیت به دلیل این است که بسیاری از واکنشهای شیمیایی در حلال آب انجام میشوند یا اینکه آب به عنوان یکی از مواد در واکنش وجود دارد. فرآیند هیدراتاسیون برای تولید بسیاری از مواد از جمله اسیدها، الکلها، آلدهیدها و ... به کار میرود.
یکی از مهم ترین فرآیندهای هیدراتاسیون در صنعت، هیدراتاسیون بتن یا سیمان است. در این حوزه، هیدراتاسیون به فرآیند ترکیب مولکلولهای این مواد با آب و تولید موادی مانند کلسیم سیلیکات هیدراتها است. این واکنشها در صنعت ساختمان سازی بسیار با اهمیت هستند.
همچنین، فرآیند هیدراتاسیون و دهیدراتاسیون در بدن انسان نیز انجام میگیرد. فرآیندهای متابولیکی بدن به کمک این فرآیندها انجام میگیرد. سلولهای ارکانیسمها به شکلی متناوب آب را جذب و دفع میکند. همچنین، آب در بدن انسان با بسیاری از مواد موجود در بدن، پیوند برقرار میکند. برخی از مهمترین فعالیتهای بدن در بستر آب و با انجام واکنشهای هیدراتاسیون انجام میشود. برای مثال، انتقال مواد غذایی و اکسیژن از این قبیل واکنشها هستند. در ادامه این مطلب از مجله فرادرس برخی از ترکیبات هیدرات به همراه کاربرد آنها معرفی شدهاند.
نمک اپسوم
نمک اپسوم به ساختار مولکول منیزیم سولفات هپتا هیدرات با فرمول مولکولی گفته میشود. این ترکیب برای بهبود عضلات آسیب دیده، یا به عنوان نمک حمام استفاده میشود. این ترکیب باعث پایین آوردن فشار خون سیستولیک میشود. همچنین، نمک اپسوم برای افزایش رشد گیاهان به خاک اضافه میشود.

سودای شست و شو
سودای شستن و شو همان سدیم بیکربنات ۱۰ آبه با فرمول شیمیایی است. در فارسی به ترکیب سدیم بیکربنات جوش شیرین گفته میشود. این ترکیب یکی از ابتداییترین ترکیبات صابون است و همچنان از این ترکیب در مواد شوینده استفاده میشود. این ماده افلورسنت است و در دمای اتاق، برخی از مولکولهای آب خود را از دست میدهد.

بوراکس
بوراکس ترکیب «سدیم تترابورات ۱۰ آبه» با فرمول شیمیایی () است. از این ترکیب در بسیاری از مواد شوینده و تمیزکننده، مواد آرایشی، لعاب مینا و ضدآتشها استفاده میشود.

سولفات مس (II)
سولفات مس (II) پنج آبه، ترکیبی با فرمول شیمیایی است. هنگامی که سولفات مس با آب ترکیب میشود، رنگ آن از سفید به آبی تغییر میکند. از این تغییر رنگ مولکول طی فرآیند هیدراتاسیون، در تولید رنگها برای نقاشی و سفالگری استفاده میشود. همچنین از این ترکیب در قارچکشها و علفکشها استفاده میشود.
کلرید کبالت (II)
کلرید کبالت (II) شش آبه ترکیبی با فرمول شیمیایی است. این ترکیب در فرآیند آبدار شدن رنگی بنفش به خود میگیرد در صورتی که مولکول بدون آب آن رنگ آبی روشن دارد. از کاغذهای حاوی کبالت کلرید آبدار برای سنجش رطوبت محیطها و وسایل استفاده میشود.













