فشار اسمزی – به زبان ساده
فشار اسمزی به عنوان یکی از خواص کولیگاتیو محلولها به شمار میآید که به هنگام استفاده از غشای نیمهتراوا میتوان آنرا مشاهده کرد. این غشا، مانعی با حفرات کوچک است که اجازه عبور مولکولهای حلال را میدهد اما مولکولهای حلشونده نمیتوانند از آن عبور کنند. جریان خالص عبوری از یک غشای نیمهتراوا را «اسمز» (Osmosis) مینامند و ریشهای یونانی به معنای فشار (هل دادن) دارد. جهت جریان حلال، همواره از محلی با غلظت کمتر حلشونده به طرف محلی با غلظت بیشتر است. در این آموزش در خصوص فشار اسمزی بحث و موارد مختلف در این زمینه را مرور میکنیم.

فشار اسمزی چیست ؟
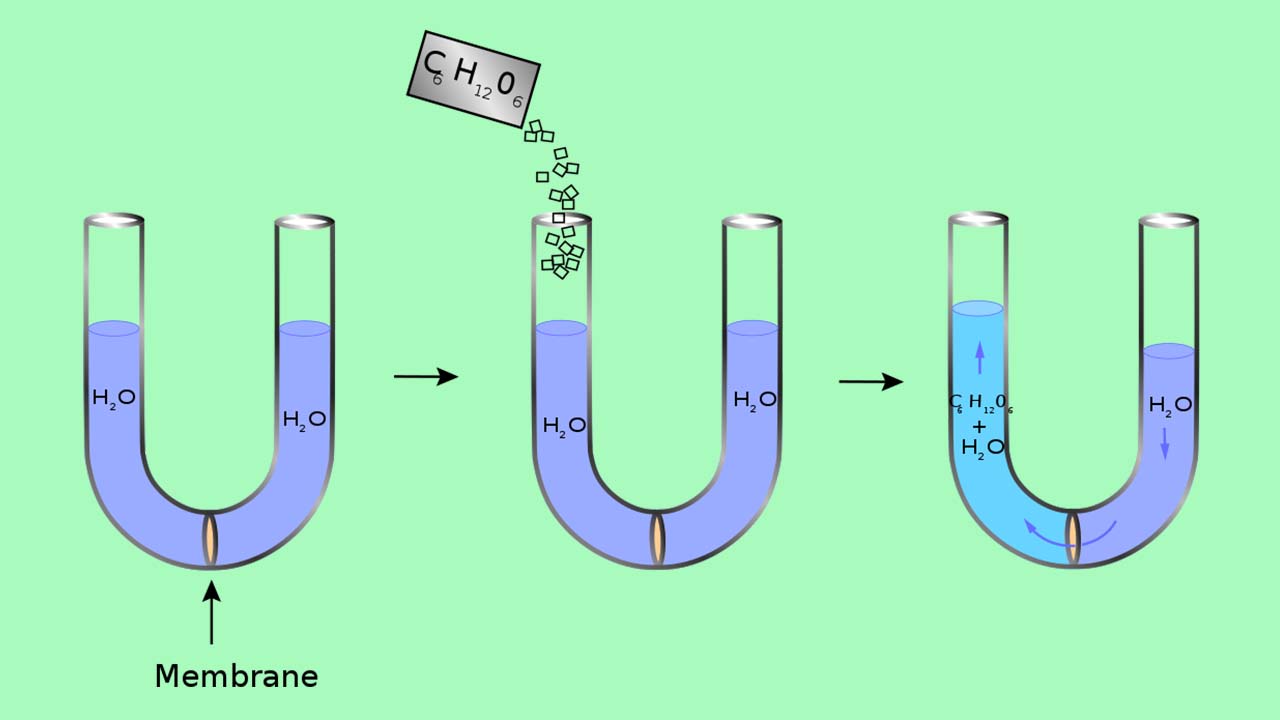
پدیده اسمز را میتوان به کمک یک لوله U شکل همچون تصویر زیر نشان داد. در این تصویر، سمت چپ لوله شامل آب خالص است و در سمت راست، محلول رقیق گلوکوز وجود دارد. جریان خالص آب از میان غشا تا زمانی ادامه مییابد که تغییر ارتفاع مایع بین دو طرف، متوقف شود و این امر یعنی سیستم به حالت تعادل رسیده است.
فشار اسمزی محلول گلوگز در حقیقت، اختلاف فشار بین دو طرف لوله یعنی ارتفاع بین دو طرف لوله است. با وجود اینکه غشا نیمهتراوا اجازه میدهد تا مولکولهای آب در هر دو جهت حرکت داشته باشند، اما نرخ جریان در هر دو طرف یکسان نخواهد بود زیرا غلظت آب در هر دو طرف لوله با یکدیگر برابر نیست. برای متوقف کردن جریان آب باید به طرف راست لوله، فشاری به اندازه فشار اسمزی اعمال کرد.
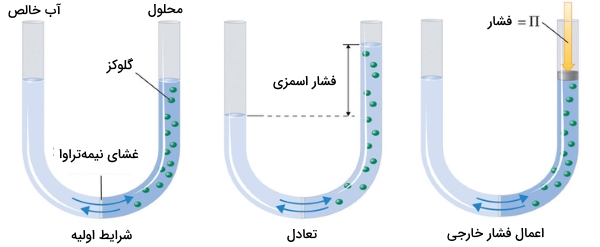
فشار اسمزی محلولها به غلظت ذرات حلشونده ارتباط دارد. رابطه این فشار مشابه با رابطه مربوط به قانون گازهای ایدهآل است.
در رابطه بالا:
- «M»: تعداد مولهای حلشونده به ازای حجم محلول (مولاریته محلول)
- «R»: ثابت گازهای ایدهآل
- «T»: دمای مطلق
مثال فشار اسمزی محلول
زمانی که برخی از مخمرها درون یک محلول غلیظ نمکی قرار بگیرند، برای مقابله با فشار اسمزی محیط اطراف، مقادیر زیادی گلیسرول با غلظت بالا تولید میکنند. فرض کنید سلولهای مخمر را درون محلولی آبی حاوی ۴ درصد جرمی قرار دادهایم و چگالی محلول در دمای 25 درجه سانتیگراد، است.
- فشار اسمزی این محلول را در دمای ۲۵ درجه محاسبه کنید.
- اگر فشار اسمزی معمول در درون یک سلول مخمر، ۷/۳ اتمسفر و متناظر با غلظت کل اجزای حل شده (0/3 مولار) باشد، به طور دقیق، سلولهای مخمر چه میزان باید گلیسرول سنتز کنند تا با فشار اسمزی خارجی در دمای ۲۵ درجه سانتیگراد برابر شود.
برای حل این سوال، استراتژی زیر را در نظر می گیریم.
در ابتدا مولاریته محلول را به کمک جرم فرمولی حلشونده و چگالی محلول، محاسبه میکنیم. سپس، غلظت کلی ذرات حلشده محاسبه خواهد شد. در ادامه، با استفاده از رابطه بالا، فشار اسمزی محلول را محاسبه میکنیم. در نهایت، برای محاسبه فشار اضافی مورد نیاز برای موازنه فشارها، فشار اسمزی معمول سلول را از فشار اسمزی محلول نمکی کم میکنیم. در انتها، با استفاده از رابطه بالا، مولاریته گلیسرول مورد نیاز برای ایجاد فشار اسمزی قابل محاسبه خواهد بود.
با توجه به اطالاعات داده شده، به حل این سوال خواهیم پرداخت.
محلول نمکی حاوی ۴ گرم نمک در هر ۱۰۰ گرم از محلول است. به کمک جرم فرمولی NaCl یعنی و چگالی محلول ، مولاریته را محاسبه میکنیم.
$$\begin{align} \require {cancel} M_{NaCl} &=\dfrac{moles\; NaCl}{\text{liter solution}} \nonumber \\[4pt] &=\left(\dfrac{4.0 \; \cancel{g} \;NaCl}{58.44\; \cancel{g}/mol\; NaCl}\right)\left(\dfrac{1}{100\; \cancel{g \;solution}}\right)\left(\dfrac{1.02\; \cancel{g\; solution}}{1.00\; \cancel{mL}\; solution}\right)\left(\dfrac{1000\; \cancel{mL}}{1\; L}\right) \nonumber \\[4pt] &= 0.70\; M\; NaCl \nonumber \end{align} \nonumber$$
از آنجایی که ۱ مول نمک، ۲ مول ذره در محلول تولید میکند، غلظت کلی ذرات حلشده در محلول برابر خواهد بود با:
حال با استفاده از اعداد بدست آمده میتوانیم فشار اسمزی محلول را محاسبه کنیم:
اگر قرار باشد فشار داخل سلولهای مخمر به طور دقیق با فشار اسمزی خارجی برابر باشند، باید تعداد گلیسرول کافی برای ایجاد فشار اضافی تولید کنند. بنابراین، مولاریته گلیسرول به صورت زیر محاسبه خواهد شد:
در حل این سوال همچنین میتوانستیم این مورد را در نظر بگیریم که تنها راهی که فشار اسمزی در درون سلول با محلول برابر باشد این است که غلظت ذرات حلشده یکی باشد. در صورت سوال، غلظت معمول ذرات حلشده در سلول داده شده و برابر با ۰/3 مولار است. همچنین محاسبه کردیم که غلظت NaCl در محلول برابر با ۱/4 مولار خواهد بود. بنابراین، سلولهای مخمر باید غلظت ذرات حلشده را از ۰/3 مولار به 1/4 مولار برسانند که برابر با 1/1 مولار گلیسرول است.
رابطه حاکم بر فشار اسمزی
«ژاکوب وانت هوف» (Jacobus van 't Hoff) رابطهای کمی بین فشار اسمزی و غلظت حلشونده پیدا کرد که به صورت زیر ارائه شد:
در این رابطه که شکل سادهتر آنرا پیشتر ارائه دادیم، «» ضریب بدون بعد وانتهوف و «» غلظت مولار است. از این رابطه زمانی استفاده میشود که غلظت حلشونده بسیار پایین باشد و بتوان محلول را به صورت محلول ایدهآل در نظر گرفت. دیدیم که این رابطه، بسیار مشابه رابطه مربوط به گازهای ایدهآل است. دو دانشمند به نامهای «مورس» (Morse) و «فریزر» (Frazer) نشان دادند که اگر این رابطه را برای محلولهایی با غلظت بیشتر استفاده کنیم باید از غلظت مولال به جای مولار بهره بگیریم. به همین دلیل، زمانیکه از مولالیته در رابطه بالا کمک بگیریم، در حقیقت از «رابطه مورس» (Morse Equation) استفاده کردهایم.
برای محلولهای غلیظتر، رابطه وانتهوف را میتوان به صورت یک سری توانی توسعه داد که تخمین اول آن به صورت زیر خواهد بود:
در این رابطه ، فشار ایدهآل و A پارامتر تجربی خواهد بود. از پارامترهای تجربی میتوان بمنظور تعیین کمی محلولها با حلشوندههای یونی و غیریونی استفاده کرد که در ترمودینامیک، محلول ایدهآل به شمار نمیآیند.

اثبات رابطه وانت هوف
سیستمی را در حالت تعادل در نظر بگیرید. در این شرایط، پتانسیل شیمیایی حلال در هر دو طرف با یکدیگر برابر است. بخش شامل حلال خالص دارای پتانسیل شیمیایی است که در اینجا به عنوان نماد فشار در نظر گرفته میشود. در بخش دیگر، در بخش حاوی حلشونده، پتانسیل شیمیایی به کسر مولی حلال $$({\displaystyle 0<x_{v}<1})$$
در اینجا، اختلاف بین دو فشار را به عنوان فشار اسمزی اعمال شده توسط حلشونده تعریف میکنیم. در این فشار، افزایش حلشونده، پتانسیل شیمیایی را کاهش میدهد. بنابراین، فشار محلول جهت غلبه بر این کاهش پتانسیل باید افزایش پیدا کند. برای یافتن یا همان فشار اسمزی باید حالت تعادل بین آب خالص و محلول در نظر بگیریم:
سمت چپ رابطه بالا را میتوانیم به شکل زیر بنویسیم که در آن، ، ضریب اکتیویته حلال است. همچنین، عبارت را به عنوان اکتیویته حلال میشناسند که اگر آب باشد با نشان داده میشود.
رابطه بالا را میتوان به صورت رابطهای برای انبساط انرژی و به صورت زیر نوشت که در این رابطه، ، حجم مولی است.
با وارد کردن رابطه بالا در رابطه مربوط به پتانسیل شیمیایی و بازآرایی آن، به رابطه زیر میرسیم:
اگر مایع، تراکمپذیر نباشد، حجم مولی ثابت است و جواب انتگرال به صورت خواهد بود. در نتیجه، خواهیم داشت:
ضریب اکتیویته، تابعی از غلظت و دما است اما در محلولهای رقیق، این عدد را ۱ در نظر میگیرند. بنابراین، رابطه بالا به صورت زیر ساده میشود:
کسر مولی حلشونده برابر با خواهد بود. بنابراین میتوان معادل آن را در رابطه بالا قرار داد و زمانی که عدد کوچکی باشد، میتوان آنرا به صورت نوشت تا به رابطه زیر دست پیدا کنیم.
کسر مولی را میتوان به شکل نوشت که اگر مقدار آن کوچک باشد به صورت نوشته میشود. همچنین، حجم مولی را نیز میتوان به شکل نوشت. در نهایت، رابطه فشار اسمزی به صورت زیر نوشته خواهد شد.
البته همانطور که در مثال حل شده بالا هم بیان شده است، برای محلولهای نمکی، باید تفکیک را در نظر گرفت یعنی به طور مثال، ۱ مول به ۲ مول یون تفکیک میشود.
فشار اسمزی در بیوشیمی
به دلیل مقادیر زیاد فشار اسمزی، این پدیده در بیوشیمی، بیولوژی و پزشکی نیز اهمیت بسیاری دارد. تقریبا هر مانعی که یک ارگانیسم یا سلول را از محیط خود جدا کند، رفتاری همچون غشای نیمهتراوا خواهد داشت و اجازه عبور جریان آب را بدون حلشونده میدهد.
فشاری اسمزی در کلیه
همین امر نیز در خصوص اجزای داخل یک ارگانیسم یا سلول وجود دارد. برخی از بافتها (موانع) موجود در بدن مانند کلیهها، تخلخل بیشتری دارند و از روشی مشابه به نام دیالیز بهره میگیرند که سبب میشود آب و مولکولهای کوچکتر از میان آنها عبور کنند اما مولکولهای بزرگتر مانند پروتئینها توانایی عبور نداشته باشند.
از همین قاعده نیز برای حفظ میوهها و ویتامینهای ضروری آنها در طول زمستان استفاده شده است. غلظتهای بالایی از شکر را در مرباها و ژلهها نه تنها برای طعم شیرین آنها بلکه برای افزایش فشار اسمزی بکار میگیرند. بنابراین، هر نوع باکتری که در طول زمان پخت، کشته نشده باشد، از این طریق، آبگیری (دهیدراته) خواهد شد که در نتیجه، از تکثیر و رشد آنها در محیط، جلوگیری میشود.
روشی مشابه نیز به کمک نمکسود کردن انواع گوشتها مانند گوشت ماهی، مرغ و همچنین جلوگیری از فساد فرآوردههای پروتئینی مانند سوسیس و کالباس مورد استفاده قرار میگیرد. تاثیر فشار اسمزی به خوبی در تصویر زیر نشان داده شده است. این تصویر، نحوه تغییر گلبولهای قرمز خون را به هنگام قرارگیری در محیطی با غلظت بسیار کمتر یا بیشتر از فشار اسمزی درونی آن نشان میدهد.
در تصویر سمت چپ، گلبول قرمز در محلول رقیق نمک نشان داده شده که فشار اسمزی در بیرون و داخل گلبول، یکسان است. زمانی که همین گلبول قرمز در آب مقطر قرار بگیرد (تصویر میانی) که فشار اسمزی آن کمتر از فشار داخل سلول است، نرخ جریان آب به درون گلبول بیشتر از نرخ جریان به خارج از آن خواهد بود و با تورم گلبول، در نهایت متلاشی خواهد شد. در تصویر سمت راست، گلبول قرمز در محیط نمکی غلیظ قرار دارد که فشار اسمزی آن بیشتر از فشار داخل گلبول است. در این حالت، نرخ جریان آب از خارج سلول به داخل آن بیشتر خواهد بود. در این حالت، سلول خشک و عملکرد آن مختل خواهد شد.

فشار اسمزی در گیاهان
علاوه بر مویینگی، درختان از فشار اسمزی نیز برای انتقال آب و سایر مواد مغذی از ریشه به ساقهها و شاخهها خود بهره میگیرند. تبخیر آب از برگ گیاه سبب افزایش غلظت نمک در برگها خواهد شد و این کار یک فشار اسمزی ایجاد میکند که در اثر آن، آب از ریشه به برگها منتقل خواهد شد.
اسمز معکوس
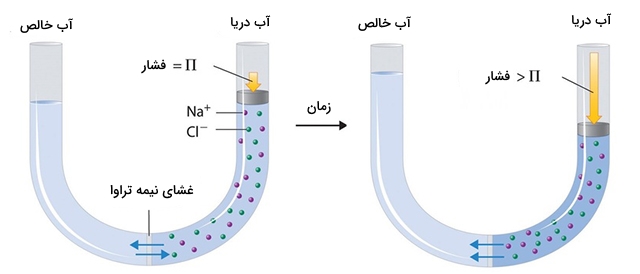
از فرآیندی به نام اسمز معکوس برای تولید آب خالص از آب شور دریا استفاده میشود. همانطور که در تصویر زیر نشان داده شده است، اعمال فشار بالا به آب دریا سبب جریان یافتن مولکولهای آب از طریق غشایی نیمهتراوا خواهد شد که این غشا، آب خالص را از آب شور جدا میکند. در اثر عبور آب، ذرات حلشونده نمک در پشت غشا باقی میمانند.
تاسیسات عظیمی وجود دارند که از این طریق، آب شور دریاها را به آب تصفیه شده و قابل مصرف تبدیل میکنند. همچنین، دستگاههای کوچک و قابل حملی ساخته شدهاند که میتوانند به کمک اسمز معکوس در هر ساعت حدود ۵ لیتر آب شیرین تولید کنند و این مقدار آب برای زندگی ۲۵ نفر کافی خواهد بود.
تفاوت فشار اسمزی و فشار هیدرواستاتیک
فشار اسمزی به فشاری میگویند که باید به یک حلال خالص وارد شود تا از عبور آن به محلول دیگر - از طریق غشا نیمهتراوا - جلوگیری شود. اما فشار هیدرواستاتیک به فشار اعمال شده توسط ستون سیالی میگویند که به دلیل نیروی گرانش، به نقطهای مشخص وارد میکند. در تصویر زیر، فشار هیدرواستاتیک در تمامی ظرفها به یک میزان و مستقل از شکل ظرف است.

فشار اسمزی کلوئیدی
کلوئید، واژهای است که به ذرات با وزن مولکولی بالا اطلاق میشود که در محلول وجود دارند. به طور مثال، در یک پلاسما، پروتئینهای پلاسما، کلوئید به شمار میآیند. کلوئیدها نیز میتوانند عامل ایجاد فشار اسمزی باشند. به این نوع فشار ایجاد شده، «فشار اسمزی کلوئیدی» (Colloid Osmotic Pressure) یا در برخی موارد «Oncotic Pressure» میگویند. در پلاسما، فشار اسمزی کلوئیدی تنها 0/5 درصد کل فشار اسمزی است.













ممنون خیلی مفید بود
فقط از غشا و نوع آن چیزی نگفتید
آیا تاثیری در فشار اسمزی ندارد؟
با سلام؛
اسمز در غشاهای نیمهتراوا دیده میشود. اندازه منافذ غشای نیمهتراوا میتواند بسته به اندازه مولکول حلشونده متفاوت باشد. برای اینکه فشار اسمزی دیده شود باید اندازه منافذ غشا به حدی باشد که مولکولهای حلال از آن عبور کنند اما مولکولهای حلشونده در یک سمت غشا به دام بیافتند. اگر اندازه منافذ غشا بزرگتر از اندازه مولکولهای حلشونده باشد، به سمت دیگر غشا انتشار مییابد و فشار اسمزی دیده نمیشود.
با تشکر از همراهی شما با مجله فرادرس