تیتراسیون – به زبان ساده
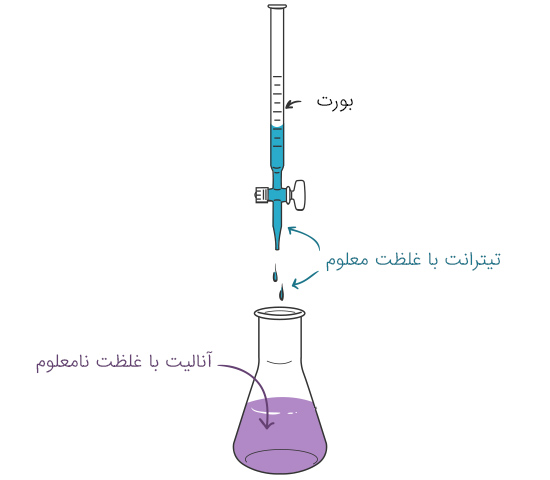
عمل تیتراسیون به تعیین غلظت یک آنالیت میگویند. از آنجایی که در تیتراسیون، اندازهگیری حجم بسیار مهم است، به این روش آنالیز حجمی نیز میگویند. روشهای مختلفی برای تیتراسیون وجود دارد. تیتراسیون اسید-باز و «ردوکس» (Redox) از روشهای معمول تیتراسیون است. در تیتراسیون، محلول استاندارد تیترانت، از یک بورت، به یک آنالیت با غلظت نامعلوم، اضافه میشود. معمولا در تیتراسیون اسید-باز، برای تعیین نقطه پایانی تیتراسیون، به محلول آنالیت یک آشکارساز pH اضافه میشود. در مواردی، به جای استفاده از آشکارساز، از pHسنج استفاده میکنند. با این روش، نقطه پایانی از نمودار تیتراسیون تعیین میشود. از حجم تیترانت در انتهای فرآیند برای محاسبه غلظت آنالیت استفاده میشود. این محاسبات بر اساس استوکیومتری واکنش است.
مراحل تیتراسیون
در این بخش بعد از چند تعریف کوتاه،به نحوه آمادهسازی این فرآیند میپردازیم.
تیترانت و آنالیت
محلولی است با غلظت معلوم که برای تعیین غلظت آنالیت به آن اضافه میشود. نامهای دیگر تیترانت، محلول استاندارد، تیتراتور و «معرف» (Reagent) است. در مقابل، آنالیت یک محلول با غلظت نامعلوم است که برای تعیین غلظت آن از واکنش بین آنالیت و تیترانت استفاده میشود.
آمادهسازی
این فرآیند از یک حجم دقیق آنالیت که در ارلن ریخته شده آغاز میشود. یک آشکارساز (مانند فنولفتالئین) در زیر بورت، استفاده میشود. تا زمانی که رنگ آشکارساز تغییر نکند، تیترانت را به آنالیت اضافه میکنیم. لحظه تغییر رنگ آشکارساز، نقطه پایانی تیتراسیون است. ذکر این نکته ضروری است که اضافه کردن تنها یک قطره بیشتر ممکن است سبب اشتباه در محاسبات شود. در حقیقت در مرحله نهایی باید یک تغییر رنگ ثابت داشته باشیم. زمانی که این فرآیند به نقطه پایانی خود رسید، حجم ماده شرکتکننده در واکنش اندازهگیری میشود. از این حجم برای اندازهگیری غلظت آنالیت استفاده میشود. رابطه آن به صورت زیر است:
- : غلظت آنالیت
- : غلظت تیترانت (به مولاریته)
- : حجم تیترانت استفاده شده (به لیتر)
- : نسبت مولی آنالیت و واکنشدهنده در فرمول شیمیایی
- : حجم آنالیت استفاده شده (به لیتر)

شرایط تیتراسیون
تیترانت و آنالیت باید به صورت محلول باشند. به طور معمول جامدات را در یک محلول آبی حل میکنند. آنالیتهای غلیظ برای افزایش دقت فرآیند، رقیق میشوند.
بسیاری از تیتراسیونهای غیر اسید و باز به یک pH ثابت در طول واکنش نیاز دارند. برای این کار از یک «محلول بافر» (Buffer Solution) در محفظه تیترانت استفاده میشود. اگر در شرایطی، به جای آنالیت، واکنشدهنده دیگری هم در واکنش شرکت کند، از یک «محلول پوشاننده» (Masking Solution) استفاده میشود. این محلول به عنوان یک پوشش برای واکنش «یون ناخواسته» (Unwanted Ion) عمل میکند. در واکنشهای ردوکس، برای افزایش سرعت واکنش، محلول واکنشدهنده حین فرآیند گرم میشود.

نمودار تیتراسیون
اگر حجم تیترانت اضافه شده روی محور x و غلظت آنالیت در آن لحظه را روی محور y نمایش دهیم، نمودار تیتراسیون بدست میآید (در تیتراسیون اسید-باز، محور y، نمودار pH است). همچنین در این فرآیند، نمودار نشاندهنده قدرت اسید و باز است. اگر تغییرات نمودار شدید نباشد و در نقطه تعادل (نقطه همارزی یا اکیوالان)، شیب تند داشته باشد، اسید یا باز قوی داریم. در این حالت، اضافه کردن تیترانت سبب تغییر چشمگیر pH در نمودار میشود. در نتیجه میتوان از انواع آشکارسازها مثل فنولفتالئین یا کاغذ لیتموس استفاده کرد.
در حالتی که یکی از مواد، اسید یا باز قوی باشد و دیگری ضعیف، با اضافه کردن تیترانت، تغییرات pH در نزدیکی نقطه تعادل شدید نیست. نمودار تیتراسیون بین اسید و باز ضعیف، شکل منظمی ندارد. به همین دلیل در این واکنش از pHسنج در اندازهگیری استفاده میشود.
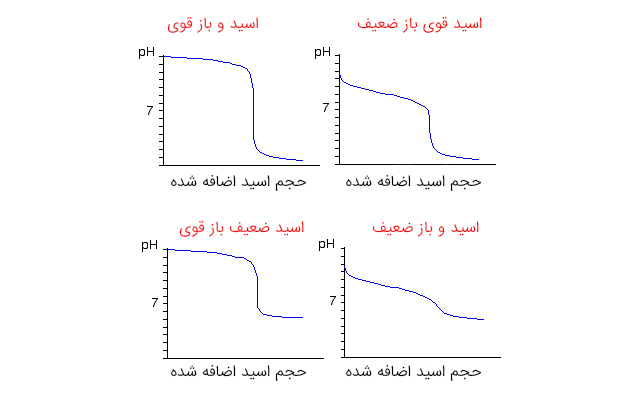
انواع تیتراسیون
همانطور که اشاره شد در علم شیمی انواع تیتراسیون مختلفی وجود ندارد که از معروفترین آنها، اسید-باز و ردوکس است.
تیتراسیون اسید باز
این فرآیند به خنثی شدن بین اسید و باز در محلول بستگی دارد. علاوه بر این، برای نمایش دامنه تغییرات pH، یک آشکارساز به محفظه تیترانت اضافه میشود. این آشکارساز با تغییر رنگ خود، نقطه پایانی فرآیند را مشخص میکند. ذکر این نکته ضروری است که نقطه پایانی با نقطه تعادل متفاوت است. نقطه تعادل از استوکیومتری در محلول واکنش تعیین میشود در حالیکه نقطه پایانی، تنها یک تغییر رنگ آشکارساز است. از اینرو، با انتخاب مناسب آشکارساز، میتوان خطای فرآیند را کاهش داد. در شرایطی که اسید و باز ضعیف داریم یا نتایج دقیق مورد نیاز است، از pHسنج استفاده میشود.
تیتراسیون ردوکس
این فرآیند بر پایه واکنشهای اکسایش-کاهش بنا شده است. زمانی که یکی از اجزای واکنش اکسایشی، «پتاسیم دی کرومات» () باشد، از یک پتانسیومتر یا آشکارساز ردوکس برای نقطه پایانی استفاده میشود. از اینرو، چون تغییر رنگ محلول از نارنجی به سبز مشخص نیست از آشکارساز سدیم دی فنیلآمین استفاده میشود.

در برخی موارد به علت رنگ اجزای تیتراسیون، نیازی به استفاده از آشکارساز نیست. به عنوان مثال، در فرآیند «منگانومتری» (Permanganometry)، آشکار شدن کمی رنگ بنفش کافی است تا به نقطه پایانی برسیم.
در یدومتری با غلظتهای بالا، از بین رفتن رنگ قرمز-قهوهای «تری یودید» () به عنوان نقطه پایانی در نظر گرفته میشود. در غلظتهای پایین نیز، از نشاسته که در واکنش با تری یودید، به رنگ آبی در میآید استفاده میشود.
نقطه تعادل و نقطه پایانی
نقطه تعادل و نقطه پایانی به طور معمول به جای یکدیگر استفاده میشوند اما ماهیتی جدا دارند. نقطه پایانی، یک مفهوم تئوری برای پایان تیتراسیون است. در حقیقت این مفهوم، حجمی از تیترانت است که با اضافه کردن آن، تعداد مول تیترانت با تعداد مول آنالیت برابر میشود. نقطه تعادل، آن چیزی است که در عمل اندازهگیری شده است. این نقطه با یک تغییر فیزیکی در محلول شناسایی میشود. این تغییر توسط آشکارساز یا دیگر ابزارها مشخص میشود.

تیتراسیون برگشتی
تیتراسیون برگشتی یا وارونه همانطور که از نامش پیداست به طور عکس انجام میشود. مقادیر مشخصی از یک «معرف» (Reagent) استاندارد به محلول اضافه میشود و این معرف تیتر میشود. زمانی از این روش استفاده میشود که پیدا کردن نقطه پایانی، به نسبت روش اصلی، سادهتر باشد. همچنین زمانی که واکنش بین تیترانت و آنالیت سریع نباشد یا آنالیت، جامد حلّال ناپذیر باشد از این روش استفاده میشود.
کاربردهای عملی تیتراسیون
در این قسمت به برخی از کاربردهای عملی تیتراسیون اشاره میکنیم.
تیتراسیون اسید باز
یکی از مواردی که در تیتراسیون اسید و باز استفاده میشود در تهیه سوختهای زیستی است. به عنوان مثال در تهیه بیودیزل از روغنهای مایع مصرفی استفاده میشود. این روغنها بعد از استفاده، حالت اسیدی دارند. کافی است میزان اسیدی بودن بخشی از این روغن توسط تیتراسیون اندازهگیری شود تا بتوان حجم زیادی را از حالت اسیدی به خنثی تبدیل کرد. این فرآیند شامل حذف اسیدهای چرب آزاد از روغن است.

تیتراسیون ردوکس
برای تعیین غلظت اکسیژن در آب از تیتراسیون ردوکس و روش وینکلر استفاده میشود. «سولفات منگنز» ()، با «پتاسیم یدید» () واکنش میدهد و تولید ید میکند. تا زمانی که اکسیژن در آب وجود داشته باشد، ید تولید میشود. در نتیجه با تیتراسیون ردوکس میتوان به غلظت اکسیژن در آب پی برد.


جمعبندی
در این آموزش به بررسی تیتراسیون پرداختیم و دو نوع فرآیند ردوکس و اسید-باز را بررسی کردیم. آموختیم هرگاه نیاز به تعیین غلظت یا اسیدی بودن یک محلول باشد، میتوان از تیتراسیون استفاده کرد. نمودارهای تیتراسیون را شناختیم و یاد گرفتیم که چطور از نوع نمودار به قدرت اسید و باز در فرآیند پی ببریم. آشکارسازها در هر فرآیند را شناختیم و نکاتی در خصوص نقطه پایانی و نقطه تعادل بیان کردیم. در انتها از هر فرآیند یک کاربرد عملی را توضیح دادیم.
در صورتیکه این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- مجموعه آموزشهای دروس شیمی
- گزارش کار آزمایشگاه — اصول نگارش
- انتقال جرم چیست؟ – از صفر تا صد
- جدول تناوبی — از صفر تا صد
^^













سلام توروخدا زود جواب بدید اگه هنگام افزودن شناساگر ما یکم اب مقطر به محلول اضافه کنیم یا تغییر غلظت میده یا نه
ایا ممکنه عنصر بور رو با دستگاه اسپکتروفتومتر خوند؟ روش اماده سازی به روش تیتراسیون ش چجوریه؟
سلام خسته نباشید
در تیتراسیون افزایش حجم آنالیت در ارلن باعث کاهش خطا میشه؟ یعنی شروع با مقدار بیشتری آنالیت دقت نتیجه رو افزایش میده؟
سلام وقتتون بخیر
خسته نباشید
نمودار تیتراسیون مگر برای تشخیص میزان pH یک محلول استفاده نمی کنند؟!!
به این صورت که مدام به محلول اسیدی ، مایع قلیایی اضافه می کنند (نمودار pH و مایع افزوده شده بصورت صاف بالا میرود تا بالاخره ثابت شود)تا به pH صفر برسد و آنگاه میزان اسیدیته اولیه را بر حسب میزان مایع قلیایی که اضافه شده حساب میکنند.
پس چرا بعضی نمودار های تیتراسیون شکل موجی دارن ، یعنی بصورت متناوب در راستای افقی و عمودی حرکت می کنند؟
با تشکر
با سلام؛
از شما بابت مطالعه مطلب سپاسگزاریم. این حالت به اصطلاح تناوبی مربوط به تیتراسیون «اسیدهای چندپروتونه» (Polyprotic Acid) است.
با تشکر از همراهی شما با مجله فرادرس
سلام وقتتون بخیر خسته نباشید
نمودار تیتراسیون مگر برای تشخیص میزان pH یک محلول استفاده نمی کنند؟!!
به این صورت که مدام به محلول اسیدی ، مایع قلیایی اضافه می کنند (نمودار pH و مایع افزوده شده بصورت صاف بالا میرود تا بالاخره ثابت شود)تا به pH صفر برسد و آنگاه میزان اسیدیته اولیه را بر حسب میزان مایع قلیایی که اضافه شده حساب میکنند.
پس چرا بعضی نمودار های تیتراسیون شکل موجی دارن ، یعنی بصورت متناوب در راستای افقی و عمودی حرکت می کنند؟
با تشکر
سلام وقت بخیر
علیرضا یاری هستم
کارشناس ارشد مهندس شیمی صنایع جداسازی
و سرپرست تولید یه شرکت تولید پلی استر
در خصوص تیتراسیون یک سوال فنی داشتم که باید براتون تلفتی شرح بدم اگه امکانش هست با بنده تماس بگیرید
ممنون میشم
با تشکر
باسلام چرا قبل از تیترکردن باید محلول راصاف کرد ؟