تعریف عنصر چیست؟ – به زبان ساده
عنصر ذرهای بنیادین است و به راحتی قابل تفکیک به اجزای کوچکتر خود نیست. در واقع شکستن عنصرها تنها با واکنشهای هستهای ممکن خواهد بود. عنصرها اجزای سازنده مواد و مولکولها هستند. هر عنصر شیمیایی خانهای مخصوص به خود در جدول تناوبی عناصر دارد. همچنین هر عنصر یک عدد اتمی و نماد دارد که این نماد از نام لاتین آن عنصر برداشته میشود. در این مطلب به تعریف عنصر و ویژگیهای آن میپردازیم.
- میآموزید عنصر چیست و چه تفاوتی با ترکیب دارد.
- نقش پروتون، نوترون و الکترون را در ساختار عنصر یاد میگیرید.
- شیوه نامگذاری و تشخیص نماد شیمیایی عنصر را فرا میگیرید.
- خواهید آموخت عدد اتمی و جرم اتمی چه مفهومی دارند.
- با دستهبندی عناصر و مفاهیم ایزوتوپ، آلوتروپ و یون آشنا میشوید.
- رفتار عنصرها در واکنش شیمیایی، هستهای و چرخههای زیستی را یاد خواهید گرفت.

تعریف عنصر
عنصرها اجزای سازنده مواد و مولکولها هستند و قابل تفکیک به اجزای کوچکتر خود نیستند. هر عنصر از سه جزء پروتون، نوترون و الکترون تشکیل شده است. تعداد این اجزا ویژگیهای هر عنصر را میسازند. عنصرها با ترتیبی بهخصوص در جدول تناوبی عناصر کنار هم نشان داده میشوند.
نماد عنصر
در شناسایی عنصرها دو مورد مهم وجود دارد که باید بدانیم:
- نام عنصر
- نماد شیمیایی آن
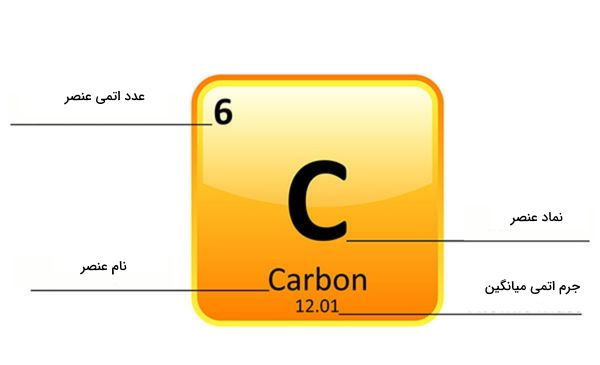
شیمیدانها هر عنصر را با یک یا چند حرف که بیشتر مواقع حروف اول نام آنها در لاتین است نمایش میدهند. البته این روش نامگذاری برای عنصرهای جدید کاربرد ندارد. نام عنصرهای تازه کشفشده برگرفته از دانشمندی است که آن را کشف کرده است. توجه داشته باشید که اگر عنصر با بیش از دو حرف نشان داده شود، همیشه اولین حرف بزرگ و دومی کوچک است. در جدول زیر نام و نماد تعدادی از عنصرها را مشاهده میکنیم.
عدد اتمی چیست ؟
مورد مهمی دیگری که باید در مورد هر اتم بدانیم عدد اتمی آن است. این عدد را در بالای خانه مربوط به هر عنصر در جدول تناوبی عناصر مشاهده میکنیم. این مقدار همیشه عددی صحیح بین ۱ تا ۱۱۸ است و در حرکت از سمت چپ به راست هر ردیف و همچنین از بالا به پایین یک ستون، افزایش پیدا میکند.
معنای عدد اتمی
عدد اتمی هر عنصر نشاندهنده تعداد پروتونهای داخل هسته اتم آن و همیشه ثابت است. برای مثال عدد اتمی طلا ۷۹ است و همیشه برابر با همین مقدار خواهد ماند. یعنی فارغ از اینکه اتم طلا در چه مولکول یا واکنشی حضور پیدا کند این عدد اتمی را دارد.
جرم اتمی میانگین چیست
در پایین هر خانه جدول تناوبی عناصر، عددی اعشاری مشاهده میکنیم که نشاندهنده جرم اتمی میانگین است. این عدد در واقع میانگین جرم یک اتم عنصر در واحد جرم اتمی (amu) است. برای مثال هیدروژن جرمی در حدود 1 amu (یکای جرم اتمی) و کربن جرمی برابر با 12 amu دارد. این جرم را با میانگینگیری از ایزوتوپهای یک عنصر به دست میآورند. در این اندازهگیری فراوانی آنها در کره زمین هم دخیل است.
اجزای تشکیل دهنده عنصرها
در قسمتهای قبلی در مورد چیستی اتم و تعریف عنصر به طور مفصل توضیح دادیم. حالا میخواهیم بدانیم که یک عنصر از چه اجزایی تشکیل شده است. هر عنصر از سه جزء تشکیل میشود.
- پروتون
- نوترون
- الکترون
تعداد این اجزا در هر عنصر متفاوت و این اختلاف مبنایی برای تشخیص عنصرها از یکدیگر است.
پروتون چیست ؟
پروتون که با نماد p نمایش داده میشود، ذرهای سنگین با جرم تقریبی 1 amu است. جایگاه پروتون هسته عنصر و دارای بار الکتریکی مثبت است.
نوترون چیست ؟
نوترونها ذرات سنگینی هستند که جرمی برابر با پروتون، یعنی 1 amu دارند. جایگاه این ذرات نیز هسته اتم است با این تفاوت که نوترون بر خلاف پروتون و الکترون بار ندارد و خنثی است. این ذره را با نماد n نشان میدهند.
الکترون چیست؟
الکترونها ذرات بسیار کوچکی هستند که با فاصلهای به دور هسته اتم میچرخند. این ذرات جرم بسیار کمی دارند و دارای بار الکتریکی منفی هستند. الکترونها را به اختصار با e نمایش میدهند.
تفاوت عنصر با ترکیب
توجه داشته باشید که نباید عنصرها با ترکیبات اشتباه گرفته شوند. طبق تعریف عنصر مادهای است که تمام اتمهای آن یکسان و از یک نوع باشند، در حالی که ترکیبات دارای اتمهای غیریکسان هستند. در زیر با اشاره به مثالهایی از عنصرها و ترکیبات این موضوع را روشنتر خواهیم کرد.
مثالهایی از موادی که عنصر هستند.
- آهن
- مس
- اکسیژن
مثالهایی از موادی که ترکیب هستند.
- سدیم کلرید
- آب
- آمونیاک
موادی که عنصر نیستند
اگر ترکیبی بیش از یک نوع اتم در خود داشته باشد، عنصر نیست. مثلا آلیاژها عنصر نیستند. در زیر لیستی از موادی را داریم که گاهی به اشتباه عنصر در نظر گرفته می شوند اما هیچ کدام عنصر نیستند.
- آب (زیرا از دو عنصر هیدروژن و اکسیژن تشکیل شده است.)
- استیل
- برنج (دارای عنصرهای فلزی متعددی است.)
طبقه بندی عنصرها
عنصرها با توجه به تعداد پروتونهای داخل هسته خود، که به عنوان عدد اتمی از آن یاد میشود، طبقهبندی میشوند. با ین حال ممکن است تعداد نوترونهای یک عنصر متنوع باشد که این تفاوت باعث به وجود آمدن ایزوتوپ میشود.
ایزوتوپ چیست ؟
بنابر تعریف ایزوتوپها عنصرهایی با تعداد برابر از پروتون و تعداد نابرابر از نوترون هستند. ایزوتوپها دارای ویژگیهای شیمیایی یکسان هستند اما در ویژگیهای فیزیکی با یکدیگر تفاوتهایی دارند. برای مثال هیدروژن دارای سه ایزوتوپ هیدروژن، دوتریم و تریتیوم است. مشخصات این ایزوتوپها را در جدول زیر مشاهده میکنید:
| نام ایزوتوپ | تعداد پروتون | تعداد نوترون |
| هیدروژن | ۱ | 0 |
| دوتریوم | ۱ | ۱ |
| تریتیوم | ۱ | 2 |
ایزوتوپهای کربن
اتم کربن جرمی برابر با 12 amu دارد و دارای ۶ پروتون و ۶ نوترون در هسته خود است. با این حال اتمهای کربن نادری وجود دارند که جرمی برابر با ۱۴ amu دارند. یعنی این اتمهای نادر کربن در هسته خود ۶ پروتون و ۸ نوترون دارند. این دو اتم کربن با یکدیگر ایزوتوپ هستند. اتم کربن-۱۴ از آن جهت اهمیت دارد که برای پی بردن به عمر آثار هنری از آن استفاده میشود.
آلوتروپ چیست ؟
اتمهای یک عنصر توانایی اتصال به یکدیگر را به چند شکل دارند. این تفاوت در نحوه اتصال باعث تفاوت در ویژگیهای شیمیایی آنها میشود. برای مثال اتمهای کربن اگر به صورت چهاروجهی کنار هم قرار بگیرند، الماس به وجود خواهد آمد اما اگر لایههایی از ششوجهی باشند زغال پدید میآید. در این صورت میگوییم که الماس و زغال آلوتروپ یا دگرشکل هم هستند.

یون های یک عنصر
عنصرهایی با تعداد پروتون و نوترون یکسان و تعداد الکترون متفاوت یونها را تشکیل میدهند. برای مثال سدیم () که فلزی بسیار واکنشپذیر است، میتواند با کلر پیوند یونی تشکیل بدهد. در این واکنش شیمیایی سدیم یک الکترون خود را از دست میدهد و تبدیل به میشود. طی این واکنش کلر با گرفتن الکترون سدیم تبدیل به میشود. در اینصورت خواهیم گفت که و هر دو همچنان یک عنصر هستند.
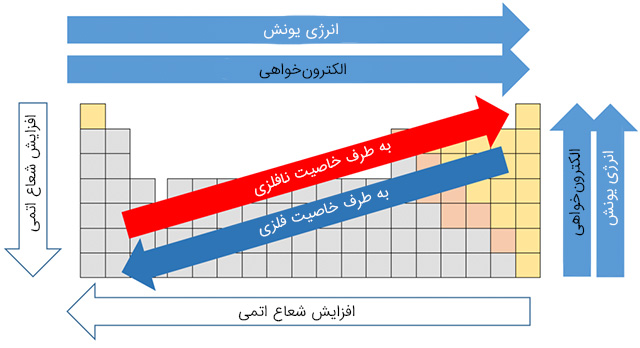
جدول تناوبی عناصر
جدول تناوبی عناصر که در برخی منابع از آن به عنوان جدول مندلیف نیز یاد میشود، ۱۱۸ عنصر دارد که از این تعداد ۹۴ عدد در طبیعت وجود دارند. باقی ۲۴ عنصر ساخته دست بشر هستند و پایداری کوتاهمدتی دارند. از این جدول اطلاعات زیادی را میتوان برداشت کرد که در زیر به تعدادی از آنها اشاره میکنیم:
- نماد عنصر
- نام عنصر
- عدد اتمی
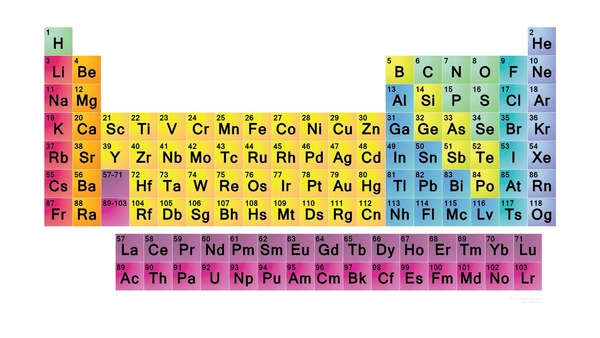
ستون و ردیف در جدول تناوبی
با نگاه به جدول تناوبی متوجه میشویم که از ردیفها و ستونهایی تشکیل شده است. به هر ردیف در این جدول یک دوره و به هر ستون یک گروه گفته میشود. عناصری که در یک ردیف یا گروه قرار دارند ویژگیهایی یکسان یا شبیه بههم از خود بروز میدهند و در واقع به همین دلیل متعلق به یک دسته هستند. از این رو با دیدن جدول تناوبی میتوان اطلاعات زیادی را برداشت کرد.
دستهبندی عنصرها در جدول تناوبی
عنصرها در جدول تناوبی بنابر ویژگیهای خود جایگاهی را اشغال میکنند و به دستههای متنوعی تقسیم میشوند. دانستن این دستهبندیها کار با آنها را برای ما آسانتر میکند. یکی از وسیعترین این دستهبندیها، تقسیم عنصرها به سه دستهی فلز و نافلز و شبهفلز است. فلزها در پایین سمت چپ و نافلزها در بالای سمت راست جدول قرار دارند.
عنصرهای فلزی
بیشتر عنصرهای موجود در جدول تناوبی ازجمله عناصر گروه یک جدول تناوبی فلز هستند. فلزات ویژگیهای منحصر به فرد خود را دارند. از این ویژگیها میتوان به جلای فلزی، سخت بودن و رسانایی اشاره کرد.
عنصرهای نافلزی
برخلاف فلزها، عنصرهایی که نافلز هستند نرم، نارسانا و رنگی هستند و توانایی تشکیل ترکیبات را با عناصر فلزی دارند.
عنصرهای شبهفلزی
شبهفلزها همانطور که از نامشان پیداست ویژگیهای بین فلزها و نافلزها دارند. با حرکت از سمت راست به چپ جدول از ویژگیهای فلزی عنصرها کاسته و به ویژگیهای نافلزی آنها افزوده میشود.
نحوه تشکیل عنصرها
واکنشهای شیمیایی قابلیت تبدیل یک عنصر به عنصر دیگر را ندارند. ذات و ویژگی یک عنصر تنها توسط تعداد پروتونها و نوترونهای داخل هسته به وجود میآید. نیروی قوی هسته یک اتم باعث کنار هم قرار گرفتن اجزای آن میشود و شکست آن را بسیار مشکل میکند. واکنشهایی مانند سوختن هیچ تغییری در ساختار اتم به وجود نمیآورند.
حالت فیزیکی عنصرها
هر عنصر حالتی فیزیکی دارد و این حالتها شامل جامد، مایع و گاز هستند. به طول مثال آهن عنصری جامد، هلیوم گازی شکل و جیوه مایع است. با این حال همین اتمها زمانی که با یکدیگر وارد واکنش میشوند ویژگیهایی خواهند داشت که کاملا منحصر به ترکیب جدید سنتز شده است.
برای مثال عنصر هیدروژن را در نظر بگیرید. همانطور که میدانیم هیدروژن اتمی گازی شکل است. همین هیدروژن میتواند با اتم اکسیژن وارد واکنش شود و محصولی به حالت فیزیکی مایع تولید کند. محصول واکنش در این مورد آب است.

پایداری عنصر در طبیعت
پیش از این در مورد پایداری عنصرها گفتیم، در این قسمت با یک مثال این مورد را روشنتر میکنیم.
- فرض کنید که یک اتم کربن داریم.
- این اتم در همراهی با اکسیژن، مولکول دیاکسید کربن را با فرمول تشکیل میدهد.
- درختی دیاکسید کربن را به دام میاندازد و طی واکنش شیمیایی فتوسنتز کربن از ساختار خود جدا شده و وارد مولکول گلوکز میشود.
- سپس گلوکز به ساخته شدن دیوار سلولزی سلولهای درخت کمک میکند.
- زمانی که این درخت بسوزد تبدیل به زغال میشود. همانطور که میدانیم زغال تودهای از کربن است و همین زغال تحت فشار بسیار بالا تبدیل به الماس میشود.
در طول این چرخه کربن وارد واکنشهای شیمیایی متعددی شد و در همراهی با اتمهای دیگر ساختارهای متنوعی را تشکیل داد. اما هیچ زمان تبدیل به عنصر دیگری نشد.

واکنش هسته ای
تنها راهی که برای تبدیل یک عنصر به عنصر دیگر وجود دارد، شکافت هستهای است. طی این واکنش هسته ای عنصرها با از دست دادن پروتون و نوترون به عنصرهای سبکتری تبدیل میشوند. عکس این واکنش همجوشی هستهای نام دارد، واکنشی که طی آن اتمهای سبک تبدیل به اتم سنگینتر از خود میشوند.
همجوشی هستهای واکنشی است که در ستارهها اتفاق میافتد، طی این واکنش هلیوم و هیدروژن با یکدیگر همجوشی داده میشوند. این واکنش با افزایش سن ستاره به وقوع میپیوندد.
عنصرها در بدن انسان
همه چیز از عنصر تشکیل شده است ازجمله بدن ما انسانها. حیوانات و گیاهان نیز از عنصر ساخته شدهاند. ۶ عنصر وجود دارند که حدود ۹۹٪ بدن انسان از آنهاست. این عنصرها شامل اکسیژن، کربن، هیدروژن، نیتروژن، کلسیم و فسفر هستند. همچنین باقیمانده بدن انسان از عنصرهایی مانند سدیم، گوگرد، پتاسیم، کلر و منگنز تشکیل شده و وجود همه این عنصرها در کنار یکدیگر برای ادامه حیات ما ضروری است.
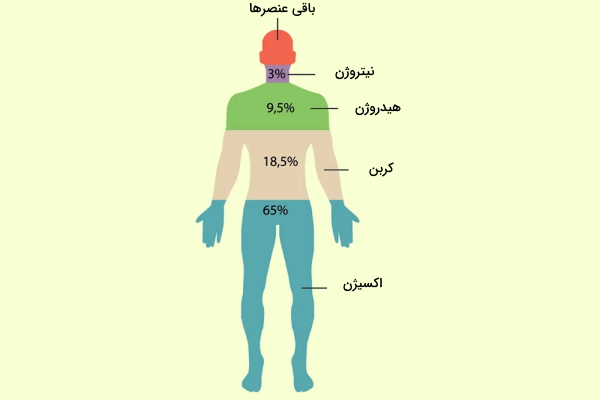
کارکرد عنصرها در بدن انسان
وجود تمام ۱۱ عنصر ذکر شده در بالا برای بدن انسان حیاتی است، زیرا این عنصرها سازنده موادی هستند که بدن برای کارکرد درست به آنها نیاز دارد. برای مثال کلسیم برای سلامت استخوان ضروری است و کمبود آن در رژیم غذایی و ویتامینهای دریافتی آسیب جدی وارد میکند.
همچنین این عنصرها سازنده مواد دیگری هستند که برای بدن نیاز است. در این مورد میتوان شکر را مثال زد که در تولید انرژي بدن انسان نقشی اساسی دارد.
عناصر شیمیایی در طول تاریخ
تعریف عنصر در قرن ما، با چیزی که در گذشته وجود داشته تفاوتهای بسیار زیادی دارد. انسانها همیشه بر این باور بودند که هر مادهای قابلیت شکسته شدن به اجزای کوچکتر از خود را دارد. تعریف باستانی عنصر به موادی غیر از آنچه ما به عنوان عنصر میشناسیم اطلاق میشد. افلاطون اولین فردی است که از این واژه استفاده کرد. در آن زمان باور یونانیان باستان این بود که در طبیعت ۴ عنصر وجود دارد:
- هوا
- آب
- خاک
- آتش.
واضح است که این تعریف در حال حاضر غیر قابلقبول و منسوخ است.

کشف عنصر
رابرت بویل در آغاز قرن ۱۷ام تعریف جدیدی از عنصر ارائه کرد. بنابر تعریف بویل، عنصر ترکیبی بود که قابلیت تفکیک به ذرات کوچکتر خود را نداشت. بعدتر شیمیدانها عنصرهای بیشتری را کشف کردند. از اولین عنصرهای کشف شده میتوان به طلا، گوگرد و جیوه اشاره کرد.
جمع بندی
در این مقاله به بررسی تعریف عنصر و ویژگیهای آن پرداختیم. به طور خلاصه عنصر کوچکترین ساختاری است که قابل تفکیک به اجزای خود نیست. هر عنصر دارای یک نماد و عددی اتمی شاخص به خود است و این اطلاعات از طریق جدول تناوبی عناصر در دسترس هستند.













تو بخش جدول تناوبی عنصر گفتین که ۹۴ تا تو طبیعت هست مگه اون ۹۲ تا تو طبیعت و ۲۶ تا ساختگی تو آزمایشگاه نبوده؟
با سلام خدمت شما؛
در منابع علمی مختلف تعداد ۹۰ تا ۹۸ عنصر موجود در طبیعت معرفی شدهاند. پرتکرارترین عدد مشخص شده برای عناصر طبیعی موجود در زمین ۹۴ است. علت این اختلاف نظر در تعداد عناصر طبیعی این است که برخی از عناصر تولید شده در اثر واپاشی هستهای برخی عناصر دیگر به وجود میآیند و نیمه عمر کوتاهی دارند و پایدار نیستند. این مسئله به این معنا است که این عناصر تولید شده در طبیعت به وجود میآیند اما پس از مدت زمان خیلی کوتاهی از بین میروند.
با تشکر از همراهی شما با مجله فرادرس