ایمنی سلولی و هومورال – تفاوت و شباهت – به زبان ساده
«ایمنی سلولی» (Humoral Immunity) و «ایمنی هومورال» (Cellular Immunity) دو فرایند «ایمنی اکتسابی» (Acquired Immunity) هستند که پس از برخورد با عامل بیماریزا فعال میشوند و از بدن محافظت میکنند. لنفوسیتها در این دو فرایند، نقش اصلی دارند و با ترشح مولکولهای پروتئینی، میکروبها، سلولهای خودی آلوده به آنها و سلولهای سرطانی را از بین میبرند. در این مطلب تفاوت و شباهت این دو مسیر دفاعی بدن را بررسی میکنیم.
ایمنی سلولی چیست ؟
ایمنی سلولی یکی از فرایندهای ایمنی اکتسابی است که بهوسیله فعال شدن ماکروفاژها و لنفوسیتهای T و سپس آزاد شدن «سیتوکینها» (Cytokines) و «کموکینها» (Chemokines) ایجاد میشود. این ایمنی در آلودگی ویروسی، قارچی، آغازیان، از بین بردن سلولهای سرطانی و رد پیوند نقش دارد و در سه مرحله از بدن محافظت میکند:
- فعالسازی لنفوسیتهای T آنتیژن ویژه، که خاصیت سمی برای سلول (Antigen-specific Cytotoxic T-Lymphocytes | CTLs) دارند. این لنفوسیتها، سلولهای خودی را شناسایی میکنند که آنتیژن شبیه به پاتوژنها دارند. سلولهای آلوده به ویروس، سلولهای آلوده به باکتری و سلولهای سرطانی از این نوع هستند.
- ماکروفاژها، سلولهای کشنده را برای از بین بردن پاتوژنهای داخل سلولی فعال میکند.
- سلول T کمککننده، سلولهای ایمنی را برای ترشح سیتوکینها تحریک میکند. سیتوکینها بر تعداد زیادی از گلبولهای سفید اثر میگذراند که در ایمنی ذاتی و ایمنی اکتسابی شرکت دارند.
سلول T چیست ؟
سلولهای T یا لنفوسیتهای T، گروهی از گلبولهای سفید و بخش مهمی از سیستم ایمنی بدن هستند. این سلولها از تقسیم و تمایز لنفوئیدهای موجود در مغز استخوان بهوجود میآیند و در تیموس بالغ میشوند. سلول T اجدادی در تیموس تقسیم میشود و به سلولهای زیر تمایز پیدا میکنند. این سلولها پس از تمایز وارد جریان خون یا لنف میشوند یا در بافتهایی مثل کبد، طحال و غشای مخاطی مستقر خواهند شد.
- «سلول T کمککننده» (Helper T Cells): در برخورد با آنتیژن، سیتوکینهایی ترشح میکند که تقسیم لنفوسیتهای B و تشکیل سلولهای پلاسمای ترشحکننده آنتیبادی را تحریک میکند.
- «سلول T تنظیمی» (Regulatory T Cells): این سلولها، واکنشهای ایمنی را تنظیم میکنند.
- «لنفوسیتT کشنده سلول» (Cytotoxic T Cells): این لنفوسیتها با تعداد زیادی از سیتوکینها فعال میشوند، به سلولهای آلوده میچسبند و آن را از بین میبرند.
- «سلولهای خاطره» (Memory T Cells): این سلولها آنتیژن ویژه هستند و کمک میکنند سیستم ایمنی در برخورد دوم با یک آنتیژن مشخص، سریعتر پاسخ دهد.
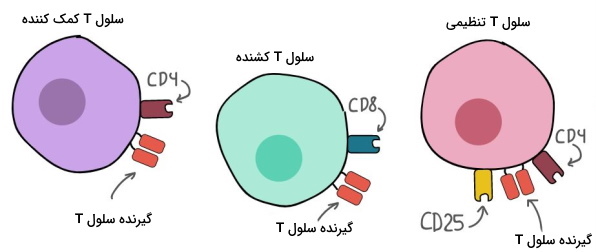
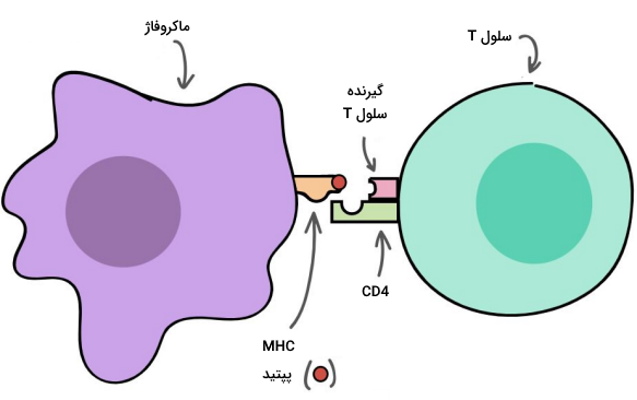
گیرندههای سلول T
«گیرندههای سلول تی» (T Cell Receptors | TCRs) و «کمکگیرندههای دسته تمایزی» (Cluster of Differentiation | CD) در زمان رشد و بلوغ سلولهای T در تیموس، ایجاد میشوند.
- گیرندههای سلول T: گیرندههای TC در تمام سلولهای T وجود دارند. این گیرندهها برخلاف آنتیبادی، مستقیم به آنتیژن متصل نمیشوند و برای شناسایی آنتيژن به کمک سلولهای دیگر نیاز دارند.
- کمکگیرندههای دسته تمایزی: در همه سلولهای T یکی از CD-های ۴ یا ۸ وجود دارد.
- در سلولهای T کمککننده CD4 بیان میشود. گیرنده این سلولها در فعال شدن سلولهای T کشنده، سلولهای B و دیگر سلولهای ایمنی نقش دارند.
- کمکگیرنده در سلولهای T کشنده، CD8 است. این گیرنده در شناسایی پاتوژنها و سلولهای خودی آلوده به میکروب مشارکت دارد.
- سلولهای T تنظیمکننده، CD4 و CD25 بیان میکنند. این سلولها مولکولهای خودی (مولکولهای سطح سلولهای سالم) را از غیرخودی (مولکولهای پاتوژن) تشخیص و با این کار خطر ابتلا به بیماریهای خودایمنی را کاهش میدهند.
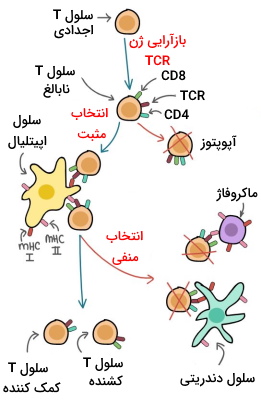
بازآرایی ژن گیرنده سلول T، سبب بیان نسخههای نوترکیب بسیار متنوعی از گیرنده در این سلول میشود، که تعداد زیادی از پاتوژنها را شناسایی میکنند. از طرفی، این تنوع ممکن است گیرندههایی تولید کند که مولکولهای خودی را به عنوان آنتیژن شناسایی کنند. دو فرایند انتخابی، قبل از بلوغ، عملکرد درست این سلولها را تنظیم میکنند و در انتها سه دسته سلول بالغ کمککننده، کشنده و تنظیمی بهوجود میآورند.
- تنظیم مثبت: این تنظیم توانایی مولکولهای MHC برای تشخیص آنتیژن خودی از پاتوژنها را بررسی میکند. این فرایند، سلولهایی را انتخاب میکند که فقط به MHCs خودی متصل میشوند. در غیر این صورت، سلول با آپوپتوز از بین میرود.
- تنظیم منفی: این انتخاب توانایی اتصال اختصاصی CD4 و CD8 را میسنجد. در این تست اگر CD4 و CD8 به مولکول MHC خودی که آنتيژن به آن متصل نیست، یا مولکول MHC متصل به آنتیژن خودی، وصل شود بهوسیله آپوپتوز حذف خواهد شد.
سلول های آماده کننده آنتیژن
لنفوسیتهای T، آنتیژنهایی را شناسایی میکنند که به گیرندههای سطح «سلولهای آمادهکننده آنتیژن» (Antigen-presenting Cell | APC) یعنی سلولهای دندریتی و ماکروفاژها متصل باشند. آنتیژن ابتدا به «گیرندههای ویژه سازگاری بافتی» (Major Histocompatibility Complex | MHC) یا همان «آنتیژن لوکوسیت انسانی» (HLA) در سطح این سلولها متصل میشود. برای شناسایی آنتیژن، CD4 و CD8 به گیرنده سلول T کمک میکنند. مولکولهای MHC به دو دسته I و II تقسیم میشوند که تفاوت آنها در ساختار جایگاه اتصال به پاتوژن است.
در جدول زیر ویژگیهای دو دسته مولکولهای MHC بیان شده است.
| ویژگیها | MHC I | MHC II |
| زنجیره پلیپپتیدی | دو زنجیره | دو زنجیره |
| پراکندگی | سطح تمام سلولهای دارای هسته | سطح سلولهای ارائهکننده آنتيژن |
| تفاوت جایگاه اتصال | دومینهای ۱ و ۱۲ | دومینهای و |
| کمک گیرنده TCR | CD8 | CD4 |
| اندازه جایگاه اتصال | پپتید ۸ تا ۱۱ آمینواسیدی | پپتید ۱۳ تا ۲۵ آمینواسیدی |
| اتصال به آنتیژن | اتصال به آنتیژن درون سلولی (ویروس، باکتری درون سلولی و انگل) | اتصال به آنتیژن خارج سلولی |
سلولهای دندریتی
سلولهای دندریتی گروهی از گلبولهای سفید مستقر در بافت پستانداران هستند. این سلولها در بافتهایی که با محیط بیرون ارتباط دارند ازجمله پوست و مخاط بینی، ریه، معده و روده مستقر میشوند و پس از فعال شدن، برای فعالسازی سلولهای B و T، به گرههای لنفاوی مهاجرت میکنند. این سلولها مثل دندریتهای نورون عصبی، زائدههای شاخهشکل دارند و به همین دلیل به آنها سلول دندریتی (درختی) گفته میشود.
سیتوکین چیست ؟
سیتوکینها پروتئینهای کوچکی برای تنظیم رشد و فعالیت سلولهای سیستم ایمنی هستند. این مولکولها بر رشد تمام سلولهای خونی و دیگر سلولهای مشارکت کننده در ایمنی و التهاب اثر میگذارند.
کموکینها یکی از گروههای سیتوکین هستند که سلول ایمنی را به منطقه هدف جذب میکنند. این مولکولها به دستههای زیر تقسیم میشوند.
- «اینترلوکین» (Interleukins): این مولکول، مولکول پیام شیمیایی بین گلبولهای سفید هستند. اینترلوکین ۲ (IL-2) یکی از گروههای شناخته شده این مولکولها است که به رشد و تقسیم سریع سلولهای ایمنی کمک میکند.
- «اینترفرون» (Interferons): این مولکولها، بدن را در برابر عفونتهای ویروسی و سلولهای سرطانی مقاوم میکنند. اینترفونها به سه گروه آلفا، بتا و گاما تقسیم میشوند.
- «فاکتور نکروز کننده تومور» (Tumor Necrosis Factors): این کموکین در بعضی فرایندهای سلولی ازجمله تکثیر، تمایز و مرگ سلول نقش دارد. این فاکتور از سلولهای التهابی ترشح میشود.
- «فاکتورهای رشد» (Growth Factors): این پروتئینهای کوچک در رشد، تمایز، مهاجرت و تغییر شکل سلولی نقش دارند.
ایمنی هومورال چیست ؟
ایمنی هومورال بخشی از ایمنی اکتسابی بدن است که بهوسیله لنفوسیت B و درشتمولکولهای پروتئینی ازجمله آنتیبادیهای ترشحی و پپتیدهای ضدباکتریایی، بدن را در برابر عوامل بیماریزا محافظت میکند. اسم این فرایند ایمنی از واژه «Humos» به معنی مایعات بدن گرفته شده است.
لنفوسیتهای B
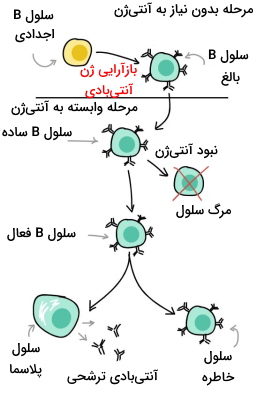
تولید، تکثیر و بلوغ لنفوسیتهای B در مغز استخوان انجام و سپس برای گردش در بدن، به سیستم لنفاوی منتقل میشوند. در غشای سلولهای B، آنتیبادیهایی وجود دارند که هر کدام نوع خاصی از آنتیژن را شناسایی میکنند. برای مثال، ساختار جایگاه اتصال در آنتیبادی شناساییکننده باکتری کزار با تب حصبه متفاوت است. با اتصال آنتیژن-آنتیبادی، سلول B ساده سریع تقسیم میشود و به سلول B خاطره و سلول B موثر یا همان سلول پلاسما تمایز مییابد.
- «سلول B خاطره» (Memory B Cell): این سلولها در سطح خود آنتیبادی مشابه سلول B ساده دارند و به ایجاد پاسخ سریع، در برخورد دوباره با همان آنتیژن کمک میکنند.
- «سلول پلاسما» (Plasma Cell): این سلولها، آنتیبادی مشابه لنفوسیت B ساده اما محلول در خون و مایعات بدن را ترشح میکنند.
گیرندههای سلول B
در غشای لنفوسیتها B، گیرندههای اختصاصی دیگری به نام گیرنده سلول بی (B Cell Receptor | BCR) وجود دارد که در اتصال به آنتیژن، ورود آنتیژن به سلول و پردازش آن مشارکت میکند. همچنین این گیرنده، به انتقال پیام سلولهای B ازجمله ترشح سیتوکینها کمک میکند.
تفاوت ایمنی سلولی و ایمنی هومورال
جدول زیر تفاوتهای بین ایمنی سلولی و هومورال را نشان میدهد.
| ایمنی سلولی | ایمنی هومورال |
| لنفوسیتهای T در آن نقش دارند. | لنفوسیتهای B در آن نقش دارند. |
| آنتی بادی نداریم. | آنتیبادیهای محلول ترشح میشود. |
| گیرندههای آنتیژنی در غشای سلول وجود دارد. | آنتیبادیهای سطح غشایی آنتیژن را شناسایی میکنند. |
| آنتیژن غیرمستقیم شناسایی میشود. | آنتیژن مستقیم شناسایی میشود. |
| در برابر آلودگی ویروسی، قارچی و باکتریهای درونسلولی از بدن محافظت میکند. | در برابر ویروسها و باکتریهای خارج سلولی از بدن محافظت میکند. |
| سلولهای سرطانی را از بین میبرد. | در نابودی سلولهای سرطانی نقشی ندارد. |
| با تاخیر به آلودگی پاسخ میدهد. | سریع به آلودگی پاسخ میدهد. |
شباهت ایمنی سلولی و ایمنی هومورال چیست ؟
با وجود تمام تفاوتها، این دو مسیر از ایمنی اکتسابی شباهتهایی دارند که در این بخش به آنها اشاره میکنیم.
- هر دو ایمنی فعال هستند.
- از بدن در برابر پاتوژنهای زیاد و متنوعی محافظت میکنند.
- سلولهای خاطره تولید میکنند.
- در افراد مبتلا به نقص ایمنی غیرفعال میشوند.
جمعبندی
ایمنی سلولی و هومورال دو بخش از ایمنی اکتسابی بدن انسان هستند که در برخورد با پاتوژن خارج بدن یا سلولهای آلوده و سرطانی فعال میشوند و از بدن دفاع میکنند. عملکرد این دو بخش به کمک دو دسته اصلی لنفوسیتهای B و لنفوسیتهای T انجام میگیرد و متفاوت است.












