الکتروپوزیتیوی چیست؟ — به زبان ساده

در شیمی، عکس «الکترونگاتیو»، خصلت «الکتروپوزیتیو» (Electropositive) بوده و معنای آن تمایل اتم برای از دست دادن الکترون است. هرچه اتم الکتروپوزیتیوتر باشد تمایل بیشتری برای دادن الکترون یا الکترونهای خود به اتمهایی که با آنها پیوند برقرار کرده دارد. این خصلت که بیشتر در فلزات وجود دارد باعث تشکیل یونهایی با بار مثبت میشود که به آنها کاتیون میگویند. دو خصلت الکترونگاتیوی و الکتروپوزیتیوی، بسیاری از خواص فیزیکی و شیمیایی عناصر و ترکیبات را تعیین میکنند. به همین دلیل در این مطلب به بررسی مفهوم الکتروپوزیتیو میپردازیم و در پایان یاد میگیریم الکتروپوزیتیوی چیست و الکتروپوزیتیوترین عناصر کدامند.
الکتروپوزیتیوی چیست ؟
الکتروپوزیتیوی معیاری برای تمایل عنصر به از دست دادن الکترون است. هرچه در اتم این خصلت بیشتر باشد یعنی اینکه اتم تمایل بیشتری برای از دست دادن الکترون و تمایل کمتری برای گرفتن الکترون دارد به همین جهت واکنشپذیری آن نیز بیشتر خواهد بود. معمولا خاصیت الکتروپوزیتیوی در عناصر فلزی بهخصوص فلزات قلیایی و قلیایی خاکی بیشتر است.
مفهوم الکتروپوزیتیوی
برای اینکه مفهوم الکتروپوزیتیوی را بهتر درک کنید باید توضیح دهیم که هر چه اتم برای رسیدن به آرایش پایدار تمایل بیشتری به از دست دادن الکترون از خود نشان بدهد الکتروپوزیتیوتر خواهد بود. این ویژگی به کمک الکترونگاتیوی نیز میتواند توضیح داده شود. هر چه یک عنصر الکترونگاتیوتر باشد الکتروپوزیتیوی آن کمتر خواهد بود. به طور کلی برای درک عمیق این مفهوم باید بدانید یون چیست و عناصر چگونه به آرایش پایدار میرسند.
اگر تعداد الکترونهای ظرفیت در لایه ظرفیت نسبت به ۸ الکترون (آرایش ۸ تایی) بیشتر باشد پس باید الکترون از دست بدهند بنابراین الکتروپوزیتیو خواهند بود. در صورتی هم تعداد الکترونهای ظرفیت کمتر از این مقدار باشد برای پر کردن اکتت خود نیاز به دریافت الکترون دارند پس الکترونگاتیو خواهند بود.
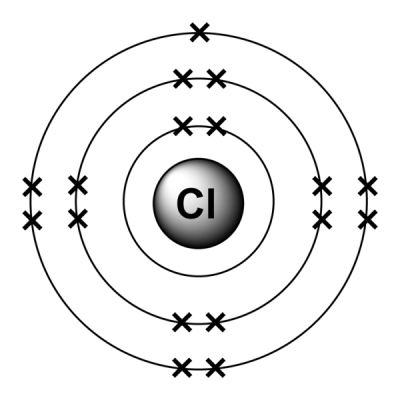
به عنوان مثال به دو تصویر زیر نگاه کنید. تصویر زیر آرایش الکترونی عنصر کلر را نشان میدهد. همانطور که مشاهده میشود در لایه ظرفیت این عنصر ۷ الکترون وجود دارد بنابراین برای پر کردن لایه ظرفیت خود و رسیدن به آرایش هشتتایی کافیست که یک الکترون دریافت کند. بنابراین عنصر کلر الکترونگاتیوی بالا و الکتروپوزیتیوی پایینی دارد.
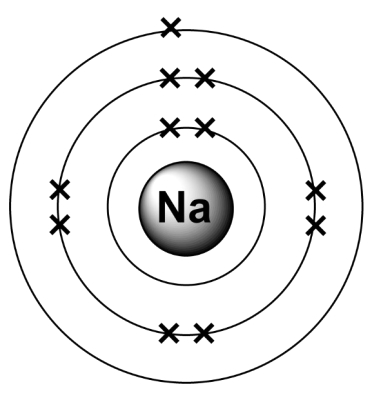
تصویر نیز مربوط به آرایش الکترونی عنصر سدیم است. همانطور که میبینید در لایه ظرفیت این عنصر تنها یک الکترون وجود دارد که به آن الکترون آزاد نیز میگویند. از آنجا که انرژی هسته بر روی این الکترون کم بوده برای همین عنصر تمایل به از دست دادن آن دارد که در این صورت لایه قبلی آن لایه ظرفیت میشود و ۸ الکترون دارد که آرایش الکترونی آن پایدار است. پس عنصر سدیم عنصری الکتروپوزیتیو بوده که الکترونگاتیوی آن بسیار پایین است.
نکاتی درباره عناصر الکتروپوزیتیو
برای اینکه با مفهوم الکتروپوزیتیوی به خوبی آشنا شویم بهتر است به سراغ چند نکته مهم و در عین حال ساده برویم:
- عکس الکتروپوزیتیوی، الکترونگاتیوی است که این خصلت بر خلاف الکتروپوزیتیوی معیاری برای تمایل اتمها به دریافت الکترون از سایر اتمهاست و در این حالت به آنیونها تبدیل میشوند.
- عناصری با الکتروپوزیتیوی بالا، الکترونگاتیوی پایینی دارند و عناصری با الکترونگاتیوی بالا الکتروپوزیتیوی پایینی دارند.
- عناصری که خصلت الکترونگاتیوی دارند تمایلی به از دست دادن الکترون برای تشکیل کاتیون نداشته و عناصری با خصلت الکتروپوزیتیو تمایلی به گرفتن الکترون برای تبدیل به آنیون شدن ندارند.
- عناصر الکتروپوزیتو اغلب با عناصر الکترونگاتیو ترکیب میشوند و نمکهای یونی را به وجود میآورند. برای مثال همانطور که در قسمت قبلی توضیح دادیم سدیم به عنوان عنصری از گروه یک جدول تناوبی برای رسیدن به آرایش الکترونی پایدار الکترون از دست میدهد و به شدت الکتروپوزیتیو است. از طرفی اتم کلر به عنوان عضوی از خانواده هالوژنها به شدت الکترونگاتیو بوده که برای رسیدن به آرایش الکترونی پایدار به سرعت الکترون دریافت میکند. بنابراین سدیم و کلر میتوانند با یکدیگر پیوند یونی برقرار کنند و ترکیب یونی سدیم کلرید را که یک جامد بلوری است تشکیل دهند.
روند الکترونگاتیوی و الکتروپوزیتیوی در جدول تناوبی
الکتروپوزیتیوی عناصر به عواملی ازجمله موارد زیر بستگی دارد:
- فاصله میان هسته و لایه ظرفیت
- تاثیر بار موثر هسته بر روی الکترونهای ظرفیت
- انرژی یونش عنصر
روند الکتروپوزیتیوی در جدول تناوبی نشان میدهد که روند آن همیشه عکس روند الکترونگاتیوی است. به دلیل اینکه الکترونگاتیوی در طول دوره افزایش در حالی که الکتروپوزیتوی در طول دوره کاهش مییاید. به طور مشابه، الکترونگاتیوی در طول گروه از بالا به پایین کاهش اما الکتروپوزیتیوی افزایش پیدا میکند.
پس در این صورت عناصر در بالا و سمت راست جدول تناوبی کمترین و در پایین و سمت چپ بیشترین خصلت الکتروپوزیتیوی را دارند.
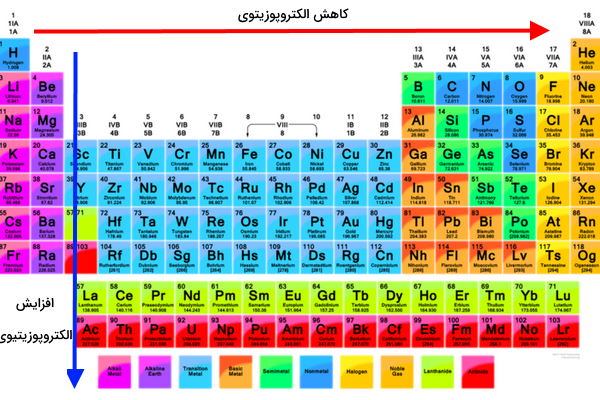
با توجه به اینکه الکتروپوزیتیوی یک خصلت فلزی به شمار میرود و همچنین روند آن در جدول تناوبی، فلزات قلیایی به عنوان الکتروپوزیتیوترین عناصر در نظر گرفته میشوند. در حالی که فلوئور، اکسیژن و کلر الکترونگاتیوترین عناصر بوده که پایینترین خصلت الکتروپوزیتوی را دارند. همچنین ویژگی الکترونگاتیوی به خصلت نافلزی عناصر ارتباط دارد.
۵ عنصر الکتروپوزیتیو
در قسمت قبلی توضیح دادیم که با توجه به قانون دورهای عناصر در پایین و ناحیه سمت چپ جدول تناوبی الکتروپوزیتیوترین عناصر وجود دارند. بنابراین ۵ عنصر الکتروپوزیتیو عبارتند از:
- لیتیوم (li)
- سدیم (Na)
- پتاسیم (K)
- روبیدیم (Rb)
- سزیم (Cs)
سوالات متداول مرتبط
سوالات پرتکرار در رابطه با الکتروپوزیتو همراه با پاسخهای کوتاه در ادامه آورده شده است.
الکتروپوزیتیو یعنی چه ؟
الکتروپوزیتیو ویژگی است که به تمایل عنصر به از دست دادن الکترون تلقی میشود که در این صورت ذرهای با بار مثبت یعنی کاتیون بهوجود میآید.
الکتروپوزیتیوترین عنصر کدام است ؟
در میان همه عناصر جدول تناوبی، فلزات قلیایی به عنوان الکتروپوزیتیوترین عناصر شناخته میشوند و از میان این گروه نیز سزیم الکتروپوزیتیوترین عنصر پایدار است. با فرض غیرپایداری فرانسیم این عنصر را نیز میتوان به صورت تئوری الکتروپوزیتیوترین عنصر در نظر گرفت.
تفاوت میان الکتروپوزیتیوته و الکترونگاتیویته چیست؟
الکترونگاتیوی یعنی عنصر در حالت تشکیل پیوند و برای رسیدن به آرایش الکترونی پایدار تمایل به جذب الکترون دارد. نافلزات در مقایسه با فلزات الکترونگاتیوتر هستند. از میان نافلزات نیز عناصر گروه ۱۷ یعنی هالوژنها الکترونگاتیوی بالایی دارند. از بین هالوژنها، عنصر فلوئور الکترونگاتیوترین عنصر شناخته میشود. در مقابل الکتروپوزیتیو تمایل اتم برای از دست دادن الکترون به منظور تشکیل یونهایی با بار مثبت است. عناصر فلزی عناصری هستند که خصلت الکتروپوزیتیو از خود نشان میدهند.
الکترونگاتیوی چیست ؟
«الکترونگاتیوی» (Electronegativity) یعنی اتم الکترونخواهی بالایی دارد و برای رسیدن به آرایش هشتتایی الکترون از سایر اتمها الکترون دریافت میکند. در این حالت بار اتم منفیتر شده و ذراتی باردار با بار منفی بهوجود میآیند و به این ذرات آنیون میگویند.
خاصیت الکترونگاتیوی در جدول تناوبی به چه صورت است؟
با توجه به قانون دوره ای عنصرها، در هر دوره از چپ به راست خصلت الکترونگاتیوی افزایش و در هر گروه از بالا به پایین این خصلت کاهش پیدا میکند.
ترتیب الکترونگاتیوی عناصر مهم چگونه خواهد بود؟
زمانیکه سخن از الکترونگاتیوی میشود قطعا نافلزات ازجمله هالوژنها در ذهن نقش میبندد. زیرا عناصر مهمی که الکترونگاتیوی بالایی دارند هالوژنهستند. ترتیب آنها نیز به این گونه است که از فلوئور تا عنصر ید الکترونگاتیوی کاهش مییابد.










