سطوح مختلف ساختاری پروتئین ها چیست؟ – به زبان ساده
تا خوردگی پروتئینها باعث به وجود آمدن ساختار فضایی این ماکرومولکولهای زیستی میشود. شناخت سطوح مختلف ساختاری پروتئین به ما کمک میکند که فعالیت پروتئینها را بهتر درک کنیم و در بخشهای مختلفی از علم مثل داروسازی، تشخیص بیماریهای مرتبط با پروتئینها، مطالعات آزمایشگاهی و غیره از دانش پروتئينی خود استفاده کنیم. در این مطلب از مجله فرادرس سطوح مختلف ساختاری پروتئين را به ترتیب از ساختار اول تا چهارم میشناسیم و سپس به سراغ روشهای مطالعه این ساختارها میرویم.
- ویژگیهای چهار سطح ساختاری پروتئین را میآموزید.
- یاد خواهید گرفت ساختار هر سطح چگونه عملکرد پروتئین را تعیین میکند.
- درک میکنید چگونه تغییرات محیطی ساختار پروتئین را تحت تاثیر قرار میدهند.
- یاد میگیرید دناتوراسیون چیست و چپرونها چه وظایفی دارند.
- تفاوتهای اصلی مارپیچ آلفا، صفحات بتا و دومینها را میآموزید.
- میتوانید فاکتورهای موثر در پایداری پروتئین را تحلیل کنید.


سطوح مختلف ساختاری پروتئین
شکل یک پروتئين برای انجام فعالیتهای آن اهمیت زیادی دارد. با بهم پیوستن آمینواسیدها به وسیله پیوند پپتیدی زنجیرههای پپتیدی ایجاد میشوند که پیچ و تاب میخورند و شکلهای فضایی خاص خود را میسازند، به این ترتیب شکل فضایی یک پروتئین تکمیل و فعالیت آن پروتئین از سر گرفته میشود. توالی زنجیره پلیپپتید برای تعیین شکل فضایی پروتئین اهمیت بسیار زیادی دارد، زیرا آمینواسیدهای مختلف خواص منحصر به فرد خود را دارند که میتواند در پیچخوردگی پروتئين اثرگذار باشد.
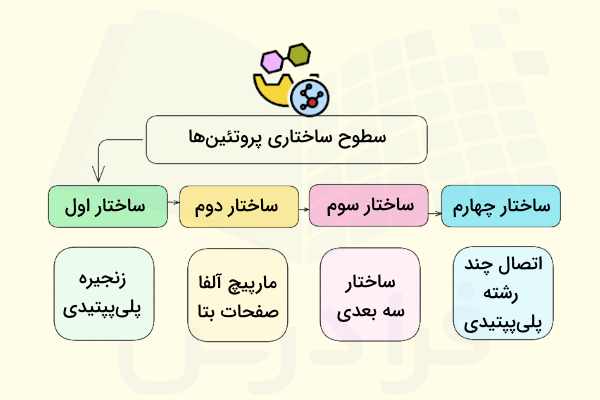
در این مطلب از مجله فرادرس قصد داریم به سطوح مختلف ساختاری پروتئین بپردازیم، بنابراین در ابتدا باید بگوییم که چهار سطح ساختاری برای پروتئینها وجود دارد که به ترتیب زیر هستند.
- ساختار اول پروتئین
- ساختار دوم پروتئین
- ساختار سوم پروتئين
- ساختار چهارم پروتئین
همه پروتئینها این پروسه را تا ساختار چهارم طی نمیکنند، اکثر پروتئینها تا ساختار سوم پیش رفته و فعالیت خود را از سر میگیرند. عوامل گوناگونی میتوانند این ساختارهای پروتئینی را تغییر داده و فعالیت پروتئین را متوقف سازند. در ادامه با ساختارهای پروتئین آشنا میشویم، سپس عوامل اثرگذار بر سطوح مختلف ساختار پروتئین را میشناسیم.
در صورتی که علاقه به کسب اطلاعات بیشتر و بهتر راجع به روند ساخت پروتئينها و ماهیت آنها دارید، مطالعه مطلب «پروتئین چیست؟ | ساختار، اجزای سازنده، عملکرد و انواع پروتئین ها» از مجله فرادرس را به شما توصیه میکنیم.
پیشنهاد میکنیم برای یادگیری سطوح ساختاری پروتئین و کاربردها و نحوه عملکرد آن، فیلم آموزش رایگان سطوح ساختاری پروتئین همراه با کاربردها و مکانیسم عملکرد در فرادرس را تماشا کنید که آن را در همین بخش آوردهایم.
ساختار اول پروتئين
ساختار اول پروتئین همان زنجیره پلیپپتیدی است که توسط ریبوزوم ساخته میشود، بنابراین سادهترین ساختار پروتئين را میتوان ساختار اولیه آن دانست. زنجیره پلیپپتیدی حاصل بهم پیوستن آمینواسیدهای مختلف از طریق پیوند پپتیدی است.
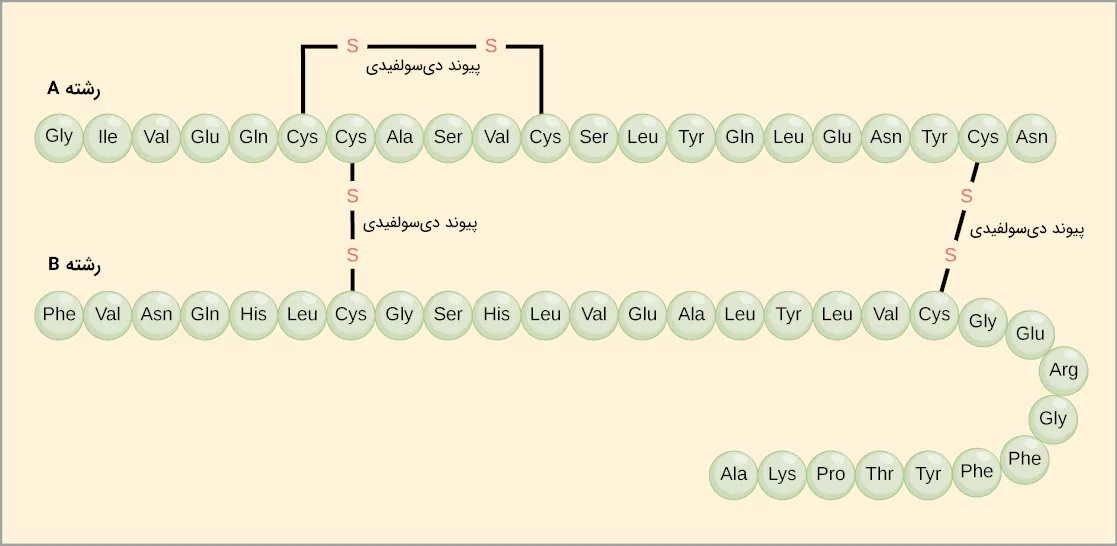
پروتئینهای مختلف میتوانند از چند زنجیره پلیپپتیدی ساخته شده باشند. به عنوان مثال هورمون انسولین را در نظر بگیرید که از دو رشته پلیپپتیدی تشکیل شده است، این دو رشته را با عنوانهای «رشته A» و «رشته B» میشناسیم. هر رشته توالی آمینواسیدی منحصر به فرد خود را دارد، برای مثال رشته A با آمینواسید گلایسین در N-ترمینال شروع شده و با آسپارژین در C-ترمینال به پایان میرسد، در حالی که رشته B با فنیل آلانین شروع میشود ولی در انتهای C-ترمینال آن آلانین قرار دارد.
توالی یک پروتئین به وسیله توالی DNA ژن کد کننده پروتئين مشخص میشود. تغییر در توالی DNA ژنومی میتواند منجر به تغییر در توالی آمینواسیدی پروتئين شود. تغییر حتی یک آمینواسید در زنجیره پلیپپتیدی پروتئینها میتواند روی ساختار نهایی و فعالیت پروتئین اثر بگذارد.
برای مثال تغییر تنها یک آمینواسید منجر به بیماری کمخونی داسیشکل میشود که یک بیماری وراثتی اثرگذار روی گلبولهای قرمز است. در کمخونی داسیشکل یکی از زنجیرههای پلیپپتیدی شکلدهنده هموگلوبین دچار تغییر شده است. در شرایط عادی، ششمین آمینواسید زنجیره بتا هموگلوبین گلوتامیک اسید است، اما در کمخونی داسیشکل والین جای گلوتامیک اسید را گرفته است.
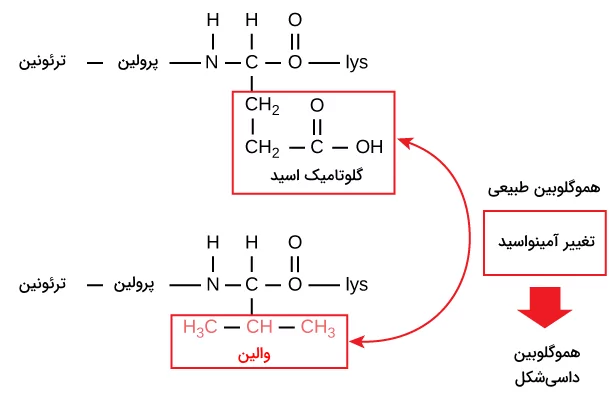
شرایط زیستی محیطی که پروتئين در آن قرار دارد نیز میتواند روی ساختار سه بعدی پروتئین تاثیرگذار باشد. برای مثال اتصال لیگاندها، سوبستراها یا پروتئينهای دیگر به یک پروتئین میتواند شکلگیری ساختار فضایی پروتئین را تحت تاثیر قرار بدهد، بنابراین میتوان گفت که با وجود آن که ساختار فضایی پروتئين به توالی پلیپپتیدی آن وابستهاست، عوامل محیطی نیز میتوانند اثراتی روی شکلگیری این ساختار داشته باشند.
تغییر در ساختار پروتئين در سطح توالی آمینواسیدی چه اثراتی در پی دارد؟ جواب این سوال را میتوان با مثال هموگلوبینهای کمخونی داسیشکل داد.
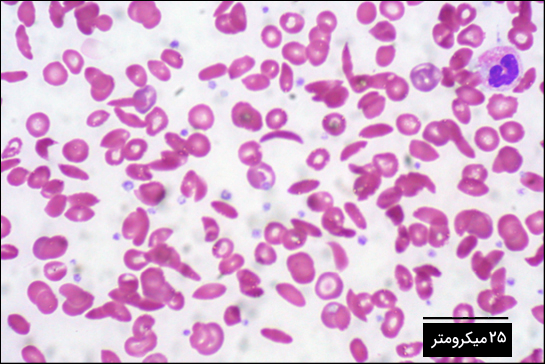
هموگلوبین از ۲ رشته آلفا و ۲ رشته بتا ساخته شده است که هر رشته دارای ۱۵۰ آمینواسید است، بنابراین در ساختار یک هموگلوبین ۶۰۰ آمینواسید میبینیم. درکمخونی داسیشکل در هر رشته بتا گلوتامیک اسید با والین در موقعیت آمینواسید ششم جایگزین شده است، پس هموگلوبین موجود در این بیماران تنها ۲ آمینواسید متفاوت با هموگلوبین طبیعی دارد. این تغییر باعث میشود که هموگلوبین به جای شکل فضایی طبیعی خود، به شکل فیبرهایی طویل در بیاید. این فیبرها دلیل اصلی داسیشکل بودن گلبولهای قرمز هستند.
گلبولهای قرمز داسیشکل میتوانند باعث بروز علائم گوناگونی در بیماران شوند، زیرا این گلبولها در جریان خون به یکدیگر میچسبند و در حرکت خون در رگها اختلال ایجاد میکنند.
ساختار دوم پروتئین
به دومین مرحله ای که پروتئينها برای تشکیل ساختار نهایی خود طی میکنند، «ساختار دوم پروتئين» یا «ساختار ثانویه» میگوییم. این ساختار به پیچ و تاب ساختار پروتئین به دلیل برهمکنشهای بین اتمی ستون فقرات زنجیره پلیپپتیدی اتفاق میافتد. منظور از ستون فقرات زنجیره پلیپپتیدی، زنجیره پلیپپتیدی بدون در نظر گرفتن گروههای جانبی آمینواسیدها است، بنابراین ساختار ثانویه ارتباطی با این گروههای جانبی ندارد.
رایجترین نوعهای ساختار دوم پروتئين، «مارپیچ آلفا» (α Helix) و «صفحات بتا» (β Sheet) هستند. هر دو این ساختارها به وسیله پیوندهای هیدروژنی ایجاد میشوند. این پیوند هیدروژنی بین اکسیژن بخش کربونیل با هیدروژن بخش آمینی دو آمینواسید تشکیل میشود.
توزیع آمینواسیدها در مارپیچ آلفا و صفحات بتا یکسان نیست، یعنی در مارپیچ آلفا آمینواسیدهای خاصی را میبینیم و در صفحات بتا آمینواسیدهای دیگری دیده میشوند. در ادامه در بخشهای مربوط به این ساختارها راجع به این آمینواسیدها جزئیات بیشتری ارائه خواهیم کرد.
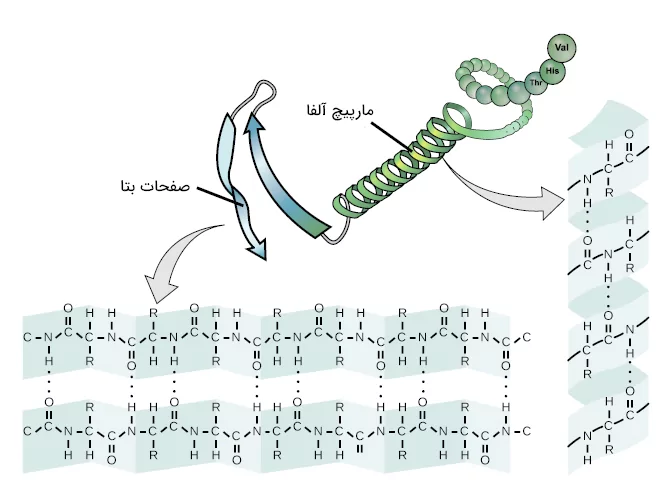
آیا در ساختار یک پروتئین فقط مارپیچ آلفا یا فقط صفحات بتا میبینیم؟ خیر. بسیاری از پروتئینها در ساختار خود هم مارپیچ آلفا و هم صفحات بتا را دارند، البته پروتئینهایی نیز هستند که فقط یکی از این ساختارها را داشته باشند یا هیچ کدام از آنها را نداشته باشند.
در هنگام مطالعه سطوح مختلف ساختاری پروتئين ممکن است با واژه «توپولوژی» (Topology) روبهرو شوید که برای اشاره به ارتباط بین انواع مختلف ساختار ثانویه پروتئین استفاده میشود. برای مثال بخشهایی از یک پروتئین به شکل صفحات بتا و بخشهایی به شکل مارپیچ آلفا هستند، حالا تصور کنید که بعد از ناحیه صفحات بتا، مارپیچ آلفا داشته باشیم و سپس صفحه بتا دیگری قرار داشته باشد. به این شرایط توصیف شده «توپولوژی بتا-آلفا-بتا» میگوییم.
مارپیچ آلفا
در مارپیچ آلفا، کربونیل (C=O) یک آمینواسید با هیدروژن بخش آمینی، چهارمین آمینواسید بعد از خود پیوند هیدروژنی برقرار میکند، برای مثال کربونیل آمینواسید شماره ۱ با هیدروژن بخش N-H آمینواسید شماره ۵ پیوند هیدروژنی میسازد. این شیوه پیوندسازی باعث میشود که زنجیره پلیپپتیدی به شکل یک مارپیچ در بیاید که در هر پیچ ۳٫۶ آمینواسید وجود دارند. گروههای جانبی هر آمینواسید در سمت بیرونی مارپیچ جایگیری میکنند و به این ترتیب برای ارتباط برقرار کردن با مولکولهای دیگر آزاد هستند.
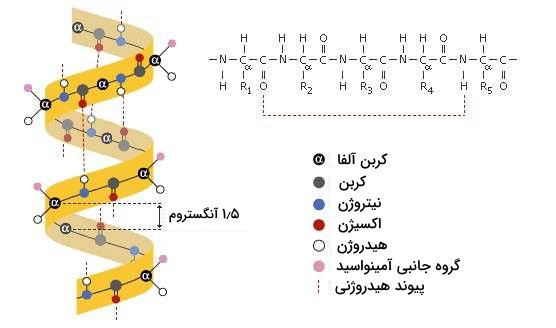
حضور بعضی از آمینواسیدها میتواند تشکیل مارپیچ آلفا را تحت تاثیر قرار دهد. برای مثال آمینواسید پرولین به عنوان «مارپیچ شکن» شناخته میشود، زیرا گروه جانبی (گروه R) این آمینواسید با گروه آمینو پیوند برقرار کرده و یک حلقه به وجود آورده است، این حلقه مانع از پیچخوردگی درست مارپیچ آلفا میشود. پرولین به طور معمول در نواحی خمهای موجود در ساختار پروتئین قرار دارد، منظور از این نواحی بخشهایی است که مثلا بین دو مارپیچ آلفای متفاوت قرار دارند.
صفحات بتا
در صفحات بتا، دو یا چند بخش از زنجیره پلیپپتیدی کنار یکدیگر ردیف میشوند و یک ساختار صفحه مانند را تشکیل میدهند که به وسیله پیوندهای هیدروژنی ساخته شده است. پیوند هیدروژنی بین گروههای آمینو و کربونیل ستون فقرات تشکیل میشوند و گروههای جانبی نیز در بالا و پایین صفحه جایگیری میکنند.
نحوه قرارگیری رشتههای پلیپپتیدی در صفحات بتا اهمیت زیادی دارد و باید به جهت قرارگیری آنها توجه کرد، دو شیوه قرارگیری در این صفحات دیده میشود.
- موازی (Parallel): رشتهها در یک جهت هستند، یعنی N-ترمینال و C-ترمینال رشتهها در یک جهت است.
- ناموازی (Antiparallel): رشتهها در جهتهای مخالف قرار دارند، یعنی N-ترمینال یک رشته در کنار C-ترمینال رشته کناری قرار میگیرد.
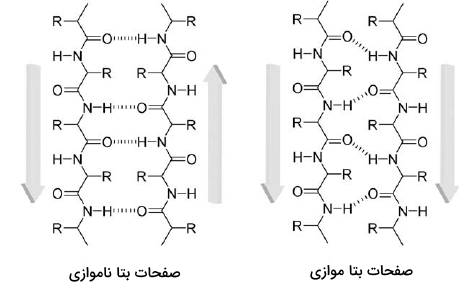
آمینواسیدهایی مانند تیروزین، تریپتوفان و فنیل آلانین که گروه جانبی آنها شامل حلقههای بزرگ است، به طور معمول در صفحات بتا دیده میشوند. گمان میرود که دلیل این اتفاق این موضوع باشد که صفحات بتا فضاهای جانبی بیشتری در اختیار گروههای جانبی آمینواسیدها قرار میدهند.
یادگیری زیست شناسی سلولی و مولکولی با فرادرس
زیست شناسی سلولی و مولکولی یکی از شاخههای گسترده و بسیار پرطرفدار زیستشناسی است که پس از ساخت میکروسکوپها محبوبیت بسیار زیادی پیدا کرد. در مطالعات زیستشناسی سلولی و مولکولی به تحقیق درباره ساختار و عملکرد سلولها به عنوان واحدهای اصلی سازنده موجودات زنده میپردازند.
نقطه شروع یادگیری این علم آشنایی با سلولها و ساختار آنهاست، پس از آن قادر خواهید بود با فعل و انفعالات رخ داده درون سلولها آشنا بشوید که در این بخش دانش مولکولی شما افزایش پیدا میکند. با توجه به اهمیت بیوتکنولوژی در دنیای مدرن، آشنایی با مفاهیم سلولی و مولکولی برای اکثریت محققان مشغول در مطالعات مربوط به بیوتکنولوژی امری ضروری به نظر میرسد. فرادرس دورههای متنوعی از مفاهیم پایهای گرفته تا دورههای پیشرفته بیوانفورماتیکی تهیه و منتشر کرده است که در ادامه تعدادی از آنها را به شما معرفی میکنیم.
- فیلم آموزش مبانی و مفاهیم مقدماتی زیست شناسی سلولی و مولکولی فرادرس
- فیلم آموزش زیست شناسی سلولی فرادرس
- فیلم آموزش بیوشیمی عمومی بخش پروتئین ها و آمینواسیدها فرادرس
- فیلم آموزش تکنیک وسترن بلات برای جداسازی و شناسایی پروتئین ها فرادرس
- فیلم آموزش پایگاه داده های بیوانفورماتیکی پروتئین برای آنالیز ویژگی پروتئین ها
ساختار سوم پروتئین
به ساختار سه بعدی نهایی یک پلیپپتید، ساختار سوم میگوییم. ساختار سوم به دلیل ارتباطات بین گروههای جانبی آمینواسیدها ایجاد میشود. این ارتباطات که ساختار سوم را میسازند به دلیل پیوندهای زیر ایجاد میشوند.
- پیوند هیدروژنی
- پیوند یونی
- برهمکنشهای دوقطبی-دوقطبی
- نیروی پراکندگی لاندن
برای یادگیری بهتر تفاوتها و نحوه تشکیل هر کدام از این پیوندهای شیمیایی، فیلم آموزش رایگان پیوندهای شیمیایی در شیمی عمومی از فرادرس را به شما توصیه میکنیم. لینک این آموزش را در کادر زیر درج کردهایم.
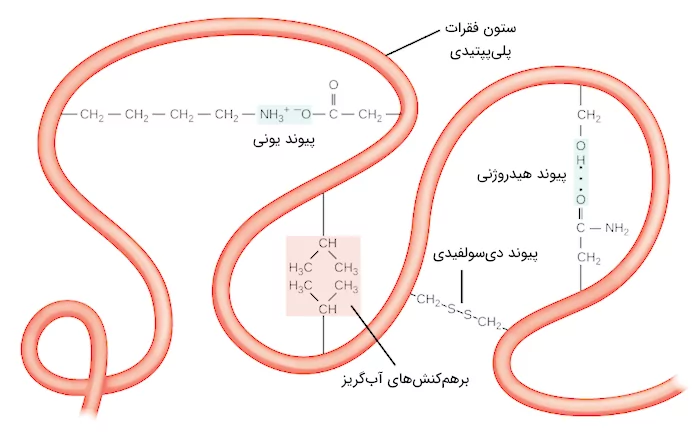
در اصل میتوان گفت که انواع پیوندهای غیرکووالانسی مسئول ایجاد ساختار سوم پروتئین هستند. به عنوان مثال میتوان به گروههای جانبی اشاره کرد که بار مشابه دارند و یکدیگر را دفع میکنند، در حالی که گروههایی با بار مخالف، با یکدیگر پیوند یونی تشکیل میدهند. اگر گروه جانبی آمینواسید قطبی باشد، میتواند با گروه قطبی دیگری پیوند هیدروژنی یا برهمکنش دوقطبی-دوقطبی تشکیل دهد.
در ساختار سوم پروتئین برهمکنشهای آبگریز یا هیدروفوب نیز اهمیت بالایی دارند. آمینواسیدهایی با گروههای جانبی غیرقطبی و آبگریز در بخش داخلی پروتئین جمع میشوند و آمینواسیدهایی که آبدوست هستند در سطح خارجی پروتئین جایگیری میکنند تا بتوانند با مولکولهای آب ارتباط داشته باشند.
در ساختار سوم بعضی پروتئينها یک نوع از پیوند کووالانسی وجود دارد که بین دو اتم گوگرد ایجاد میشود و آن را با عنوان «پیوند دیسولفیدی» (Disulfide Bond) میشناسیم. در گروه جانبی آمینواسید سیستئین اتم گوگرد وجود دارد که میتوانند این پیوندهای دیسولفیدی را در ساختار پروتئینها ایجاد کنند. این دسته از پیوندها، قویتر از دیگر پیوندهای نام برده هستند و به عنوان نقاط اتصالی قوی مولکولی عمل میکنند، زیرا میتوانند بخشهای پلیپپتیدی مختلف را محکم کنار یکدیگر نگه دارند.
برای کسب اطلاعات کاملتر راجع به انواع نیروهایی که در این بخش نام بردیم، به شما مطالعه مطلب «نیروهای بین مولکولی در شیمی — به زبان ساده» از مجله فرادرس را توصیه میکنیم.
دومینها و موتیفها
پس از تشکیل ساختارهای مختلف یک پروتئین میتوان یک پروتئین را به بخشهای مختلفی تقسیم کرد که به آنها «موتیف» (Motifs) و «دومین» (Domain) میگوییم. موتیفها متشکل از چند ساختار دوم هستند که کنار هم قرارگیری آنها به پروتئین یک قابلیت خاص میدهد. برای مثال یک موتیف میتواند متشکل از یک مارپیچ آلفا، یک «دور» (Turn) و مارپیچ آلفای بعدی باشد، ممکن است حضور این موتیف در یک پروتئین به آن قابلیت اتصال به DNA را بدهد.
توجه داشته باشید که حضور این موتیف به تنهایی نمیتواند توانایی اتصال به DNA را به پروتئین بدهد، بلکه حضور این موتیف و ارتباطش با دیگر بخشهای پروتئین دلیل به وجود آمدن این خاصیت است.
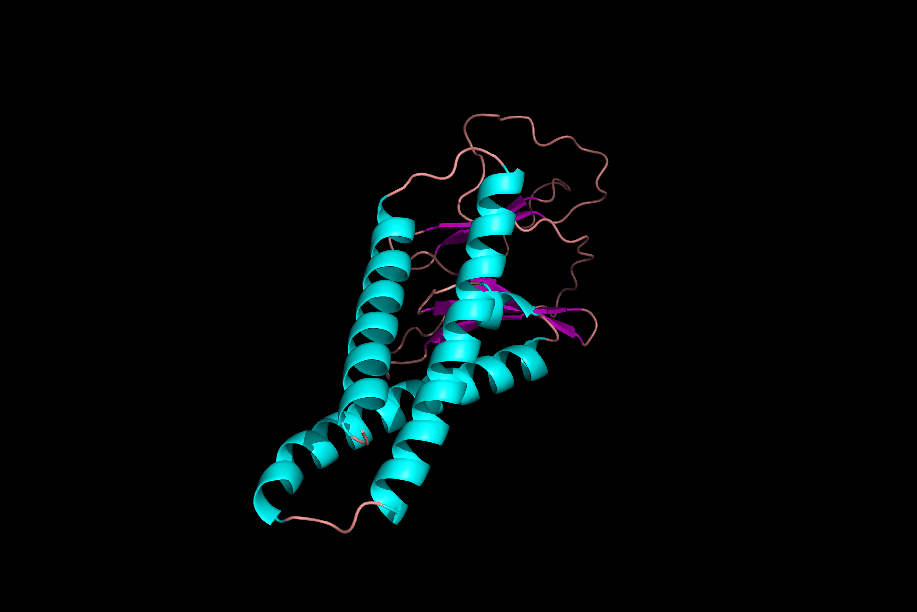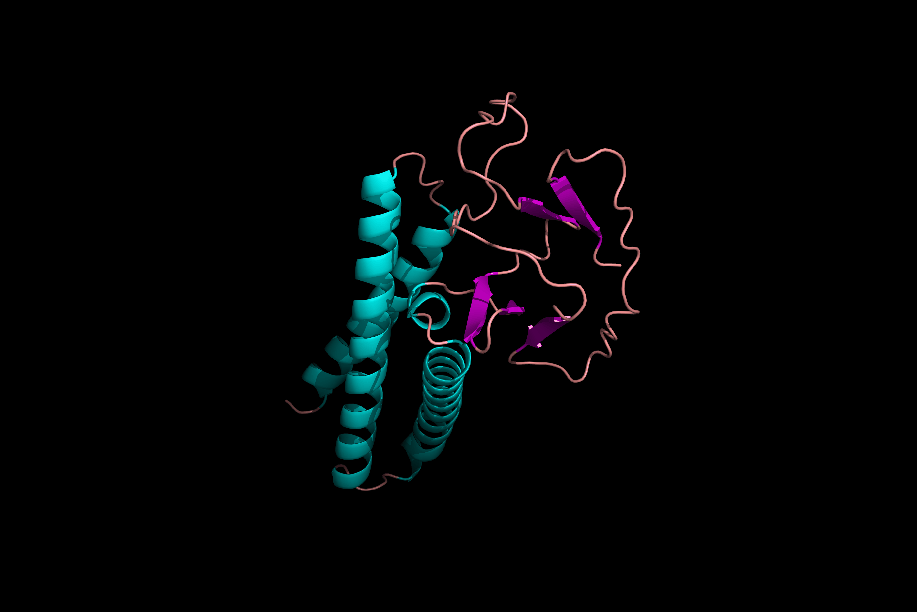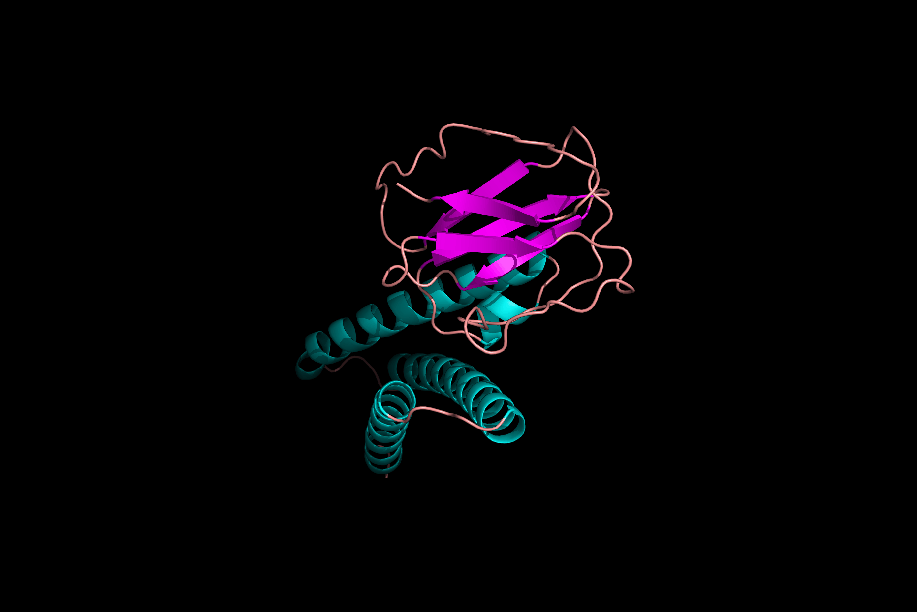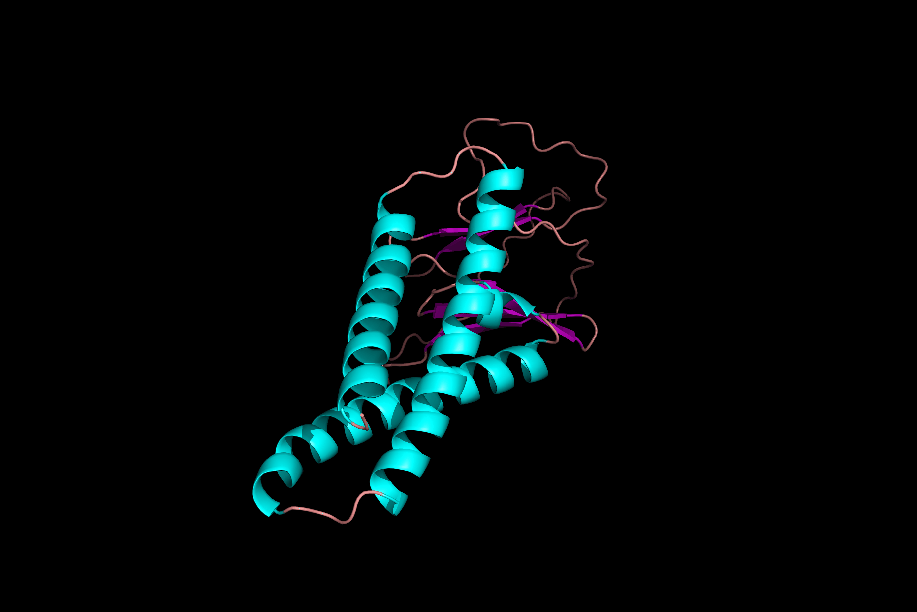
دلیل عدم فعالیت موتیفها به تنهایی چیست؟
موتیفهای مختلف یک پروتئین در حین تشکیل ساختار سوم، کنار هم قرار میگیرند و با پیوندهای مختلف ازجمله پیوند هیدروژنی به یکدیگر متصل میشوند. در نظر بگیرید که بتوانیم یکی از موتیفهای پروتئینی را جدا کنیم، این موتیف با از دست دادن پیوندهای هیدروژنی که با دیگر موتیفها برقرار کرده بود، ساختار اصلی و کارآمد خود را از دست میدهد و نتیجه این اتفاق بیثمر بودن موتیف جدا شده است.
دومینها ساختارهایی سه بعدی و دارای فعالیت هستند. یک پروتئین میتواند ۱ یا چند دومین داشته باشد و هر دومین نیز میتواند متشکل از ۱ یا چند موتیف باشد. دومینها برخلاف موتیفها برای فعال بودن به دیگر بخشهای پروتئین وابسته نیستند.
اگر یک دومین را از دیگر دومینهای پروتئین جدا کنیم، دومین جداشده ساختار فضایی خود را از دست نمیدهد، زیرا برای حفظ ساختار خود وابسته به پیوندهای هیدروژنی که به بخشهای دیگر متصلش کنند، نبوده است. از دست ندادن شکل فضایی دومین به این معنی است که فعالیت خود را از دست نمیدهد. برای مثال دومینی را در نظر بگیرید که میتواند ATP را تجزیه کند، این دومین حتی پس از جداسازی از پروتئين قادر به تجزیه ATP است.
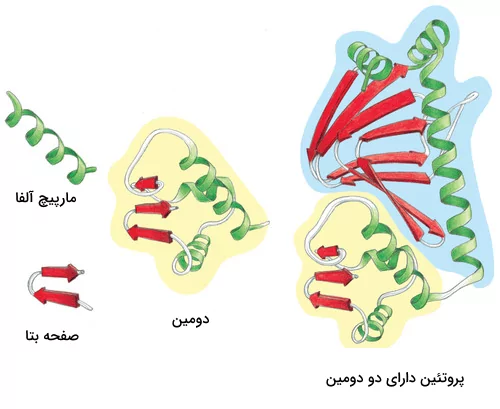
جهش در ساختار یک دومین نه تنها میتواند فعالیت همان دومین را تحت تاثیر قرار دهد بلکه قادر است فعالیت دومینهای دیگر پروتئین را نیز تغییر داده یا متوقف کند. با توجه به این نکته میتوان نتیجه گرفت که برای فعالیت یک پروتئین باید از توالی دومینها در طی روند تکامل محافظت شده باشد. مطالعات تکاملی دانشمندان در سطح پروتئینهای گونههای مختلف نیز این موضوع را به اثبات رسانده است.
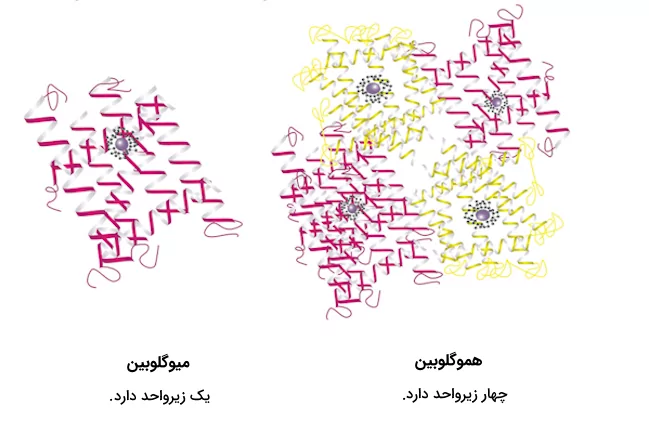
ساختار چهارم پروتئين
بسیاری از پروتئينها از یک زنجیره پلیپپتیدی تشکیل شدهاند و ۳ سطح از سطوح مختلف ساختاری پروتئين را طی میکنند تا فعالیت خود را از سر بگیرند، اما بعضی پروتئینها از چند رشته پلیپپتیدی ساخته شدهاند که به آنها «زیرواحد» (Subunit) گفته میشود. زمانی که این زیرگروهها کنار یکدیگر قرار بگیرند، ساختار چهارم پروتئين شکل میگیرد.
هموگلوبین یکی از پروتئینهایی است که ساختار چهارم را در آن میبینیم. در بخش ساختار اول پروتئین گفتیم که هموگلوبین از ۴ زیرگروه تشکیل شده است که شامل ۲ رشته آلفا و ۲ رشته بتا است. DNA پلیمراز نیز یکی دیگر از مثالهای این دسته از پروتئینها است. این آنزیم که در سنتز رشتههای جدید DNA نقش دارد، از ۱۰ زیرواحد تشکیل شده است.
پیوندهای مسئول در ساختار چهارم پروتئین، همان پیوندهای مسئول در ساختار سوم هستند، اما در بین پیوندهای نام برده شده پیوندهای ضعیفتری مانند پیوند هیدروژنی و نیروی پراکندگی لاندن نقش پررنگتری در تشکیل ساختار چهارم دارند. این پیوندها زیرگروههای مختلف را کنار یکدیگر نگه میدارند.
جدول مقایسه سطوح مختلف ساختاری پروتئين
تا اینجای این مطلب از مجله فرادرس با سطوح مختلف ساختاری پروتئین به طور دقیقی آشنا شدیم، اما در بین این مطالب نکاتی وجود دارند که اهمیت بیشتری دارند، ازجمله این نکات پیوندهای مسئول در تشکیل ساختارهای هر مرحله هستند. در جدول زیر علاوه بر پیوندها به ساختارهایی که در هر مرحله میبینیم نیز اشاره شده است تا اطلاعات بخشهای قبلی به خوبی مرور شود.
| سطوح مختلف ساختاری پروتئین | پیوندهای مسئول در تشکیل | ساختارهای دیده شده در هر مرحله |
| ساختار اول پروتئين | پیوند پپتیدی | توالی پلیپپتیدی (زنجیره آمینواسیدها) |
| ساختار دوم پروتئين | پیوند هیدروژنی | مارپیچ آلفا، صفحات بتا، حلقهها و خمیدگیها |
| ساختار سوم پروتئین | پیوند هیدروژنی | دومینها و موتیفها |
| پیوند یونی | ||
| برهمکنش دوقطبی-دوقطبی | ||
| نیروی پراکندگی لاندن | ||
| برهمکنشهای آبگریز | ||
| پیوند دیسولفیدی (نوعی پیوند کووالانسی) | ||
| ساختار چهارم پروتئین | پیوندهای شکلدهنده ساختار سوم به ویژه پیوند هیدروژنی و نیروی پراکندگی لاندن | زیرواحدهای متفاوت |
دناتوره شدن و پیچخوردگی پروتئین
هر پروتئينی ساختار فضایی و شکل منحصر به فرد خودش را دارد. در صورتی که دما یا pH محیط اطراف پروتئین تغییر کند، یا در معرض مواد شیمیایی قرار بگیرد، امکان دارد پیوندهای موجود در ساختار پروتئین از بین بروند و این مولکول زیستی ساختار خودش را از دست بدهد و تبدیل به زنجیره آمینواسیدی بشود که هیچ ساختار سه بعدی ندارد.
هنگامی که پروتئین ساختار پیچیده خود را از دست بدهد، با عنوان «پروتئین دناتوره شده» شناخته میشود و به طور معمول در این شرایط فعالیتی ندارند. برای بعضی از پروتئینها دناتوراسیون میتواند برگشتپذیر باشد، زیرا زنجیره پلیپپتیدی از بین نرفته است و امکان دارد که توانایی دوباره پیچ و تاب خوردن را داشته باشد. به روند بازآرایی ساختار فضایی «رناتوراسیون» گفته میشود.
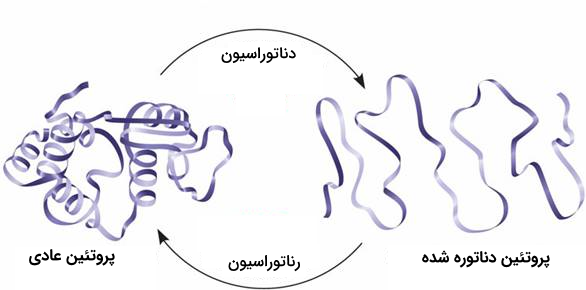
در اکثر مواقع دناتوره شدن پروتئین اتفاقی دائمی و برگشت ناپذیر است. برای مثال هنگامی که تخممرغ را آبپز میکنیم، «آلبومین» که نوعی پروتئين موجود در سفیده تخممرع است، به دلیل دمای بالای آب دناتوره میشود و دیگر به حالت اصلی خود برنمیگردد.
بعضی از پروتئينها تنها به واسطه توالی آمینواسیدی خود میتوانند سطوح مختلف ساختار پروتئين را طی کنند و فعالیت خودشان را بازسازی کنند اما اکثر پروتئینها نمیتوانند بدون کمک گرفتن از پروتئینهای «چپرون» (Chaperone) به درستی پیچ و تاب بخورند، از آنجایی که این پروتئینها در محیطهایی مثل لوله آزمایش در دسترس نیستند، پروتئينهای دناتوره نمیتوانند دوباره به درستی ساختار فضایی خود را بسازند.
عوامل موثر بر سطوح مختلف ساختاری پروتئين
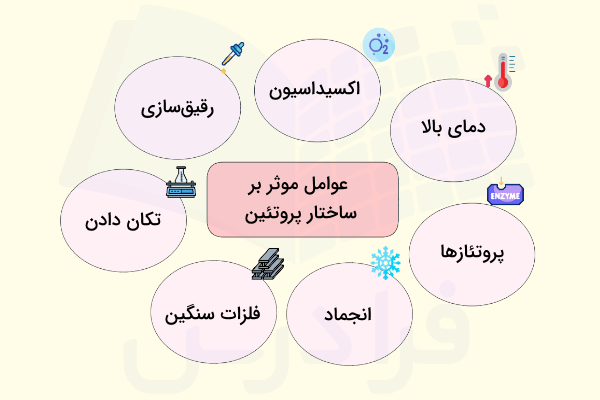
پروتئینها مولکولهای حساسی هستند که عوامل گوناگونی میتوانند ساختار آنها را تحت تاثیر قرار بدهند و منجر به دناتوراسیون آنها بشوند. همانطور که در بخش قبل گفتیم، دناتوراسیون به معنی از دست دادن ساختار پروتئین است که در اکثر اوقات به صورت برگشت ناپذیر اتفاق میافتد. عوامل اصلی موثر بر ثبات ساختاری پروتئينها موارد زیر هستند.
- دمای بالا: دمای بالا، انرژی سینتکی را افزایش میدهد که باعث افزایش سرعت جنبش مولکول میشود. این موضوع باعث قطع شدن پیوندهای هیدروژنی و دیگر برهمکنشهای هیدروفوب غیرقطبی میشود و به این ترتیب دناتوراسیون پروتئين رخ میدهد.
- فعالیت پروتئازی: آنزیمهای تجزیهکننده پروتئینها که به آنها «پروتئاز» میگوییم، در شرایط مختلف آزاد میشوند و میتوانند باعث دناتوره شدن پروتئینها شوند. در شرایط آزمایشگاهی برای جلوگیری از فعالیت این آنزیمها میتوان از روشهای مختلفی مانند نگهداری پروتئين روی یخ استفاده کرد.
- انجماد: زمانی که یک محلول حاوی پروتئین را منجمد میکنیم تا بعد از آن را گرم کرده و استفاده کنیم، احتمال دارد که پروتئینها از لحاظ ساختاری آسیب ببینند.
- حضور فلزات سنگین: نمک فلزات سنگین، یونی هستند و میتوانند باعث اختلال در پیوندهای یونی داخل ساختار پروتئین شوند. در نتیجه این اتفاق ترکیبی از پروتئين و فلز سنگین ایجاد میشود که نامحلول است.
- اکسیداسیون: پروتئینها در صورت اکسید شدن، ناپایدار میشوند.
- اثر رقیقسازی: رقیقسازی یک محلول پروتئینی میتواند پایداری پروتئين را تحت تاثیر قرار دهد. برای جلوگیری از دناتوراسیون پروتئین هنگام رقیقسازی باید غلظت پروتئین را بیشتر از ۱ میلیگرم در هر میلیلیتر نگهداشت.
- تکان دادن: روشهای آزمایشگاهی مثل «Shaking» ،«Vortexing» یا هم زدن محلولها میتواند باعث تهنشینی پروتئينها و دناتوره شدن آنها بشود.
توجه به عوامل موثر بر ساختار پروتئینها میتواند به بهبود فرآیند آزمایشهای آزمایشگاهی کمک کند.
روشهای مطالعه سطوح مختلف ساختاری پروتئین
روشهای متعددی برای مطالعه ساختارهای پروتئینها وجود دارند که استفاده از هر کدام مزایا و معایب مختص به خود را دارد.
- «کریستالوگرافی پرتو ایکس» (X-Ray Crystallography)
- «طیفسنجی رزونانس مغناطیسی هسته» (Nuclear Magnetic Resonance Spectroscopy | NMR Spectroscopy)
- «میکروسکوپ الکترونی» (Electron Microscopy)
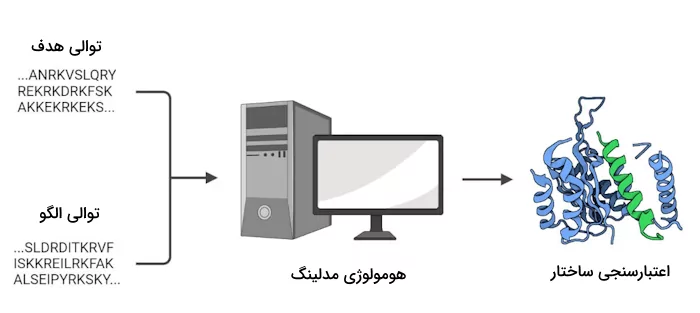
- «هومولوژی مدلینگ» (Homology Modeling)
مطالعه ساختار پروتئینها به ما کمک میکند تا با فعالیتها متنوع آنها آشنا شویم. با توجه به این که آنزیمها بزرگترین دسته پروتئينها هستند، آشنایی با سطوح مختلف ساختاری پروتئین به محققان این امکان را میدهد که با واکنشهای آنزیمی آشنا شده و آنزیمهایی با ویژگیهای خاص را طراحی و تولید کنند.
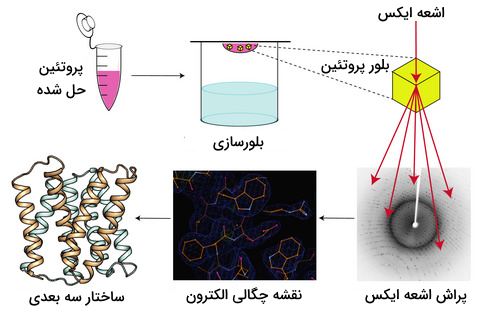
کریستالوگرافی پرتو ایکس
یکی از رایجترین روشهای تعیین ساختار پروتئینها کریستالوگرافی پرتو X است. برای استفاده از این روش ابتدا باید بلور (کریستال) پروتئین را به دست آورد و سپس آن را در معرض پرتو ایکس گذاشت. پراش اشعه ایکس توسط نقشه چگالی الکترون ساخته شده در این روند، تحلیل میشود. از این نقشه برای تعیین موقعیت مکانی هر اتم تشکیل دهنده پروتئین استفاده میکنند.
بنابراین میتوان گفت که به کمک کریستالوگرافی پرتو ایکس میتوان اطلاعات جزئی اتمهای ساختار پروتئینها را به دست آورد. اما این روش کارآمد محدودیتهایی نیز دارد. غیرممکن است که بتوان از تمام پروتئینها بلور تهیه کرد، در حقیقت این روش برای پروتئینهای سخت در مقایسه با پروتئینهایی با قدرت انعطافپذیری زیاد، کاربرد بیشتری دارد.
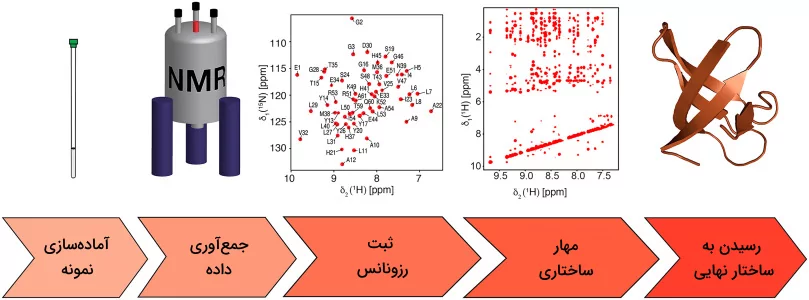
طیف سنجی رزونانس مغناطیسی هسته
در طیفسنجی NMR پروتئینهای خالص شده را در یک میدان مغناطیسی قرار میدهند، سپس آنها را با استفاده از امواج رادیویی بررسی میکنند. رزونانس حاصل از این مرحله اطلاعاتی راجع به کنفورماسیون اتمها ارائه میدهد که میتوان به کمک آن ساختار پروتئین را تعیین کرد. این روش برای مطالعه پروتئینهای انعطافپذیر موجود درون محلولها مناسب است. محدودیت این روش زمانی مشخص میشود که با یک پروتئین بزرگ مواجه باشیم، زیرا ممکن است در قلههای طیفسنجی همپوشانیهایی وجود داشته باشد که تحلیل را دشوار میکنند.
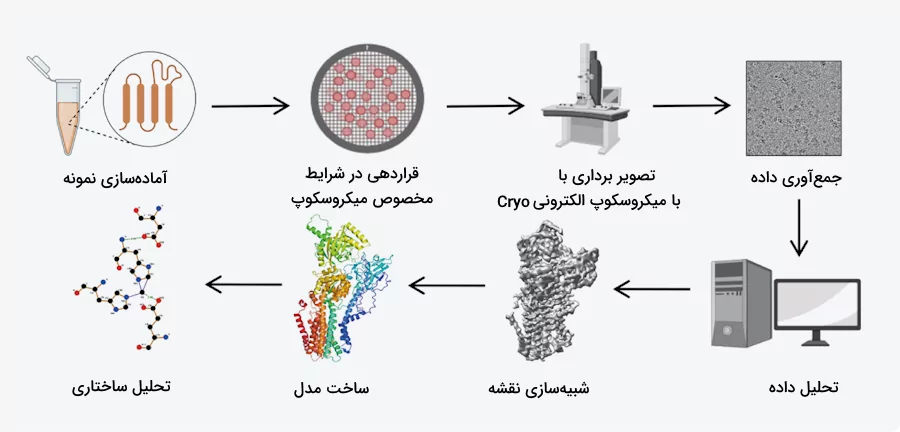
میکروسکوپ الکترونی
استفاده از میکروسکوپ الکترونی سه بعدی روشی برای تعیین ساختار سه بعدی مولکولهای بزرگ است. در این روش با استفاده از پرتوهای الکترونی و عدسیهای خاص از مولکولهای زیستی تصویربرداری میکنند. نحوه آمادهسازی نمونه برای عکسبرداری الکترونی بسیار مهم است، برای مثال در روش «میکروسکوپ الکترونی کرایو» (Cryo-EM) نمونه در یخ قرار دارد و یک تصویر دوبعدی از آن به دست میآید.
هومولوژی مدلینگ
هومولوژی مدلینگ یک روش محاسباتی برای پیشبینی ساختار پروتئین است. روشهایی تجربی مانند الگوهای به دست آمده از کریستالوگرافی اشعه ایکس، اطلاعات اتمی حاصل از طیفسنجی NMR و ساختار فضایی کلی پروتئين که توسط میکروسکوپ الکترونی به دست میآید، برای رسیدن به مدل اتمی یک پروتئین کافی نیستند. بنابراین باید از ابزارهای محاسباتی نیز برای تحلیل توالی پروتئینها استفاده کرد.
در هومولوژی مدلینگ با در نظر گرفتن ساختار یک پروتئین شناخته شده به عنوان الگو شروع به مطالعه پروتئین ناشناخته میکنند. پروتئین الگو باتوجه به میزان شباهتش به پروتئین مدنظر انتخاب میشود. در این روند، توالی آمینواسیدی پروتئین الگو با پروتئین هدف مقایسه میشود تا ساختار پروتئین تعیین شود.
جمعبندی
در این مطلب از مجله فرادرس با سطوح مختلف ساختاری پروتئين آشنا شدیم که شامل موارد زیر است.
- ساختار اول پروتئين: زنجیره پلیپپتیدی
- ساختار دوم پروتئین: مارپیچ آلفا و صفحات بتا
- ساختار سوم پروتئین: موتیفها و دومینها
- ساختار چهارم پروتئین: برهمکنش دو یا چندین زنجیره پلیپپتیدی
یکی از عوامل تعیینکننده شکل فضایی پروتئینها توالی پلیپپتیدی آنها است که به وسیله ژن مربوط به پروتئین تعیین میشود. بسیاری از پروتئينها برای این که به ساختار فضایی مطلوب برای فعال شدن برسند نیاز به حضور پروتئینهایی به نام «چپرون» دارند.
مطالعه ساختار پروتئینها اهمیت بالایی دارد، زیرا فعالیت این ماکرومولکولهای زیستی به همین ساختار سهبعدی وابسته است. روشهای متفاوتی برای مطالعه و پیشبینی ساختار پروتئینها وجود دارد که هر کدام با مزایا و محدودیتهایی همراه است.