آمیدها – به زبان ساده
یک آمید به طور معمول از کربوکسیلیک اسید مشتق میشود. یک کربوکسیلیک اسید شامل گروه است. با جایگزینی گروه به جای گروه ، به ساختار آمید خواهیم رسید. بنابراین یک آمید شامل گروه خواهد بود.


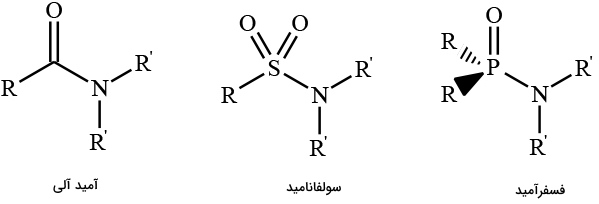
یک تعریف جامعتر برای آمیدها به این صورت است که آمیدها ترکیباتی با گروه عاملی هستند. در جدول زیر میتوان فرمول عمومی بسیاری از آمیدها را مشاهده کرد:
| آمید | فرمول کلی آمید |
| کربوکسی آمید (آمیدهای آلی) | |
| فسفرآمید | |
| سولفونامید |
ساختار و تشکیل پیوند
سادهترین آمیدها مشتقاتی از آمونیاک هستند که در آنها یک گروه آسیل با یک اتم هیدروژن جایگزین شده است. در این صورت شکل کلی این ترکیب را میتوان به صورت نشان داد. این نوع از آمید را با نام «آمید نوع اول» (Primary Amide) میشناسند. آمیدهای نوع دوم از آمینهای نوع اول مشتق میشوند و فرمول عمومی آنها به صورت است.
به همین صورت آمیدهای نوع سوم مشتقاتی از آمینهای نوع دوم هستند و فرمولی به صورت دارند. همانطور که در بالا اشاره شد، آمیدها را به عنوان مشتقاتی از کربوکسیلیک اسیدها در نظر میگیرند که گروه هیدروکسیل آنها با یک آمین یا آمونیاک جایگزین شده است.
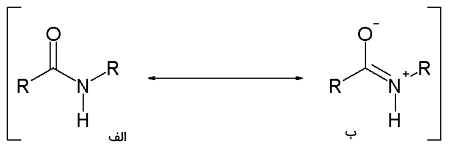
در خصوص تصویر زیر ذکر این نکته ضروری است که جفتالکترونهای ناپیوندی نیتروژن میتوانند به گروه عاملی کربونیل جذب و موجب تشکیل یک پیوند دوگانه با کربن متصل به گروه کربونیل شود. در نتیجه، نیتروژن در آمیدها به شکل هرمی نیست. به طور مثال، ساختار استامید را به صورت یک ساختار رزونانسی در نظر میگیرند که 62 درصد به صورت الف و 28 درصد به صورت ب قرار دارد:
نامگذاری آمیدها
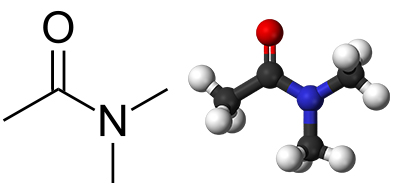
به طور معمول از عبارت آمید برای نامگذاری آمیدها استفاده میشود و کافی است تا این عبارت را به ریشه اسید مولد آن اضافه کرد. به طور مثال، آمیدی که از استیک اسید مشتق شده است را به صورت «استامید» (Acetamide) نامگذاری میکنند، البته آیوپاک نام اتانآمید (اتانامید) را پیشنهاد داده است که کاربرد کمتری دارد. زمانی که آمید از یک آمین نوع اول یا دوم مشتق شده باشد، گروهای جایگزین را در ابتدای نام آن ذکر میکنیم. در نتیجه، آمیدی که از دیمتیل آمین با فرمول و استیک اسید گرفته شده است را به صورت (ان و ان- دیمتیل استامید) نامگذاری میکنند که مدل و ساختار آن در تصویر زیر آورده شده است:
نامگذاری آمیدهای نوع اول
آمیدهای نوع اول را با حذف پسوندهای «ایک» و «اوییک» و اضافه کردن عبارت «آمید» نامگذاری میکنند. شمارهگذاری را از کربن متصل به گروه کربونیل آغاز میکنیم. البته نیازی به ذکر شماره گروه عاملی نیست چراکه فرض میشود گروه عاملی در انتهای زنجیره والد قرار دارد.
مثال
ساختار ۳-کلروبنزامید و پنتامید را رسم کنید.
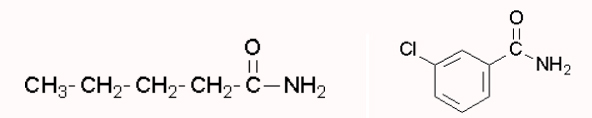
نامگذاری آمیدهای نوع دوم
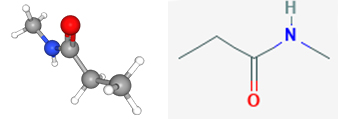
در نامگذاری آمیدهای نوع دوم از حرف استفاده میکنیم تا گروه آلکیل متصل به نیتروژن را مشخص کنیم. به طور مثال ان-متیل پروپانامید بیانگر این است که گروه متیل به نیتروژن متصل است.
نامگذاری آمیدهای نوع سوم
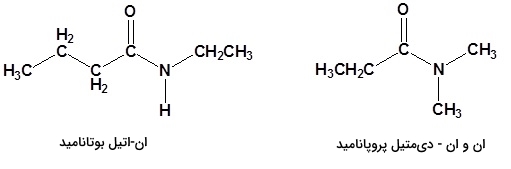
نامگذاری آمیدهای نوع سوم را به همان صورت آمیدهای نوع دوم انجام میدهیم با این تفاوت که در صورت لزوم از دو حرف استفاده میکنیم.
خواص آمیدها
حلالیت و همچنین خواص بازی را میتوان در خصوص آمیدها مورد بررسی قرار داد:
قدرت بازی
آمیدها بازهای بسیار ضعیفی در مقایسه با آمینها هستند. اسید مزدوج یک آمید، برابر با دارد، درحالیکه اسید مزدوج یک آمین دارای برابر با است. این خاصیت ضعیف بازی را میتوان در طبیعت الکترونگیرنده گروه کربونیل جستجو کرد، جایی که جفتالکترونهای ناپیوندی نیتروژن بوسیله رزونانس از آن جدا میشوند. در مقابل، آمیدها نسبت به کربوکسیلیک اسیدها، آلدهیدها، استرها و کتونها، بازهای قویتری هستند.
به دلیل الکترونگاتیوی بیشتر اکسیژن، گروه کربونیل ، خاصیت «دوقطبی» (Dipole) بیشتری نسبت به پیوند دارد. این ویژگی سبب میشود تا آمید به عنوان پذیرنده پیوند هیدروژنی عمل کند. در آمیدهای نوع اول و دوم، حضور پیوند عاملی است تا آمیدها به عنوان دهنده پیوند هیدروژنی نیز عمل کنند. در نتیجه آمیدها میتوانند در تشکیل پیوندهای هیدروژنی با آب و دیگر حلالهای پروتوندار نقش داشته باشته باشند.
علاوه بر این، اتم اکسیژن میتواند پذیرای پیوند هیدروژنی از آب باشد و همچنین اتم هیدروژن در پیوند به عنوان دهنده پیوند هیدروژنی عمل میکند. در نتیجه این برهمکنشها، حلالپذیری آمیدها در آب نسبت به هیدروکربنهای متناظر خود بیشتر است.
پروتونِ آمیدهای نوع اول یا دوم به سادگی و تحت شرایط معمول تفکیک نخواهند شد. به عکس، تحت شرایط به شدت اسیدی، اکسیژن گروه کربونیل پروتوندهی میشود و در حدود خواهد داشت. این اتقاق نه تنها به دلیل بار مثبت نیتروژن، بلکه به خاطر رزونانس و بار منفی روی اکسیژن نیز صورت میگیرد.
انحلالپذیری
همانطور که در بالا اشاره شد، آمیدها و استرها حلالپذیری خوبی دارند. به طور معمول، آمیدها از آمینها و کربوکسیلیکاسیدها حلالپذیری کمتری دارند. لازم به ذکر است که آمیدهای نوع سوم به جز «ان و ان دی متیل فرمامید» (N,N-dimethylformamide)، حلالپذیری کمی در آب دارند.

کاربرد آمیدها
آمیدها در طبیعت و فناوری بسیار پرکاربرد هستند. تشکیل پیوندهای آمیدی بسیار ساده است و موجب افزایش استحکام ساختاری و مقاوت در برابر هیدرولیز میشود. نایلونها، «آرامید» (Aramid)، «توارن» (Twaron) و «کولار» (Kevlar) همگی در دسته پلیآمیدها قرار میگیرند. پیوندهای آمید موجب تعریف ویژگی مولکولی پروتئینها میشود.
در حقیقت بخشی از ساختار دوم پروتئینها به دلیل قابلیت پیوند هیدروژنی آمیدها است. در متون بیوشیمی، زمانی که پیوندهای آمیدی در زنجیره اصلی پروتئینها اتفاق بیافتند با نام «پیوندهای پپتیدی» (Peptide Bonds) و زمانی که در زنجیره جانبی آنها اتفاق بیافتند به نام «پیوندهای ایزوپپتیدی» (Isopeptide Bonds) شناخته میشوند. آمیدهای با جرم مولی پایین، همچون دیمتیل فرمامید با فرمول ، از جمله حلالهای پرمصرف قلمداد میشوند. بسیاری از داروها مانند پنیسیلین و استامینوفن نیز در دستهبندی آمیدها قرار میگیرند.
سنتز آمید
روشهای بسیاری برای سنتز آمیدها وجود دارد. سادهترین روش در تولید آمید، «جفتشدن» (Coupling) یک کربوکسیلیک اسید با آمین است. این واکنش به لحاظ ترمودینامیکی نیز امکانپذیر است اما برای انجام آن به «انرژی فعالسازی» (Activation Energy) زیادی نیاز داریم. در حقیقت کاستن پروتون از کربوکسیلیک اسید به انرژی زیادی نیاز دارد. در نتیجه، انجام واکنش زیر نیازمند دمای بالا است:
روشهای متعددی بر روی هدایت واکنشها به طرف راست تمرکز دارند. به عبارت دیگر، با فعالسازی کربوکسیلیک اسید و تبدیل آن به موادی همچون استرها، اسیدکلریدها (آسیلکلریدها) یا اسید انیدریدها که همگی الکتروندوستهای بهتری هستند، میتوان سنتز آمیدها را عملی کرد.

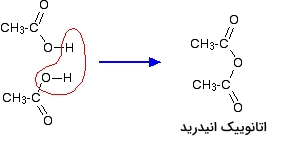
تولید آمید از اسید انیدرید
اگر یک مولکول آب را از دو کربوکسیلیک اسید حذف کنید، به اسید انیدرید دست پیدا خواهید کرد. به طور مثال، اگر از دو مولکول اتانوییک اسید، یک مولکول آب حذف شود، به اتانوییک انیدرید خواهیم رسید:
در تصویر زیر، واکنش یک آمین با اسید انیدرید و تولید یک آمید نمایش داده شده است:
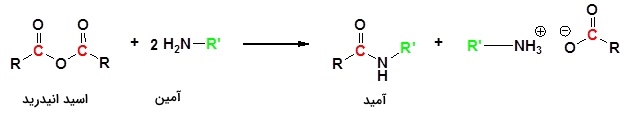
اگر اتانوییک اسید را به محلول غلیظ آمونیاک اضافه کنیم، اتانامید و آمونیوم اتانوات تولید میشوند. این واکنش در دو مرحله صورت میگیرد. در مرحله اول اتانامید و اتانوییک اسید به تولید میرسند:
در مرحله بعد، اتانوییک اسید تولیدی با آمونیاک اضافی وارد واکنش و آمونیوم اتانوات تولید میشود:
در نتیجه، واکنش کلی این مراحل به صورت زیر خواهد بود:
تولید آمید از کربوکسیلیک اسید
کربوکسیلیک اسید را ابتدا به نمکهای آمونیوم تبدیل و در مرحله بعد با گرما، تولید آمید میکنند. با اضافه کردن آمونیوم کربنات جامد به اسید میتوان نمکهای آمونیوم را تشکیل داد. به طور مثال، با اضافه کردن آمونیوم کربنات با مقدار اضافی از اتانوییک اسید، به آمونیوم اتانوات دست پیدا میکنیم:
پس از تکمیل واکنش، مخلوط حاصل را حرارت میدهند و طی یک فرآیند آبگیری، نمکهای آمونیوم، اتانامید تولید میکنند:
از مقدار اضافی اتانوییک اسید به این منظور استفاده میشود تا از تفکیک نمکهای آمونیوم قبل از آبگیری جلوگیری کنند. نمکهای آمونیوم در اثر گرما به آمونیاک و اسید مولد خود تبدیل میشوند که در یک واکنش تعادلی به هنگام سرد کردن، به حالت قبل برخواهند گشت. اگر در این حالت تفکیک نمکهای آمونیوم رخ بدهد، آمونیاک از واکنش حذف میشود و به نوعی آن را از دست میدهیم:
اگر با مفهوم ثابت تعادل و غلظتهای تعادلی آشنا باشید، متوجه خواهید شد که مقدار اضافی از اتانوییک اسید، جهت پیشرفت واکنش بالا را به طرف چپ هدایت میکند. این پدیده را همچنین میتوان به کمک اصل لوشاتلیه نیز بیان کرد.

نکات عملی برای انجام این روش
آمونیوم کربنات به آرامی به اتانوییک اسید غلیظ اضافه میشود و واکنش تا زمان توقف تولید دیاکسید کربن ادامه خواهد داشت.
در مرحله بعد، برای انجام مرحله آبگیری، ظرف واکنش را به مدت نیم ساعت تحت رفلاکس (جریان بازگشتی) حرارت میدهند.
مخلوط حاصل را در دمای ۱۷۰ درجه سانتیگراد تقطیر میکنند تا اتانوییک اسید اضافی و آب از آن حذف شود و در ظرف آزمایش، اتانامید خالص باقی بماند.
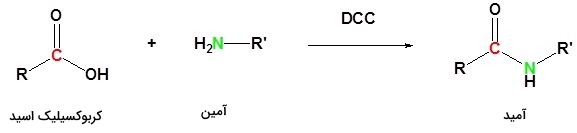
استفاده از ماده فعالساز
به کمک مادهای فعالساز با نام «ان، ان-دی سیکلو هگزیل کربودی ایمید» (N,N'-Dicyclohexylcarbodiimide)، میتوان کربوکسیلیک اسید را به آمید تبدیل کرد. لازم به ذکر است که نام تجاری این «ماده فعالساز» (Activating Agent) موسوم به DCC است و واکنش آن را در پایین ملاحظه میکنید:
تولید آمید از آسیل کلریدها
اسید کلریدها (آسیل کلریدها) دارای فرمول عمومی هستند. اتم کلر را میتوان به سادگی با دیگر ترکیبات جایگزین کرد. به طور مثال میتوان آن را با یک گروه برای تولید آمید جابجا کرد:
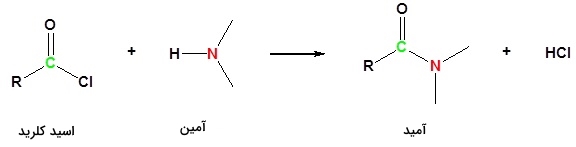
برای تولید اتانامید از اتانوییل کلرید، میتوان اتانوییل کلرید را به محلول غلیط آمونیاک در آب اضافه کرد. نتیجه این کار، یک واکنش شدید با تولید ابر سفید خواهد بود. این ابر سفید در حقیقت مخلوطی از آمونیوم کلرید جامد و اتانامید است. مقادیری از این مخلوط به صورت بیرنگ و محلول در آب حضور دارد. این واکنش را میتوان دو مرحلهای در نظر گرفت. در مرحله اول آمونیاک با اتانوییل کلرید وارد واکنش میشود و اتانامید و گاز هیدروژن کلرید تولید میکند:
هیدروژن کلرید تولیدی با آمونیاک اضافی واکنش میدهد و آمونیوم کلرید تولید میشود:
در نهایت، واکنش کلی را میتوان به صورت زیر در نظر گرفت:
تولید آمید از نیتریلها
هیدرولیز نیتریلها روشی مناسب برای آمادهسازی آمیدهای «بدون استخلاف» (Unsubstituted) است. این روش مخصوصا در محیطهای بازی و به کمک هیدروژن پراکسید، سادهتر انجام میشود.

برای آمادهسازی آمیدهایی با فرمول که در آنها یک گروه آلکیل نوع سوم با نیتروژن پیوند دارد، از «واکنش ریتر» (Ritter Reaction) استفاده میشود. این واکنش شامل واکنش یک الکل یا آلکن با نیتریل یا هیدروژن سیانید و شامل سه مرحله است. به طور مثال در تصاویر زیر، آمادهسازی «ان-ترت بوتیل آلکانامید» (N-tert-butylalkanamide) را ملاحظه میکنید. در این واکنشها را میتوان یک آلکیل سیانید مانند اتان نیتریل یا هیدروژن سیانید در در نظر گرفت:
واکنش اول شامل تشکیل یک کربوکاتیون در اثر واکنش اسید سولفوریک بر روی یک آلکن یا الکل است:
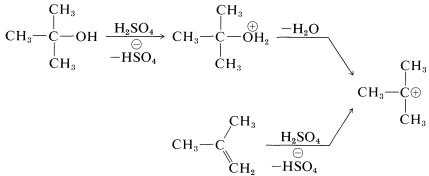
در واکنش دوم، کربوکاتیون، پذیرنده جفتالکترون ناپیوندی نیتروژن خواهد بود و در واکنش سوم آبدهی خواهیم داشت که هر دو واکنش به ترتیب در تصاویر زیر آورده شدهاند:
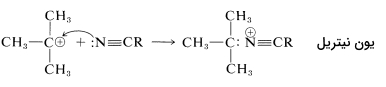
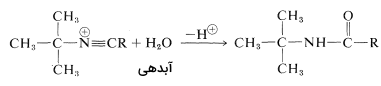
واکنشهای آمید
با وجود اینکه فعالیت آمیدها در مقایسه با استرها کمتر است، اما در واکنشهای شیمیایی بسیاری شرکت میکنند. آمیدها در شرایط بازی و همچنین شرایط اسیدی قوی هیدرولیز میشوند. در شرایط اسیدی، کربوکسیلیک اسید و یون آمونیوم به تولید میرسند و در شرایط بازی، یون کربوکسیلات و آمونیاک.
هستهدوستها (الکتروفیلها) به اکسیژن متصل به گروه کربونیل حمله میکنند. این مرحله به طور معمول قبل از هیدرولیز انجام و با اسیدهای لوری-برونستد کاتالیز میشوند. در جدول زیر، نام واکنشها و محصولات آنها آورده شده است:
| نام واکنش | محصول | توضیحات |
| «آبگیری» (Dehydration) | نیتریل | واکنشگر(ریجنت): فسفرپنتااکسید، بنزن سولفونیل کلراید |
| «بازآرایی هافمن» (Hofmann Rearrengement) | آمین با یک اتم کمتر کربن | ریجنت: برم و سدیم هیدرکسید |
| کاهش آمید | آمین | ریجنت: «لیتیوم آلومینیوم هیدرید» (LAH) |
| واکنش «ویلزمیر-هاک» (Vilsmerer-Haack Reaction) | آلدهید | استفاده از مواد «فسفریل کلرید» ، فرمامید |
| واکنش «بیشلر-نپیرالسکی» | «ایمین حلقوی» (Cyclic Imine) | استفاده از مواد فسفریل کلرید، تیونیل کلرید و ... |
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش ترمودینامیک مهندسی شیمی
- ساختار لوویس — به زبان ساده
- آلومینیوم و فرآیند هال — از صفر تا صد
^^













خیلی مفید بود ممنون