یون هیدرونیوم چیست؟ – به زبان ساده + فرمول
«یون هیدرونیوم» (Hydronium Ion) یا هیدرونیوم نامهای دیگر کاتیون آبیِ هستند که از ترکیب پروتون و آب بهوجود میآید. در معادلههای شیمیایی آبی، وقتی از استفاده میشود منظور یون هیدرونیوم است. اسیدیته هیدرونیوم معیاری برای محاسبه قدرت اسیدی محلولهای آبی است و به همراه هیدروکسید، یونهای تشکیل دهنده آب هستند. خواندن این مطلب به شما کمک میکند با مراحل رسم ساختار لوویس این یون و محاسبه pH به کمک غلظت آن آشنا شوید.
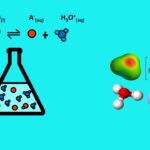
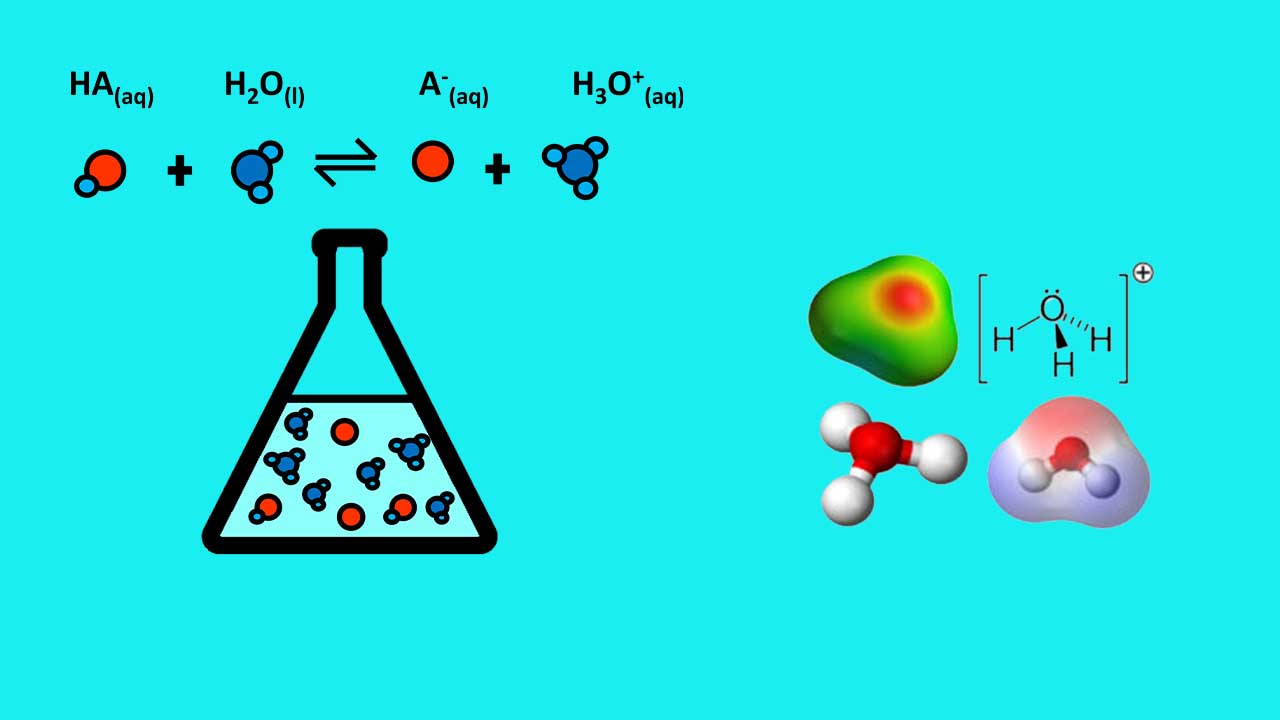
یون هیدرونیوم چیست ؟
یون هیدرونیوم کاتیونی است که از ترکیب یون هیدروژن با آب تشکیل میشود و سادهترین شکل اکسونیوم است. «اکسونیوم» (Oxonium) به یونی میگویند که در ساختارش، کاتیون اکسیژنِ سهظرفیتی داشته باشد. یون هیدرونیوم که همچنین با نامهای هیدروکسونیوم و هیدرونیوم نیز شناخته میشود بهطور رسمی در آیوپاک اکسونیوم نام دارد. برای این یون به ترتیب در شیمی آلی و معدنی نامهای اکسونیوم و «اکسیدانیوم» (Oxidanium) پیشنهاد شدهاند.
نماد یون هیدرونیوم
برهمکنش بین و به قدری زیاد است که شاید نوشتن به عنوان فرمول یون هیدرونیوم نادرست به نظر برسد. نوشتن یون هیدرونیوم در معادلات شیمیایی به صورت زمانی جایز است که بهیاد داشته باشیم در محلولهای آبی نه با یون هیدروژن، که با یون هیدرونیوم سر و کار داریم.
به دو دلیل فرمول شکل مناسبتری برای یون هیدرونیوم است:
- نشاندهنده مولکول است.
- نشاندهنده اسید مزدوجِ آب است.
هیدرونیوم چگونه تشکیل میشود؟
یون هیدرونیوم میتواند از راههای گوناگونی تشکیل شود. «خودیونش آب» (Self-ionization of Water) و واکنش آب و اسید از راههای رایج تشکیل این یون هستند.
خودیونش آب
یون هیدرونیوم میتواند از خودیونش آب بهوجود بیاید. آب از ترکیب یونهای با تشکیل شده است. از نسبت بین این دو یون برای بهدست آوردن پیاچ استفاده میکنند.
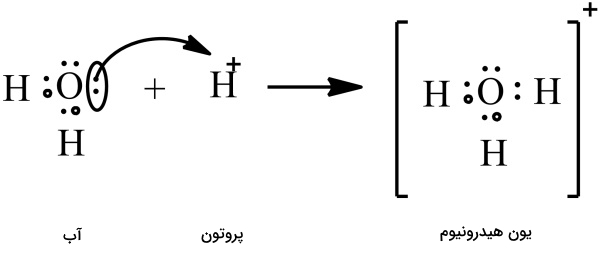
به دلیل اکترونگاتیوی بالای اکسیژن نسبت به هیدروژن، مولکول آب قطبی است و بار جزئی منفی دارد و میتواند یونهای را جذب کند. از پیوند یون هیدروژن با مولکول آب، یون هیدرونیوم بهوجود میآید.
به عبارتی دیگر، پروتون، کاتیونِ هیدروژن است که هیچ الکترونی ندارد. هنگامی که پروتون به مولکول آب نزدیک میشود، اکسیژن با دادن یک الکترون به هیدروژن، هیدرونیوم را تشکیل میدهد. از آنجاییکه در تشکیل هیدرونیوم، هر دو الکترون متعلق به اکسیژن هستند، پیوند تشکیل شده از نوع «پیوند داتیو یا کووالانس کوئوردینانس» (Coordinate Covalent Bond) است.
افزون بر الکترونگاتیوی بیشتر اکسیژن، دلیل دیگری که قطبی بودن مولکول آب را نشان میدهد هندسه مولکولی آن است. ساختار نامنتقارن آب باعث میشود که گشتاور دوقطبی الکتریکی داشته باشد. گشتاور دوقطبی الکتریکی از معیارهای تشخیص قطبی بودن مولکول به شمار میرود که واحد آن کولن در متر تعریف شده است.
واکنش آب و اسید
علاوه بر خودیونش آب، هیدرونیوم در واکنشهای اسید با آب هم بهوجود میآید. برای مثال وقتی هیدروکلریک اسید با آب واکنش میدهد، با تفکیک اسید و پیوند یونهای هیدروژن با آب، یون هیدرونیوم تشکیل میشود.
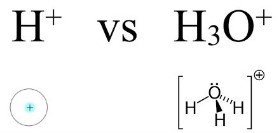
چرا یون هیدروژن آزاد در آب وجود ندارد؟
یون هیدروژن در محلولهای آبی تنها یک پروتون با یک هسته با بار مثبت و بدون الکترون است. پروتون در این حالت صد میلیونیوم () از حجم کل اتم هیدروژن را شامل میشود و مانند سنگ ریزی در وسط ورزشگاه فوتبال است.
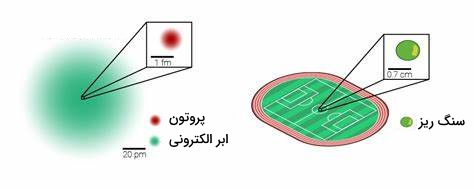
«چگالی بار الکتریکی» (Charge Density) زیاد پروتون باعث میشود به هر اتم یا مولکول با بار منفی، بهشدت جذب شود. در مولکول آب، وجود جفتالکترونهای ناپیوندی باعث جذب پروتون میشود و با تشکیل پیوند داتیو بین آنها یون هیدرونیوم شکل میگیرد. به عبارت دیگر، آب در این واکنش نقش یک باز را ایفا میکند و یون هیدرونیوم اسید مزدوج آن است.
نتایج بهدست آمده از آزمایشها نشان میدهند که در حقیقت، پروتون به مولکول آب متصل نمیشود و به دلیل اندازه و جرم منحصربهفردی که دارد در هر ثانیه بارها روی مولکولهای مختلف آب جابهجا میشود. هر جابهجایی باعث ایجاد یون هیدرونیوم خواهد شد.
در حقیقت، مانند این است که فرض کنیم یون هیدرونیوم بین مولکولهای آب در حال حرکت است. یون هیدروکسید که میتوان آن را جایگاهِ پروتون نامید، رفتاری مشابه یون هیدرونیوم دارد. دلیل رسانایی بالای محلولهای اسیدی یا قلیایی، همین حرکت یونهای هیدرونیوم و هیدروکسید است که بدون هیچ مانعی با کنار زدن مولکولهای آب و سایر یونها در محلول حرکت میکنند.
ساختار لوویس یون هیدرونیوم
اتمهای سازنده هیدرونیوم، عناصر هیدروژن و اکسیژن هستند. در ساختار لوویس هیدرونیوم سه پیوند وجود دارد. هنگام رسم ساختار لوویس، الکترونهای لایه ظرفیت به صورتی قرار میگیرند که اتمهای سازنده ترکیب از قاعده هشتتایی پیروی کنند (هیدروژن از این قاعده جداست).
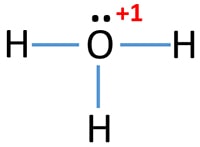
مراحل رسم ساختار لوویس هیدرونیوم
مراحل رسم ساختار لوویس یون هیدرونیوم به ترتیب زیر است.
۱. محاسبه الکترونهای ظرفیت کل
نخست باید تعداد کل الکترونهای لایه ظرفیت هیدروژن و اکسیژن محاسبه شود.
- هیدروژن عنصر گروه ۱ یا IA جدول تناوبی است و تنها یک الکترون در آخرین لایه ظرفیت خود دارد.
- اکسیژن عنصر گروه ۱۶ یا VIA است و در آخرین لایه ظرفیت خود ۶ الکترون دارد.
با این حساب، تعداد کل الکترونهای ظرفیت برابر با ۹ است ولی به دلیل وجود یک بار مثبت در یون هیدرونیوم، از تعداد کل الکترونها یک عدد کم میشود. الکترونهای ظرفیتی هر عنصر عبارتند از:
= الکترونهای ظرفیت هیدروژن
= الکترونهای ظرفیت اکسیژن
= الکترونهای ظرفیت کل
نکته: علامت مثبت روی ساختار یون، نشاندهنده از دست دادن الکترون و علامت منفی نشاندهنده گرفتن الکترون است.
۲. محاسبه مجموع جفتالکترونهای پیوندی
جفتالکترونهای پیوندی (A) از رابطه زیر بهدست میآید:
- = تعداد پیوندهای
- = تعداد پیوندهای
- N = تعدادجفتالکترون غیرپیوندی
که برای یون هیدرونیوم به دست میاد:
همچنین با تقسیم الکترونهای ظرفیتی کل به ۲، تعداد جفتالکترونهای پیوندی مشخص میشوند. الکترونهای ظرفیتی کل در یون هیدرونیوم برابر با ۸ است که جفتالکترونهای پیوندی آن برابر ۴ میشود.
۳. تعیین اتم مرکزی
معمولاً اتمی که تعداد پیوند بیشتری تشکیل دهد را به عنوان اتم مرکزی در نظر میگیرند که در یون هیدرونیوم، اکسیژن اتم مرکزی است.
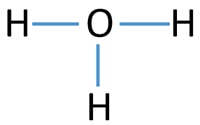
پس از رسم فرمول ساختاری ترکیب با پیوندهای یگانه، باید بررسی شود که اتمها از قاعده هشتایی پیروی کنند. در پایان، نوع بار اتمها مشخص میشوند که در اینجا اکسیژن، یک بار مثبت دارد.
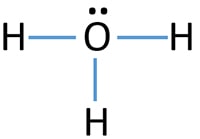
- نکته ۱: معمولاً الکترونهای باقیمانده را با علامتگذاری از اتمهای بیرونی آغاز میکنند. در هیدرونیوم چون اتمهای بیرونی، هیدروژن هستند و بیش از دو الکترون نمیتوانند دریافت کنند، الکترونهای باقیمانده روی اکسیژن قرار خواهند گرفت.
- نکته ۲: الکترونهای ناپیوندی روی اتمها با با دو نقطه نشان داده میشوند. در نهایت پیرامون هر اتم هشت الکترون (پیوندی و ناپیوندی) باید وجود داشته باشد.
- نکته ۳: وقتی اتمهای یکسانی به اتم مرکزی پیوند دارند، رسم پیوند دوگانه بر پیوند سهگانه، برتری دارد.
آیا هیدرونیوم یک اسید است؟
«ثابت تفکیک اسیدی» (Acid Dissociation Constant) برای یون هیدرونیوم در دمای ۲۵ درجه سلسیوس برابر با و اسیدی قوی است. با تعریف آرنیوس از اسید، مفهوم یون هیدرونیوم نیز بهوجود آمد. طبق تعریف آرنیوس، اسید مادهای است که پس از تفکیک به یونهای هیدروژن و هیدروکسید ، باعث پرتوندهی آب میشود و یون هیدرونیوم را تشکیل میدهد. بنابراین، یون هیدرونیوم اسید مزدوج آب است. اسیدهای پروتوندهنده، هم به عنوان اسیدهای آرنیوس و هم برونستد شناخته میشوند.
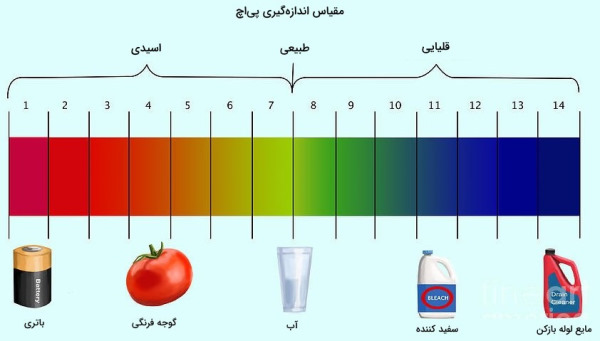
رابطه بین pH و غلظت یون هیدرونیوم
محاسبه از راههای گوناگونی انجام میشود. یکی از راههای بهدست آوردن محلول، محاسبه نسبت یونهای هیدرونیوم و هیدروکسید است.
همچنین با استفاده از غلظت یون هیدروژن میتوانیم محلولی را بهدست آوریم.
محاسبه pH
به طور معمول برای محاسبه پیاچ از رابطه زیر استفاده میشود.
در این فرمول لگاریتم در پایه ۱۰ و غلظت یون هیدروژن بر حسب مولار است. همانطور که بالاتر نیز توضیح داده شد یون هیدروژن و هیدرونیوم در واکنشهای آبی معادل یکدیگرند و هنگام نوشتن، ممکن به جای هم استفاده شوند.
با استفاده از به میزان اسیدی یا بازی بودن محلولهای آبی پی میبرند. مقادیر از ۰ تا ۱۴ متغیر است و آب خالص ۷ گرفته میشود. بالا یا پایین رفتن میزان به غلظت بستگی دارد. با افزایش غلظت هیدرونیوم مقدار کاهش پیدا میکند و محلول به سمت اسیدی شدن میرود.
| غلظت هیدرونیوم | مقدار | نتیجه |
| افزایش | کاهش | محلول اسیدیتر میشود. |
| کاهش | افزایش | محلول بازیتر میشود. |
در ثابت تعادل ترمودینامیکی برای واکنش خودیونش آب از اکتیویته شیمیایی به جای غلظت استفاده میشود. در واکنش زیر، خودیونش آب نشان داده شده است.
ثابت تعادل واکنش خودیونش آب در زیر آورده شده که در آن نشان دهنده اکتیویته است.
بهطور کلی اکتیویته آب برابر با یک در نظر گرفته میشود:
اکتیویته یونها در محلولهای آبیِ رقیق با غلظتشان برابر است. پس ثابت یونش، ثابت تفکیک یا ثابت خودیونش آب برابر است با:
در این رابطه، غلظت یون هیدرونیوم بر حسب مولار و غلظت هیدروکسید است. در دمای ۲۵ درجه سلسیوس و قدرت یونی صفر، برابر با است.
همچنین میتوان را چنین تعریف کرد:
که خواهیم داشت:
فرمول محاسبه غلظت یون هیدرونیوم چیست؟
با داشتن مقدار میتوانیم مقدار غلظت یون هیدرونیوم را با استفاده از فرمول زیر محاسبه کنیم.
ساختار هیدرونیوم چگونه است؟
یون هیدرونیوم سه ساختار پیشنهادی دارد که در فهرست زیر آورده شدهاند.
- «کاتیون استویانوف» (Stoyanov Cation)
- «کاتیون ایگن» (Eigen Cation)
- «کاتیون زوندل» (Zundel Cation)
دادههای بهدست آمده از «طیفبینی فروسرخِ» (Infrared Spectroscopy) نشان میدهند که ساختار اول، شکل رایجتر این یون است. در جدول زیر، این کاتیونها به همراه شکل و فرمول نشان داده شدهاند.
| کاتیون | فرمول | ساختار |
| ایگن | چهارآبه (تتراهیدرات) | |
| زوندل | دوآبه (دیهیدرات متقارن) | |
| استویانوف | ششآبه (هگزاهیدرات) |
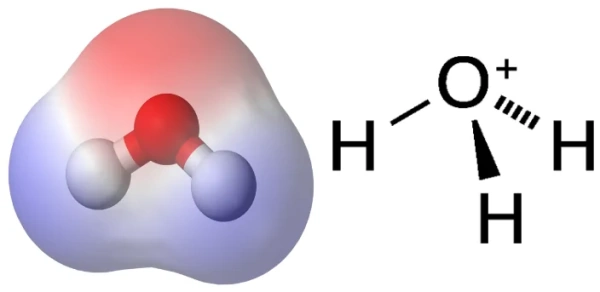
شکل فضایی یون هیدرونیوم
چگونگی قرارگیری اتمها در فضای سهبعدی هیدرونیوم به صورت «سهضلعی هرمی» (Trigonal Pyramidal) است. در این ساختار هیدرونیوم سه اتم هیدروژن و یک اتم اکسیژن دارد.
جفتالکترونی که روی عنصر اکسیژن قرار میگیرد، چنین هندسه مولکولی را ایجاد میکند. بین اتمها، زاویه پیوندی برابر با ۱۱۳ درجه است.
هیدرونیوم چه کاربردی دارد؟
از هیدرونیوم در محصولات مراقبت از پوست به عنوان لایهبردار و بازسازیکننده استفاده میشود. هیدرونیوم در ترکیب با دیگر مواد شیمیایی در درمان سوختگی و زخمها نیز مؤثر است. وجود هیدرونیوم بیشتر در محصولات پوستی، پوست را کاهش میدهد و سلولهای مرده را از بین میبرد.
یون چیست؟
اتم یا مجموعهای از اتمها شلمل بار الکتریکی، یون نام دارند. یونهایی که در ساختارشان تعداد الکترون کمتری نسبت به پروتون دارند، کاتیون و در مقابل اگر تعداد الکترونها بیشتر از پروتون باشد آنیون نامیده میشوند. ترکیبات یونی از کاتیونها و آنیونها تشکیل شدهاند و توسط پیوند یونی به یکدیگر متصل هستند.
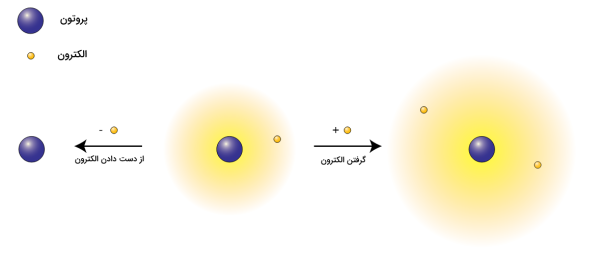
به بیان سادهتر، یونها ذرات بارداری هستند که میتوانند بار مثبت یا منفی داشته باشند. یونهایی که بار مثبت دارند کاتیون و یونهای که بار منفی دارند آنیون نامیده میشوند.
- کاتیون: وقتی تعداد الکترون پروتون است، کاتیون بار مثبت دارد.
- خنثی: وقتی تعداد الکترون برابر پروتون است.
- آنیون: وقتی تعداد الکترون پروتون است. آنیون بار منفی دارد.
در ساختار هیدروژن تنها یک الکترون و یک پروتون وجود دارد. گاهی اوقات هنگامی که پیوند هیدروژن با مولکول شکسته میشود، الکترونِ هیدروژن همراه مولکول میماند. هیدروژن با از دست دادن الکترون، تبدیل به یونی میشود که تنها یک پروتون دارد که آن را به صورت نمایش میدهند.
مولکول آب را میتوان به شکل نوشت. با جدا شدن یک هیدروژن از یا حضور یک اسید در آب، یون هیدروژن تولید میشود. در محلولهای آبی، به سمت قطبهای منفی مولکول آب جذب میشود و موجب تشکیل میشود.
سوالات متداول درباره هیدرونیوم
تا اینجا فهمیدیم که هیدرونیوم چیست.در ادامه، به برخی از سؤالهای مهم در رابطه با این یون میپردازیم.
تفاوت بین یون هیدروژن و هیدرونیوم چیست؟
در محلول آبی، اسیدها با مولکولهای آب واکنش میدهند و هیدرونیوم تشکیل میشود که آن را با نشان میدهند. این یون به اختصار در متنها به صورت یون هیدروژن نیز نوشته میشود و تفاوتی ندارند.
یون هیدرونیوم و هیدروکسید چه تفاوتی دارند؟
هیدروکسید و یون هیدرونیوم به ترتیب یونهای کاتیون و آنیون تشکیلدهنده آب هستند.
- یون هیدرونیوم همان است که به صورت نیز آن را نمایش میدهند.
- یون هیدروکسید با فرمول نشان داده میشود.
هیدرونیوم کجا پیدا میشود؟
هیدرونیوم به دلیل واکنشپذیری بالا به صورت آزاد در طبیعت یافت نمیشود. هیدرونیوم در ابر میانستارهای و دم دنبالهدارها وجود دارد که احتمالا نتیجه یونش در است.
هیدرونیوم چند الکترون دارد؟
هیدرونیوم ۸ الکترون دارد.












