پیوند فلزی – به زبان ساده
در دهه ۱۹۰۰، «پاول درود» (Paul Drude) مدلی موسوم به «دریای الکترونی» (Sea of Electrones) ارائه داد که فلزات را به صورت مخلوطی از هسته اتم و الکترونهای لایه ظرفیت در نظر میگرفت. پیوند فلزی همانطور که از نامش پیداست، در بین فلزات رخ میدهد. لازم به ذکر است که پیوند یونی، عناصر فلزی را به نافلزی پیوند میدهد اما در پیوند فلزی، مجموعهای از اتمهای فلزی با هم پیوند دارند.


لازم به ذکر است «فایل PDF پیوندهای شیمیایی» (تقلبنامه پیوندهای شیمیایی) را نیز میتوانید به طور جداگانه دانلود و مطالعه کنید. این تقلبنامه شامل تعریف انواع پیوندهای شیمیایی همچون پیوندهای یونی و کووالانسی است. همچنین، نیروهای بین مولکولی و پیوندهای هیدروژنی و فلزی نیز به طور کامل مورد بررسی قرار گرفتهاند.
ماهیت پیوند فلزی
فلزات، نقطه ذوب و جوش بالایی دارند و این امر به دلیل وجود پیوندهای قوی بین اتمهای آنها است. حتی فلزی نرم مانند سدیم با نقطه ذوب 97/8 درجه سانتیگراد، در دمایی بسیار بیشتر از عنصر قبل از خود در جدول تناوبی یعنی نئون، ذوب میشود. آرایش الکترونی سدیم به شکل زیر است:
زمانی که اتمهای سدیم کنار یکدیگر جمع شوند، الکترونِ اوربیتال اتمی در یک اتم سدیم، فضای خالی خود را با الکترون اتم متناظر در همسایگی خود به اشتراک میگذارد تا یک اوربیتال مولکولی تشکیل شود. نحوه به اشتراکگذاری و تشکیل این اوربیتال نیز بسیار به تشکیل یک پیوند کووالانسی شبیه است.
تفاوت پیوند فلزی و کووالانسی
تفاوت این پیوند با پیوند کووالانسی را در این نکته میتوان ذکر کرد که هر اتم سدیم، با هشت اتم سدیم دیگر احاطه شده است و این اشتراکگذاری بین اتم مرکزی و اوربیتال ، بین تمامی هشت اتم انجام میشود. تمامی این هشت اتم به ترتیب با هشت اتم سدیم دیگر در تماس هستند و آنها نیز با هشت اتم دیگر و به این ترتیب تمامی اتمها در یک مجموعه واحد، سدیم را تشکیل میدهند.
در اثر همپوشانی تمامی اوربیتالهای ، تعداد بسیار زیادی از اوربیتالهای مولکولی تشکیل خواهند شد که در طول یک قطعه فلز گسترش پیدا میکنند. با توجه به اینکه هر اوربیتال، تنها میتواند دو الکترون را در خود نگهداری کند، به تعداد بسیار زیادی اوربیتال مولکولی نیاز داریم.
الکترون آزاد
الکترونها میتوانند آزادانه در داخل این اوربیتالهای مولکولی حرکت کنند و در نتیجه، هر الکترون از اتم اصلی خود جدا خواهد شد. این الکترونها موسوم به «الکترون آزاد» (Delocalized Electron) یا الکترون غیرمتمرکز هستند چراکه آزادانه حرکت میکنند. اتمهای یک فلز از طریق نیروهای قدرتمند جاذبه بین هسته مثبت و الکترونهای آزاد در کنار یکدیگر نگاه داشته شدهاند.
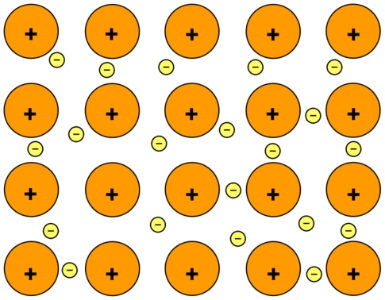
در حقیقت، این نوع از آرایش را به صورت دریایی از الکترون توصیف میکنند که در آن، هر یون مثبت، توسط دریایی از الکترون احاطه شده است. البته در استفاده از چنین تعریفی، این سوال پیش میآید که یک فلز، از یونها ساخته میشود یا اتمها؟ باید بگوییم که از اتم ساخته شده است. تصویر بالا، نشاندهنده اتمهایی است که هر هسته مثبت آنها شامل الکترونهایی، جدای از الکترون اصلی خود هستند اما این الکترون از بین نرفته است بلکه در ساختار فلز و در محلی دیگر قرار دارد. به همین دلیل است که فلز سدیم را گاهی به صورت و گاهی به صورت نشان میدهند.
مثال
با استفاده از مدل دریای الکترونی، علت نقطه ذوب بالای منیزیم را توضیح دهید.
اگر به همان شکلی که اتم سدیم را بررسی کردیم، به بررسی منیزیم بپردازیم، در نهایت به پیوندهای قوی و نقطه ذوب بالا خواهیم رسید. آرایش الکترونی منیزیم در لایه ظرفیت شامل اوربیتال است. این دو الکترون، هردو به دریای الکترونی اضافه خواهند شد و در نتیجه، چگالی الکترون در این مدل، ۲ برابر آنچیزی است که در اتم سدیم وجود داشت. یونهای حاصل نیز، بارِ دو برابری خواهند داشت که همین امر، جاذبه بیشتری را بین یونهای مثبت و دریای الکترونی ایجاد میکند.
علاوه بر این، هر اتم منیزیم، شامل ۱۲ پروتون در هسته است که این مقدار برای سدیم، ۱۱ پروتون ذکر میشود. در هر دو حالت، تعداد 10 الکترون با آرایش وجود دارد که بین هسته و الکترونهای آزاد قرار گرفتهاند. این امر بدان معنی است که مقدار کششی که هستههای منیزیم با بار ایجاد میکنند، بیش از هسته اتم با بار است.
در نتیجه، نه تنها تعداد الکترونهای آزاد بیشتری در منیزیم وجود دارد، بلکه جاذبه بیشتری نیز از طرف هسته به الکترونهای آزاد وارد خواهد شد. هر اتم منیزیم نیز در همسایگی خود، ۱۲ اتم دارد که در مقایسه با ۸ اتم سدیم، عدد بالاتری است. تمامی این عوامل، موجب تقویت قدرت پیوند میشوند.
قدرت پیوند فلزی در فلزات واسطه
توجه داشته باشید که فلزات واسطه، به طور ویژهای نقطه ذوب و جوش بالایی دارند. دلیل این امر آن است که علاوه بر اوربیتال ، اوربیتال را هم در الکترونهای آزاد شرکت میدهند. هرقدر الکترونی که در این مدل وجود دارد، بیشتر شود، قدرت جاذبه و به تبع آن پیوند فلزی نیز بیشتر خواهد بود.
خواص تودهای فلزات در پیوند فلزی
فلزات، خواص منحصربهفرد و ویژهای دارند که از آنجمله میتوان به موارد زیر اشاره کرد:
- رسانایی
- انرژی یونش پایین
- الکترونگاتیوی پایین
- درخشندگی
- قابلیت ریختهگری
- چکشخواری
علاوه بر این، فلزات میتوانند ساختاری بلوری هم داشته باشند اما به سرعت تغییر شکل خواهند داد. در مدل دریای الکترونی، هیچکدام از الکترونهای آزاد به اتم خاصی نسبت داده نمیشوند و تمامی این الکترونها به طور آزادانه در توده فلزی حرکت میکنند. در ادامه به برخی از ویژگیهای حاصل از مدل دریای الکترونی خواهیم پرداخت.
رسانایی
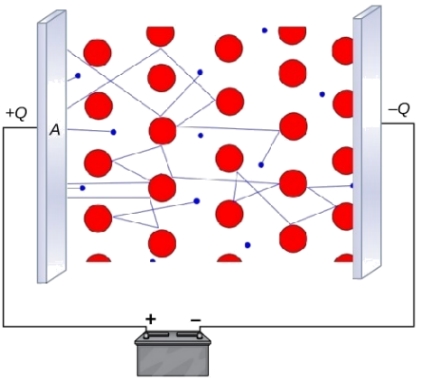
اگر رسانایی الکتریکی را به صورت حرکت الکترون (بار) تعریف کنیم، دلیل رسانایی فلزات، به خوبی توضیح داده میشود. از آنجایی که پیوند فلزی شامل الکترونهای آزاد است، اگر الکترون، از منبعی خارجی، به یک سرِ سیمی فلزی وارد شود، الکترون دیگری با همان سرعت در انتهای سیم، از آن خارج خواهد شد که همین امر، دلیل رسانایی فلزات است. در تصویر زیر، این فرآیند را ملاحظه میکنید. زمانی که یک میدان الکتریکی همچون باتری، به مدار تصویر زیر وارد شود، الکترونها با حرکت خود، رسانایی را ایجاد میکنند.
چرا فلزات چکش خوار هستند؟
چکشخواری و قابلیت ریختهگری، از عوامل دیگری است که با تعریف پیوند فلزی و دریای الکترونی به توضیح آن خواهیم پرداخت. دریای الکترونی که پروتونها را احاطه کرده است، همچون یک ضربهگیر عمل میکند و به طور مثال، زمانی که فلزی چکشکاری شود، ترکیب کلی در ساختار یک فلز تغییر نخواهد کرد. در این حالت، پروتونها در اثر ضربه، آرایش جدیدی به خود میگیرند که بر اساس همین آرایش، دریای الکترونی، موقعیت خود را تغییر میدهد و در نتیجه ساختار اصلی فلز بدون تغییر، باقی خواهد ماند. زمانی که در دریای الکترونی، لایهای از یونها در طول فضا روی لایهای دیگر حرکت کنند، ساختار بلوری نمیشکند و فقط تغییر شکل میدهد.
تصویر زیر نشاندهنده این موضوع است. به هنگام ضربه، لایهای از اتمها در مقایسه با لایه دیگر، حرکت میکند که در نهایت، شکل لایه جدید با لایه قبل مشابه خواهد بود. در نتیجه، زمانی که به فلزی ضربه بزنیم، ساختار بلوری آن تغییر نمیکند بلکه فقط شکل آن عوض میشود. چنین رفتاری در پیوند فلزی کاملا با رفتار یک بلور یونی متفاوت است.

درخشندگی
الکترونهای آزاد در دریای الکترونی، نقش جاذب فوتون را ایفا میکنند. در حقیقت، این الکترونها در سطح، نور را با همان فرکانسی که تابیده شده است، برمیگردانند و به همین دلیل، ماهیتی براق دارند.
البته تمامی این موارد، خواصی کیفی هستند و به صورت کمی نمیتوان آنها را بیان کرد. نظریه دریای الکترون، تنها نوعی تعریف است که به کمک آن بتوان رفتار پیوند فلزی را توضیح داد.
پیوند فلزی در فلز مذاب
در یک فلز مذاب، حتی با وجود شکستن ساختار منظم فلزی، باز هم پیوند فلزی داریم. پیوند فلزی تنها در زمان جوشیدن فلز شکسته خواهد شد. به عبارت دیگر، نقطه جوش، بیان بهتری از قدرت پیوند فلزی در مقایسه با نقطه ذوب است چراکه به هنگام ذوب، این پیوند سست میشود اما نمیشکند.
عوامل موثر بر قدرت پیوند فلزی
قدرت پیوند فلزی را در ۳ عامل زیر میتوان بیان کرد:
- تعداد الکترونهای آزادی که در فلز وجود دارند
- بار کاتیونها
- اندازه کاتیونها
یک پیوند فلزی قوی، نتیجه الکترونهای آزادِ بیشتر است. همانطور که گفته شد، علاوه بر الکترونهای آزاد، الکترونهای دیگری نیز بین هسته و الکترونهای آزاد وجود دارند. با افزایش تعداد الکترونهای آزاد، مقدار بار موثر هسته بر این الکترونها افزایش مییابد که همین امر، اندازه کاتیونها را کوچکتر میکند. پیوند فلزی ازجمله پیوندهای قدرتمندی است که برای شکستن آن، انرژی زیادی باید صرف شود. درنتیجه، همانطور که پیشتر نیز توضیح داده شد، فلزات، نقطه جوش و ذوب بالایی دارند.
با توجه به اینکه فلزات در سمت چپ جدول تناوبی عناصر دیده میشوند، تعداد الکترون کمی در لایه ظرفیت خود دارند. در نتیجه، نظریه پیوند فلزی علاوه بر خواص منحصربهفرد، باید قدرت بالای پیوند فلزی را با توجه به تعداد کم الکترونهای لایه ظرفیت توضیح دهد.
تعداد پیوندهای احتمالی
پیشتر در این خصوص صحبت کردیم که پیوند بین اتمها را میتوان به صورت دامنه پیوندهای احتمالی بین پیوند یونی و پیوند کووالانسی دستهبندی کرد. زمانی که دو اتم با اختلاف الکترونگاتیوی کم، به یکدیگر برای تشکیل پیوند کووالانسی نزدیک شوند، یکی از اتمها، بیشتر از دیگری، الکترونها را جذب میکند. به این نوع از پیوند، «پیوند کووالانسی قطبی» (Polar Covalent Bond) میگویند. در حقیقت، پیوند کووالانسی و یونی، مفاهیمی ایدهآل هستند اما بیشتر پیوندها در یک شبکه دو بعدی پیوسته موسوم به «مثلث فن آرکل-کتلار» (van Arkel-Ketelaar Triangle) توصیف میشوند.
مثلث پیوندی
به کمک مثلث فن آرکل میتوان درجات مختلف هر پیوند را از نظر یونی، کوالانسی و فلزی بودن بررسی کرد. در سال 1941، شیمیدان هلندی، «آنتون ادوارد فن آرکل» (Anton Eduard van Arkel) متوجه سه نوع ماده و نوع پیوندهای همراه آنها شد.او با استفاده از 36 عنصر گروههای اصلی جدول تناوبی همچون فلزات، شبهفلزات و نافلزات، پیوندهای یونی، فلزی و کووالانسی را در هر گوشه از یک مثلث قرار داد و ذراتی نیز در میان این مثلث پیشنهاد داد. این «مثلث پیوندی» (Bond Triangle) نشان میدهد که پیوندهای شیمیایی، نوع خاصی از یک پیوندِ تنها نیستند بلکه این نوع از پیوندها با یکدیگر ارتباط دارند و هرکدام، درجه متفاوتی از مشخصههای پیوند را شامل میشوند.
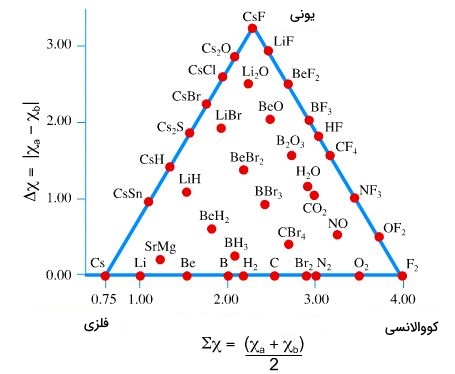
همانطور که در تصویر بالا مشخص است، این مثلث، دو محور و دارد که محور ، به الکترونگاتیوی عناصر و محور به اختلاف الکترونگاتیوی ارتباط دارد. اگر الکترونگاتیوی هر عنصر را با نشان دهیم، میتوانیم از روابط زیر برای تعیین محل پیوند استفاده کنیم:
پیوند حاکم بر ترکیبات را به این ترتیب میتوان تعیین کرد. در سمت راست تصویر بالا، ترکیبات با اختلاف الکترونگاتیوی مختلف قرار میگیرند. ترکیبات با الکترونگاتیوی یکسان، همچون مولکول ، در گوشه مثلث و در بخش کوولانسی قرار میگیرند. این درحالیست که ترکیبات با اختلاف الکترونگاتیوی زیاد مانند ، در درسته ترکیبات یونی جای میگیرند. قاعده مثلث (از پیوند فلزی تا کووالانسی)، شامل ترکیباتی با جهتگیریهای مختلف در پیوند است. در یک گوشه، پیوند فلزی و در گوشهای دیگر پیوند کووالانسی قرار دارد.
مثال
الکترونگاتیوی عناصر زیر به ترتیب داده شدهاند. با دانستن مقدار الکترونگاتیوی عناصر، موارد خواسته شده زیر را برای ترکیبات ، و حساب کنید:
- الکترونگاتیوی متوسط در پیوند
- خاصیت یونی
- نوع پیوند
| نام عنصر | الکترونگاتیوی |
برای محاسبه موارد خواسته شده در ترکیب ، با استفاده از روابط بالا خواهیم داشت:
با توجه به مثلث پیوندی میتوان دریافت که این ترکیب، زیر ده درصد خاصیت یونی دارد و نوع پیوند آن بین پیوند فلزی و کووالانسی قرار میگیرد.
به طور مشابه، برای محاسبات ترکیب خواهیم داشت:
با توجه به مثلث پیوندی، ترکیب حاصل، ناقطبی و کمتر از ۳ درصد خاصیت یونی دارد و نوع پیوند آن از نوع پیوند فلزی است.
در ترکیب ، با استفاده از روابط، مقدار اختلاف الکترونگاتیوی و الکترونگاتیوی متوسط در پیوند را محاسبه میکنیم.
ترکیب حاصل، قطبی و خاصیت یونی آن در حدود ۷۵ درصد است. با توجه به مختصات بدست آمده، نوع پیوند، یونی خواهد بود.

شعاع فلزی
شعاع فلزی را به صورت نیمی از فاصله بین دو یون فلزی مجاور در ساختار یک فلز تعریف میکنند. این شعاع به طبیعت اتم و محیط اطراف آن یا همان عدد کوئوردینانسی (Coordination Number) بستگی دارد که میتوان آن را به دما و فشار اعمال شده مرتبط کرد. این شعاع، از روندهای تناوبی پیروی میکند به این معنی که در هر دوره، به علت افزایش بار موثر هسته، این شعاع کاهش پیدا میکند. همچنین، در هر گروه از بالا به پایین، با افزایش عدد کوانتومی، این شعاع افزایش پیدا میکند.
مقایسه قدرت پیوندهای شیمیایی
در جدول زیر، پیوندهای شیمیایی با یکدیگر مقایسه شدهاند.
| اساس مقایسه | پیوند یونی | پیوند فلزی | پیوند کووالانسی |
| حالت ماده | جامد | جامد و مایع (فلزات مذاب) | جامد، مایع و گاز |
| وقوع پیوند | بین یک فلز و نافلز | بین دو فلز | بین دو نافلز |
| اساس پیوند | انتقال الکترونی از لایه ظرفیت | جاذبه بین الکترونهای آزاد در شبکه فلزی | اشتراک الکترون لایه ظرفیت |
| رسانایی | رسانایی پایین | رسانایی بالای الکتریکی و حرارتی | رسانایی کم |
| سختی | سختی بالا به دلیل طبیعت بلوری | سختی پایین | به غیر از سیلیکون، کربن و الماس، این نوع از پیوندها، موادی سخت بدست نمیدهند. |
| نقطه ذوب و جوش | بالاترین نقطه ذوب و جوش را دارند. | بالا | پایین |
| چکشخواری و قابلیت انعطاف (تورق پذیری) | چکشخوار و تورقپذیر نیستند. | دارای خاصیت چکشخواری و تورقپذیری | چکشخوار و تورقپذیر نیستند. |
| انرژی پیوند | بیشتر از پیوند فلزی | کمترین انرژی پیوند | بیش از پیوند فلزی |
| الکترونگاتیوی | بیشتر از 1/7 | با استفاده از روابط موجود در مثلث پیوندی محاسبه میشود. | کووالانسی قطبی: بین 0/5-1/7
ناقطبی: کمتر از 0/5 |
| مثال پیوند | ، و ... | طلا، نقره، مس، آلومینیوم، آهن، نیکل | الماس، کربن، سیلیس، گاز هیدروژن، آب، گاز نیتروژن |
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- نیروهای بین مولکولی در شیمی — به زبان ساده
- تقطیر جز به جز – از صفر تا صد
^^












سلام ببخشید در مقایسه پیوند کووالانسی و پیوند یونی کدوم قدرت بیشتری داره؟
با سلام؛
پیوندهای یونی با توجه به مبادله کامل الکترون و تشکیل کاتیون و آنیون و به دنبال آن، نیروی قوی الکترواستاتیکی، قدرت بیشتری دارد.
با تشکر از همراهی شما با مجله فرادرس
واقعا فوق العاده. بهترین مقاله ای که تو فرا درس خونده بودم
واقعا عالی دسستون درد نکنه. بهترین مقاله ای که تو فرا درس خونده بودم
سلام وقت بخیر ببخشید میشه قدرت همه ی پیوند هارو در یک پیام بگید؟
با سلام؛
برای همین منظور میتوانید تقلبنامه پیوندهای شیمیایی را از این لینک دانلود کنید.
از همراهی شما با مجله فرادرس سپاسگزاریم
خیلی خوب توضیح داده شد
فقط در پیوند فلزیوجود چه خاصیتی در ماده باعث یکپارچگی سطح ان میشود؟
از شما بابت مطالعه این مطلب سپاسگزاریم؛
آنچه که پیوند فلزی را به صورت یکپارچه تبدیل میکند، جذب الکترونها به اتمهای مختلف است و این امر سبب میشود تا میزان «تحرک» (Mobility) مناسبی در فلز ایجاد شود. پیشنهاد میکنم برای توضیح دقیقتر، بخش «چرا فلزات چکشخوار هستند» را یکبار دیگر مطالعه کنید.
با تشکر
واقعا عالی بود متشکرم قابل فهم و صریح توضیح داده بودید
فقط من قسمت مثلث آرکل را احساس کردم یکم نیاز به توضیح بیشتری دارد چون خودم به اندازه بقیه قسمت ها متوجه نمودار نشدم ???❤❤❤
از شما بابت مطالعه این مطلب سپاسگزاریم؛
اگر بخواهیم مثلث آرکل را به طور خلاصه توضیح دهیم باید بگوییم که نوع پیوند هر ترکیب دوتایی را میتوان به کمک این مثلث تعیین کرد. در حقیقت، شما برای دانستن نوع پیوند، به یک مختصات x و y نیاز دارید تا از آن طریق، محل پیوند را تشخیص دهید. مختصات x همان ∑χ و مختصات y، همان Δχ است. با داشتن الکترونگاتیوی هرکدام از عناصر و روابط داده شده، مختصات آنرا پیدا میکنیم و محل آن در مثلث مشخص خواهد شد.
با تشکر