شیمی فضایی – به زبان ساده
از مهمترین خواص یک مولکول در دنیای شیمی، شکل سهبعدی آن است. از آنجایی که شکل یک مولکول، نحوه برهمکنش دو مولکول در کنار یکدیگر را نیز بیان میکند، بر خواص فیزیکی آن نیز تاثیرگذار است. به طور مثال، اگر ترکیبی، شامل مولکولهایی باشد که آن مولکولها به خوبی در کنار یکدیگر قرار نگرفته باشند، نیروهای پراکندگی لاندن محدود میشوند و ترکیب مورد نظر به احتمال زیاد، جامد نخواهد بود. شیمی فضایی به آرایش سهبعدی اتمها میپردازد. در همین راستا باید بگوئیم، زمانی که دو ترکیب، اتمهای یکسان با نحوه اتصال مشابه داشته اما شکل سهبعدی متفاوتی داشته باشند، به «ایزومرهای فضایی» (Steroisomers) معروف هستند.

در این مطلب، در خصوص شیمی فضایی یا استریوشیمی بحث میکنیم و شکل سه بعدی مولکولها در شیمی فضایی، کایرالیته و کنفیگراسیون در شیمی فضایی را یاد میگیریم.
نمایش شکل سه بعدی مولکول در شیمی فضایی
قبل از شروع بحث در خصوص شیمی فضایی بهتر است تا نحوه نمایش مولکول به صورت سه بعدی را بررسی کنیم. چراکه با این کار، سادهتر میتوانیم مفهوم شیمی فضایی را توضیح دهیم. به طور مثال، زمانی که ساختار لوییس مولکول متان را رسم میکنیم، تنها نمایش دو بعدی آن را شاهد هستیم اما در واقع این مولکول، شکلی سه بعدی دارد. اتم مرکزی در مولکول متان، به صورت چهاروجهی است که چهار اتم هیدروژن در چهار گوشه آن حضور دارند.
یک چهاروجهی را به صورت شکل زیر نیز میتوانیم نشان دهیم. همانطور که در تصویر زیر مشاهده میکنید، دو پیوند در مولکول متان را به صورت دو مثلث (گوه) مشکی و خطچین نشان دادهایم. در خصوص مثلث مشکی میگوییم: اتم هیدروژن به سمت ما قرار دارد و در خصوص مثلث خطچین میگوییم: اتم، در حال دور شدن از ماست یا اتم به سمت ما نیست. با وجود اینکه چنین نمایشی، بر روی یک صفحه تخت انجام میشود، اما نوع مثلثها حاکی از شکل سه بعدی مولکول هستند.
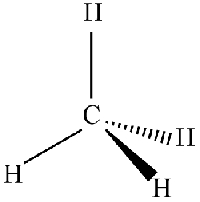
اتمهای کربنی که به چهار اتم در همسایگی خود پیوند دارند، همواره شکلی چهاروجهی دارند و اتمهای اطراف کربن، زاویه 109/5 درجه با یکدیگر دارند. پنتان، ترکیبی با چهار کربنِ چهاروجهی در یک ردیف است که هر کدام از اتمهای کربن را میتوان به شکل زیر نشان داد.
تصاویر آینهای و کایرالیته در شیمی فضایی
زمانی که به آینه نگاه میکنید، شخصی مجازی و در واقع، تصویر آینهای خود را میبینید. هر شئ نیز تصویری آینهای دارد اما این تصویر، لزوما با شئ اصلی تشابه ندارد. برای توضیح بیشتر، صندلی چوبی تصویر زیر را در نظر بگیرید.
تصویر این صندلی در آینه، دقیقا با خود آن یکسان است. زمانی که یک شئ و تصویر آن در آینه یکسان باشد، به آن «انطباقپذیر» (Superimposable) میگویند. اشیایی که برهم منطبق هستند را میتوان به گونهای کنار هم قرار دارد که ویژگیهای سه بعدی هرکدام با دیگری برابر باشند.

اما این بار بهتر است شیئی را در نظر بگیریم که با تصویر آینهای خود یکسان نباشد. به این نوع از تصاویر، «انطباقناپذیر» (non-Superimposable) میگویند. از مثالهای آن میتوان به صندلی دستهدار اشاره کرد که در تمامی کلاسهای درس وجود دارد. تصویر آینهای یک صندلی دستهدارِ راست دست، به صورت صندلی چپدست نمایش داده میشود. تصویر زیر به خوبی بیانگر این موضوع است.

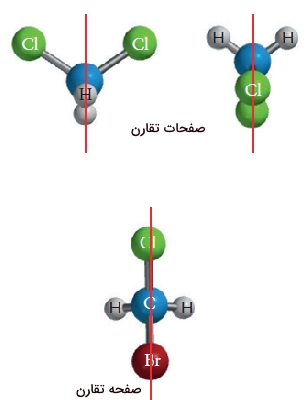
این مورد را در مورد تصویر دستهای خود در آینه هم میتوانیم مشاهده کنیم. میدانیم که دستهای ما بر یکدیگر منطبق نیستند. در تعریفی دیگر، به شیئی که تصویر آینهای آن بر دیگری منطبق نباشد، «کایرال» (Chiral) میگویند که این عبارت از واژهای یونانی به معنای دست گرفته شده است. اشیایی همچون کفش و دستکش را میتوان کایرال نامید. کایرالیته یک شئ را میتوان بدون آینه هم نشان داد. در صورتیکه یک شئ، شامل صفحه تقارن باشد، کایرال نیست و به آن «اکایرال» (Achiral) میگویند. یک صفحه تقارن، شئ را به دو بخش تقسیم میکند به طوریکه هر بخش، تصویر آینهای دیگری باشد. عکس صندلی بدون دسته، دارای صفحه تقارن و بنابراین اکایرال است. در نتیجه، وجود یا عدم وجود صفحه تقارن، تعیین کننده کایرالیته یک شئ خواهد بود.
مولکولهای کایرال در شیمی فضایی
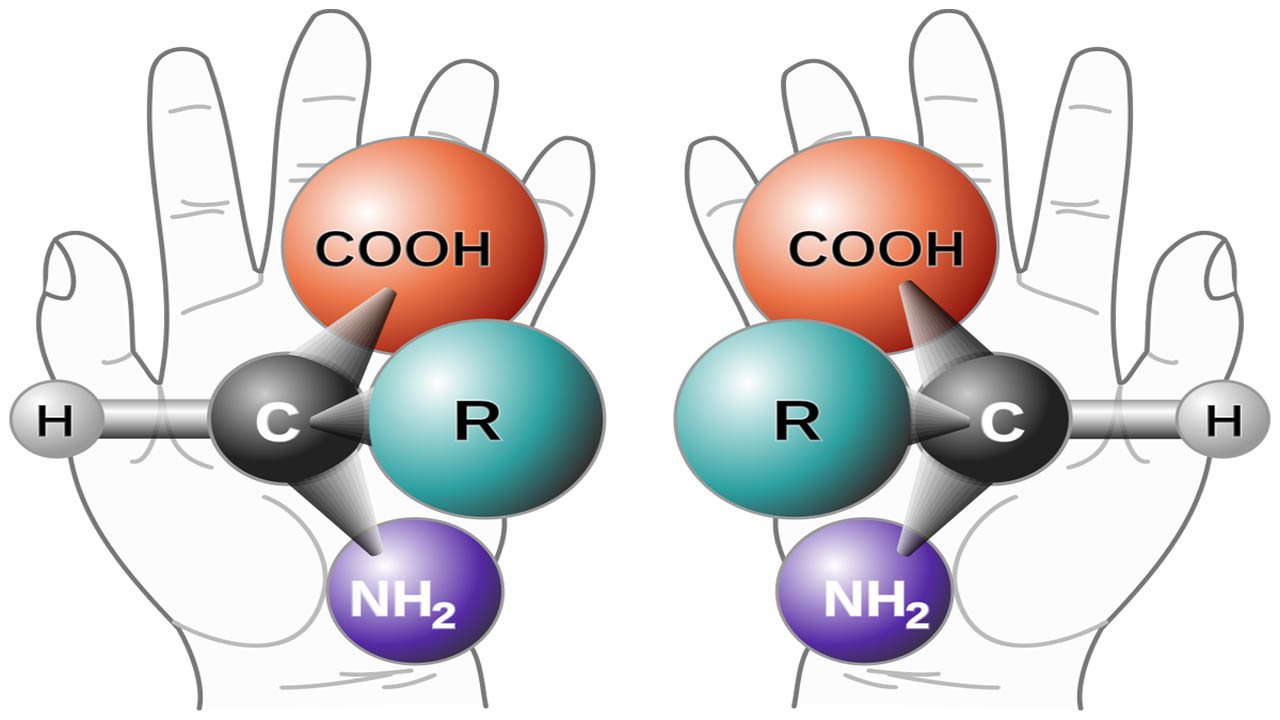
مفهوم کایرالیته را میتوان تا ابعاد مولکولی نیز گسترش داد. بنا به تعریف، مولکولی کایرال است اگر حداقل شامل یک اتم کربن متصل به چهار اتم یا گروه مختلف باشد. به چنین اتم کربنی، «مرکز استرئوژنیک» (Stereogenic Center) میگویند. در برخی موارد، مرکز استرئوژنیک (استروژنیک) را مرکز کایرال و به اتم کربن در این شرایط، کربن کایرال میگویند. البته، این مولکول است که کایرالیته دارد نه اتم کربن تنها. بیشتر مولکولهای تولیدی در ارگانیسمهای زنده، کایرال هستند و تمامی داروها نیز به شکل کایرال وجود دارند. در نتیجه، سنتز مولکولهای کایرال در آزمایشگاه، بخش مهمی از سنتز آلی را تشکیل میدهد.
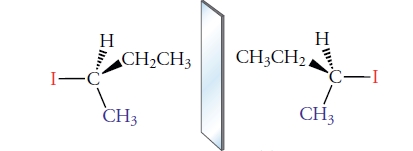
چهار اتم یا گروه متصل به مرکز کایرال، در دو آرایش مختلف قرار میگیرند تا دو «ایزومر فضایی» (Stereoisomers) بسازند. نمونهای از آن را میتوان در ایزومر فضایی برومو کلرو فلوئورو متان مشاهده کرد. این ماده، صفحه تقارن ندارد. تصویر زیر نشان میدهد که این مولکول، از نوع مولکول کایرال است چراکه تصویر آینهای آن، بر خودش منطبق نیست.

انانتیومرها
در شیمی فضایی به دو ایزومر فضایی که تصویر آینهای آنها بر یکدیگر منطبق نباشند، «انانتیومر» (Enantiomer) میگویند. همانطور که گفته شد، مولکولی که دارای مرکز استرئوژنیک باشد، موسوم به مولکول کایرال است. به طور مثال، مولکول ۲-برومو بوتان را یک مولکول کایرال در نظر میگیریم زیرا اتم کربن به چهار گروه مختلف متصل میشود. در مقابل، در مولکول ۲-برومو پروپان، هیچ اتم کربنی وجود ندارد که به چهار گروه مختلف متصل باشد. در نتیجه، ۲-برومو پروپان، کایرال نیست.

خواص انانتیومرها
یک جفت انانتیومر، خواص شیمیایی و فیزیکی یکسانی دارد. آنتالپی تشکیل، چگالی، نقطه ذوب و جوش در آنها برابر و واکنشهای آنها در محیطهای اکایرال نیز یکسان است. اما در محیطهای کایرال، میتوان انانتیومرها را شناسایی کرد. این اختلاف، در بسیاری از فرآیندهای سلولهای زنده، اهمیت پیدا میکند. از آنجایی که، محل پیوندی در آنزیمها، کایرال است، در نتیجه، یکی از جفتهای انانتیومر میتوانند در محل پیوندی آنزیم قرار بگیرد.
فعالیت نوری
با وجود اینکه انانتیومرها، خواص شیمیایی یکسانی در محیطهای اکایرال دارند، اما در یک خاصیت مهم فیزیکی با یکدیگر متفاوت هستند. رفتار انانتیومرها در خصوص نور قطبیده (پلاریزه) با یکدیگر متفاوت است. این اختلاف به ما کمک میکند تا در آزمایشگاه، مولکول کایرال را از انانتیومرش شناسایی کنیم.
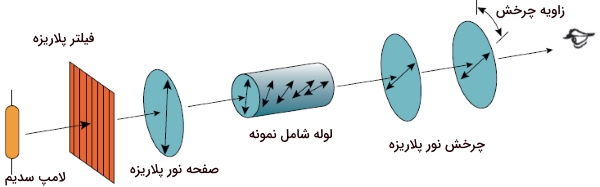
پرتو نور از موجهای الکترومغناطیسی تشکیل شده است که در بینهایت صفحه عمود بر جهت انتشار، نوسان میکند. زمانی که پرتو نوری از میان یک فیلتر پلاریزه عبور کند، به «نور قطبیده مسطح» (Plane Polarized Light) تبدیل میشود که امواج الکترومغناطیس آن تنها در یک صفحه نوسان میکنند. در زندگی روزمره، با چنین پدیدهای آشنا هستیم. برخی از عینکهای آفتابی بمنظور کاهش شدت نور آفتاب، آن را پلاریزه میکنند. در حقیقت، این کار با جلوگیری از عبور نور افقی متصاعد شده از اشیا انجام میشود. همچنین، در برخی از لنزهای دوربینهای عکاسی، از فیلترهای پلاریزه برای کاهش شدت پرتو خورشید بهره میگیرند.
نور پلاریزه شده با مولکولهای کایرال برهمکنش انجام میدهد. این برهمکنشها را با دستگاهی به نام پلاریمتر اندازهگیری میکنند. در یک پلاریمتر، نور با طول موج تنها - که به آن، «نور تکرنگ» (Monochromatic Light) میگویند - از میان یک فیلتر پلاریزه عبور میکند. در مرحله بعد، نور قطبیده، از لولهای شامل محلول مورد آزمایش، عبور میکند. مولکولهای اکایرال، تاثیری بر نورهای قطبیده ندارند. اما صفحه نور پلاریزه، به هنگام جذب توسط مولکولهای کایرال، میچرخد. بعد از خروج نور از لوله، این نور از فیلتر پلاریزه دیگری عبور میکند که نقش آشکارساز دارد. این صفحه میتواند در جهتهای ساعتگرد و پادساعتگرد چرخش داشته باشد تا با چرخش نور منطبق شود.
زاویه چرخش فیلتر دوم را مینامند. مقدار زاویهای که ترکیب کایرال، نور پلاریزه را میچرخاند، با آلفا برابر است. از آنجایی که مولکولهای کایرال، موجب چرخش در نور پلاریزه میشوند، دارای فعالیت نوری هستند. مولکولهای اکایرال، نمیتوانند نور پلاریزه را بچرخانند و در نتیجه، فعالیت نوری ندارند.
چرخش ویژه
میزان چرخشی که در یک پلاریمتر دیده میشود، به ساختار ماده و غلظت آن وابسته است. فعالیت نوری ماده کایرال خالص را با «چرخش ویژه» (Specific Rotation) و نماد تعریف میکنند و رابطه آن به صورت زیر است:
اگر مادهای کایرال، نور قطبیده را به راست (ساعتگرد) بچرخاند، به آن «راستگردان» (Dextrorotatory) و اگر به سمت چپ (پادساعتگرد) بچرخاند، به آن «چپگردان» (Levorotatory) میگویند. انانتیومرهای یک ماده کایرال، نور پلاریزه را به یک میزان اما با جهتی متفاوت میچرخانند. بنابراین، در شیمی فضایی به آنها «ایزومرهای نوری» (Optical Isomers) نیز میگویند.
انانتیومرهای مواد را بسته به نوع چرخش و علامت مثبت یا منفی مشخص میکنند. به طور مثال، در یکی از انانتیومرهای ۲-یدو بوتان، است. در این حالت این انانتیومر را به صورت (-)-2-یدو بوتان و به طور مشابه، انانتیومر دیگر با را به شکل (+)-2-یدو بوتان نشان میدهند. علاوه بر این، چنین ایزومرهای (+) و (-) را به شکل d و s نیز میشناسند.
روش فیشر در رسم شکل مولکول
رسم یک مولکول در سه بعد، کاری دشوار و زمانبر است. علاوه بر این، خوانش فرمول ساختاری، مخصوصا برای مولکولهایی با چندین مرکز کایرال، کار سادهای نیست. در شیمی فضایی برای رسم ساختار مولکول یک ماده کایرال، میتوان از «روش فیشر» (Fischer Projection) استفاده کرد. «امیل فیشر» (Emil Fischer)، شیمیدان آلمانی، این روش را در حدود یک قرن پیش معرفی کرد. «پیکربندی» (Configuration) یا کنفیگراسیون یک ماده کایرال در روش فیشر، به کمک مقایسه آن با کنفیگراسیون مادهای مرجع به نام «گلیسرآلدهید» (Glyceraldehyde) بدست میآید.

گلیسرآلدهید دارای اتم کربن متصل به چهار گروه مختلف است. در نتیجه، دارای دو انانتیومر خواهد بود. انانتیومرهای این ماده را به کمک روش فیشر، به صورت زیر رسم میکنند:
- زنجیره کربن را به صورت عمودی مرتب کنید. در این حالت، بیشترین گروه اکسید شده در بالا قرار بگیرد. در اینجا، در بالا قرار میگیرد.
- اتم کربن کایرال را در داخل صفحه قرار دهید.
- از آنجایی که اتم کربن مرکزی، به چهار گروه مختلف، متصل است، گروه و ، پشت صفحه و اتم هیدروژن و گروه هیدروکسیل در بیرون از صفحه قرار میگیرند.
- این چهار گروه را بر روی یک صفحه قرار دهید. در این روش به طور معمول، اتم کربن کایرال را نشان نمیدهند. در حقیقت، نقطه تقاطع خطوط پیوندی، بیانگر کربن کایرال است. در روش فیشر، خطوط عمودی، از ناظر دور میشوند و خطوط افقی به طرف ناظر قرار دارند. در تصویر زیر به ترتیب ساختارهای پرسپکتیو، آینهای و فیشر را مشاهده میکنید.

روش تصویری فیشر، نوعی نمایش دو بعدی است. در این ساختار، اگر مولکول را از یک طرف، حول کربن کایرال دوران بدهیم، به ساختار انانتیومر آن دست پیدا خواهیم کرد.
کنفیگراسیون R و S
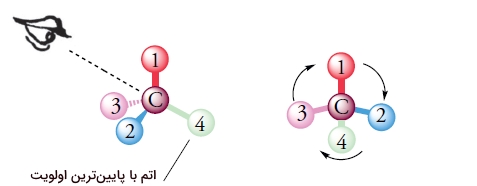
در کنفیگراسیون R و S، چهار گروه متصل به کربن استرئوژنیک، با ترتیب و اولویت مشخصی چیده میشوند. گروه با بالاترین اولویت را با عدد ۱ و کمترین اولویت را با عدد 4 نشان میدهند. چرخش مولکول را طوری تنظیم میکنیم که پیوند اتم کربن با گروه ۴، در دورترین فاصله و در راستای خط دید ما باشد. زمانی که این کار انجام شد، ۳ گروه بعدی، پیرامون محیط یک دایره و به سمت ما قرار میگیرند.
برای درک سادهتر این روش، فرض کنید شاخه گلی را در دست گرفتهاید، ساقه گل نقش گروه عدد ۴ را دارد و گلبرگهای آن، در نقش سه گروه دیگر ظاهر میشوند. حال، به شمارهگذاری گروهها دقت کنید که در اینجا، ساعتگرد است. کنفیگراسیون ساعتگرد را با R و پادساعتگرد را با S نشان میدهیم.
تعیین اولویتها
همانطور که دیدیم، برای شمارهگذاری گروههای متصل به اتم کربن کایرال، باید اولویتهایی را در نظر بگیریم. این اولویتها به ترتیب در زیر آورده شدهاند:
- اتمها: به ترتیب کاهش عدد اتمی، اتمهای متصل به کربن را شمارهگذاری کنید. عدد اتمی کمتر، اولویت کمتری هم دارد. ایزوتوپها را به ترتیب کاهش جرم اتمی مرتب میکنیم. به طور مثال، در ایزوتوپهای هیدروژن، اولویت دوتریوم از هیدروژن بیشتر است.
$$\mathrm{I}>\;mathrm{Br}>\;mathrm{Cl}>\;mathrm{F}>\;mathrm{O}>\;mathrm{N}>\;mathrm{C}>\;^{2} \mathrm{H}>\;^{1} \mathrm{H}$$
- گروهی از اتمها: اگر یک اتم کایرال، به دو یا چند اتم مشابه متصل شده باشد، با بررسی زنجیر کربنی، گروههای آلکیلی را پیدا و قانون اول را بر آنها اعمال میکنیم. بدین ترتیب خواهیم داشت:
- پیوندهای چندگانه: هر پیوند یگانه، یک اولویت محسوب میشود. بنابراین، وقتی پیوند سهگانه داریم، اولیت آن ۳ برابر بیشتر از پیوند یگانه است. بدین صورت برای پیوندهای چندگانه خواهیم داشت:
اولویت شمارهگذاری برای گروههای عاملی معروف شامل اکسیژن به صورت زیر است:
(الکلها) (آلدهیدها) (کربوکسیلیک اسیدها)
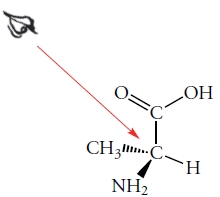
از این روش میتوانیم برای توضیح کنفیگراسیون انانتیومر «آلانین» (Alanine) استفاده کنیم. این مولکول، شامل یک مرکز کایرال متصل به اتم هیدروژن، یک گروه متیل، یک گروه کربوکسیلیک اسید و یک گروه آمینو است. کنفیگراسیون این مولکول به شکل زیر و از نوع S خواهد بود.
خوب است بدانید که جهت چرخش نوری یک ایزومر فضایی، نوع کنفیگراسیون آن را تعیین نمیکند. به عبارت دیگر، علامت (+)، نشاندهنده نوع کنفیگراسیونی همچون R نیست. به طور مثال، چرخش نوری مولکول (S)-(-)-2 بوتانول به صورت ساعتگرد است. ایزومر آن به صورت زیر نوشته میشود:
(S)-(+)-2 بوتانول
مولکولهایی با چندین مرکز استرئوژنیک
ترکیبات بسیاری هستند که چندین مرکز استرئوژنیک دارند. به طور مثال، آنتیبیوتیک اریترومایسین، دارای ۱۸ مرکز استريوژنیک است که در تصویر زیر نیز دیده میشود. کایرالیته یک مولکول با بیش از یک مرکز استرئوژنیک، به نوع مراکز و همارز بودن آنها بستگی دارد. عبارت «ناهمارز» (non-Equivalent) به این معنی است که کربن استرئوژنیک با گروههای جانشینی مشابه، پیوند ندارد.

مراکز استرئوژنیک ناهمارز
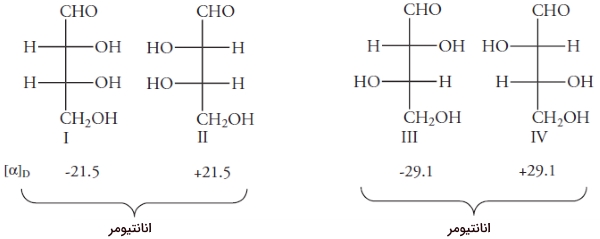
همانطور که گفته شد، اگر مولکولی، بیش از یک مرکز استرئوژنیک داشته که به گروههای مشابه متصل نشده باشد، به آن ناهمارز میگویند. اگر n مرکز ناهمارز داشته باشیم، تعداد ایزومرهای فضایی برابر خواهد بود با . مولکول ۲و۳و۴ تریهیدروکسی بوتانال را در نظر بگیرید:

کربنهای شماره ۲و ۳ کایرال هستند. با توجه به اینکه به گروههای مشابهی متصل نیستند، ناهمارز به شمار میآیند. در نتیجه، کنفیگراسیون در کربنهای ۲ و ۳ میتواند به صورت R یا S باشد. کنفیگراسیونهای مختلف این مولکول را در تصویر زیر مشاهده میکنید. همانطور که در بالا فهمیدیم، تعداد ایزومرهای فضایی این مولکول، ۴ است.
دیاسترومرها
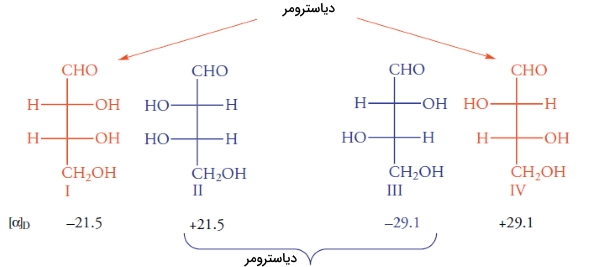
ارتباط بین ایزومرهای فضایی مولکول قبل را میتوان با قرار دادن یک آینه مشخص کرد. فرض کنید آینهای بین مولکولهای I و II قرار دادهایم. ساختارهای I و II، بریکدیگر منطبق نیستند و در نتیجه، انانتیومر یکدیگر هستند. ساختارهای III و IV نیز بر یکدیگر منطبق نیستند. همانند تمامی انانتیومرها، این ساختارها، نور را با جهت مخالف اما به یک میزان میچرخانند.
ساختارهای I و III، ایزومر فضایی هستند اما انانتیومر یکدیگر نیستند. ایزومرهای فضایی که انانتیومر نباشند را «دیاسترومر» (Diastromer) مینامند. با این تعریف، جفتهای II و III نیز به همراه I و IV و همچنین II و IV دیاسترومر نام دارند. برخلاف انانتیومرها که خواص فیزیکی و شیمیایی یکسانی داشتند، این خواص برای دیاسترومرها متفاوت است. به طور مثال، انانتیومرهای I و II، هردو در دمای اتاق مایع و به شدت در اتانول، انحلالپذیر هستند. انانتیومرهای III و IV، هردو در دمای 130 درجه سانتیگراد ذوب میشوند و انحلالپذیری کمی در اتانول دارند.
شیمی فضایی و حس بویایی
حواس ما، با کنفیگراسیون مولکولها واکنش نشان میدهند. حس چشایی و بویایی، هردو به دلیل تغییر القا شده در رسپتور حسی به هنگام تشکیل پیوند با مولکولی کوچک (لیگاند) بوجود میآید. در نتیجه، بوهای مختلفی که حس میکنیم، حاصل پیوندهای لیگاند و همچنین کایرالیته مولکول است.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی آلی ۳
- اصطلاحات کروماتوگرافی گازی — به زبان ساده
- هیدروکربن ها — به زبان ساده
^^













یه سوال؟
یه جایی گفته شده راستگرد(ساعتگرد) و چپگر بودن(پادساعتگرد) رو d,s مشخص نمی کنه!
متن زیر :
خوب است بدانید که جهت چرخش نوری یک ایزومر فضایی، نوع کنفیگراسیون آن را تعیین نمیکند. به عبارت دیگر، علامت (+)، نشاندهنده نوع کنفیگراسیونی همچون R نیست. به طور مثال، چرخش نوری مولکول (S)-(-)-2 بوتانول به صورت ساعتگرد است. ایزومر آن به صورت زیر نوشته میشود:
S)-(+)-2 بوتانول
می شه بیشتر توضیح بفرمایید؟
چون با توضیحات بالاتر، تو ذهن من اینجوری نشسته که ساعتگرد یعنی راستگرد و انحراف نور بسمت راست و پادساعتگرد یعنی انحراف بسمت چپ نور!
ممنون می شم
سلام
بسیار خوب و روان توصیح داده اید. واقعا لذت بردم.
اشکالات زیادی داشتم که با مطالعه مطالب شما، وقتی بر طرف می شد، حس خیلی خوبی بهم دست می داد.
خیلی خیلی ممنونم.
همواره موفق و سر افراز باشید.
بسیار روان و قابل فهم توضیح دادین
خیلی ممنون 🌻🙏
چقدر کامل و روان توضیح دادید. بسیار ممنون
با سلام؛
خوشحالیم که مطالعه این مطلب برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
باسلام مطالب بسیار خوب وبا تصاویر واضح توضیح داده شد ه است وبرای همه مفید است حتی مدرسان .
بسیار ممنون از مطالب ارزشمند شما بزرگواران
سلام خیلی ممنون از توضیحاتتون
میشه فیلمی از این که تصاویر آینه ای به طور کامل بر هم منطبق نمیشن بذارید؟
چون من منطبق نشدن دست راست و چپ رو متوجه نمیشم
سلام وقتتون بخیر ممنون از وقتی که گذاشتید برای ارائه مطالب
ببخشید من اون قسمت که مربوط به تعیین علامت مثبت و منفی هست متوجه نمیشم میشه راهنمایی بفرمایید
سلام و وقت شما بهخیر؛
انانتیومرها نور قطبیده را با مقدار برابر و در جهت مخالف یکدیگر میچرخانند و برای بیان آن از عددی استفاده میشود که دارای علامت مثبت و منفی است. در صورتی که چرخش نور قطبیده توسط یک انانتومر بهصورت ساعتگرد باشد، مقدار آن چرخش را با علامت مثبت مشخص میکنند. همچنین برای انانتیومرهایی که نور قطبیده را در جهت پادساعتگرد میچرخانند، علامت منفی به کار میرود.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
دوست عزیز منظور اینه که اگر دست راست و چپ رو کنار هم بزارید انگار تصویر یک جسم در آینه هست اما منظور از منطبق نشدن این است که یک دست را به طور مثال به طور عمود بلند کنید و روی دست دیگر بزارید نه اینکه انگشتان را نظیر به نظیر مقابل هم قرار دهید.
مرسی از توضیحات واضح و کاملتون
سلام . ببخشید می شود مثل اکثر آموزک های ریاضی و فیزیک ؛ ویدیو هم بگذارید ؟
عاااااااااالیییییی بود بینظیر بود …?????
عالی
آقای بحرکاظمی، درود برشما؛ بسیار مفید بود.
خیلی ممنون???
عالی، تشکر
عالی
بسیار عالی متشکرم