مخلوط راسمیک چیست؟ — به زبان ساده
در شیمی، مخلوطی که شامل هر دو مقدار انانتیومر راستگردان و چپگردان یک مولکول کایرال باشد را مخلوط راسمیک مینامیم. اولین مخلوط راسمیک شناخته شده موسوم به راسمیک اسید است که توسط لویی پاستور کشف شد. از آنجایی که انانتیومرها در مخلوط راسمیک، چرخش ویژه برابر، اما با جهت مخالف دارند، یک مخلوط راسمیک هیچ فعالیت نوری ندارد. بنابراین، نمیتوان تنها به کمک دستگاه پلاریمتر، یک مخلوط راسمیک را از یک ماده اکایرال تشخیص داد.
توجه داشته باشید که عبارات «فعالیت نوری» (Optical Activity) و «کایرال» (Chiral) را با یکدیگر اشتباه نگیرید. نمیتوان گفت که یک مخلوط راسمیک، اکایرال است چراکه کایرالیته خواصی از مولکول است که به طور جداگانه آن را برای یک مولکول تعیین میکنند. یک مخلوط راسمیک از مولکولهای کایرال تشکیل شده است اما به دلیل وجود انانتیومرهای راستگرد و چپگرد، فعالیت نوری ندارد.
خواص مخلوط راسمیک
همانطور که در ابتدای متن نیز به آن اشاره شد، یک مخلوط راسمیک فاقد فعالیت نوری است. همچنین، برخلاف انانتیومرهای خالص که خواص فیزیکی مشابهی - به غیر از چرخش نور پلاریزه - دارند، در برخی موارد، مخلوط راسمیک خواصی متفاوت از انانتیومرهای خالص نشان میدهد. از بین این خواص، به طور معمول میتوان به نقطه ذوب متفاوت اشاره کرد اما تفاوت در انحلالپذیری و نقطه جوش نیز از مواردی هستند که در مخلوطهای راسمیک نسبت به انانتیومرهای خالص قابل بررسی است.
راسمیک شدن
به فرآیندی که در آن، یک مخلوط راسمیک از مواد کایرال تشکیل شود را «راسمیک شدن» (Racemization) میگویند. یکی از روشهای راسمیک شدن، مخلوط کردن مقادیر مساوی از انانتیومرهای مواد است. به طور مثال، زمانی که (R)-3- فنیل-۲-بوتانون در محلول آبی اتانول شامل سدیم هیدروکسید یا هیدروژن کلرید حل شود، یک مخلوط راسمیک بدست میآید.
در صورتیکه فرآیند راسمیک شدن منجر به تولید مخلوطی با تعداد برابر انانتیومرهای راستگردان و چپگردان شود، به مخلوط حاصل، مخلوط راسمیک میگویند. همچنین، تبلور یک مخلوط راسمیک، ممکن است هر دو شکل ایزومرهای راستگردان و چپگردان را بدست دهد و در مواردی نیز، یک مخلوط راسمیک، در اثر تبلور بدست میآید.
سنتز مخلوط راسمیک
بدون استفاده از یک کاتالیزور یا حلال کایرال، واکنشی که فرآوردهای کایرال بدست دهد، همواره به صورت مخلوط راسمیک به تولید میرسد. با اینکار، سنتز یک مخلوط راسمیک سادهتر و ارزانتر از تولید انانتیومر خالص است چراکه به شرایط خاصی نیاز ندارد. واکنشدهندههایی (ریجنتها) که مخلوط راسمیک تولید میکنند، خاصیت «فضاویژگی» (Stereospecificity) یا «فضاگزینی» (Stereoselectivity) ندارند.
چنین شرایطی برای ذرات مسطحی همچون اتم کربن $$sp^2$$ نیز وجود دارد که همچون یک «الکتروندوست» (Electrophile) عمل میکند. یک هستهدوست با احتمال ۵۰ درصد به دو طرف یک مولکول مسطح برخورد میکند که در نتیجه آن، مخلوطی راسمیک به تولید میرسد.
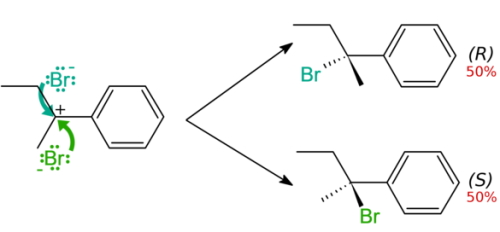
تفکیک در مخلوط راسمیک
جداسازی مخلوطهای راسمیک از جمله مشکلاتی است که شیمیدانها با آن سروکار دارند. انانتیومرها، انحلالپذیری و همچنین نقطه ذوب و جوش یکسانی دارند. در نتیجه، روشهای مختلفی که برای جداسازی مواد وجود دارند، در خصوص مخلوطهای راسمیک کارساز نیستند. به همین منظور، جداسازی انانتیومرها را در محیطی کایرال انجام میدهند چراکه رفتار مخلوطهای راسمیک در چنین محیطهایی متفاوت است.
یکی از این روشها، استفاده از «عامل تفکیککننده» (Resolving Agent) را شامل میشود. این روش بر مبنای اختلاف خواص فیزیکی دیاسترومرها بنا شده است. به طور مثال، فرض کنید که بخواهیم انانتیومرهای ۲-هیدروکسیل پروپیونیک اسید را از یکدیگر جدا کنیم. مادهای خالص (از نظر شیمی فضایی) را مانند (R)-۲-فنیل-اتیلآمین را به عنوان عامل تفکیککننده به مخلوط اضافه میکنیم. انانتیومرها در اثر برهمکنش با عامل تفکیککننده، دو ماده نمکی را تولید میکنند که دیاسترومر یکدیگر هستند. در نهایت، این دیاسترومرها را به کمک تبلور از یکدیگر جدا میکنند.
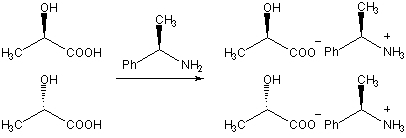
روش دیگر، بکارگیری یک روش کروماتوگرافی موسوم به کروماتوگرافی کایرال است. در این فرآیند، مخلوط راسمیک را در درون ستونی پرشده از یک ماده کایرال قرار میدهند. انانتیومرها به شکل متفاوتی با ماده درون ستون برهمکنش انجام میدهند و با سرعتهای متفاوتی به شکل «محصول شویش» (Eluate) از ستون خارج میشوند. از این روش در جداسازی انانتیومرها، همچون خالصسازی یک ماده نیز بهره میگیرند.
فزونی انانتیومری
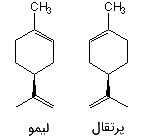
در بسیاری از موارد، کایرالیته یک مولکول، اهمیت زیادی به خصوص در کاربردهای آن دارد. این خصوصیت بویژه در سیستمهای بیولوژیکی اهمیت پیدا میکند. نمونهای از این حالت را میتوان در دو مولکول «لیمونین» (Limonene) مشاهده کرد که در این حالت، دو طعم متفاوت پرتقال و لیمو را میتوان از یک مولکول انتظار داشت.
زمانی که شیمیدانها بخواهند ترکیب مهمی را به لحاظ بیولوژیکی سنتز کنند، همواره نیازمند یک انانتیومر با خلوص بسیار بالا هستند. درجه خلوص انانتیومری در یک محلول را با «فزونی انانتیومری» (Enantiomeric Excess) یا ee بیان میکنند. فزونی انانتیومری را به صورت قدر مطلق اختلاف کسر مولی هر انانتیومر و با رابطه زیر بیان میکنند:
$${\displaystyle e e= | F_ {R}- F_ {S}|}$$
$${\displaystyle F_ {R} + F _{S} = 1}$$
در عمل، فزونی انانتیومری را به صورت درصد نشان میدهند:
$$% e e=\left(\left|F_{R}-F_{S}\right| \times 100right)$$
اگر تعداد مول هر انانتیومر تولیدی را بدانیم، فزونی انانتیومری را به کمک انانتیومرهای راستگردان و چپگردان و از طریق رابطه زیر میتوانیم محاسبه کنیم:
$$% e e=((R-S) /(R+S) \times 100)$$
به طور مثال، نمونهای با ۷۰ درصد ایزومر R و ۳۰ درصد ایزومر S، فزونی انانتیومری برابر با ۴۰ درصد خواهد داشت. به عبارت دیگر، در این مخلوط، ۴۰ درصد ایزومر خالص R و ۶۰ درصد، مخلوط راسمیک داریم. از فزونی انانتیومری به عنوان معیاری برای سنجش موفقیت یک «سنتز نامتقارن» (Asymmetric Synthesis) استفاده میشود.
از جمله استراتژیها برای تولید یک ماده خالص، تولید مخلوط راسمیک و تفکیک آن با یکی از روشهای مذکور است. البته از این روشها نمیتوان در واکنشهای گرانقیمت سنتزی و چندمرحلهای بهره گرفت زیرا با حذف یکی از انانتیومرها، بازده کاهش پیدا میکند. راه حل بهتر، بکارگیری ریجنتی است که به صورت گزینشی، تولید بیشتری از یک انانتیومر داشته باشد. البته، چنین مادهای باید یک کایرال باشد.
استفاده از ریجنت کایرال نیز با دشواری همراه است زیرا با کامل شدن واکنش، ریجنت کایرال از بین میرود. در نتیجه، بهتر است از یک کاتالیزور کایرال بهره بگیریم تا بتوان بارها از آن استفاده کرد. بهرهگیری از کاتالیزورهای کایرال، روشی نوین در شیمی آلی محسوب میشود که میتواند جایگاه خاصی به سنتز آلی ببخشد.
جمعبندی
در نهایت، با توجه به موارد مطرح شده در بالا، سه حالت مختلف را در بررسی مخلوطهای راسمیک خواهیم داشت. به تصاویر زیر نگاه کنید تا با مثالی ساده، این حالتها را بررسی کنیم.

- مخلوط راسمیک: در تصویر اول، تعداد برابر از دستکشهای دست راست و چپ داریم. در حقیقت، به تعداد مساوی انانتیومر داریم. چنین مخلوطی را مخلوط راسمیک میگویند.
- فزونی انانتیومری: در تصویر دوم، مقدار اضافی از دستکش دست راست داریم. در مواردی از این قبیل میتوان گفت که فزونی انانتیومری داریم.
- خلوص انانتیومری: در تصویر سوم، تنها دستکش دست راست داریم و میگوییم چنین مخلوطی به لحاظ اناتیومری خالص است چراکه تنها یک انانتیومر داریم.
برای اینکه گفتههای بالا را با شیمی تطابق دهیم، فرض میکنیم که مخلوطی از یک مولکول کایرال همچون ۲-بوتانول داریم که میتواند انانتیومرهایی به صورت S و R داشته باشد:
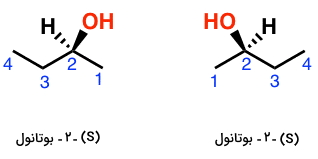
- محلولی که شامل مقادیر برابر از (R)-۲-بوتانول و (S)-۲-بوتانول باشد، یک مخلوط راسمیک است.
- محلولی که مقادیر اضافی از انانتیومرهای R یا S داشته باشد، دارای فزونی انانتیومری است.
- محلولی که تنها یکی از دو انانتیومر راستگردان یا چپگردان را داشته باشد، از لحاظ انانتیومری، خالص در نظر گرفته میشود.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه نرمافزارهای مهندسی شیمی
- آموزش رسم چند بعدی ساختار شیمیایی با ChemOffice (کم آفیس)
- اوربیتال مولکولی — به زبان ساده
- رزونانس در شیمی — به زبان ساده
^^










