اکسیداسیون چیست؟ – به زبان ساده + توضیح کامل و مثال
اکسیداسیون فرایندی است که طی آن یک الکترون از یک ترکیب به ترکیب دیگر منتقل میشود. این ترکیبهای شیمیایی میتوانند به فرم اتم، یون یا مولکول باشند. تعاریف متفاوتی برای فرایند اکسیداسیون وجود دارد. اکسیداسیون میتواند افزایش اتم اکسیژن به یک مولکول در نظر گرفته شود. به این فرایند اکسید شدن نیز میگویند. عکس این فرایند کاهش یا (احیا شدن در شیمی) نام دارد که در واقع کاهش اتم اکسیژن از مولکول است. واکنشهای اکسیداسیون در اطراف ما بسیار اتفاق میافتند. احتراق انواع سوختها، خوردگی فلزات و حتی فرایند فتوسنتز و تنفس سلولی نیز شامل واکنشهای اکسیداسیون هستند. در این مطلب از مجله فرادرس یاد میگیریم که اکسیداسیون چیست و به توضیح فرایندهای اکسایش-کاهش (ردوکس) و مثالهای آنها میپردازیم.
- یاد میگیرید شناسهها و افعال کمکی را درست بشناسید و به کار ببرید.
- یاد میگیرید عامل اکسنده و کاهنده در واکنش را شناسایی کنید.
- میآموزید عدد اکسایش را محاسبه و در تحلیل واکنش به کار ببرید.
- میتوانید واکنشهای ردوکس را با قواعد دقیق موازنه کنید.
- تفاوت موازنه در محیط اسیدی و بازی را خواهید شناخت.
- با نمونههای متنوع اکسیداسیون در زندگی و صنعت آشنا میشوید.


فرایند اکسیداسیون چیست؟
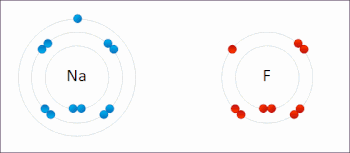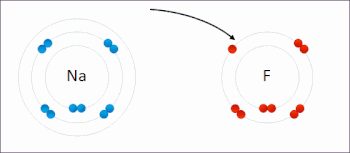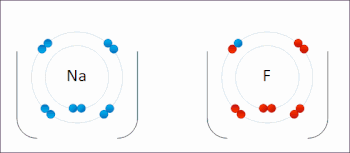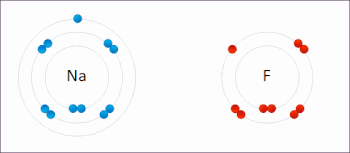
اکسیداسیون فرایندی است که در آن انتقال الکترون بین دو اتم، مولکول یا یون صورت میگیرد. در قسمت قبل اشاره شد که فرایند اکسیداسیون چیست و مثالهایی برای آن آورده شد. در تصویر زیر انتقال الکترون بین دو اتم سدیم و فلوئور را مشاهده میکنید.
اکسیداسیون لزوما به معنای انتقال اکسیژن نیست و میتواند با انتقال الکترون بدون حضور اکسیژن نیز صورت بگیرد.
واکنش ردوکس (اکسایش کاهش)
به واکنشهایی که شامل فرایند اکسیداسیون هستند، واکنش ردوکس گفته میشود. با کشف الکترون ،دانشمندان متوجه شدند که فرایند اکسایش و فرایند کاهش همزمان اتفاق میافتند و قابل جداسازی نیستند. فرایند انجام واکنشهای اکسایش و کاهش گاهی وقتها به صورت جداگانه به صورت نیمواکنشهای اکسایش-کاهش، نوشته میشوند. سپس، این دو واکنش با هم در نوشتار ترکیب شده و واکنش کلی نمایش داده میشود. این نیمواکنشها برای درک بهتری از شیوهی انتقال الکترون در اکسیداسیون نوشته میشوند. در فرمول کلی واکنش، الکترونهای نوشته شوه بازنویسی نمیشوند.
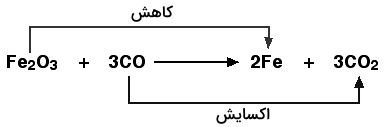
در تصویر زیر، واکنش اکسیداسیون کربن مونواکسید نوشتهشده است. این واکنش توسط پودر قرمز-قهوهای اکسید آهن III انجام میشود. فراوردههای این واکنش عنصر آهن و کربن دی اکسید هستند.
عاملهای اکسیدکننده و کاهنده در اکسیداسیون چیست؟
عامل کاهنده عاملی است که باعث کاهش اتم دیگر در فرایند اکسیداسیون میشود و به اتم کاهش یافته، الکترون میدهد. عامل اکسیدکننده اما، عاملی است که الکترون را دریافت میکند و باعث اکسیداسیون اتم دیگر در واکنش میشود. اکسیدکنندهها اتمهایی هستند که قابلیت دریافت الکترون از اتمهای دیگر را دارند و باعث اکسایش آنها میشوند. این اتمها طی فرایند اکسیداسیون خود کاهش مییابند.
برای مثال در واکنش زیر، منیزیم اکسید شده پس کاهنده است و مس کاهش یافته، پس اکسیدکننده است. این واکنش با ترکیب پودر سیاه رنگ اکسید مس و منیزیم صورت میگیرد و فراوردههای آن فلز مس و پودر سفید رنگ اکسید منیزیم هستند.
عوامل اکسیدکننده با یک علامت کلی بر روی برچسب اطلاعاتشان در آزمایشگاه شناسایی میشوند. در شکل زیر علامت اخطار دهنده مواد شیمیایی اکسنده را مشاهده میکنید.

عدد اکسایش در اکسیداسیون چیست؟
در قسمت قبل توضیح این که عامل اکسنده و کاهنده در فرایند اکسیداسیون چیست آورده شد. حال میخواهیم بدانیم چگونه میتوانیم تشخیص دهیم که یک فرایند شامل اکسیداسیون است. در برخی از موارد با نگاه کردن به فرمول واکنش میتوانیم تشخیص دهیم که واکنش شامل فرایند اکسیداسیون است یا خیر. برای مثال در واکنش زنگ زدن آهن، میتوان تشکیل یونهای و را از اتمهای خنثی آهن و اکسیژن مشاهده میکنیم.
واکنش زنگ زدن آهن به صورت زیر است.
در باقی موارد، ممکن است تشخیص اکسیداسیون به این سادگی نباشد. برای کمک به تشخیص این واکنشها، شیمیدانها عبارت (عدد اکسایش) یا (مرتبه اکسایش) را ابداع کردهاند.
عدد اکسایش به مقدار بار الکترونی گفته میشود که اتم اگر خنثی نبود میتوانست داشته باشد.
قوانین تعیین عدد اکسایش
حال با شناخت کافی از عدد اکسایش میخواهیم بدانیم قواعد تعیین عدد اکسایش اتمها در واکنشهای اکسیداسیون چیست. تعیین عدد اکسایش اتمها قوانین خاصی دارد که در زیر به توضیح آنها میپردازیم.
۱. اتمی به حالت خنثی
عدد اکسایش اتمها در حالت خنثی برابر با ۰ است.
برای مثال، عدد اکسایش اتم کلر در مولکول برابر با ۰ است. همین روند برای اتم هیدروژن در اتم و اتم گوگرد در مولکول وجود دارد.
۲. یونهای تکاتمی
عدد اکسایش در یونهای تکاتمی برابر با بار یون است.
برای مثال، عدد اکسایش کاتیون مس برابر با ۲+ و عدد اکسایش در آنیون برم برابر با ۱- است.
۳. ترکیبات مولکولی
در ترکیبات مولکولی، فلزات قلیایی (گروه۱ جدول تناوبی) همواره عدد اکسایشی برابر با ۱+ و فلزات قلیایی خاکی (گروه ۲) جدول تناوبی عدد اکسایشی برابر با ۲+ دارند.
۴. اتم فلوئور
اتم فلوئور همواره در ترکیبات عدد اکسایشی برابر با ۱- دارد.

۵. هیدروژن
در بیشتر ترکیبات هیدروژن عدد اکسایشی برابر با ۱+ دارد. استثنای بزرگی در این مورد هنگامی است که مولکول هیدروژن با فلزات ترکیب میشود. برای مثال در مولکول عدد اکسایش هیدروژن برابر با ۱- و در مولکول عدد اکسایش هیدروژن برابر با ۱- است.
۶. اکسیژن
عدد اکسایش اکسیژن در بیشتر ترکیبات برابر با ۲- است. در موارد استثنا، اکسیژن میتواند عدد اکسایشی برابر با ۱- داشته باشد. برای مثال در ترکیباتی که پروکسید نامیده میشوند( شامل) ، عدد اکسایش اکسیژن برابر با ۱- است. پروکسیدهای معروف و هستند.
۷.هالوژنهایی به غیر از فلوئور
در هالوژنهای کلر ، برم و ید ، عدد اکسایش برابر با ۱- است. مگر اینکه این ترکیبات با فلوئور ترکیب شوند. برای مثال در ترکیب عدد اکسایش کلر برابر با ۷- است.
توضیح این مسئله در ادامه آورده شده است.
از آنجا که عدد اکسایش اکسیژن ۲- است و بار کلی یون ۱- است،
۸. مجموع اعداد اکسایش در یک مولکول
مجموع اعداد اکسایش در یک مولکول خنثی برابر با ۰ و در یک یون چنداتمی برابر با بار یون است. برای مثال در یون چنداتمی نیترات، عدد اکسایش اکسیژن ۲- و بار کلی یون ۱- است پس عدد اکسایش نیتروژن برابر با ۵+ است.

مثال به دست آوردن عدد اکسایش
در ادامه چند مثال برای تمرین به دست آوردن عدد اکسایش آورده شده است.
۱. عدد اکسایش اتم گوگرد در ترکیب چند است؟
توضیح این مثال بدین صورت است که عدد اکسایش فلوئور و بار کلی اتم است. از آنجا که
پس عدد اکسایش اتم گوگرد برابر با ۶+ است.
به همین روش پاسخ سوالهای زیر نیز به دست میآید.
۲. عدد اکسایش اتم فسفر در ترکیب چند است؟
توضیح این مثال بدین صورت است که عدد اکسایش اتم هیدروژن = ۱+ و عدد اکسایش اتم هیدروژن = ۱+ است. از آنجا که
پس عدد اکسایش اتم فسفر برابر با ۵+ است.
۳. عدد اکسایش اتم ید در ترکیب چند است؟
توضیح این مثال بدین صورت است که عدد اکسایش اتم اکسیژن = ۲- و بار کلی مولکول = ۱- است. از آنجا که
پس عدد اکسایش اتم ید برابر با ۵+ است.
۴. عدد اکسایش اتم کربن در ترکیب چند است؟
توضیح این مثال بدین صورت است که عدد اکسایش اتم اکسیژن = ۲- و بار کلی اتم = ۲- است. از آنجا که
پس عدد اکسایش اتم کربن برابر با ۴+ است.
به دست آوردن عدد اکسایش به کمک ساختار لوییس اتمها
در مباحث قبل به دست آوردن عدد اکسایش را از روی واکنش اکسیداسیون فراگرفتیم و آموختیم اکسیداسیون چیست. یکی دیگر از روشهای به دست آوردن عدد اکسایش استفاده از ساختار لوییس اتمها در ترکیب است. ساختار لوییس یک ساختار ساده شده از آرایش الکترونی اتمها به صورت یونی و یا در مولکولها و پیوندهای کووالانسی را نشان میدهد.
در این ساختار، الکترونها به شکل تک نقطههایی اطراف اسم عنصر نوشته میشوند. هدف از این ساختار، دستیابی به بهترین آرایش الکترونی آخرین لایه اوربیتال اتمهاست. البته، در مطالب پیشین مجله فرادرس، به طور کامل راجع به آرایشهای الکترونی صحبت کردهایم که برای آشنایی بیشتر میتوانید مطلب موردنظر را مطالعه کنید.
قوانین تعیین عدد اکسایش اتم به کمک ساختار لوییس
در ادامه این مطلب، قوانین تعیین عدد اکسایش اتمها به کمک ساختار لوییس اورده شده است:
۱. جفت الکترونها متعلق به اتمی هستند که به آن متصل اند.
۲. الکترونهای درون پیوند دو اتم یکسان، به طور مساوی بین آنها تقسیم میشوند.
۳. الکترونهای پیوند بین اتمهای ناهمسان، متعلق به اتم الکترونگاتیوتر هستند.
برای محاسبه عدد اکسایش اتمها به کمک ساختار لوییس از فرمول زیر بهره میگیریم:
(تعداد الکترونهای اتم در ترکیب) - (تعداد الکترونهای والانس اتم در حالت خنثی) = عدد اکسایش اتم
مثال تعیین عدد اکسایش اتم به کمک ساختار لوییس
در ادامه مثالی برای درک بهتر این موضوع آورده شده است:
در تصویر زیر ساختار لوییس ترکیب (گاز بی رنگ) را مشاهده می کنید.

تعداد الکترونهای والانس اتم نیتروژن ۵ و اتم اکسیژن ۶ است. اتم اکسیژن از نتیروژن فعالتر است، پس الکترونهای پیوند آنها متعلق به اکسیژن در نظر گرفته میشود.
عدد اکسایش اتم نیتروژن
در مثال تعیین عدد اکسایش گاز بیرنگ دی نیتروژن مونواکسید از روی ساختار لوییس آن به روش زیر عمل میکنیم.
تعداد اکترونهای اتم نیتروژن +۵ و اتم اکسیژن +۶ است. به همان روش بالا، الکترونهای بین پیوند نیتروژن و اکسیژن برای اکسیژن که الکترونگاتیوتر است محاسبه میشود.
عدد اکسایش اتم نیتروژن مرکزی:
عدد اکسایش اتم اکسیژن:
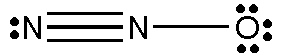
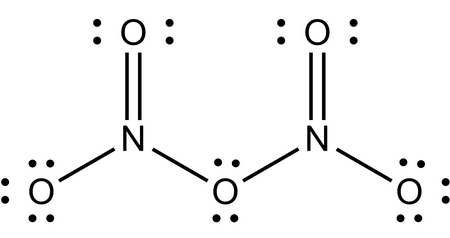
در مثال زیر در تعیین عدد اکسایش دی نیتروژن پنتا اکسید (پودر سفیدرنگ) اتمهای اکسیژن تمام بار الکترونی نیتروژنها را به سمت خود میکشند. پس عدد اکسایش اتم نیتروژن +۵ است. هر اتم اکسیژن نیز در ترکیب ۸ الکترون اطراف خود دارد. پس عدد اکسایش آن خواهد بود.
یادگیری واکنشهای شیمیایی با فرادرس
در این مطلب با واکنش اکسیداسیون که یکی از انواع واکنشهای شیمیایی است آشنا میشویم. برای شناخت اکسیداسیون در ابتدا با مفهوم واکنشهای اکسایش-کاهش آشنا میشویم. پس از آن باید مفهوم عدد اکسایش و نحوه تعیین آن را در انواع ترکیبها بیابیم تا بتوانیم واکنشهای اکسیداسیون را موازنه کنیم.
پیشنهاد میکنیم از فیلمهای آموزشی حوزه شیمی فرادرس بهره ببرید که با زبانی ساده ولی کاربردی این مطالب را توضیح میدهند. در فهرست زیر به چند مورد از این آموزشها اشاره کردهایم:
فرادرس فیلمهای آموزشی متنوعی را منتشر کرده که در فهرست زیر به چند مورد اشاره کردهایم:
- فیلم آموزش شیمی عمومی جامع با مفاهیم کلیدی
- مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی
- فیلم آموزش شیمی ۳ پایه دوازدهم
- فیلم آموزش شیمی دبیرستان همراه با نکته و حل تست کنکور
- فیلم آموزش شیمی عمومی ۱ و ۲ همراه با مرور و حل مسئله
موازنه نیمواکنشهای اکسایش-کاهش در اکسیداسیون چیست؟
به همان میزان که دانستن عدد اکسایش در فرایند اکسیداسیون حائز اهمیت است، موازنهی واکنشهای شیمیایی نیز اهمیت دارد.
برای موازنه کردن واکنشهای اکسایش کاهش، ابتدا باید بتوانیم به خوبی نیمواکنشهای آنها را بنویسیم. یک نیمواکنش برای مشخص کردن اکسایش و یک نیمواکنش برای مشخص کردن واکنش کاهش نوشته میشود. سپس این نیمواکنشها از لحاظ جرمی (استوکیومتری) و اندازه بار الکترونی موازنه میشوند. در انتها دو نیمواکنش اکسایش و کاهش باهم ترکیب شده و الکترونها که باید تعدادشان در هر دونیمواکنش برابر باشد، حذف میشوند و معادله موازنه میشود.
برای مثال واکنش اکسیداسیون و کاهش کبالت و نیکل را درنظر میگیریم.
حال میخواهیم بررسی کنیم که آیا این یک واکنش موازنه شده است یا خیر. باتوجه به تعداد هریک از اتمها در دو طرف معادله میتوانیم دریابیم که این معادله از لحاظ جرمی موازنه شده است. اما با توجه به بار یونها میتوان دریافت که بار الکترونی دوطرف واکنش موازنه نیست. مجموع بارهای الکترونی سمت چپ معادله برابر با ۳+ و مجموع بارهای الکترونی سمت راست معادله برابر با ۴+ است. برای موازنه کردن این معادله همانطور که در بالا اشاره شد ابتدا نیمواکنشهای اکسایش کاهش این واکنش را مینویسیم.
نیمواکنش اکسایش
برای بهتر انجام دادن موازنه در واکنشهای اکسایش کاهش، باید بدانیم واکنش اکسایش در این واکنش اکسیداسیون چیست. از آنجایی که اتم نیکل درحال اکسید شدن است، پس نیمواکنش اکسایش باید شامل اتم نیکل باشد.
با مشاهده میزان الکترون دو طرف نیمواکنش، متوجه میشویم که نیمواکنش از لحاظ بار الکترونی موازنه نیست. دو الکترون از دست رفتهی نیکل که باعث ایجاد کاتیون نیکل شده است باید در سمت راست نیمواکنش نوشته شود.
نیمواکنش کاهش
به همان ترتیب بالا نیمواکنش کاهش را نیز برای یون کبالت مینویسیم:
در این نیمواکنش کبالت (۳+) یک الکترون گرفته و به کبالت (۲+) تبدیل شده است.
در نهایت برای موازنه کردن این واکنش، دونیمواکنش اکسایش کاهش را زیر یکدیگر نوشته و بررسی میکنیم. برای برابر شدن تعداد الکترونهای جابجا شده معادلهی کاهش باید ضریب ۲ بگیرد.
حال میتوانیم دو نیمواکنش را با یکدیگر ترکیب و الکترونهای منتقل شده را حذف کنیم.
سپس نیمواکنش کاهش را اضافه میکنیم.
مشاهده میکنیم که معادله نهایی تعداد برابری از هر اتم در هر دو طرف واکنش دارد و میزان بار الکترونی هردو طرف برابر۶+ است.

موازنه کردن واکنشهای اکسایش کاهش پیچیده اسیدی و بازی
در مثال قبلی ما یک واکنش ساده اکسایش کاهش را موازنه کردیم. بسیاری از واکنشهای ردوکس در فاز آبی اتفاق میافتند و از واکنش بالا پیچیدهتر هستند. روش موازنه این نوع واکنشهای اکسیداسیون چیست؟ در چنین مواردی نیاز است که به معادله نیمواکنشها، مولکولهای آب و یک آنیون یا کاتیون اضافه شود.
در محلولهای اسیدی به معادله کاتیون و در محلولهای بازی به معادله آنیون اضافه میشود. در ادامه هرکدام از این موارد با توضیح بیشتری به همراه مثال آورده شدهاند.
مثال موازنه واکنش ردوکس در محلول اسیدی
سوال: واکنش فلز مس با یون نیترات را در محلول اسیدی موازنه کنید.
برای شروع موازنه واکنش را به دو نیمواکنش اکسایش( برای فلز مس) و کاهش (برای یون نیترات ) تقسیم میکنیم.
با توجه به دو نیمواکنش بالا درمییابیم که در نیمواکنشها تعداد اتمها برابر هستند.
در مرحله بعدی موازنه، برای برابر کردن بار الکترونی دوطرف نیمواکنشها، نیاز داریم که دو الکترون در سمت راست معادله اکسایش اضافه کنیم:
حال برای موازنه معادله کاهش، یک اتم اکسیژن در سمت راست نیمواکنش کم است. برای حل این مسئله، یک مولکول آب به سمت راست معادله اضافه میکنیم.
با انجام این کار تعداد اتمهای هیدروژن معادله بهم میریزد. برای حل این مشکل نیز به سمت چپ معادله دو کاتیون +H اضافه میکنیم و سپس تعداد الکترونهای دوطرف نیمواکنش را موازنه میکنیم.
بدین ترتیب خواهیم داشت:
در نهایت برای موازنه کردن واکنش کلی باید تعداد الکترونهای دو نیمواکنش برابر باشند، پس به نیمواکنش کاهش ضریب ۲ میدهیم و دو نیمواکنش را با یک دیگر ترکیب میکنیم.
و بدین ترتیب واکنش ما موازنه شد.

موازنه واکنشهای ردوکس در محلولهای بازی
در قسمت قبل موازنه واکنشهای ردوکس در محلولهای اسیدی را بررسی کردیم. حا میخواهیم بدانیم در محلولهای قلیایی روش موازنه واکنش اکسیداسیون چیست. در محلولهای بازی روشی مشابه موازنه محلولهای اسیدی را داریم با این تفاوت که برای موازنه تعداد اکسیژنها و بار الکترونی از مولکول آب و آنیون استفاده میکنیم.
سوال: واکنش آنیون پرمنگنات و آنیون ید را در محلول بازی موازنه کنید.
قدم اول: تقسیم معادله به نیمواکنشهای اکسایش( یون ید) و کاهش( یون پرمنگنات)
قدم دوم: موازنه تعداد اتمها و بار الکترونی
برای موازنه تعداد اکسیژنهای نیمواکنش کاهش با اضافه کردن همزمان مولکول آب و یون به روش آزمون و خطا میتواند مشکلساز و وقتگیر باشد. برای آسانتر کردن این موازنه ابتدا تصور میکنیم این واکنش در محلول اسیدی انجام شده است. بدین ترتیب تعداد مولکولهای آب و کاتیونهای هیدروژن را اضافه میکنیم.
و سپس برای حذف کردن کاتیونهای هیدروژن در واکنش و خنثی کردن آن، به تعداد آنها به دو طرف معادله، آنیونهای اضافه میکنیم.
مجموع کاتیونهای و آنیونهای ، مولکول آب را تشکیل میدهند. سپس تعداد الکترونهای مورد نیاز برای موازنه بار الکترونی را اضافه و به نیمواکنش اکسایش ضریب میدهیم و دو نیمواکنش را با یکدیگر ترکیب میکنیم.
در نهایت الکترونها را حذف میکنیم و معادله ما موازنه میشود. از ترکیبات فراورده این واکنش، پودر سیاه رنگ منگنز دیاکسید است.
سایر تعریف های اکسیداسیون چیست؟
در مطالب قبل آموختیم که اکسیداسیون چیست و چگونه میتوان عدد اکسایش اتمها را به دست آورد و واکنشها را موازنه کرد. حال میخواهیم فرایند اکسیداسیون را از جنبههای دیگر نیز بررسی کنیم. اکسیداسیون دربیشتر اصطلاحات، فرایندی است که در آن اتمی الکترون به دست میآورد و کاهش فرایندی است که طی آن اتم الکترون از دست میدهد. واکنشهای اکسایش و کاهش بیشتر وقتها در کنار هم و به عنوان واکنش ردوکس شناخته میشوند. واکنشهای الکتروشیمیایی یک از بهترین مثالهای تشخیص این گونه اکسیداسیون هستند.
برای مثال هنگامی که یک مفتول مسی را داخل محلولی که دارای یون نقره است قرار دهیم، الکترونها از فلز مس به نقره متنقل میشوند. فلز مس اکسید شده و رسوبات نقره روی مفتول مسی تشکیل میشوند. درحالی که یونهای مس در محلول آزاد میشوند و رنگ محولو را به آبی متمایل میکنند.

یک مثال دیگر اکسیداسیون از این نوع، هنگامی است که یک عنصر با اکسیژن ترکیب میشود. برای مثال ترکیب فلز منیزیم با اکسیژن برای تشکیل منیزیم اکسیداز این نوع است.

بالاتر اساره شد که اساس یک واکنش اکسیداسیون چیست. در اکسیداسیون یک انتقال الکترون رخ میدهد. درواقع هنگامی که اکسایش رخ میدهد یک الکترون از یک اتم جدا شده و هنگامی که کاهش اتفاق میافتد یک الکترون به اتم اضافه میشود.
با ذکر یک مثال به توضیح بیشتر این موضوع میپردازیم. در واکنش فلز منیزیم با اکسیژن هوا منیزیم اکسید سفید رنگ تولید میشود. این واکنش با شدت بسیاری انجام میگیرد و با آزاد شدن انرژی به صورت نور و حرارت همراه است.
در واکنش بالا اتم منیزیم الکترون از دست میدهد تا به منیزیم اکسید تبدیل شود. همچنین اکسید مس، یک الکترون دریافت میکند و به فلز مس خالص تبدیل میشود.
اکسیداسیون میتواند در اتم، مولکول یا یون اتفاق بیافتد. عکس این فرایند که کاهش نام دارد به شکل جذب الکترون یا افزایش درجه اکسایش اتم مولکول یا یون شکل میگیرد.
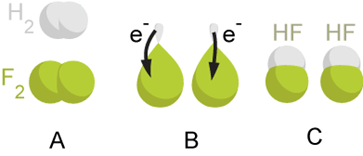
مثال خوب دیگری از این واکنش تشکیل مولکول هیدروفلوئوریک از دو مولکول فلوئور و هیدروژن است. در واکنش زیر مشاهده میکنید که هیدروژن اکسید شده و الکترون از دست میدهد در حالی که فلوئور کاهش یافته و الکترون جذب میکند.
اکسیداسیون شامل اتم اکسیژن
در یک معنی قدیمی تر از فرایند اکسیداسیون، این فرایند همراه با انتقال اتم اکسیژن همراه بود. این واقعه به این علت است که در ابتدا اولین عامل اکسیدکنندهی مواد، اکسیژن هوا در نظر گرفته میشده است. اکسیژن اضافه شده به یک ترکیب به عنوان یکی از روشهای اکسیداسیون در نظر گرفته میشود.
هرچند که درواقع افزایش اکسیژن به یک ترکیب با کاهش الکترون در آن همراه است اما امروزه به طور معمول افزایش اکسیژن جزو دیگر دسته بندی واکنشها قرار میگیرد. برای مثال افزودن اکسیژن به هیدروکربنها در دسته بندی واکنشهای شیمیایی احتراق قرار میگیرد. یکی از آشناترین مثالهایاکسیداسیون شامل اتم اکسیژن، تشکیل اکسید آهن قرمز طی واکنش زیر است. اسید آهن تولید شده در واقع همان زنگ آهن است.
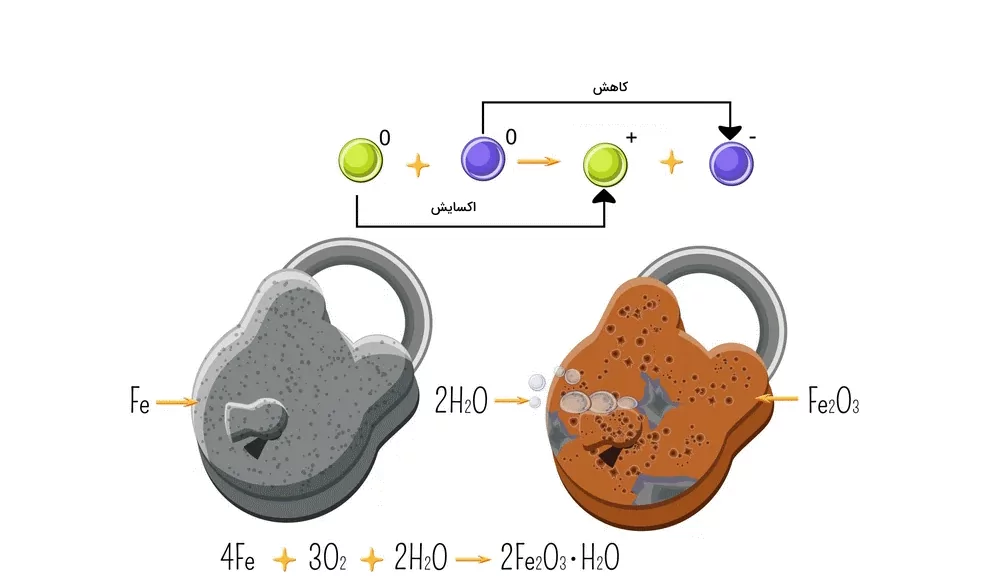
به تصویر زیر نگاه کنید که البته بالاتر نیز به آن اشاره کردیم. زمانی که آهن در ترکیب مولکولی اکسید آهن با کربن مونواکسید واکنش میدهد، فلز آهن خالص به همراه گاز کربن دی اکسید تولید میشود. برای تشخیص این موضوع که اکسیژن در این فرایند کجا اضافه شده و الکترون کجا کاهش یافته است به روش زیر عمل میکنیم:

میتوانیم بگوییم کربن مونواکسید اکسید شده است از آنجا که یک اتم اکسیژن به آن اضافه شده و کربن دی اکسید تشکیل شده است. به اکسید آهن که باعث اکسید شدن کربن مونواکسید شده است عامل اکسایش یا اکسیداز میگویند.
برای بررسی تاثیر کربن مونواکسید روی اکسید آهن، واکنش آن را بررسی میکنیم. کربن مونواکسید با کاهش دادن اکسیژن اکسید آهن آنرا کاهش داده است پس به آن کاهنده میگویند.
اکسیداسیون شامل اتم هیدروژن
اکسیداسیون شامل اتم هیدروژن تعریف جدیدتر واکنش اکسیداسیون است.همچنین برای توضیح انواع واکنشها در شیمی آلی استفاده از اتم هیدروژن راحتتر از اکسیژن است. در اکسیداسیون شامل اتم هیدروژن، اتمی که اکسید میشود هیدروژن خود را از دست میدهد. اتمی که کاهش میابد، هیدروژن دریافت میکند.

اکسیداسیون بر اساس انتقال الکترون
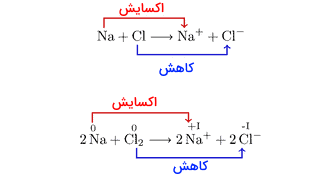
بر اساس تعریف انتقال الکترون در واکنش، اکسیداسیون از دست دادن الکترون و کاهش به دست آوردن الکترون است.اتمها با دریافت یا از دست دادن الکترون میتوانند به یون مثبت(کاتیون) یا یون منفی (آنیون) تبدیل شوند. برای مثال اکر اتم سدیم الکترون از دست بدهد، تبدیل به کاتیون می شود و اتم کلر اگر الکترون دریافت کند، تبدیل به آنیون میشود. به همین ترتیب گفته میشود که اتم کلر کاهش یافته و اتم هیدروژن اکسایش یافته است.
واکنشهای عدم تناسب
همانگونه که اشاره شد، اتمها میتوانند در فرایندهای ردوکس، اکسایش یا کاهش بیابند. نوع دیگری از فرایندها نیز وجود دارند که در این واکنشها یک عنصر به طور همزمان در یک واکنش هم اکسایش و هم کاهش مییابد. به این فرایندها واکنش عدم تناسب میگویند. برای مثال، یون تیوسولفات ( با عنصر گوگرد در مرتبه اکسایش +۲) در حضور اسید میتواند هم عنثر حنثی کوکرد با عدد اکسایش ۰ و هم گوگرد دیاکسید با درجه اکسایش ۴+ تولید کند.
مثالهایی از اکسیداسیون در دنیای واقعی
در مطالب قبل آموختیم که اکسیداسیون چیست و از چه جنبههایی قابل بررسی است. همچنین مثالهایی از واکنشهای اکسیداسیون را در شیمی باهم بررسی کردیم. حال به بررسی مثالهایی از اکسیداسیون در دنیای پیرامونمان میپردازیم.
اکسیداسیون در شیمی
یکی از مهمترین مثالهای واکنش اکسیداسیون در شیمی واکنش جایگزینی(جانشینی) فلزات است. در یک ترکیب یا محلول، یک اتم فلز با یک اتم فلز دیگر جایگزین میشود. برای مثال، در واکنش فلز روی با محلول سولفات مس، فلز روی با فلز مس جایگزین میشود و روی سولفات و فلز مس فراوردههای این واکنش هستند. واکنش اشاره شده یک واکنش اکسیداسيون است. این واکنش در بستری به نام سلول گالوانیزه رخ میدهد.
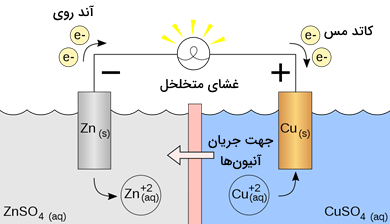
برای درک بهتر چگونگی انجام این دست واکنشها باید به سری واکنش پذیری فلرات توجه کنیم. فلزات فعال تر در این واکنشها با فلزاتی که کمتر واکنشپذیر هستند جایگزین میشوند.
از دیگر فرایندهای مهم اکسیداسیون که پیشتر به آن اشاره شد می توان احتراق را نام برد. فرایند احتراق بسیاری از هیدروکربنها بشدت گرما و نور تولید میکنند و میتوانند منابع مهمی برای انواع سوخت باشند. برای مثال واکنش اکسیداسیون پروپان را در زیر مشاهده میکنید.
پتانسیل فرایند اکسیداسیون چیست؟
همانطور که اشاره شد، کاهش شامل به دست آوردن الکترون و اکسایش با از دست دادن الکترون اتفاق میافتد و از این موضوع در سلولهای گالوانی استفاده میشود. به تمایل یک الکترود در سلول برای جذب الکترون، پتانسیل احیا ( یا پتانسیل اکسیداسیون احیا، یا پتانسیل کاهش) گفته می شود. این پارامتر بر اساس انرژی تعریف شده و بر حسب ولت اندازه گیری میشود.
اکسیداسیون در زیست شناسی
بسیاری از پدیدههای طبیعی بیولوژيک با واکنش ردوکس اتفاق میافتند. برای مثال فرایندهای تنفس سلولی از واضح ترین مثالهای اکسیداسیون در طبیعت هستند. برای مثال واکنش اکسید شدن گلوکز( قند ساده) و تبدیل آن به کربن دی اکسید و آب یک نوع اکسیداسیون است. عکس این فرایند نیز که درواقع همان فرایند فتوسنتز است یک واکنش ردوکس است.
فرایند فتوسنتز به کاهش کربن دراکسید به قند و اکسیداسیون مولکول اکسیژن به آب میانجامد.
از دیگر مثالهای فرایند اکسیداسیون در طبیعت میتوان به ترش شدن سرکه (تولید سرکه از اتانول)، سوختن چوب ، سبز شدن مجسمههای برنزی، فرایند شکسته شدن قند در بدن، اکسیداسیون اسیدهای چرب و احتراق سوختهای فسیلی اشاره کرد. هم چنین فرایند فاسد شدن میوهها نیز نوعی اکسیداسیون است. قهوهای شدن رنگ سیب و موز در حضور هوا باعث قهوهای شدن موادی به نام ترکیبات فنولی در میوهها میشود.

اکسیداسیون در زمین شناسی
واکنشهای اکسیداسیون در زمینشناسی نیز به اندازه سایر زمینهها اهمیت دارند. واکنشهای ردوکس برای تولید مواد معدنی و انتقال آنها در طبیعت، رسوب لایههای زمین و ... اتفاق میافتند. برای مثال بطور کلی، زمینشناسان از روی رنگ سنگها میتوانند به مرحله اکسایش آنها پی ببرند. درشرایط محیطی مناسب برای اکسیداسیون، معمولا رنگ سنگها به سمت قرمز میل میکند. اگر رنگ سنگ یا خاک به سبز یا سفید میلکند، نشان دهنده آن است که مایعی کاهش دهنده از بستر آن سنگ یا خاک عبور کرده است.

اکسیداسیون در صنعت
حفاظت کاتودی تکنیکی است که برای جلوگیری از خوردگی فلزات در صنعت استفاده میشود. این کار با تبدیل سطح فلز به یک کاتد یک سلول الکتروشیمیایی انجام میشود. در این روش از یک فلز دیگر به عنوان آند گالوانیزه(فدا شونده) استفاده میشود تا به جای فلز اصلی دچار خوردگی شود. یکی از اصلیترین نمونههای این استفاده سلول گالوانیزه است که پیش تر اشاره شد.
مثالهای دیگر اکسیداسیون چیست؟
در جدول زیر از مجله فرادرس چند نمونه دیگر از مثالهای فرایندهای اکسیداسیون آورده شده است.
| واکنش | فرمول |
| اکسیداسیون متان | |
| اکسیداسیون آلومینیوم در حضور برم (تولید آلومینیوم برمید سفید-زرد) | |
| اکسیداسیون لیتیوم (تولید اکسید لیتیوم سفید) | |
| اکسیداسیون منیزیم در حضور نیتروژن (تولید منیزیم نیترید سبز-زرد) |
جمع بندی
اکسیداسیون به فرایندی گفته میشود که طی آن یک اتم اکسید شده باشد. فرایند اکسیداسیون همواره با فرایند کاهش همراه است و به معادلهی کلی، واکنش اکسایش کاهش گفته میشود. در این واکنشها معمولا با انتقال الکترون یا اکسیژن همراه هستند. به اتمی که الکترون از دست میدهد کاهنده ( اکسید شده ) و به اتمی که الکترون به دست میآورد اکسیدکننده (کاهش یافته) میگویند. راه دیگری برای تشخیص فرایند اکسیداسیون استفاده از عدد اکسایش است که اگر افزایش یابد، اتم اکسید شده و اگر کاهش یابد، اتم کاهش داده شده است. اکسیداسیون اساس بسیاری از فرایندهایی است که در زندگی روزمره و طبیعت اتفاق میافتند.












