انرژی یونش – به زبان ساده
انرژی یونش به انرژی مورد نیاز برای حذف یک الکترون از یک اتم یا یون در حالت گازی میگویند. انرژی یونش اولیه یا ابتدایی در یک اتم یا مولکول که آن را با نشان میدهند، به انرژی مورد نیاز برای حذف یک مول الکترون از یک مول اتم یا یون گازی مجزا میگویند.


علاوه بر این، انرژی یونش (یونیزاسیون) را به عنوان معیاری برای دشواری حذف الکترون یا قدرت پیوند در یک الکترون در نظر میگیرند. هرقدر انرژی یونش بیشتر باشد، حذف الکترون با دشواری بیشتری همراه است. در نتیجه، انرژی یونش را میتوان به عنوان معیاری برای واکنشپذیری یک اتم دانست. همچنین، انرژی یونیزاسیون را میتوان برای پیشبینی قدرت پیوند شیمیایی نیز به کار برد.
مقدمه
همانطور که گفته شد، انرژی یونش، به مقدار انرژی میگویند که یک اتم در حالت گازی باید جذب کند تا با از دست دادن یک الکترون، یک کاتیون بوجود بیاید.
واکنش آن را به صورت زیر نشان میدهند:
به طور معمول، این انرژی را به صورت بیان میکنند. زمانی که یک اتم خنثی را در نظر میگیریم، خارج کردن اولین الکترون از اتم، به انرژی کمتری نسبت به خارج کردن الکترون دوم نیاز دارد و به همین ترتیب، الکترون دوم، انرژی کمتری نسبت به الکترون سوم نیاز دارد. این امر به این دلیل پیش میآید که بعد از خارج شدن الکترون اول، بار کلی اتم، مثبت و نیروهای منفی الکترون، به بار مثبت در یون جدید جذب میشوند. هرقدر الکترون بیشتری از دست برود، بار مثبت بیشتری در یون خواهیم داشت و جداکردن الکترون از آن، دشوارتر خواهد بود.
به طور کلی، هرقدر یک الکترون از هسته اتم دورتر باشد، خارج کردن آن، سادهتر میشود. به عبارت دیگر، انرژی یونش، تابعی از شعاع اتمی است و هرقدر شعاع اتمی کوچکتر باشد، به انرژی بیشتری برای حذف الکترون از خارجیترین لایه نیاز داریم. به طور مثال، خارج کردن اتم از عناصر بزرگ همچون کلسیم، بسیار سادهتر از خارج کردن الکترون از اتمی همچون کلر است که در آن، الکترونها با نیروی بیشتری در اطراف هسته قرار گرفتهاند.
در یک واکنش شیمیایی، فهم انرژی یونش از آن جهت اهمیت دارد که به کمک آن میتوان رفتار اتمها در تشکیل یک پیوند یونی یا کووالانسی را توضیح داد. به طور مثال، انرژی یونیزاسیون سدیم برابر با است. درحالی که انرژی یونش اول اتم کلر، مقداری برابر با دارد. به دلیل این اختلاف در انرژی یونش، به هنگام واکنش با یکدیگر، پیوند حاصل، از نوع پیوند یونی است. عناصری که در جدول تناوبی در کنار یکدیگر قرار گرفتهاند یا عناصری که اختلاف زیاد در انرژی یونش ندارند، پیوندهای کووالانسی یا پیوندهای قطبی کووالانسی تشکیل میدهند.
به طور مثال، کربن و اکسیژن، را بوجود میآورند. دو اتم شرکتکننده در مولکول دیاکسید کربن، هر دو در یک تناوب از جدول تناوبی و با فاصله کمی از یکدیگر قرار دارند. بنابراین، پیوند کووالانسی تشکیل میدهند. کربن و کلر نیز با تشکیل ، مولکول دیگری با پیوند کووالانسی را تولید میکنند.
روند انرژی یونش در جدول تناوبی
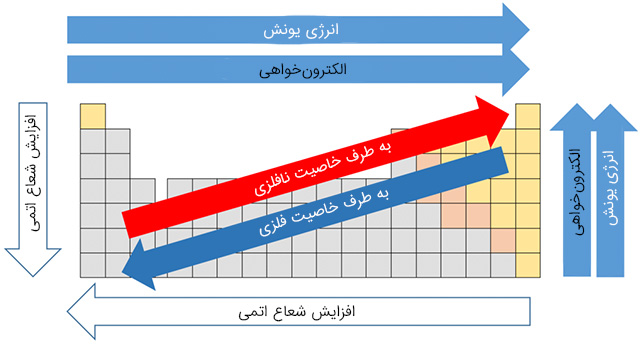
همانطور که در بالا توضیح داده شد، انرژی یونش به شعاع اتمی وابسته است. از آنجایی که با حرکت از سمت چپ به راست در جدول تناوبی، شعاع اتمی کاهش پیدا میکند، در نتیجه، انرژی یونش نیز با حرکت از چپ به راست در هر تناوب افزایش مییابد. به همین صورت، با افزایش شعاع اتمی از بالا به پایین در هر گروه، انرژی یونش، کاهش پیدا میکند.
البته فلزات قلیایی خاکی (گروه ۲) و عناصر گروه نیتروژن (گروه ۱۵) از این روند پیروی نمیکنند. به طور معمول، عناصر گروه ۲ انرژی یونش بیشتری نسبت به عناصر گروه ۱۳ دارند. به همین شکل، انرژی یونش در عناصر گروه ۱۵، بیشتر از عناصر گروه ۱۶ است. در حقیقت، آرایش الکترونی لایه آخر در گروههای ۲ و ۱۵، به صورت اوربیتالهای نیمه پر شده دیده میشود و به همین دلیل، برای حذف الکترون از آنها، به انرژی بیشتری نیاز خواهیم داشت.
اثر پوششی
فلزات قلیایی، به خصوص در مقایسه با هالوژنها، انرژی یونش کمی دارند. علاوه بر شعاع اتمی، تعداد الکترونهای بین هسته و الکترون مورد نظر در لایه آخر نیز بر انرژی یونش موثر هستند. به این اثر که بار مثبت هسته، به دلیل بار منفی الکترونهای داخلی حذف میشود و الکترون لایه آخر آن را احساس نمیکند، «اثر پوششی» (Shielding Effect) میگویند.
هرقدر اثر پوششی الکترونهای درونی بیشتر باشد، خارج کردن الکترون لایه آخر سادهتر است. در نتیجه، هرقدر اثر پوششی بیشتر باشد، انرژی یونش کمتر خواهد بود. با توجه به این روند، سزیم، کمترین انرژی یونش و فلوئور، بیشترین انرژی یونش را دارد. البته هلیوم و نئون را باید به عنوان استثناء در نظر گرفت.
نمودار انرژی یونش
اگر نمودار انرژی یونش اول بر حسب عدد اتمی را برای گروههای اصلی در جدول تناوبی رسم کنیم، به نمودار زیر میرسیم:
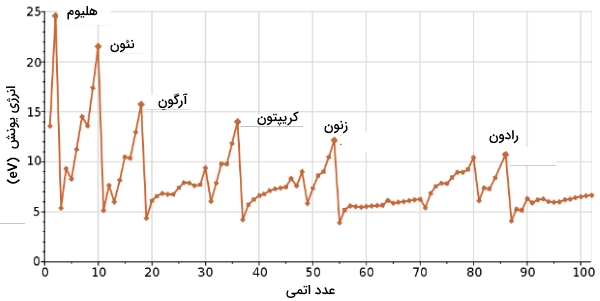
همانطور که توضیح داده شد، با حرکت از چپ به راست در جدول تناوبی، انرژی یونیزاسیون افزایش پیدا میکند که این موضوع را با بار هسته در اتم توضیح دادیم. هرقدر تعداد پروتونها در یک اتم بیشتر باشد، جاذبه آنها بر الکترونها نیز بیشتر خواهد بود. همچنین، خلاصه روندهای تناوبی را میتوانید در نمودار زیر، مشاهده کنید:
انرژی یونش اول، دوم و سوم
همانطور که در ابتدای متن نیز گفته شد، مقدار انرژی مورد نیاز برای جدا کردن الکترون اول، دوم و سوم را به ترتیب با نام انرژی یونش اول، دوم و سوم میشناسند. اگر انرژی یونش را با نشان دهیم، روند انرژی یونش اول، دوم و ... را میتوان به صورت زیر نشان داد:
انرژیهای یونش در واکنشها را به شکل زیر نشان میدهند:
در جدول زیر میتوانید انرژی یونش اول، دوم و سوم را در برخی عناصر مشاهده کنید:
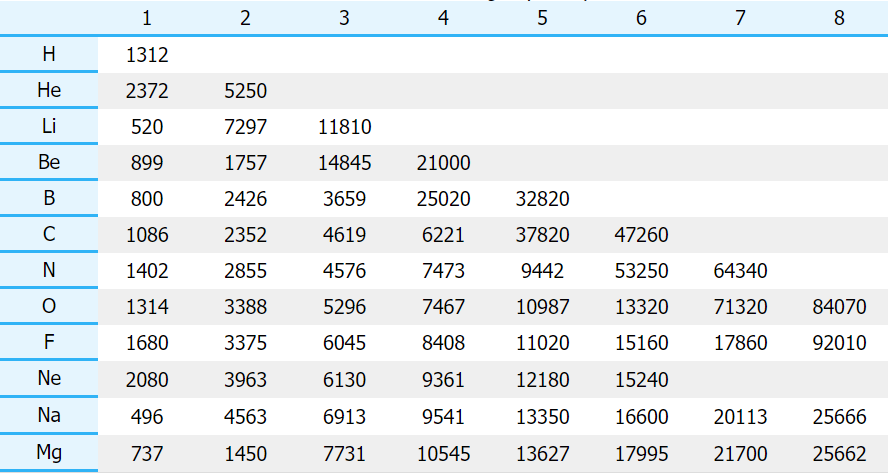
به صورت یک رابطه کلی میتوان بیان کرد که nامین انرژی یونش، به مقدار انرژی مورد نیاز برای حذف یک الکترون ار ذرهای با بار میگویند. به طور مثال، سه انرژی یونش را به صورت زیر میتوان تعریف کرد:
انرژی یونش اول:
انرژی یونش دوم:
انرژی یونش سوم:
جهش بزرگ در انرژی یونش
اوربیتالهای الکترونی به لایههای مختلفی تقسیم میشوند که تاثیر زیادی بر انرژی یونیزاسیون در الکترونهای مختلف دارند. به طور مثال، آلومینیوم، اولین عنصر در تناوب خود با لایه الکترونی است. همین امر باعث میشود تا در مقایسه با دیگر عناصر در تناوب، انرژی یونش کمتری داشته باشد زیرا با از دست دادن تنها یک الکترون، به لایه پایدار میرسد. اما زمانی که الکترون اول را جدا کردیم، برای جدا کردن الکترون دوم، جهش بزرگی بین انرژی یونش اول و دوم بوجود خواهد آمد. در حقیقت، انرژی بسیار زیادی برای جدا کردن الکترون دوم از اتم، مورد نیاز است چراکه در این حالت میخواهیم یک الکترون از اوربیتال پایدار جدا کنیم. علاوه بر این، لایههای الکترونی نیز دارای اثر پوششی هستند.
الکترونخواهی و انرژی یونش
توجه داشته باشید که «الکترونخواهی» (Electron Affinity) و «انرژی یونش» (Ionization Energy)، مفاهیمی جداگانه هستند اما روند یکسانی در جدول تناوبی دارند. به طور مثال، با افزایش انرژی یونش در طول یک دوره تناوب، الکترونخواهی نیز افزایش پیدا میکند. به طور مشابه، الکترونخواهی در هر گروه از بالا به پایین کاهش پیدا میکند. هالوژنها در مقایسه با گروههای اول و دوم، به راحتی الکترون جذب میکنند. همانطور که میدانید، به این تمایل برای جذب الکترونها به سمت خود، الکترونگاتیوی میگویند.
پیشبینی پیوند یونی و کووالانسی
اختلاف الکترونگاتیوی یا انرژی یونش بین دو اتم، نوع پیوند آندو را معین میکند. به طور مثال،با مقایسه الکترونگاتیوی میفهمیم اختلاف شدیدی بین الکترونگاتیوی و انرژی یونش اتمهای سدیم و کلر وجود دارد. بنابراین، سدیم به طور کامل، الکترون را از لایه ظرفیت خود خارج و کلر نیز آن را جذب میکند و پیوندی یونی خواهیم داشت. اما در حالتی که اختلاف زیادی در الکترونگاتیوی وجود ندارد، پیوندهای کووالانسی در اثر به اشتراکگذاری الکترون بدست میآیند.
مثال از انرژی یونش
1. با نگاه به آرایش الکترونی عناصر زیر، بگویید کدامیک از عناصر زیر، کمترین انرژی یونش را دارد؟
- عنصر اول:
- عنصر دوم:
- عنصر سوم:
- عنصر چهارم:
- عنصر پنجم:
با نگاه به عناصر بالا درمییابیم که عنصر چهارم، پایینترین انرژی یونش را خواهد داشت چراکه با از دست دادن تنها یک الکترون، به زیرلایه پایدار میرسد.
2. انرژی یونش اول در گالیم، و در کلسیم، است. بر اساس روندهای تناوبی، با توجه به اینکه کلسیم، در سمت چپ گالیم قرار دارد، باید انرژی یونش کمتری داشته باشد. دلیل این تناقض را توضیح دهید.
گالیم، یک الکترون در اوربیتال خود دارد که با از دست دادن آن، به اوربیتال پایدار میرسد. اما کلسیم، یک اوربیتال کامل پایدار دارد و برای گرفتن یک الکترون، باید این اوربیتال پایدار را از بین برد.
جمعبندی عوامل موثر بر انرژی یونش
به طور خلاصه، عوامل موثر بر انرژی یونش عبارتند از:
- بار هسته: هرقدر مقدار بار هسته بیشتر باشد، الکترونها با شدت بیشتری در کنار یکدیگر نگه داشته شدهاند و بنابراین، انرژی یونش نیز بیشتر خواهد بود.
- تعداد لایههای الکترونی: با افزایش اندازه اتم که با افزایش تعداد لایههای الکترونی همراه است، قدرت هسته برای نگه داشتن الکترونها، کاهش و به تبع آن، انرژی یونش کاهش مییابد.
- بار موثر هسته : هرقدر مقدار اثر پوششی الکترونها بیشتر باشد، الکترونهای لایه آخر، با قدرت کمتری توسط هسته حفظ میشوند و کمتری خواهیم داشت که در اثر آن، انرژی یونش نیز کمتر خواهد بود.
- اوربیتال پایدار: اتمی که آرایش الکترونی پایدارتری داشته باشد، تمایل کمتری برای از دست دادن الکترون دارد و بنابراین، انرژی یونش بیشتری خواهد داشت.
- پرشدگی اوربیتال: اوربیتالی که به طور کامل یا نیمه، از الکترون پر شده باشد، پایداری بیشتری دارد و برای از دست دادن الکترون، باید انرژی بیشتری صرف شود، در نتیجه، اتمی که اوربیتال پرشده کامل یا نیمه داشته باشد، انرژی یونش بیشتری خواهد داشت.
توصیف الکترواستاتیک انرژی یونش
انرژی یونش را به کمک پتانسیل الکترواستاتیک و مدل اتمی بور نیز میتوان توضیح داد که در ادامه به آن میپردازیم.
الکترونی با بار و هسته اتمی با بار را در نظر بگیرید که در آن، ، تعداد پروتون در هسته است. بر اساس مدل اتمی بور، اگر الکترونی برای تشکیل پیوند، به اتمی نزدیک شود، در شعاع a قرار خواهد گرفت. پتانسیل الکترواستاتیک در فاصله a از هسته یونی با رابطه زیر تعریف میشود:
از آنجایی که بار الکترون، منفی است، از طریق پتانسیل الکترواستاتیک مثبت، به طرف داخل کشیده میشود. انرژی مورد نیاز الکترون برای جدا کردن آن از اتم برابر است با:
استفاده از این روش مشکلی دارد و آنهم این است که فاصله a به عنوان یک متغیر نامعلوم در نظر گرفته میشود که میتوان این فاصله را برای الکترون هر عنصر شیمیایی به عنوان فاصله مشخصه آن در نظر گرفت.
این مدل را میتوان به کمک یک روش کلاسیک گسترش داد که در آن، «تکانه» (Momentum) به صورت کوانتیده در نظر گرفته شده و چنین روشی، به خوبی برای اتم هیدروژن با یک الکترون قابل استفاده است. مقدار تکانه زاویهای برای یک مدار دایرهای به صورت زیر محاسبه میشود:
انرژی کل در یک اتم، برابر با مجموع انرژیهای جنبشی و پتانسیل است:
با برابر گرفتن جاذبه کولن با نیروی مرکزگرا، میتوان مولفه سرعت را از انرژی جنبشی حذف کرد:
با حل کردن تکانه زاویهای برای v و جایگذاری آن در معادله انرژی جنبشی خواهیم داشت:
این رابطه، وابستگی شعاع را به n به صورت زیر بیان میکند:
حال، انرژی را میتوان بر اساس مولفههای Z، e و r محاسبه کرد. با استفاده از رابطه جدیدِ انرژی جنبشی در معادله انرژی کل در بالا، خواهیم داشت:
در کمترین مقدار، عدد n برابر با ۱ و r را برابر با شعاع بور در نظر میگیریم که با مقدار برابر است. حال، معادله انرژی را بر اساس شعاع بور میتوانیم تعریف کنیم که به صورت زیر خواهد بود:
توصیف انرژی یونش از طریق مکانیک کوانتوم
بر اساس نظریه مکانیک کوانتوم، محل یک الکترون را به کمک یک اوربیتال اتمی میتوان توصیف کرد. انرژی یونش را با انتگرالگیری روی این ابر الکترونی میتوان بدست آورد. این ابر الکترونی در حقیقت یک تابع موج متشکل از اوربیتالهای اسپین است.
به طور کلی، محاسبه nامین انرژی یونش، تنها در سیستمهای ساده تکاتمی همچون هیدروژن قابل انجام است. به همین دلیل، از روشهای تقریبی برای محاسبه آن بهره میگیرند.در همین راستا، برای محاسبه انرژی یونش از شبیهسازیهای کامپیوتری در شاخهای موسوم به «شیمی محاسباتی» (Computational Chemistry) استفاده میشود.

انرژی یونش آدیاباتیک و عمودی در مولکولها
یونش مولکولها به طور معمول سبب تغییر در شکل و هندسه مولکولی میشود. در این خصوص، دو نوع مختلف انرژی یونش اول، موسوم به انرژی یونش آدیاباتیک و عمودی تعریف میشوند.
انرژی یونش آدیاباتیک
انرژی یونش آدیاباتیک یک مولکول، به حداقل انرژی مورد نیاز برای خارج کردن یک الکترون از مولکول خنثی میگویند. به عبارت دیگر، به اختلاف انرژی حالت ارتعاشی پایه یک ذره خنثی و یون مثبت آن، انرژی یونش آدیاباتیک میگویند.
انرژی یونش عمودی
به دلیل تغییرات احتمالی شکل مولکول در اثر یونش، ممکن است حالات انتقالی دیگری بین حالت ارتعاشی پایه ذره خنثی و حالت برانگیخته یون مثبت وجود داشته باشند. به عبارت دیگر، یونش با «برانگیختگی ارتعاشی» (Vibrational Exitation) همراه است. شدت این حالات انتقالی به خوبی توسط «اصل فرانک-کاندون» (Frank-Condon Principle) توصیف میشود. این اصل پیشبینی میکند که اگر حالت برانگیخته ارتعاشی یون مثبت، هندسه یکسانی با مولکول خنثی داشته باشد، انتقال محتمل و شدیدی خواهیم داشت.
برای یک مولکول دو اتمی، هندسه مولکولی به کمک طول پیوند یگانه تعریف میشود. حذف یک الکترون از اوربیتال مولکولی پیوندی، پیوند را ضعیف میکند و طول آن را افزایش میدهد. در تصویر زیر، نمودار پایینی برای مولکول خنثی و نمودار بالایی مربوط به یون مثبت است. هر دو نمودار، انرژی پتانسیل را به صورت تابعی از طول پیوند نشان میدهند. خطوط افقی، متناظر با سطوح به همراه توابع موج ارتعاشی هستند. از آنجایی که یون، پیوند ضعیفتری دارد، طول پیوندی بیشتری خواهد داشت. این اثر را با انتقال مینیمم نمودار انرژی پتانسیل به طرف راست نشان میدهند.
یونش آدیاباتیک به صورت انتقال قطری حالت ارتعاش پایه بیان میشود. یونش عمودی ممکن است شامل برانگیختگی ارتعاشی حالت یونی پایه باشد و بنابراین، به انرژی بیشتری نیاز دارد.
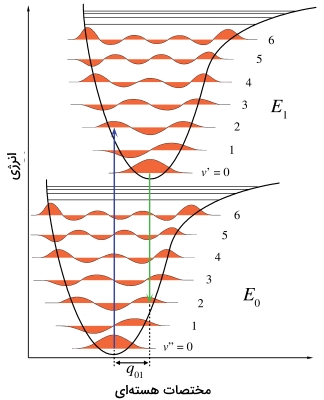
در تصویر بالا، نمودار انرژی «فرانک-کاندون» (Frand-Condon) را مشاهده میکنید. برای یونیزاسیون یک مولکول دواتمی، تنها مختصات هستهای، طول پیوند است. نمودار پایینی، انرژی پتانسیل یک مولکول خنثی و نمودار بالایی، مربوط به یون مثبت با طول پیوند بیشتر است. فلش آبی، یونش عمودی را نشان میدهد.
در بسیاری از حالات، انرژی یونش آدیاباتیک، کمیتی است که بیشتر جلب توجه میکند چراکه اختلاف انرژی را بین دو سطح انرژی پتانسیل توصیف میکند. به دلیل محدودیتهای آزمایشگاهی، تعیین انرژی یونش دشوار است در حالیکه صورت دیگر آن به راحتی قابل اندازهگیری است.
شباهتهای انرژی یونش با سایر سیستمها
همانطور که در طول این آموزش متوجه شدید، انرژی یونش در فاز گازی ذرات اتمی یا مولکولی بکار میرود. کمیتهای مشابه دیگری نیز به در سایر سیستمهای فیزیکی وجود دارند که مقدار انرژی مورد نیاز برای حذف یک الکترون از آن سیستم را بیان میکنند.
انرژی بستگی هسته
«انرژی بستگی الکترون» (Electron Binding Energy)، عبارتی کلی برای انرژی یونش است که برای ذرات در بارهای مختلف بکار میرود. به طور مثال، انرژی بستگی الکترون برای یون کلرید عبارتست از حداقل انرژی مورد نیاز برای حذف یک الکترون از اتم کلر با بار . در این مثال، انرژی بستگی هسته، مقداری برابر با الکترونخواهی اتم کلر خنثی دارد. در مثالی دیگر، انرژی بستگی هسته، به حداقل انرژی مورد نیاز برای حذف یک الکترون از دیآنیون دیکربوکسیلات میگویند. بیشترین انرژی بستگی، مربوط به نیکل با ۲۸ پروتون و برابر با مقدار است.
تابع کار
«تابع کار» (Work Function)، به حداقل انرژی مورد نیاز برای حذف یک الکترون از سطح یک جامد میگویند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجوعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- قانون هس — به زبان ساده
- هیدروکربن ها — به زبان ساده
^^













سلام وقت بخیر ممنون میشم بگید علت بی نظمی در انرژی یونش چیست ممنون زودتر بگید
سلام اولین جهش الکترونی یه ترکیب رو چجوری میتونیم محاسبه کنیم؟ مثلا ماله یه الکان خطی رو
با سلام؛
اگر به سطر اول مطلب توجه کنید، انرژی یونش به انرژی برای حذف یک اتم یا یون در حالت گازی میگویند و بنابراین، این تعریف برای ترکیبات کاربرد ندارد. البته در بخش «مقدمه» نحوه بکارگیری این اعداد برای درک پیوندهای یک ترکیب ذکر شده است.
با تشکر از همراهی شما با مجله فرادرس
با سلام خدمت استاد عزیز.
چطوری میتونیم هر فراورده ایی که میخواهیم رو فقط با داشتن اطلاعاتی در باره عناصر پایه اون محاسبه کنیم؟
چه مطالبی رو باید به ترتیب بدونیم؟
اگر براتون مقدور هستش لیست این موارد رو بنویسید و یا مقاله ی جامعی رو در اختیار من قرار دهید با تشکر.
با سلام؛
چنین کاری تقریبا غیرممکن است چون عوامل بسیار زیادی فارغ از نوع اتمها در یک واکنش شیمیایی دخالت دارند. آشنایی با شیمی آلی و مکانیسم واکنشها میتواند در این امر موثر باشد اما نمیتوان در تمامی موارد، تنها با داشتن نوع عناصر، فرآوردهها را مشخص کرد. با این وجود، مطالعه مطالب زیر پیشنهاد میشوند:
تعریف واکنش شیمیایی — به زبان ساده
مکانیسم واکنش شیمیایی — به زبان ساده
واکنش آلی در شیمی — از صفر تا صد
واکنش افزایشی — به زبان ساده
قانون مارکونیکوف — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
سلام مهندس کاظمی عزیز وقتتون بخیر، جناب مهندس من یک سوالی دارم اینکه چطور میتونم یک الکترون از هسته اتم طلا بیرون بکشم بدون نیاز به پرتو گاما و اتاقک یونیزاسیون آیا راه دیگه ای وجود داره راه حل اول بسیار سخت و هزینه بر هست چه پیشنهادی دارید سپاسگزارم ازتون
با سلام؛
با توجه به اینکه چنین روشی به انرژی بسیار زیادی نیاز دارد، در نتیجه شاید بتوان یکی از ارزانترین روشها را استفاده از پرتو گاما دانست که البته در مقیاسهای کوچک توجیح اقتصادی ندارد و به طور معمول در آزمایشگاههای فیزیک مورد استفاده قرار میگیرد. بهترین پیشنهاد، ارائه یک طرح تحقیقاتی به دانشگاههای مجهز و استفاده از تجهیزات دانشگاه با پرداخت هزینه مربوط به آن است تا نیازی به تهیه تجهیزات گرانقیمت وجود نداشته باشد.
با تشکر از همراهی شما با مجله فرادرس
سلام لطفا برام توضیح بدید که
چرا قدرت یونیزاسیون با سرعت ذره رابطه عکس دارد؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. همانطور که در متن و در بخش «توصیف الکترواستاتیک انرژی یونش» توضیح داده شده است، تحت شرایطی خاصی، اثر سرعت را از انرژی یونش حذف میکنند. اگر این شرایط برقرار نباشند، سرعت الکترون نیز در نظر گرفته میشود.
با تشکر
سلام میشه توضیح بدید که چرا قدرت یونیزاسیون با سرعت ذره رابطه عکس داره؟؟؟؟
این مطالب مخصوص دانشگاهه؟!