پیوند یونی – به زبان ساده
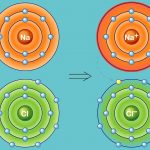
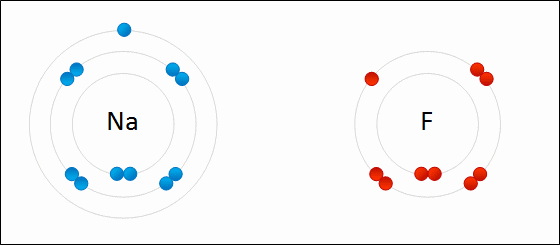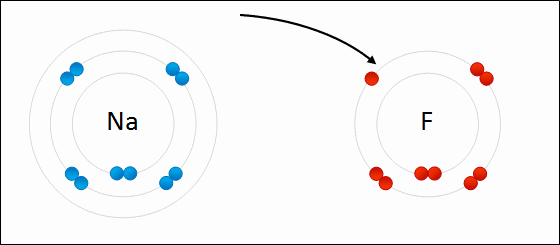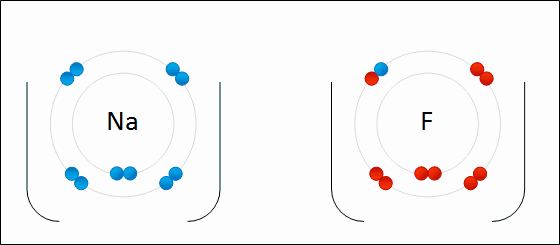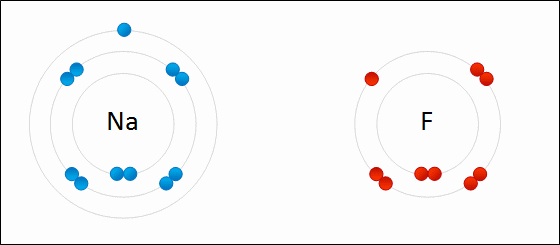
پیوند یونی نوعی از پیوند شیمیایی است که جاذبه الکترواستاتیک بین دو یون با بار ناهمنام را شامل میشود و به عنوان برهمکنش اصلی در ترکیبات یونی به شمار میآید. «پیوند یونی» (Ionic Bonding)، از جمله پیوندهای مهم در کنار پیوندهای کووالانسی و فلزی است. در تعریف دیگر، پیوند یونی، انتقال کامل الکترونهای لایه ظرفیت بین اتمها نام دارد که در نهایت سبب تولید دو بار ناهمنام میشود. علت این نوع پیوندها را میتوان در عناصر فلزی جستجو کرد چراکه بیشتر فلزات در خارجیترین لایه خود تعداد کمی الکترون دارند و با از دست دادن آنها به آرایش گاز نجیب میرسند. به طور مشابه، نافلزات هم تنها با گرفتن چند الکترون، لایه ظرفیت خود را کامل میکنند.
لازم به ذکر است «فایل PDF پیوندهای شیمیایی» (تقلبنامه پیوندهای شیمیایی) را نیز میتوانید به طور جداگانه دانلود و مطالعه کنید. این تقلبنامه شامل تعریف انواع پیوندهای شیمیایی همچون پیوندهای یونی و کووالانسی است. همچنین، نیروهای بین مولکولی و پیوندهای هیدروژنی و فلزی نیز به طور کامل مورد بررسی قرار گرفتهاند.
مقدمه
در پیوند یونی، الکترونها از یک اتم به اتم دیگر منتقل میشوند که در نتیجه این فرآیند، یونهای مثبت و منفی تشکیل میشوند. جاذبه ایجاد شده بین یونهای مثبت و منفی است که یک ترکیب را حفظ میکند. انجام یک پیوند یونی، فارغ از در نظر گرفتن انرژی یونش و «الکترونخواهی» (Electron Affinity)، به دلیل جاذبه الکترواستاتیک قابل انجام است. زمانی که فاصله بیناتمی مناسب باشد، جاذبه بین ذرات سبب آزاد شدن انرژی میشود که این انرژی، تشکیل پیوند را امکانپذیر میکند. بیشتر ترکیبات یونی به دلیل وجود یونهای ناهمنام، درحلالهای قطبی تفکیک میشوند چراکه این ترکیبات به طور معمول قطبی هستند.
در یک بیان سادهتر، دلیل انجام پیوندهای یونی را میتوان در ساختار الکترونی گازهای نجیب پیدا کرد که در لایه ظرفیت خود، هشت الکترون دارند. داشتن هشت الکترون در لایه ظرفیت سبب بروز چنین واکنشهایی است.
لازم به ذکر است که در یک پیوند یونی، به یونهای منفی که الکترون جذب کردهاند، آنیون و یونهای مثبتی که الکترون از دست دادهاند کاتیون میگویند. انتقال الکترون در بین اتمها را با نام «الکترووالانس» (Electrovalence) میشناسند که مفهومی مقابل کووالانس به شمار میآید. به طور معمول، کاتیون شامل یک اتم فلزی و آنیون شامل یک اتم نافلزی است اما این یونها میتوانند طبیعتی پیچیدهتر نیز داشته باشند. به طور مثال، میتوان به یونهای مولکولی مانند و اشاره کرد. در بیانی سادهتر، پیوند یونی به انتقال الکترونها از یک فلز به نافلز میگویند که در نتیجه این فرآیند، هر دو اتم به آرایش پایدار گاز نجیب میرسند.
ذکر این نکته لازم است که هیچگاه یک پیوند یونی شامل انتقال کامل الکترون از یک اتم یا مولکول به دیگری نیست و تمامی پیوندهای یونی، شامل درجهای از پیوند کووالانسی یا اشتراک بین الکترونها هستند. در نتیجه، از واژه پیوند یونی زمانی استفاده میشود که خاصیت یونی در یک پیوند، بیشتر از خاصیت کووالانسی باشد. به عبارت دیگر، پیوندی را یونی مینامیم که اختلاف الکترونگاتیوی زیادی بین دو اتم شرکت کننده وجود داشته باشد و موجب شود تا پیوند، بیشتر خاصیت قطبی داشته باشد تا کووالانسی. پیوندهایی که به طور جزئی یونی و به طور جزئی کووالانسی هستند را «پیوندهای قطبی کووالانسی» (Polar Covalent Bond) مینامند.
ترکیبات یونی مذاب یا محلول، قابلیت هدایت الکتریکی دارند و به طور معمول نقطه ذوب بالایی دارند. هر قدر مقدار بار در ترکیبات یونی بیشتر باشد، نیروهای چسبندگی بیشتر است و در نتیجه، نقطه ذوب بالاتری خواهیم داشت. ترکیبات یونی، تمایل به انحلال در آب نیز دارند اما هرقدر نیروهای چسبندگی بیشتر باشد، انحلالپذیری کمتر است.
پیوند یونی چگونه تشکیل می شود؟
در بیشتر موارد، پیوند یونی نتیجه واکنشهای اکسایش و کاهش (ردوکس) است به گونهای که یک اتم از عنصری فلزی با انرژی یونش پایین، الکترونهای خود را برای رسیدن به آرایش پایدار گاز نجیب از دست میدهد. جاذبه الکترواستاتیک بین کاتیونهای و آنیونها موجب تشکیل جامدی با ساختار بلوری میشود. در ساختار این نوع یونها، نمیتوان یک واحد مولکولی پیوسته را مشاهده کرد و ترکیبات تشکیل شده، ترکیبات مولکولی نیستند. البته یونها خود ساختاری پیچیده دارند که میتوانند یونهای مولکولی همچون آنیون استات با فرمول یا کاتیون آمونیوم با فرمول تشکیل دهند.
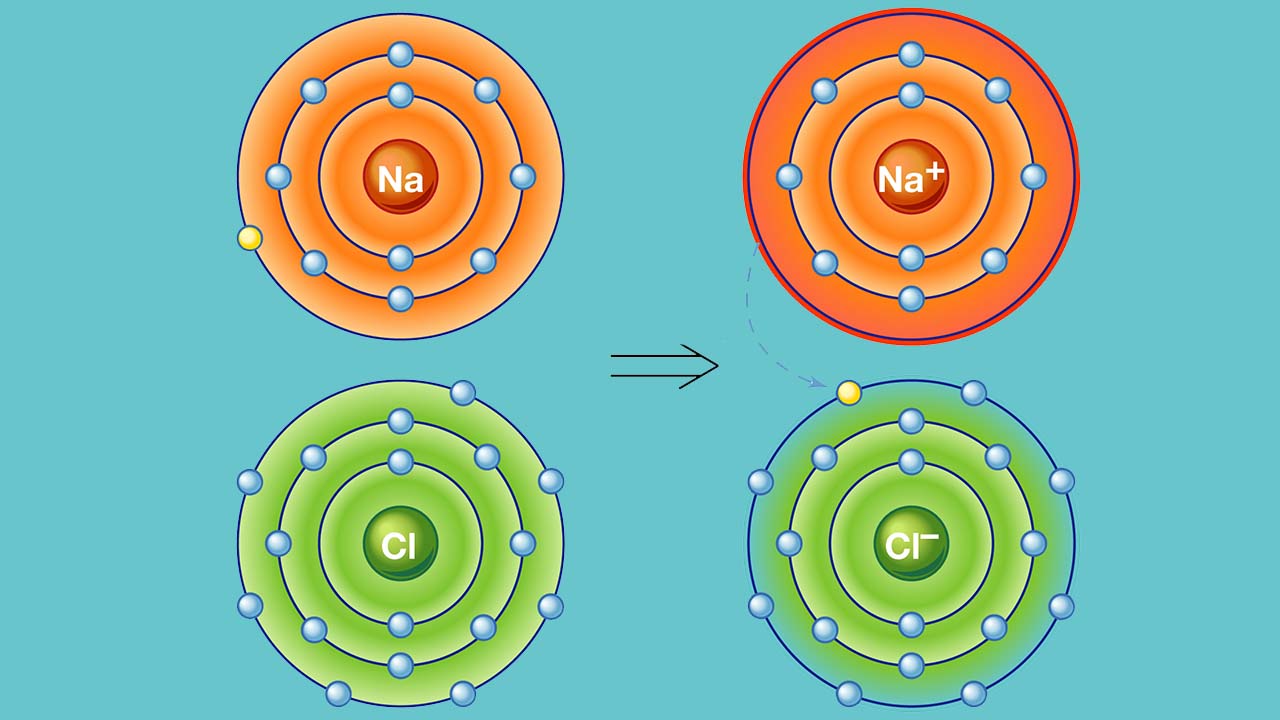
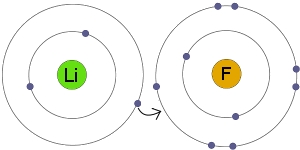
به طور مثال، نمک خوراکی را همه با فرمول سدیم کلرید میشناسند. زمانی که اتم سدیم با اتم کلر ترکیب شود، هر اتم سدیم یک الکترون از دست میدهد و کاتیون را تشکیل میدهد. به همین ترتیب، اتمهای کلر نیز با گرفتن الکترون به آنیون تبدیل میشوند. در نهایت، این یونها هرکدام با نسبت یک به یک، جذب یکدیگر خواهند شد که نتیجه این امر، تولید سدیم کلرید است:
در هر صورت، برای اینکه یک ترکیب یونی خنثی باشد، نسبتهای دقیقی از آنیونها و کاتیونها در ساختار آنها دیده میشود و در نتیجه، ترکیبات یونی، با وجود اینکه ترکیباتی مولکولی نیستند، از قوانین استوکیومتری تبعیت میکنند. البته این موضوع برای آلیاژها که مخلوطی از پیوندهای یونی و فلزی هستند صدق نمیکند. لازم به ذکر است که بسیاری از سولفیدها، ترکیباتی غیر استوکیومتری را تشکیل میدهند.
بسیاری از ترکیبات یونی را با نام نمک میشناسند که این نمکها در «واکنشهای خنثیسازی» (Neutralization Reaction) یک باز و اسید شرکت میکنند:
حذف الکترون از یک کاتیون، فرآیندی گرماگیر و موجب افزایش انرژی کلی سیستم است. همچنین، تغییرات انرژی دیگری نیز به دلیل شکست پیوندها یا اضافه شدن الکترون برای تشکیل آنیون وجود خواهد داشت. البته با همه اینها، عمل پذیرش الکترون لایه ظرفیت کاتیون توسط آنیون و جاذبه بین یونها در نهایت، موجب آزاد شدن انرژی خواهد بود و در نتیجه، انرژی کلی سیستم کاهش پیدا میکند.
پیوند یونی زمانی تشکیل میشود که این تغییرات انرژی واکنش برای تشکیل پیوند، مناسب باشند. به طور کلی، این نوع از واکنشهای تشکیل پیوند یونی گرماده هستند که از آنجمله میتوان به واکنش تشکیل ماده سمی مرکوریک اکسید اشاره کرد:
مقدار بار یونهای حاصل از تشکیل پیوند یونی، عامل مهمی در تعیین قدرت پیوند به شمار میآید. به طور مثال، بر اساس قانون کولن، قدرت پیوند در نمکی به شکل ، در حدود چهار برابر ضعیفتر از نمک به شکل است. البته در این خصوص میتوان از اندازه یونها و نوع چینش اتمها در شبکه بلور چشمپوشی کرد.
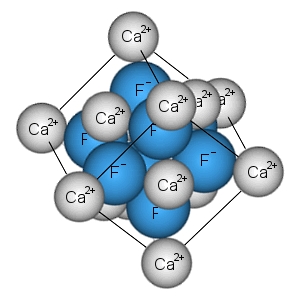
ساختار ترکیبات یونی
ترکیبات یونی در حالت جامد، ساختارهای بلوری را تشکیل میدهند. دو عامل اساسی در تعیین شکل بلور شامل اندازه و بار نسبی یونها است. برخی ساختارها از تعداد زیادی ترکیبات مختلف گرفته شدهاند. به طور مثال، ساختار سدیم کلرید از بسیاری از هالیدهای قلیایی و همچنین اکسیدهای دوتایی مانند منیزیم اکسید بدست آمده است.
به طور معمول، برای پیشبینی ساختار بلورهای یونی از «قوانین پاولینگ» (Pauling's Rules) استفاده میکنند.
انرژی شبکه و قدرت پیوند یونی
برای یک جامد بلوری، تغییرات آنتالپی به هنگام تشکیل جامد از یونهای گازی را با نام «انرژی شبکه» (Lattice Energy) تعریف میکنند. مقادیر آزمایشگاهی انرژی شبکه را میتوان با استفاده از «چرخه بورن-هابر» (Born-Haber Cycle) تعیین کرد. این انرژی را همچنین میتوان با استفاده از رابطهای موسوم به «بورن-لانده» (Born-Lande) به عنوان مجموع انرژیهای پتانسیل الکترواستاتیک محاسبه کرد که این انرژیها از طریق محسابه مجموع برهمکنشها بین کاتیونها و آنیونها و یک عبارت انرژی پتانسیل قابل محاسبه هستند.
رابطه بورن-لانده، تقریب مناسبی از انرژی شبکه را بدست میدهد. به طور مثال، مقدار پیشبینی شده انرژی شبکه برای سدیم کلرید با استفاده از رابطه بورن-لانده، میزان گزارش شده است که این انرژی به کمک چرخه بورن-هابر، ذکر میشود. در محلولهای آبی، قدرت پیوند را به جای استفاده از طبیعت یونها همچون قطیبت و اندازه، به کمک روابط «بیوم» (Bjerrum) یا «فاوس» (Fuoss) توصیف میکنند. همچنین، قدرت پیوند را در محلولها به کمک اندازهگیریهای تعادلی بین مولکولهای حاوی نواحی کاتیونی و آنیونی بیان میکنند.
اثر قطبیدگی در پیوند یونی
یونها در شبکه بلوری ترکیبات یونی خالص، به صورت کروی هستند. اگرچه، در صورتیکه یون مثبت، کوچک باشد و بار زیادی داشته باشد، موجب تغییر شکل ابر الکترونی یون منفی میشود که این اثر در «قوانین فاژانس» (Fajans Rules) آورده شده است. «قطبیدگی» (Polarization) یون منفی موجب افزایش چگالی بار بین دو هسته میشود که این خود به معنی خاصیت جزئی کووالانسی است.
یونهای منفی بزرگتر، راحتتر قطبیده میشوند اما این اثر تنها زمانی اهمیت پیدا میکند که یونهایی با بار مانند نیز دخیل باشند. گرچه، یونهای و نیز در مواردی قطبیدگی نشان میدهند چراکه اندازه این یونها بسیار کوچک است. به طور مثال، پیوند یونی است که خواصی از پیوندهای کووالانسی را نیز به همراه دارد. باید توجه داشته باشید که این موضوع با اثر «قطبیدگی یونی» (Ionic Polarization) تفاوت دارد چراکه اثر قطبیدگی یونی به جابجایی یونها در شبکه بلوری و به کمک استفاده از میدان الکتریکی اشاره دارد.
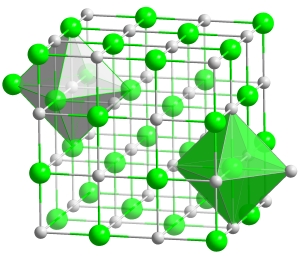
مقایسه پیوند یونی و کووالانسی
در پیوندهای یونی، تشکیل پیوند در اتمها بوسیله جاذبه یونها با بار ناهمنام صورت میگیرد درحالیکه در پیوندهای کووالانسی، اتمها بوسیله اشتراکگذاری الکترونها برای رسیدن به آرایش الکترونی پایدار پیوند تشکیل میدهند. در پیوندهای کووالانسی، هندسه مولکولی اطراف اتم به کمک نظریه دافعه جفتالکترونهای لایه ظرفیت موسوم به وسپر تعیین میشود اما در مواد یونی، هندسه ترکیبات از «قوانین حد نهایی بسته» (Maximum Packing Rules) تبعیت میکنند.
در پیوندهای یونی، با توجه به اینکه هیچ الکترون اشتراکی وجود ندارد، دافعهای نیز وجود نخواهد داشت و بنابراین، یونها تا حد ممکن میتوانند کنار یکدیگر جمع شوند. این امر به طور معمول سبب میشود تا اعداد کووردینانسی بالاتری داشته باشیم. به طور مثال در ، هر یون دارای ۶ پیوند است و زاویه تمام این پیوندها ۹۰ درجه است. در ، عدد کوردینانسی با ۸ برابر است. کافی است که برای مقایسه، به کربن نگاه کنیم. این عنصر در نهایت میتواند چهار پیوند تشکیل دهد.
شرط وجود پیوند یونی
همانطور که پیشتر نیز اشاره شد، ترکیب خالصی که تماما دارای پیوند یونی باشد وجود ندارد. به طور مثال، برهمکنشهای NaCl و MgO دارای درصدی از کووالانسی هستند درحالیکه پیوندهای SiO به طور معمول، ۵۰ درصد یونی و ۵۰ درصد کووالانسی است. پاولینگ تخمین زد که اختلاف الکترونگاتیوی 1/7، برابر با ۵۰ درصد خاصیت یونی است و بنابراین اختلافی بیش از ۱/7 با پیوندی کاملا یونی متناظر خواهد بود.
در حالت کلی، زمانی که پیوندی یونی در یک جامد یا مایع تشکیل شود، نمیتوان در خصوص یک پیوند یونی بین دو اتم مجزا صحبت کرد چراکه نیروهای چسبندگی که شبکه بلور را در کنار یکدیگر نگه میدارند، طبیعتی بههمپیوسته دارند. این امر در خصوص پیوندهای کووالانسی کمی متفاوت است چرا که میتوانیم در خصوص دو اتم مجزا در یک پیوند به بحث بپردازیم.

پیوندها در شیمی آلی
پیوندهای کووالانسی و یونی، دو مورد از مهمترین پیوندها هستند. پیوندهای کووالانسی قطبی، در میان این دو پیوند قرار دارند. همانطور که بالاتر هم به آن اشاره شد، برخی پیوندهای یونی خاصیت کووالانسی دارند و برخی پیوندهای کووالانسی به طور جزئی یونی هستند. به طور مثال، بیشتر ترکیبات کربن به صورت پیوند کووالانسی دیده میشوند اما در برخی موارد به صورت جزئی خاصیت یونی هم دارند.
هر دو پیوند یونی و کووالانسی در شیمی آلی مورد استفاده قرار میگیرند. پیوندهای یونی از آن جهت اهمیت دارند چون در سنتز ترکیبات خاص آلی از آنها بهره میگیرند. دانشمندان، خواص یونی و برهمکنشهای آنها را به منظور دستیابی به فرآوردههای مورد نظر با یکدیگر ترکیب میکنند. پیوندهای کووالانسی نیز به این دلیل اهمیت دارند چراکه بیشتر برهمکنشهای مولکولهای کربن از طریق این نوع پیوند انجام میشوند. لازم به ذکر است که پیوندهای کووالانسی با به اشتراک گذاشتن الکترونها سبب تولید مولکولهای مختلف با زنجیرههای بلند هیدروکربنی میشوند که در زندگی بشر نقش حیاتی ایفا میکنند.
اگر مطلب بالا برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- پیوند هیدروژنی — از صفر تا صد
- ساختار لوویس — به زبان ساده
^^













سلام وقت بخیر میشه ترکیب دو تا مولکول مثل p4O10+H2O رو توضیح بدید اگر براتون مقدور هست رسم کنید و میشه درباره تعیین بار یک مولکول مطلبی رو ارائه بدید ممنون میشم با تشکر
سلام وقت بخیر، یه سوالی داشتم بین F2, CL2, NAI, CO2 کدومشون پیوند یونی دارن؟ ممنون میشم پاسخ بدید
سلام ببخشید ترکیب دو اتم فلزی باهم چه نام داره و چطوریه؟ مثلا دو اتم سدیم که با نماد شیمیایی Na11 نمایش داده میشه
با سلام؛
برای آشنایی با پیوند میان فلزات پیشنها میکنیم مطلب «پیوند فلزی — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام
برای ایجاد مثلا یون لیتیوم از اتم آن
چرا باید انرژی بگیریم؟ مگه پایدار تر نمیشود؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. از آنجایی که جداسازی الکترون از اتم و خارج کردن آن از محدوده اثر پوششی هسته بر روی الکترونها، تنها با صرف انرژی امکانپذیر است، در نتیجه برای این کار نیاز به مصرف انرژی داریم. همچنین توجه داشته باشید که این اتفاق به طور معمول به هنگام تشکیل پیوند رخ میدهد و در آن زمان، اتم به پایداری میرسد. پیشنهاد میکنیم برای مطالعه بیشتر، مطالب زیر را مدنظر قرار دهید:
«انرژی یونش — به زبان ساده»
«رادیکال آزاد — از صفر تا صد»
با تشکر
سلام
وقتی نمک رو داخل آب حل می کنیم، آیا پیوند یونی بین سدیم و کلر شکسته میشه و این دو تا از همدیگه جدا میشن و توسط مولکول های آب احاطه میشن؟ یعنی کلر توسط هیدروژن های مولکول های آب و سدیم توسط اکسیژن های مولکول های آب احاطه میشن!
اگر اینجوریه پس باید بعد از الکترولیز محلول آب و نمک، در نهایت سدیم باقی بمونه، چون اکسیژن و هیدروژن که تجزیه میشن و کلر هم که بصورت گاز درمیاد و از محلول خارج میشه و در نهایت سدیم باقی میمونه. (اما اگر در نهایت سدیم کلرید بخواد باقی بمونه یک انرژی فعال سازی ای لازم هست که حداقل آغازگر شروع واکنش بین اتم های سدیم و کلر باشه تا سدیم و کلر دوباره باهمدیگه پیوند بخورن؛ خوب این انرژی فعال سازی از کجا میاد؟)
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. برای درک بهتر انحلال نمک در آب میتوانید تصاویر مطلب «انحلال پذیری مواد در شیمی — از صفر تا صد» را مشاهده کنید. همچنین الکترولیز محلول آبی سدیم کلرید،کلر و محلول سدیم هیدروکسید بدست میهد و گازهای هیدروژن و کلر به صورت حباب ظاهر میشوند. البته توجه داشته باشید که الکترولیز محلول سدیم کلرید با الکترولیز سدیم کلرید مذاب متفاوت است و تفاوت این دو را میتوانید در مطلب «الکتروشیمی – به زبان ساده» مطالعه کنید.
با تشکر
خسته نباشید
تعریف ها کامل و قابل فهم بودند
اما من یکم نکات تستی مهم تر می خواستم که بعضی هاشون اینجا توضیح داده شدند البته این به این دلیل نیست که شما مطالب ناقصی گذاشتیند بلکه یه پیشنهادی بود که شایددددددد مشکل بقیه هم باشه
ممنون از مطالبتون