پیوند کووالانسی – به زبان ساده
فرض کنید که پیوندهای شیمیایی را به خوبی بشناسیم. در این صورت میتوانیم ترکیبات مختلف را شناسایی کنیم و فرمولهای شیمیایی آنها را بنویسیم و بر اساس این فرمولها، محاسبات استوکیومتری و گرماشیمی را برای آنها انجام دهیم. میتوان تمام این محاسبات را بدون در نظر گرفتن ساختار ماده انجام داد. اما شکل مولکول که در حقیقت آرایش اتمهای آن در فضا است، خواص شیمیایی آن ماده را تعیین میکند. به طور مثال، اگر مولکول آب شکلی متفاوت داشت، خواص آن به طور قابل توجهی تفاوت داشت. در این آموزش قصد داریم تا در خصوص پیوند کووالانسی یا پیوند اشتراکی صحبت کنیم، پیوندی که با اشتراکگذاری الکترونها بین اتمها همراه است. البته برای فهم دقیق پیوند کووالانسی، باید درک صحیحی از ساختار لوییس داشته باشید تا به کمک آن، با این نوع از پیوندهای شیمیایی آشنا شوید.

لازم به ذکر است «فایل PDF پیوندهای شیمیایی» (تقلبنامه پیوندهای شیمیایی) را نیز میتوانید به طور جداگانه دانلود و مطالعه کنید. این تقلبنامه شامل تعریف انواع پیوندهای شیمیایی همچون پیوندهای یونی و کووالانسی است. همچنین، نیروهای بین مولکولی و پیوندهای هیدروژنی و فلزی نیز به طور کامل مورد بررسی قرار گرفتهاند.
قاعده اکتت
قاعده هشتتایی (اکتت) بیان میکند برای اینکه مولکولها به پایداری برسند، باید در لایه ظرفیت تمامی اتمهای آنها، تعداد ۸ الکترون وجود داشته باشد که این ۸ الکترون میتوانند از طریق اشتراکگذاری، گرفتن یا از دست دادن الکترون بدست بیایند. در پیوند کووالانسی، اتمها تمایل دارند تا برای رسیدن به قاعده اکتت یا همان آرایش گاز نجیب، الکترونهای خود را به اشتراک بگذارند.
مقدمهای بر پیوند کووالانسی یا پیوند اشتراکی
اتم کلر با توجه به الکترونخواهی خود، به گرفتن یک الکترون و تکمیل آرایش الکترونی خود تمایل دارد. به نظر شما، این الکترون را از کدامیک از دو اتم سدیم یا هیدروژن، سادهتر میتوان بدست آورد؟ از هیچکدام از دو اتم نمیتوان به سادگی الکترون کسب کرد اما انرژی مورد نیاز برای جذب الکترون از سدیم (انرژی یونش) بسیار کمتر از انرژی مورد نیاز برای جذب هیدروژن است.
در حقیقت، هرقدر انرژی یونش کمتر باشد، خاصیت فلزی عنصر بیشتر میشود. در نتیجه، سدیم، خاصیت فلزی بیشتری از هیدروژن دارد. در حقیقت، هیدروژن را به عنوان عنصری نافلز در نظر میگیرند. اتم هیدروژن در حالت گازی، الکترونی را در اختیار اتم نافلز دیگری قرار نمیدهد. انجام پیوند بین یک اتم هیدروژن و یک اتم کلر، با اشتراک گذاشتن الکترون امکانپذیر است که به پیوند حاصل، «پیوند کووالانسی» (Covalent Bonding) میگویند. برای روشنتر شدن اشتراکگذاری الکترونها، بهتر است در خصوص ساختار لوییس مولکول HCl به بحث بپردازیم.
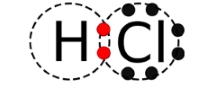
در تصویر بالا، خارجیترین لایه اتم توسط خطچینهایی نشان داده شده است. همچنین، الکترونهای لایه ظرفیت نیز توسط نقطههایی نمایش داده شدهاند. با دقت در این ساختار، درمییابیم که اتم هیدروژن، دو الکترون در لایه آخر خود دارد و آرایش لایه آخر آن مشابه با اتم هلیوم است. به همین صورت، اتم کلر، ۸ الکترون در لایه ظرفیت خود و آرایشی مشابه با آرگون دارد.
توجه کنید که در این شمارش الکترونها، الکترونهایی که با رنگ قرمز مشخص شدهاند را دو بار حساب کردیم، یک بار برای اتم هیدروژن و یک بار برای اتم کلر. این دو الکترون، بین دو اتم کلر و هیدروژن به اشتراک گذاشته شدهاند. به عبارت دیگر، این جفتالکترون اشتراکی، پیوند کووالانسی را تشکیل میدهد. در تصویر زیر، ساختارهای لوییس برای دو مولکول دیگر نمایش داده شده است:
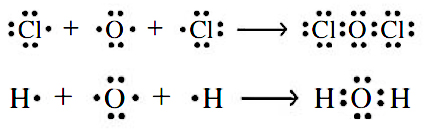
همانند اتم کلر در ، اتم اکسیژن در ساختارهای لوییس و ، با هشت الکترون، احاطه شده است. توجه داشته باشید که اتم هیدروژن، نوعی استثنا است چراکه این اتم تنها ۲ الکترون را در لایه ظرفیت خود جای میدهد. ساختار لوییس به در فهم این موضوع کمک میکند که چرا عناصر هیدروژن و کلر به صورت مولکولهای دواتمی و وجود دارند. در هر دو مولکول، یک جفت الکترون بین دو اتم به اشتراک گذاشته شده است.
پیوند کووالانسی یگانه
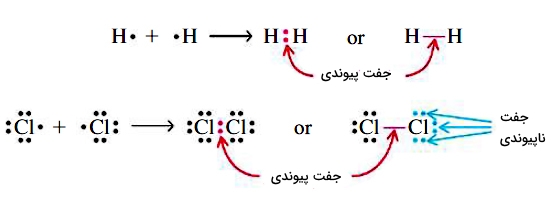
اشتراکگذاری یک جفت الکترون بین اتمهای پیوندی، سبب ایجاد یک پیوند یگانه کووالانسی میشود. برای فهم اهمیت الکترونها در ساختار لوویس، از واژه «جفتهای پیوندی» (Bond Pairs) برای جفتالکترونهای حاضر در پیوند بهره میگیرند.
همچنین، واژه «جفتهای ناپیوندی» (Lone Pairs) به جفتالکترونهایی میگویند که در پیوند حضور نداشته باشند. علاوهبر این، در ساختار لوویس، برای نمایش جفتهای پیوندی، از یک خط بین دو اتم استفاده میکنند. تمامی مواردی که به آن اشاره شد، در تصویر زیر آمدهاند:
پیوند کووالانسی کوردینانسی
نظریه پیوندهای لوویس، پیوند کوولانسی را به صورت اشتراکگذاری یک جفت الکترون تعریف میکند اما این تعریف، لزوما بیان نمیکند که هر اتم، یک الکترون را به پیوند اختصاص میدهد. به پیوندی که در آن، یک اتم، هر دو الکترون را به عنوان جفتالکترون به اشتراک میگذارد، «پیوند کووالانسی کووردینانسی» (Covalent Bond) میگویند.
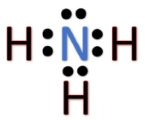
ساختار لوییس مولکول آمونیاک را در نظر بگیرید. اگر بخواهیم، هیدروژن چهارمی را به ساختار لوییس اضافه کنیم، با مشکل مواجه میشویم. الکترونی که همراه اتم هیدروژن آورده میشود، تعداد کل الکترونهای لایه ظرفیت را در اطراف اتم نیتروژن به ۹ میرساند، که در نتیجه از قاعده اکتت تبعیت نمیکند. بنابراین، مولکول تشکیل نخواهید شد و در ازای آن، یون آمونیوم با فرمول به تولید میرسد. به عبارت دیگر، در این پیوند، اتم هیدروژن، بدون الکترون پیوندی با مولکول پیوند تشکیل میدهد. به عبارت بهتر، یون ، با مولکول همراه میشود تا یون آمونیوم را بسازد.
پیوندی که بین اتم از آمونیاک و یون هیدروژن برقرار میشود، موسوم به پیوند کووالانسی کوردینانسی (کوئوردیناسی) یا «پیوند داتیو» (Dative Bond) است. باید توجه داشته باشید که بعد از تشکیل پیوند، نمیتوان گفت کدامیک از پیوندهای ، کوردینانسی هستند. در نتیجه، یک پیوند کووالانسی کوردینانسی، از پیوند کووالانسی معمولی قابل تشخیص نیست. نمونه دیگری از پیوندهای کووالانسی کوردیناسی را میتوان در یون هیدرونیوم مشاهده کرد.
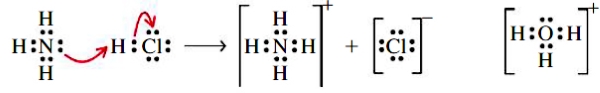
پیوندهای کووالانسی چندگانه
در بحث قبل، برای توضیح پیوند کووالانسی یا پیوند اشتراکی از یک جفتالکترون استفاده کردیم. اما به طور معمول، بیش از یک جفتالکترون برای دستیابی به قاعده اکتت باید به اشتراک گذاشته شود. و ، از جمله مولکولهایی هستند که اتمهای آنها بیش از یک جفت الکترون به اشتراک میگذارند.
پیوند کووالانسی در مولکول دی اکسید کربن
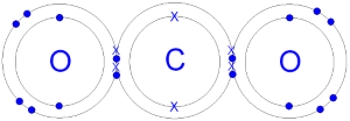
در ابتدا بهتر است از ساختار لوییس برای مولکول کربن دی اکسید استفاده کنیم. با استفاده از نمادهای لوویس، متوجه خواهیم شد که اتم C، میتواند یک الکترون لایه ظرفیت خود را با هر اتم اکسیژن به اشتراک بگذارد. در نتیجه، همچون تصویر زیر، دو پیوند یگانه کربن-اکسیژن خواهیم داشت.
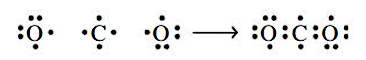
اما با توجه به نوع پیوند انجام شده، اتمهای اکسیژن و کربن، هیچکدام از قاعده اکتت پیروی نمیکنند. این مشکل را میتوان با انتقال جفتالکترون ناپیوندی به منطقه پیوندی حل کرد که در تصویر زیر با فلش قرمزرنگ نشان داده شده است:
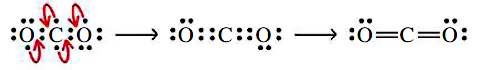
بنابراین، در مولکول دیاکسید کربن، دو اتم اکسیژن و یک اتم کربن در مجموع دو الکترون به اشتراک میگذارند و در نهایت، دو پیوند دوگانه بین اتمهای کربن و اکسیژن تشکیل میشود.
پیوند کووالانسی سهگانه
در ساختار لوییس تصویر بالا، اتمهای پیوندی، ۲ جفتالکترون به اشتراک گذاشتهاند که به صورت یک پیوند دوگانه نمایش داده میشود. حال بهتر است ساختار لوییس برای مولکول را رسم کنیم. در اولین تلاش، به ساختاری با یک پیوند یگانه میرسیم که صحیح نیست.
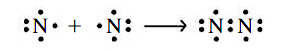
هر اتم نیتروژن، تنها شش الکترون در خارجیترین لایه خود دارد. در نتیجه، از قاعده اکتت تبعیت نمیکند. برای حل این مشکل، مانند تصویر زیر میتوان از هر اتم، دو الکترون ناپیوندی را به منطقه پیوندی انتقال داد. در نهایت، مشاهده میکنیم که سه جفتالکترون و یک پیوند سهگانه کووالانسی خواهیم داشت.
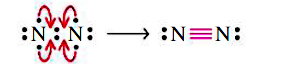
پیوند سهگانه ، پیوندی قدرتمند محسوب میشود که شکستن آن در یک واکنش شیمیایی ساده نیست. قدرت بالای این نوع پیوند سبب شده است تا خاصیتی شبیه به یک گاز بیاثر داشته باشد. در نتیجه، مولکولهای و ، در اتمسفر وجود دارند و در دماهای بالا، مقادیر اندکی از اکسیدهای نیتروژن را تولید میکنند. عدم واکنشپذیری مولکول اکسیژن و نیتروژن، برای برقراری شرایط حیات در زمین، ضروری است. علاوه بر این، بیاثر بودن گاز نیتروژن، سنتز آن را با دشواری روبرو میکند. مولکول دیگری که دارای پیوند چندگانه باشد را میتوان در و پیوند دوگانه مشاهده کرد:
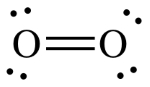
پیوند کووالانسی در استیلن
در مولکول استیلن با فرمول ، یک پیوند سهگانه بین اتمهای کربن و همچنین پیوندهای یگانه بین اتم کربن و هیدروژن داریم که در تصویر زیر نشان داده شده است:
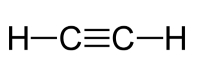
پیوندهای کووالانسی قطبی و نقشههای پتانسیل الکترواستاتیک
یک پیوند کووالانسی که در آن، الکترونها به طور مساوی بین دو اتم به اشتراک گذاشته نشده باشند، «پیوند کووالانسی قطبی» (Polar Covalent Bond) نام دارد. در این نوع از پیوندها، جابجایی الکترونها به طرف عناصر با خاصیت نافلزی بیشتر است. این اشتراکگذاری نابرابر، بار جزئی منفی را برای این نوع از عناصر به همراه دارد که آن را با نشان میدهند.
به همین صورت، عناصر با خاصیت فلزی، بار جزئی مثبت پیدا خواهند کرد. در نتیجه، برای نمایش پیوند کووالانسی قطبی در ، میتوان آن را به کمک یک ساختار لوییس نمایش داد که در آن، بارهای جزئی مثبت و منفی نمایش داده شده باشند:
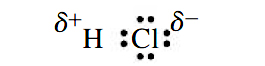
ظهور کامپیوترهای سریع و ارزانقیمت سبب شد تا شیمیدانها، روشهایی را برای توسعه نمایش توزیع الکترون در مولکول توسعه دهند. این توزیع، به کمک حل معادله شرودینگر برای یک مولکول بدست آمد. با وجود اینکه حل این معادله، تنها به کمک روشهای تقریبی انجامپذیر است، این نوع از روشها یک «نقشه پتانسیل الکترواستاتیکی» (Electrostatic Potential Map) بدست میدهند که به کمک آن میتوان توزیع بار در یک مولکول را نمایش داد.
قبل از توضیح این نوع از نقشهها، بهتر است نگاهی به چگالی الکترونی بیاندازیم. در حقیقت، رفتار الکترون در اتم را میتوان به کمک یک سری توابع ریاضی موسوم به اوربیتال توضیح داد. احتمال حضور یک الکترون در ناحیه سهبعدی اطراف اوربیتال، با مربع تابع اوربیتال اتمی مرتبط است.
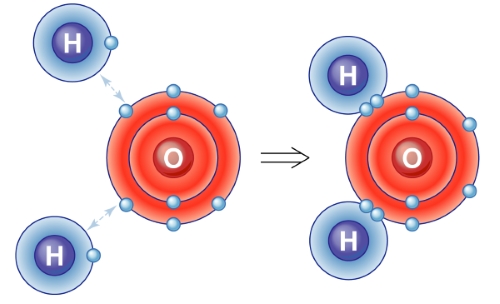
به عکس، با قرار دادن بار در منطقهای که الکترون در آن کمتر است، شاهد دافعه خواهیم بود و در نتیجه، پتانسیل الکترواستاتیک مثبت خواهد بود. مراحل ایجاد یک نقشه پتانسیل الکترواستاتیک در تصویر زیر آورده شده است که توزیع دانسیته (چگالی) الکترونی در آمونیاک را نشان میدهد.
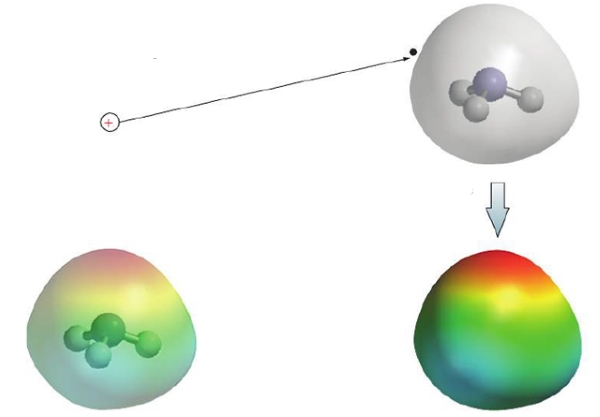
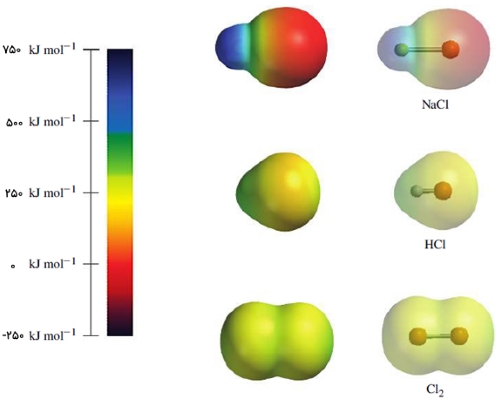
یک نقشه الکترواستاتیک اطلاعاتی در خصوص توزیع بار الکترون در یک مولکول بدست میدهد. به طور مثال، در یک مولکول خنثی، اگر پتانسیل در نقطهای مثبت باشد، میتوان گفت که اتم در این نقطه بار خالص مثبت دارد. در نمایش نقشه الکترواستاتیک، از رنگهای یک رنگینکمان استفاده میشود. رنگ قرمز با کمترین انرژی در انتهای طیف، بیانگر مناطقی با بیشترین پتانسیل الکترواستاتیک منفی و رنگ آبی بیانگر بیشترین پتانسیل الکترواستاتیک مثبت است. در این بین نیز دیگر رنگها قرار دارند که نشاندهنده پتانسیل الکترواستاتیک بین این دو بازه هستند. بنابراین، این پتانسیل از رنگ قرمز شروع میشود و تا رنگ زرد و در نهایت تا آبی تیره (بنفش) ادامه پیدا میکند.
به طور مثال، رنگ سبز-آبی اطراف اتم هیدروژن در تصویر قبل، نشان میدهد که این اتم، مقداری بار مثبت به همراه دارد. همچنین اتم نیتروژن با رنگ قرمز شامل بار خالص منفی است.

در تصویر زیر، نقشههای پتانسیل الکترواستاتیک ، و را ملاحظه میکنید. در این تصویر میبینید که مولکول دو اتمی کلر، توزیعی یکپارچه از بار الکترونی دارد که رنگ آن نیز گویای همین مطلب است. این نوع از توزیع یکپارچه، بیشتر در پیوندهای کووالانسی ناقطبی و تمامی مولکولهای دواتمی با اتم یکسان وجود دارد. اما به عکس، در مولکول سدیم کلرید، چگالی الکترونی غیریکپارچه ملاحظه میشود. اتم سدیم در محدوده رنگ آبی و بار مثبت و اتم کلر، در محدوده قرمز و بار منفی قرار دارد.
این نقشه پتانسیل الکترواستاتیک، در پیوندهای یونی بسیار معمول است. با نگاهی به نقشه میتوان دریافت که انتقال چگالی الکترون از اتم سدیم به کلر به طور کامل صورت نمیگیرد. این بدان معنی است که پیوند سدیم کلرید به طور کامل، یونی نیست و آزمایشات نشان میدهند که پیوند سدیم کلرید در حدود ۸۰ درصد خاصیت یونی دارد. مولکول نیز توزیع نامتقارن چگالی الکترونی را نشان میدهد که این موضوع را میتوان از گرادیان رنگی در نقشه پتانسیل الکترواستاتیک آن ملاحظه کرد.
البته توجه داشته باشید که در این حالت، اتم کلر به طور کامل در محدوده رنگی قرمز قرار نمیگیرد و بار منفی بزرگی را شامل نمیشود. در عوض، در محدوده قرمز-نارنجی قرار دارد که نشان میدهد این اتم مقداری جزئی بار منفی دارد. به همین شکل، اتم نیتروژن، دارای بار جزئی مثبت و با رنگ آبی کمرنگ نشان داده شده است. نقشه الکترواستاتیک مولکول به وضوح از وجود یک پیوند کووالانسی قطبی حکایت دارد.
اگر مطلب بالا برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزشهای دروس شیمی
- آموزش شیمی عمومی
- تغییر فیزیکی — به زبان ساده
- آلوتروپ — از صفر تا صد
^^
آزمون پیوند کووالانسی
۱. کدام گزینه مفهوم درست پیوند کووالانسی را بیان میکند؟
تشکیل پیوند بین اتمهای فلزی با الکترونهای آزاد و متحرک
انتقال کامل الکترون از یک اتم به اتم دیگر برای ایجاد یون
حضور نیروی جاذبه بین یونهای مثبت و منفی در شبکه یونی
اشتراکگذاری یک جفتالکترون بین دو اتم برای رسیدن به آرایش پایدار
پیوند کووالانسی زمانی شکل میگیرد که دو اتم با اشتراکگذاری یک جفتالکترون به آرایش پایدار شبیه گازهای نجیب برسند. عبارت «انتقال کامل الکترون از یک اتم به اتم دیگر» متعلق به پیوند یونی است. «حضور نیروی جاذبه بین یونهای مثبت و منفی» هم ویژگی ساختارهای یونی است و «تشکیل پیوند بین اتمهای فلزی با الکترونهای آزاد» مربوط به پیوند فلزی میشود. بنابراین تنها اشتراکگذاری الکترونها ویژگی پیوند کووالانسی است.
۲. مطابق ساختار لوییس، چه عاملی باعث تشکیل پیوند کووالانسی یگانه بین دو اتم کلر (Cl) میشود؟
کم بودن انرژی یونش کلر نسبت به هیدروژن
تشکیل پیوند دوگانه برای استقلال الکترونی
تمایل به رسیدن هر دو اتم به آرایش پایدار گاز نجیب با اشتراک گذاری جفت الکترون
وجود سه جفت الکترون ناپیوندی روی هر اتم کلر
تشکیل پیوند کووالانسی یگانه بین دو اتم کلر بر اساس مدل لوییس زمانی رخ میدهد که هر دو اتم با اشتراکگذاری یک جفت الکترون، به آرایش پایدار هشتتایی شبیه گاز نجیب دست مییابند. این میل به پایداری دلیل اصلی اشتراکگذاری الکترونها است، نه وجود جفتهای ناپیوندی یا انرژی یونش پایین. همچنین در مولکول ، تنها یک پیوند یگانه ایجاد میشود، نه دوگانه. در نتیجه، «تمایل به رسیدن هر دو اتم به آرایش پایدار گاز نجیب» عامل اصلی این پیوند است.
۳. برای رعایت قاعده اکتت در مولکول ، چه نوع پیوندی بین دو اتم اکسیژن شکل میگیرد؟
هر دو اتم با یک پیوند یگانه به هم متصل میشوند.
تنها پیوند کووالانسی داتیو برقرار میشود.
بین دو اتم اکسیژن پیوند دوگانه تشکیل میشود.
بین آنها پیوندی به صورت یونی به وجود میآید.
در مولکول ، برای این که هر اتم اکسیژن به آرایش پایدار الکترونی یعنی قاعده اکتت برسد، دو جفت الکترون خود را با اتم مقابل به اشتراک میگذارد و پیوند دوگانه بین دو اتم ایجاد میشود.
۴. بر اساس ساختار لوییس، اگر در یک مولکول تنها یک اتم هر دو الکترون پیوند را به اشتراک بگذارد، این پیوند از چه نوعی خواهد بود؟
این وضعیت به پیوند کووالانسی کوردینانسی یا داتیو مربوط میشود.
تنها پیوند هیدروژنی در این شرایط شکل میگیرد.
این پیوند به عنوان پیوند یونی شناخته میشود.
چنین حالتی فقط در پیوند فلزی رخ میدهد.
وقتی در ساختار لوییس، هر دو الکترون مشترک یک پیوند از یک اتم تامین شود، نوع پیوند، پیوند کووالانسی کوردینانسی یا داتیو است. برخلاف پیوندهای کووالانسی عادی که هر اتم یک الکترون ارائه میدهد، در حالت داتیو یک اتم هر دو الکترون پیوند را میدهد.
۵. در نقشه پتانسیل الکترواستاتیک، تفاوت مشخص توزیع بار بین مولکول HCl و بیانگر چه ویژگی ساختاری است؟
در HCl یک طرف مولکول ناحیه پررنگ قرمز و طرف دیگر آبی، نشاندهنده پیوند قطبی است.
HCl و هر دو توزیع بار یکنواخت دارند و هر دو ناقطبی هستند.
یک سر قرمز و یک سر آبی دارد، لذا پیوندش قطبی محسوب میشود.
در HCl و اختلاف بار دیده نمیشود و هر دو مشابه هستند.
در نقشه پتانسیل الکترواستاتیک، HCl دارای توزیع نامتقارن بار است. یک سر با رنگ قرمز (الکترون بیشتر) و سر دیگر آبی (الکترون کمتر) دیده میشود، که معرف پیوند کووالانسی قطبی است. این تفاوت رنگی نشاندهنده جابجایی چگالی الکترونی به سمت عنصر الکترونگاتیوتر است. اما در بهدلیل یکسان بودن اتمها، توزیع الکترون متقارن است و اختلاف بار خاصی میان دو طرف مولکول دیده نمیشود و ناقطبی است. پس فقط HCl با این نقشه دارای پیوند قطبی است و گزینه درباره ناحیه قرمز و آبی در HCl نشانه قطبیت را درست بیان میکند.
۶. در پیوند میان اتمهای هیدروژن و کلر چه ویژگی الکترونی باعث به وجود آمدن بارهای جزئی δ+ و δ- میشود؟
نامساوی بودن اشتراکگذاری الکترونها
مقدار متفاوت شعاع اتمی بین دو عنصر
تقارن کامل ساختار لوییس مولکول
امنیت بالاتر لایه ظرفیت هیدروژن
در مولکولهایی مانند HCl، دلیل به وجود آمدن بارهای جزئی δ+ و δ-، نامساوی بودن اشتراکگذاری الکترونها میان اتمهای هیدروژن و کلر است. الکترونهای پیوندی بیشتر به سمت کلر تمایل دارند و این عدم تقارن باعث ایجاد بار جزئی مثبت روی هیدروژن و بار جزئی منفی روی کلر میشود.













سلام یک سوال داشتم من توی امتحان شیمی دیروز دو تا سوال داده بودن پیوند یونی و پیوند کووالانسی برای پیوند یونی زده بود Mg¹² با N⁷ و برای پیوند کووالانسی P¹⁵ با O⁸ میخواستم ببینم اینا پیوند میخورن با هم یا نه من که توی امتحان زدم پیوند نمیخوره کل دوستام یک روش رفته بودن بعد گفتن من غلط رفتم من فکر میکنم اونا غلط زدن چون غیر ممکنه پیوند بخوره لطفا اگر میشه واضح بگید من بگیرم که چی شده با تشکر🌹🌹
سلام میشه راجب پیوند اشتراکی در رادیکال ها توضیح بدید منظورم پیوند SO در SO2 هست که اکسیژن هیچ الکترونی از خودش به اشتراک نذاشته
سلام و روز شما بهخیر؛
در هر مولکول دیاکسید گوگرد، یک پیوند دوگانه بین گوگرد و هر اتم اکسیژن وجود دارد. توجه داشته باشید که با توجه به الکترونهای ظرفیتی که هر اتم دارند، روی هر اتم اکسیژن دو زوج الکترون تنها و روی گوگرد، یک جفت الکترون تنها حضور دارد. در این حالت ساختار لوییس آن پایدار است.
خوشحالیم که با مجله فرادرس همراه هستید.
سلام. من هم دقیقا سوالم این بود که پیوند شبه کوالانسی یعنی چی؟ توی مقالات خارجی زیاد دیدم.
با سلام.
منظور از پیوند شبه کوالانسی (که در برخی متون آورده شده) چیست؟
ممنون از شما عالی بود،سوال من این هست که در پیوند ALCL3 ،هر اتم کلر با اشتراک گذاری یک الکترون خود با یک الکترون الومینیوم ظرفیت لایه والانسش کامل میشوداما الومینیوم که در لایه والانس خود 3الکترون دارد با اشتراک گذاری انها تعداد الکترون های لایه ظرفیتش به6عدد میرسد و لایه والانسش کامل نمیشود ،چطور میشه این پیوند و ترکیب رو توجیه کرد ممنون
با سلام؛
در متون مرجع شیمی در رابطه با پیوند شبهکووالانسی مطلبی آورده نشده است. البته مفهوم شبهپیوند در شیمی وجود دارد که به هر اتصال منطقی یا فیزیکی بین اتمها میگویند که این اتصال از نوع پیوند کووالانسی نباشد.
با تشکر از همراهی شما با مجله فرادرس
سلام
در پیوندها کدام مولکول پایدارتر است؟
مثلا چرا co2 از co پایدارتره؟
اونی که تعداد پیوند های بیشتر و طول پیوند کمتری داشته باشه
سلام وقت بخیر مقالتون واقعا عالی بود خسته نباشید
سلام.
ببخشید فرمول محاسبه تعداد پیوند کوالانسی در استر چیه؟
با سلام؛
به طور معمول فرمولی را برای این مورد در نظر نمیگیرند مگر این که در نکات کنکوری به آن اشاره شود که بحث جامعی نیست. با این وجود پیشنهاد میکنیم مطلب «استرها — به زبان ساده» را نیز مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام ببخشید تعداد پیوندهای اشتراکی در C7H6O چند تا هستش
ممنون
فکر میکنم ۵۶ میشه
سلام ببخشید میشه بگید کووالانسی غیر قطبی یعنی چی؟
اگر میشه لطفا پاسخ بدید
سلام امکان داره یک اتم بیشتر از ۴ پیوند اشتراکی ایجاد کنه؟
با سلام؛
اتم فسفر میتواند چنین شرایطی را تجربه کند زیرا میتواند جفتالکترونهای ناپیوندی خود در اوربیتال 3S را به سمت اوربیتال خالی 3d جابجا کند و ۵ پیوند تشکیل دهد که مولکول PCl5 نمونهای از آن به شمار میآید.
با تشکر از همراهی شما با مجله فرادرس
با سلام؛
به پیوند بین دو اتم غیر فلزی با الکترونگاتوی یکسان میگویند که در نتیجه این اتفاق، اشتراکگذاری جفت پیوندی به میزان یکسانی صورت میگیرد و پیوند کووالانسی بین آنها از نوع کووالانسی ناقطبی خواهد بود.
با تشکر از همراهی شما با مجله فرادرس
سلام
آبا مایع کووالانسی داریم؟
سلام
ببخشید میخواستم بدونم آیا درسته در تشکیل مولکول متان، هر اتم کربن دو پویند کووالانسی می دهد؟!
ممنون میشم اگه جوابمو بدین
با سلام؛
متان، مولکولی چهاروجهی با چهار پیوند کربن-هیدروژن است. پیشنهاد میکنیم برای مطالعه بیشتر، مطلب «متان چیست ؟ — از صفر تا صد» را مطالعه کنید.
از همراهی شما با مجله فرادرس سپاسگزاریم.
با سلام؛
از شما به خاطر مطالعه این مطلب سپاسگزاریم.
به طور کلی، ترکیبات کووالانسی میتوانند به صورت جامد، مایع و گاز حضور داشته باشند اما بیشتر به شکل مایع و گاز با دمای ذوب و جوش پایین وجود دارند. آنچه که در خصوص این ترکیبات مطرح میشود، نوع پیوند آنها است به طوریکه وقتی شبکه سهبعدی از یک ترکیب جامد کووالانسی را ذوب میکنیم، این پیوندها تشکیل یک مایع فلزی میدهند مگر اینکه اختلاف الکترونگاتیوی شدیدی بین اجزای آن وجود داشته باشد. این نگاه سبب میشود تا برخی از مایعات را به صورت مایع کووالانسی بررسی کنیم. برای آشنایی بیشتر با ساختار مایعات کووالانسی میتوانید به مقاله «Structure of Covalent Liquids» نوشته «M P Tosi» رجوع کنید.
با تشکر