فسفر و موارد استفاده از آن – از صفر تا صد
عنصر فسفر بخش مهمی از زندگی موجودات زنده را تشکیل میدهد. بدون فسفرِ موجود در مولکولهای بیولوژیکی همچون ATP ،ADP و DNA، زندگی امکانپذیر نخواهد بود. ترکیبات فسفر را همچنین میتوان در استخوانها و دندانها مشاهده کرد. این عنصر همچنین بخش مهمی از رژیم غذایی انسان را تشکیل میدهد. در حقیقت، در تمامی غذاهایی که مصرف میکنیم، ردی از آن یافت میشود. علاوه بر این، عنصری فعال است و به همین سبب ماده اصلی در کبریتها به شمار میآید چراکه بسیار اشتعالپذیر است. همچنین، فسفر، عنصری حیاتی برای گیاهان محسوب میشود و برای افزایش رشد آنها، فسفاتها را به خاک این گیاهان اضافه میکنند.


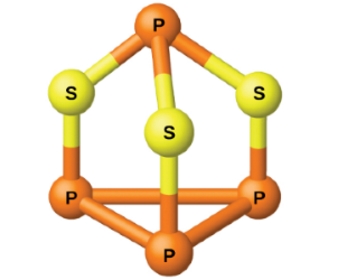
این عنصر معمولا در اعداد اکسایش ، و وجود دارد. ترکیباتی که در آنها پیوندهای فسفر-فسفر حضور داشته باشند، اعداد اکسایشی بدست میدهند که برای عناصر گروه 15، معمول نیست. از نمونههای این ترکیبات میتوان به «دیفسفر تتراهیدرید» و «تترافسفر تریسولفید» اشاره کرد.
مقدمه
فسفر همانطور که برای زندگی موجودات ضروری است، میتواند خطرناک هم باشد. زمانی که کودهای حاوی این عنصر، به آب وارد شوند، موجب رشد سریع جلبکها میشوند. این مورد سبب تغییر میزان مواد مغذی در دریاچهها رودخانهها خواهد بود و این بدان معنی است که میزان مواد مغذی در اکوسیستم افزایش پیدا میکند و به همین سبب، تبعات منفی برای محیط زیست خواهد داشت.
به دلیل وجود مقدار اضافی از این عنصر، گیاهان به طور سریعی رشد میکنند و میمیرند و به تبع آن، فقدان اکسیژن و کاهش کیفیت آب را خواهیم داشت. این عنصر را به کمک واکنش با ترکیباتی همچون فریک کلرید، فریک سولفات و آلومینیوم سولفات یا آلومینیوم کلروهیدرات، میتوان از آب حذف کرد. این عنصر، زمانی که با آلومینیوم یا آهن ترکیب میشود، نمکهای نامحلول را تشکیل میدهد. ثابتهای تعادل انحلالپذیری و برابر با و است. با توجه به این انحلالپذیری کم، در نتیجه میتوان رسوبات حاصل را به کمک فیلتراسیون جدا کرد.
نمونه دیگری از خطرناک بودن این عنصر را میتوان در تولید کبریت مشاهده کرد. طبیعت اشتعالپذیر و ارزان بودن روش تولید فسفر سفید، ساخت کبریت را در قرن بیستم امکانپذیر کرد. البته، فسفر سفید به شدت سمی است. بسیاری از کارگران کارخانههای کبریتسازی به این دلیل که در معرض بخارات این ماده بودند، دچار بیماری با نام «نکروز فسفر فک» (Phosphorus Necrosis of The Jaw) شدند. فسفر اضافی در بافتهای استخوانی این افراد موجب از بین رفتن این بافتها به خصوص در فک میشد. به همین دلیل، امروزه از فسفر قرمز یا «سسکوئی سولفید فسفر» (Phosphorus Sesquisulfide) در کبریتهای بیخطر استفاده میشود.
در ویدیوی کوتاه زیر میةوانید آموزش ترکیبات فسفر در کشاورزی را مشاهده کنید.
کشف فسفر
فسفر در زبان یونانی به معنای «آورنده آتش» ( Bringer of Light) است. به طور معمول، این عنصر را به شکل خالص نمیتوان یافت کرد چراکه عنصری بسیار فعال به شمار میآید. به همین دلیل، کشف این عنصر مدت زمان زیادی به طول انجامید. اولین جداسازی این عنصر توسط شیمیدان آلمانی، «هنیگ براند» (Hennig Brand) در سال 1669 انجام شد.
او بعد از فرآیندهای مختلفی موفق به تولید فسفر سفید شد که به مرور زمان، بازده آزمایشهای خود را با اضافه کردن ماسه بهبود بخشید. بعدها این ماده را از خاکستر استخوان تهیه کردند. البته امروزه از این روشها برای تولید آن استفاده نمیکنند بلکه از کلسیم فسفات و کُک بهره میگیرند.
آلوتروپهای فسفر
فسفر، نافلزی است که در دمای اتاق به حالت جامد قرار دارد و هادی ضعیف گرما و الکتریسیته به شمار میآید. این عنصر را حداقل در ده آلوتروپ مختلف میتوان مشاهده کرد. معمولترین آلوتروپ این عنصر، موسوم به فسفر سفید (زرد) است که حالتی پلاستیکی و مومی دارد. آلوتروپ معمول دیگر این عنصر که برخلاف فسفر سفید، فعالیت بسیار کمتری دارد، فسفر قرمز نام دارد که بخش جانبی جعبههای کبریت را تشکیل میدهد که به کمک آنها میتوان کبریت را روشن کرد.
فسفر سفید شامل مولکولهای است درحالیکه ساختار بلوری فسفر قرمز، شبکههای پیچیدهای از پیوندها را شامل میشود. فسفر سفید را برای جلوگیری از احتراق، در آب نگهداری میکنند اما فسفر قرمز در هوا پایدار است. با سوختن فسفر قرمز میتوان دو ماده مختلف تولید کرد. اگر میزان اکسیژن در واکنش سوختن، محدود باشد، ترکیب حاصل، مانند سوختن فسفر سفید به صورت خواهد بود. اما اگر میزان کافی اکسیژن در اختیار داشته باشیم، به تولید میرسد.
دیفسفر
دیفسفر با فرمول ، شکل گازی این عنصر و از لحاظ ترمودینامیکی در بازه 1200 تا 2000 درجه سانتیگراد، پایدار است. برای تولید دیفسفر، فسفر سفید را تا دمای 826 درجه سانتیگراد حرارت میدهند. این آلوتروپ با داشتن انرژی تفکیک پیوند ، مادهای بسیار واکنشپذیر است.
فسفر سفید
فسفر سفید ، ساختاری چهاروجهی و همانطور که گفته شد، شکلی نرم و مومیشکل دارد. دلیل شفافیت فسفر سفید، اکسید شدن آهسته بخار آن توسط هوا ذکر میشود. این ماده به لحاظ ترمودینامیکی به شدت ناپایدار است و در حضور هوا میسوزد. در ساخت مواد آتشبازی و منفجره نیز از این ماده بهره میگیرند.

پیشنهاد می کنیم برای درک بهتر خواص این نوع فسفر و کاربردها و خطرات محیطی آن، فیلم آموزش فرادرس که در ادامه آورده شده است را مشاهده کنید.
فسفر قرمز و فسفر بنفش
در مقایسه با فسفر سفید، در فسفر قرمز، اتمهای بیشتری با یکدیگر در داخل شبکه، پیوند تشکیل دادهاند و همین امر سبب پایداری بیشتر آن شده است. اشتعالپذیری کمی دارد اما با دادن مقدار کمی انرژی، شعلهور میشود. به همین دلیل از این ماده در تولید کبریتهای بیخطر بهره میگیرند.

فسفر بنفش با روشهای خاصی شامل حرارت دادن و تبلور فسفر قرمز تولید میشود. شکل فسفر بنفش به صورت لولههایی پنجوجهی است.
فسفر سیاه (پلیمری)
فسفرسیاه، پایدارترین نوع از این عنصر به شمار میآید. ساختار فسفر سیاه همانند گرافیت، به صورت لایهلایه است و به همین دلیل خواصی مشابه با گرافیت نیز دارد.

ایزوتوپهای فسفر
ایزوتوپها مختلفی از فسفر وجود دارند که تنها یکی از آنها پایدار است و به شکل نمایش داده میشود. دیگر ایزوتوپهای این عنصر رادیواکتیو هستند و نیمه عمری کوتاه از چند نانوثانیه تا چند ثانیه دارند. البته برای دو ایزوتوپ و ، نیمه عمر بیشتری ذکر کردهاند و نیمه عمر آنها به ترتیب، 14 و ۲۵ روز است. این میزان از نیمه عمر کافی است تا به کمک آن به تحلیل و علامتگذاری DNA بپردازند.
در سال 1952 و در «آزمایش هرشی-چیس» (Hershey-Chase Experiment) نقش اساسی داشت. در این آزمایش، «آلفرد هرشی» (Alfred Hershey) و «ماراتا چیس» (Martha Chase)، از ایزوتوپهای رادیواکتیو گوگرد و فسفر استفاده کردند تا نشان دهند که DNA، مادهای ژنتیکی است و پروتئین نیست. این آزمایش سبب شد تا گوگرد و فسفر به ترتیب به عنوان «نشانگرهای» (Markers) پروتئین و DNA شناخته شوند.
آزمایش به اینصورت بود که هرشی و چیس نمونهای از ویروس را در حضور عنصرهای رادیواکتیو و رشد و اجازه دادند که باکتریهایی را آلوده کنند. آنها نمونههای و را به طور جداگانه ترکیب و دو نمونه را سانتریفیوژ کردند. سانتریفیوژ سبب شد تا مواد ژنتیکی از مواد غیرژنتیکی جدا شوند. مواد ژنتیکی به داخل جامدِ حاوی باکتری در انتهای لوله نفوذ کردند درحالیکه مواد غیرژنتیک در داخل مایع باقی ماندند. با تحلیل نشانگرهای رادیواکتیو، هرشی و چیس متوجه شدند که در کنار باکتری و در داخل مایع حضور دارند.
حضور در طبیعت
بدن ما بسیاری از عناصر را به شکل معدنی دریافت میکند. در طبیعت، این عنصر به صورت فسفات وجود دارد. سنگهای دارای فسفات عبارتند از:
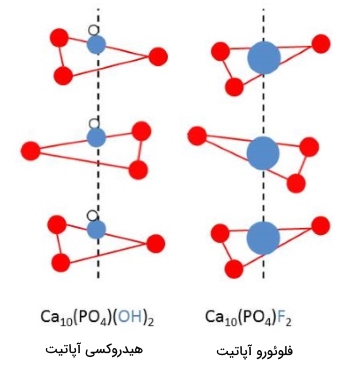
- «فلوئورو آپاتیت»
- «کلرو آپاتیت»
- «هیدروکسی آپاتیت»
آرایش اتمها و یونها در استخوانها و دندانها بسیار به آرایش این مواد معدنی نزدیک است. در حقیقت، اگر یونهای هیدروکسید دندانها را با یون جایگزین کنیم، دندانها در برابر پوسیدگی مقاوم میشوند. تصویر زیر، جانشینی یون هیدروکسید را توسط یون فلوراید برای تشکیل فلوئوروآپاتیت در مینای دندان نشان میدهد. در این تصویر، یون فلوراید (دایرههای آبیرنگ بزرگ) با یون هیدروکسید جایگزین شده است.
نیتروژن، فسفر و پتاسیم، مواد اصلی برای گیاهان هستند که وجود این مواد در کودها از اصلیترین اجزا به شمار میآیند. از منظر اقتصادی و صنعتی، ترکیبات شامل فسفر اهمیت بسیاری دارند. بنابراین، شناخت این عنصر از نظر اقتصادی، علمی و تجاری حائز اهمیت است.
فسفر مغز
پنجاه سال بعد از کشف فسفر، پزشکی با نام «یوهان توماس هنسینگ» (Johann Thomas Hensing) نشان داد که مغز، منبعی دیگر از این عنصر است. او مغز گاو را با آلومینیوم پتاسیم سولفات در غیاب اکسیژن، برای ساعتها حرارت داد. زمانی که به آزمایش خود، هوا اضافه کرد، ماده باقیمانده به طور خودبهخودی سوخت و او به حضور این عنصر پی برد. البته در این خصوص دو موضوع را میتوان بررسی کرد:
- اول اینکه مواد بسیاری مانند شکر وجود دارند که چنین رفتاری را از خود نشان میدهند.
- تلاشهای دیگر برای تکرار آزمایش فوق موفقیتآمیز نبودند چراکه این آزمایش در گذشته انجام شده و شرایط آن به دقت ذکر نشده بود.
البته این دانشمند را به عنوان اولین شخصی میشناسند که به طور کیفی وجود فسفر در مغز را اثبات کرد. در سال 1864، شیمیدانی با نام «ژان پیر کورب» (Jean-Pierre Couerbe)، با بررسی مغز نتایج جالبی را ارائه داد. او اظهار داشت که به طور معمول، بافت مغز حاوی 2 تا 2/5 درصد فسفر است. او این مقدار را برای «عقبافتادگان ذهنی» (Idiot) در حدود 1 تا 1/5 درصد و برای «دیوانگان» (Madmen) در حدود 3 تا ۴ درصد ذکر کرد.
البته این یافته دوام چندانی نداشت چراکه توسط فیلسوف فرانسوی «پاول ژانت» (Paul Janet) به چالش کشیده شد، زیرا مشخص شد مغز ماهیها، حاوی مقادیر زیادی از این عنصر است درحالیکه این موجودات را به لحاظ مغزی، ضعیف توصیف کردهاند.

فسفر در بدن جانداران
همانطور که گفته شد، فسفر برای سلامت گیاهان و جانوران ضروری است. بسیاری از سلولهای بدن جانداران حاوی این عنصر هستند. یکی از مهمترین مواد موجود در بدن جانداران، موسوم به «آدنوزین تریفسفات» (ADP) است که انرژی مورد نیاز برای حیات سلولها را تامین میکند. علاوه بر این، وجود این عنصر برای تکامل استخوانها و دندانها حیاتی است. همچنین، نوکلئیک اسیدها نیز دارای فسفر هستند. به طور مثال، این مواد در بدن نقش حامل اطلاعات ژنتیکی را دارند.
زیادی فسفر در بدن
مقدار مورد نیاز این عنصر برای انسان، در حدود یک گرم توصیه شده است. این مقدار را به سادگی میتوان از طریق گوشت، شیر، حبوبات و غلات بدست آورد. البته، وجود این عنصر به صورت خالص در بدن، بسیار خطرناک است. مقدار کمی فسفر سفید در بدن موجب از دست دادن خون و تخریب کبد، معده، رودهها و سیستم گردش خون میشود و در مواردی، کما و مرگ را به همراه دارد. حمل و نقل فسفر سفید نیز خطرناک است و موجب سوختگیهای شدید خواهد شد.
منابع فسفر
غذاهای مختلف، حاوی مقادیری از این عنصر هستند که در زیر آورده شدهاند:
- گوشت مرغ و ماهی
- سویا و غلات
- شیر و لبنیات

بررسی دقیقتر
این عنصر به عنوان عضوی از خانواده نیتروژن در گروه ۱۵ جدول تناوبی عناصر، ۵ الکترون در لایه ظرفیت خود برای تشکیل پیوند دارد. همچنین، آرایش لایه ظرفیت آن به صورت نوشته میشود. در بیشتر موارد، فسفر تشکیل پیوندهای کووالانسی میدهد. از سنگهای حاوی این عنصر برای تولید فسفر خالص بهره میگیرند. سنگهای فسفات خردشده به همراه ماسه در دمای 1426 درجه سانتیگراد واکنش میدهند تا فسفروس اکسید با فرمول تولید شود.
به کمک کربن و در واکنش زیر کاهش مییابد:
جامدات مومیشکل فسفر سفید، بلورهای مولکولی حاوی مولکولهای هستند. خاصیت فسفر سفید در آن است که به طور خودبهخودی در هوا میسوزد. واکنش سوختن آن در زیر آورده شده است:
ساختار را میتوان به کمک آرایش الکترونی توضیح داد. اشتراکگذاری ۳ الکترون با سایر اتمهای موجب تشکیل ۶ پیوند و یک جفتالکترون ناپیوندی میشود که محل این جفتالکترون را نیز به کمک ساختار لوییس میتوان به خوبی نشان داد. در شرایط عدم اکسیژن کافی، واکنش سوختن به صورت زیر است و به هر پیوند یک اتم اکسیژن وارد میشود:
در صورتی که این عنصر، با مقدار اضافی اکسیژن بسوزد، تشکیل میشود که اتم اکسیژن به صورت مستقیم به اتم P متصل میشود.
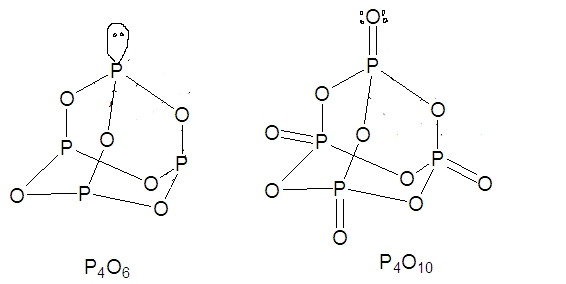
بنابراین، و خواص جالبی دارند. اکسیدهای در آب حل میشوند و تشکیل فسفریک اسید میدهند:
فسفریک اسید، یک اسید چند پروتونه است و در سه مرحله یونیزه میشود:
فسفریک اسید
چندپروتونه بودن فسفریک اسید، آن را به یک بافر ایدهآل تبدیل میکند. جداکردن هیدروژن از فسفات با افزایش مقدار سختتر و سختتر میشود. این مقدار به ترتیب، 2/12، 7/21 و 12/67 است.
| واکنش کلی: | |
| ثابت تفکیک | واکنش |
موارد استفاده از فسفر
فسفر، از گذشته کاربردهای فراوانی داشته است و امروزه نیز از آن استفادههای زیادی میشود. از این عنصر در روشنایی، اسباببازیها، تمبرها، تلویزیونهای قدیمی و بسیاری موارد دیگر بهره میگیرند.
ترکیبات فسفر به صورت تجاری در ساخت فسفریک اسید با فرمول بکار میرود که در تولید نوشابههای گازدار و کودها نقش اساسی دارد. کاربردهای دیگر آن در آتشبازی و البته در مواد فسفرسانس است که در تاریکی میدرخشند. فسفریک اسید همچنین به عنوان محلول بافر مورد استفاده قرار میگیرد. در گذشته از ترکیبات فسفردار در شویندهها و سختیگیرهای آب استفاده میشد اما به دلیل تبعاتی که در آلودگی و افزایش بیرویه مواد مغذی خاک داشت، بکارگیری آن منسوخ شد. همچنین در گذشته از فسفر در پزشکی به عنوان داروی تقویتی یاد میشد اما بعدها دانشمندان به سمی بودن آن پی بردند.
کاربردهای دیگر این عنصر در تولید آلیاژهای مخصوص همچون فروفسفروس و «فسفر برنز» (Phosphor Bronze) است. فسفر در ساخت آفتکشها، کبریتها و برخی پلاستیکها نیز کاربر دارد.
سنگ فسفر چیست؟
فسفریت یا سنگ فسفات که به سنگ فسفر هم معروف است، از جمله سنگهای رسوبی است که مقادیر زیادی از فسفاتهای معدنی را شامل میشود. در حدود ۹۰ درصد سنگهای فسفات تولیدی بمنظور استفاده در کودها به مصرف میرسد. علاوه بر این، در تامین مواد مغذی دامها نیز از این ماده بهره می گیرند.
تولید و آمادهسازی فسفر
همانطور که پیشتر نیز به آن اشاره شد، آمادهسازی صنعتی این عنصر به کمک سنگهای فسفاته، ماسه و کُک طبق واکنش زیر است:
فسفر به کمک تقطیر از کوره خارج میشود و سپس آن را یا سرد میکنند تا به حالت جامد تبدیل شود یا اینکه با اکسیژن اضافی میسوزانند تا تشکیل دهد. اسیدها و فسفاتها در کودهای شیمیایی و دیگر صنایع شیمیایی کاربردهای زیادی دارند.
ترکیبات فسفر و هالوژنها
این عنصر به طور مستقیم با هالوژنها برای تشکیل تریهالیدهایی به شکل و پنتاهالیدهایی به شکل وارد واکنش میشود. تریهالیدهای فسفر بسیار پایدارتر از تریهالیدهای نیتروژن متناظر با آنها هستند. لازم به ذکر است که نیتروژن پنتاهالیدها به دلیل عدم توانایی نیتروژن برای تشکیل بیش از چهار پیوند، تشکیل نمیشوند.
کلریدهای و که در تصویر زیر میبینید از مهمترین هالیدهای این عنصر به شمار میآیند. فسفر تریکلرید، مایعی بیرنگ است که به کمک گذردهی کلر از فسفر مذاب بدست میآید. فسفر پنتاکلرید نیز به حالت جامد وجود دارد و بوسیله اکسیداسیون تریکلرید با مقدار اضافی کلر بدست میآید. به هنگام گرم کردن پنتاکلرید، این ماده تصعید میشود و به هنگام حرارت دادن، تعادلی بین تریکلرید و کلر برقرار خواهد شد.

همانند بسیاری از هالیدهای نافلزی، هر دو کلرید فسفر با مقدار اضافی آب واکنش میدهند و هیدروژن کلرید و اکسیاسید تولید میکنند به اینصورت که فسفروس اسید و فسفریک اسید تولید میکنند.
به دلیل اوربیتال خالی d در لایه ظرفیت پنتاهالیدهای فسفر، این مواد به عنوان اسید لوییس در نظر گرفته میشوند. این ترکیبات به سادگی با یونهای هالیدی (باز لوییس) واکنش میدهند و آنیون را تولید میکنند.
با وجود اینکه فسفر پنتافلوئورید در تمام حالات، یک ترکیب مولکولی است، مطالعات اشعه ایکس نشان میدهند که جامد فسفر پنتاکلرید ترکیبی یونی به شکل را شامل میشود و به همین شکل، فسفر پنتابرمید و فسفر پنتایدید به ترتیب، ترکیباتی یونی به شکل و را تشکیل میدهند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی آلی ۳
- آلدهیدها — به زبان ساده
- الکل ها — از صفر تا صد
^^













خیلی مفید و اموزنده بود خیلی خیلی ممنونم
سلام
اربیتال های فسفر هنگام تشکیل پیوند دوگانه با اکسیژن در ترکیباتی نظیر P4O10 و اسید فسفریک چه وضعیتی دارند؟؟ اتم های فسفر چجوری با اکسیژن پیوند میدن؟ آیا اربیتال های خالی d فسفر نقشی دارند?؟
ممنونم بابت مقالتون.راستش من میخوام بدونم چطور میشه اون قسمت فسفر کنار جعبه کبریتو درست کرد؟ی سری ظرف سفالی درست کردم بعنوان جا کبریتی و الان اون قسمت فسفرش مونده
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. در ابتدا باید گفت که در مورد پیوند فسفر با اکسیژن، اروبیتالهای d نقشی ندارند زیرا آرایش الکترونی فسفر و اکسیژن به np ختم می شود. البته در برخی منابع قدیمی علت را اربیتالهای خالی d بیان کردهاند اما این موضوع صحیح نیست که در منابع جدید نیز رد شده است. در مورد حضور فسفر در P4O10 باید گفت که این ساختار از پیوندهای 6P−O−P با هیبریداسیون SP3 اکسیژن تشکیل شده است. ۴ اکسیژن دیگر به هر یک از اتم فسفر از طریق پیوند دوگانه فسفر و اکسیژن (P=O) متصل میشوند که در این حالت هیبریداسیون اکسیژن به صورت SP2 خواهد بود. در اولین حالت هیبریداسیون اوربیتال P−O−P در زاویههای ۱۰۲ درجه و ۱۲۳ درجه از هم قرار دارند. برای حالت دوم (P=O) زاویه این پیوند برابر ۱۸۰ درجه است.
در مورد پیوند فسفر با اکسیژن در فسفریک اسید باید گفت که اتم فسفر یک الکترون از دست میدهد و بار آن مثبت میشود که این بار مثبت فسفر باعث به وجود آمدن هیبرید SP2 می شود. این هیبرید این امکان را میدهد تا با اکسیژن پیوند دوگانه تشکیل دهد و به گروههای OH متصل شود. بنابراین اتم فسفر در مرکز فسفریک اسید قرار میگیرد و هیبریداسیون SP2 تشکیل میشود (اروبیتال S دارای یک الکترون و اوربیتال P دارای سه الکترون) و به اینگونه ساختار چهاروجهی فسفریک اسید تشکیل میشود.
و اما برای نحوه پیوند فسفر با اکسیژن باید عرض کرد که فسفر با دادن الکترون به اکسیژن پیوند تشکیل میدهد.
با تشکر
سلام و عرض ادب و احترام
چندتا سوال دارم، خوشحال میشم پاسخ بدید. متشکرم
1- ما میدونیم که اتم فسفر، در تاریکی می درخشه. مثل بعضی دکمه های روی ریموت تلویزیون. آیا این دکمه ها از فسفر خالص ساخته شده اند که کل دکمه می درخشه؟
2- سر چوب کبریت ها، فسفر قرمز خالص هست؟ اگر ترکیبه لطفا ترکیب شیمیایی اش رو بفرمایید.
3- اگر سر چوب کبریت، از فسفر ساخته شده پس چرا تو تاریکی نمی درخشه؟
4- وقتی فسفر سر چوب کبریت آتیش می گیره و می سوزه، بعد از سوختنش، یک خاکستر سیاه باقی می مونه، ترکیب این زغال سیاه رنگ چیه؟
5- و سوال مهم، چطور میشه فسفر خالص رو از پنتا اکسید فسفر بدست آورد؟
سلام من پایه نهمم الان یه تست حل میکردم درباره فسفر بود خوب مدار اخرش۵ تا الکترون هس پس چرا توی گروه ۱۵ هستش؟
سلام و روز شما بهخیر؛
آرایس الکترونی عنصر فسفر را میتوان بهصورت زیر نشان داد.
1s22s22p63s23p3
همانطور که مشاهده میکنید تعداد اتمهای مربوط به لایه آخر که در زیرلایه 3s و 3p قرار دارند، برابر با ۵ عدد است. عنصرهای دیگر موجود در این گروه مانند نیتروژن و آرسنیک نیز از همین روند پیروی میکنند. توجه داشته باشید که شماره گروه نشاندهنده اتمهای موجود در لایه ظرفیت آن نیست.
خوشحالیم که با مجله فرادرس همراه هستید.
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم.
۱. فسفر معمولا به مواد پلاستیکی قالب اضافه میشود یا با یک چسب مخصوص مخلوط میشود تا به صورت رنگ مورد استفاده قرار بگیرد. یکی از این ترکیبات رنگی « ZnS:Cu» است.
۲ و ۳. کبریتها معمولا شامل ۴۵-۵۵ درصد پتاسیم کلرات با مقداری سولفور و نشاسته به همراه مقادیری خنثی کننده مثل کلسیم کربنات و … . در کبریتهای جدید، نه خود کبریت بلکه سطح ساینده شامل ۵۰ درصد فسفر قرمز است. البته ممکن است این ترکیبات برای هر شرکت تولید کننده کبریت، متفاوت باشد.
۴. با توجه به ترکیبات متفاوت در کبریت، بنابراین، فرآورده این واکنش مواد مختلفی را شامل میشود که از جمله آنها میتوان به KCl و فسفر پنتااکسید اشاره کرد.
۵. نحوه آمادهسازی و تولید فسفر به طور خلاصه در داخل متن آورده شده است و استفاده از فسفر پنتا اکسید برای تولید فسفر، به طور معمول صورت نمیگیرد.
با تشکر