حالت پایه اتم چیست؟ – در شیمی و به زبان ساده
حالت پایه اتم حالتی است که اتم تحت اثر هیچ انرژی خارجی قرار نگرفته و الکترونهای آن در پایدارترین حالت ممکن هستند. الکترونهای اتم در حالت پایه، کمترین انرژی ممکن را دارند. با عوامل خارجی مانند امواج الکترومغناطیسی یا گرما، میتوان اتم را از حالت پایه خارج کرد و به حالت برانگیخته منتقل کرد. اتمها زمانی برانگیخته میشوند که الکترون آنها با دریافت انرژی به لایهها و زیرلایههای الکترونی با انرژی بالاتر بروند. این الکترونهای برانگیخته، سپس میتوانند با آزاد کردن انرژی دریافت شده، به حالت پایه بازگردند. حالت پایه اتم در بررسی خواص اتم، فعالیت آن و شناسایی آن بسیار حائز اهمیت است. در این مطلب از مجله فرادرس، توضیح می دهیم حالت پایه اتم چیست و تفاوتهای آن با حالت برانگیخته را توضیح خوهیم داد.
- میآموزید حالت پایه اتم را از حالت برانگیخته تمایز دهید.
- آرایش الکترونی پایه را با قوانین آفبا، پائولی و هوند خواهید نوشت.
- با نقش لایهها، زیرلایهها و اوربیتالها در ساختار اتم آشنا میشوید.
- نحوه نگارش آرایش فشرده برای عناصر بزرگتر را یاد میگیرید.
- مدل کوانتومی اتم و کاربرد طیفهای نشری را بررسی خواهید کرد.
- ارتباط آرایش الکترونی پایه با خواص شیمیایی عناصر را میآموزید.


در ابتدای این متن بررسی میکنیم که حالت پایه اتم چیست. سپس آرایش الکترونی اتم را در حالت پایه توضیح میدهیم. در ادامه مثالهایی را برای یادگیری رسم آرایش الکترونی اتم در حالت پایه بررسی میکنیم. سپس میآموزیم چگونه باید حالت پایه اتم را نشان داد. در ادامه متن، به بررسی تفاوتهای حالت پایه و برانگیخته اتم میپردازیم. برای نشاندادن اوربیتالهای اتم روش جعبه و فلش را میآموزیم و مثالهایی را برای یادگیری بهتر آن بررسی میکنیم. در ادامه توضیح میدهیم مدل کوانتومی اتم چیست و در نهایت حالتهای هم ارزی حالت پایه و اهمیت یادگیری حالت پایه اتم را توضیح میدهیم. با مطالعه این مطلب تا انتها میتوانید این مفهوم مهم را به شکلی کامل و کاربردی بیاموزید.
حالت پایه اتم چیست؟
حالت پایه اتم حالتی است که در آن اتم در پایینترین سطح انرژی ممکن قرار دارد و بسیار پایدار است. در واقع، حالت پایه اتم وضعیتی است که در آن اتمها به وسیله هیچ منبع یا عامل خارجی برانگیخته یا باردار نشده باشند. این منابع برانگیختگی میتوانند نور، فوتون یا هر تابش الکترومغناطیسی دیگری باشند. هنگامی که مقادیر مشخصی از انرژی مانند انرژی کوانتومی به اتم وارد شود، اتم برانگیخته میشود و الکترونهای آن از حالت پایه آرایش الکترونی خارج شده و به زیرلایهها یا لایههای دیگر میروند. الکترونها پس از مدتی با از دست دادن انرژی دریافت شده، به حالت پایه بازگشته و این انرژی اضافی را منتشر میکنند.
حالت پایه اتم مربوط به آرایش الکترونی آن و انرژی الکترونها است. در حالت پایه اتم، اتم یا هریک از الکترونهای آن برانگیخته نشدهاند. در حالت پایه تمامی الکترونها به ترتیبی قرار گرفتهاند که کمترین انرژی ممکن را داشته باشند. الکترونها ممکن است حالتهای مختلفی را در ساختار اتم اشغال کنند و انرژیهای متفاوتی را به اتم بدهند. اتمهای برانگیخته نسبت به حالت پایه ناپایدارتر هستند.
یادگیری شیمی دهم با فرادرس
شیمی دهم یکی از مهمترین کتب درسی در پایه متوسطه است که به مفاهیم مهمی مانند ساختار اتم و آرایش الکترونی مواد میپردازد. در کتاب شیمی این پایه، مباحثی چون اتم، مولکول، ترکیبات شیمیایی، واکنشهای شیمیایی و تعادل شیمیایی بیان میشود. همچنین موازنه واکنشهای شیمیایی و مباحث انحلالپذیری که از مهمترین مباحث سینتیک شیمیایی مواد هستند در این کتاب آموزش داده میشوند. پیشنهاد میکنیم برای یادگیری بهتر این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه دهم بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادمه آورده شده است، میتوانید به آموزشهای بیشتری در خصوص ساختار اتم دسترسی داشته باشید.
- فیلم آموزش علوم تجربی پایه هشتم بخش شیمی
- فیلم آموزش ماده در فیزیک چیست؟ ساختار و ویژگیها
- فیلم آموزش شیمی عمومی جامع و با مفاهیم کلیدی
آرایش الکترونی حالت پایه اتم چیست؟
برای درک این موضوع که حالت پایه اتم چیست، باید به آرایش الکترونی آن توجه کنیم. آرایش الکترونی حالت پایه اتم، آرایش الکترونی اتم در طبیعت است. این آرایش الکترونی لایه و زیرلایههای اتم را به همراه تعداد الکترون آنها مشخص میکند. آرایش الکترونی اتمها، توضیحی دقیق و جامع درباره موقعیت و چینش الکترونها در ساختار اتم را نمایش میدهد. درک ساختار الکترونی اتمها یکی از مفاهیم کلیدی در درک خواص شیمیایی اتم، رفتارهای آن و روش برهمکنش آنها با سایر اتمها است. این ساختار با قوانین مختلفی کنترل میشود.
این قوانین شامل قانون طرد پائولی، اصل هوند و اصل آفبا هستند. این قوانین نتایجی را در آرایش الکترونی اعمال میکنند که دلیل اصلی پایداری الکترونها در حالت پایه است. مجموعه این قوانین بیان میکند که هیچ دو الکترونی نمیتوانند اعداد کوانتومی برابری داشته باشند و الکترونها طبق اصل آفبا لایهها و زیرلایههای الکترونی را به ترتیب از انرژی کم به انرژی زیاد اشغال میکنند. نمایش آرایش الکترونی اتم در حالت پایه به شکل زیر است.
این نمایش بسته به تعداد الکترونهای اتم در حالت خنثی، میتواند متفاوت باشد. در تصویر زیر، آرایش الکترونی و لایههای الکترونی را برای اتم منیزیم مشاهده میکنید. هر اتم از لایهها، زیرلایهها و اوربیتالهای مختلفی تشکیل شده است.
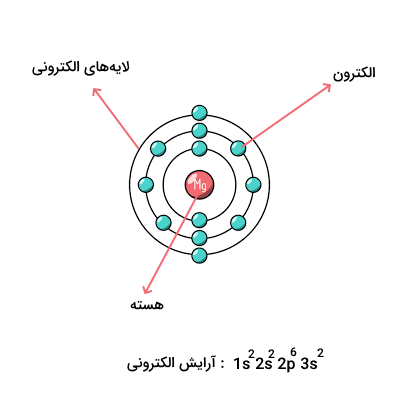
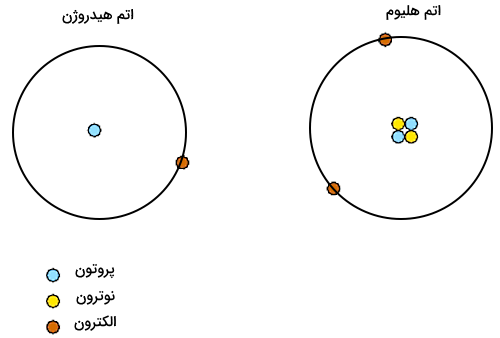
آرایش الکترونی اتم، نمایش لایهها و زیرلایههای اتم به همراه تعداد الکترونهای هریک از این زیرلایهها است. هر اتم دارای آرایش الکترونی خاصی است که در این آرایشهای الکترونی طبق اصول و قوانین مطرح شده در سطوح مختلف انرژی لایههای الکترونی را پر میکنند. برای مثال، الکترون اتم هیدروژن سطح انرژی اول را اشغال کرده و الکترونهای اتم هلیوم این سطح انرژی را پر میکنند. آرایش الکترونی اتمهای هیدروژن و هلیوم به شکل زیر است.
هیدروژن:
هلیوم:
لایههای الکترونی
لایههای الکترونی اتم با حرف انگلیسی «n» نمایش داده میشود و به آن عدد کوانتومی اصلی گفته میشود. این عدد درواقع نمایانگر فاصله الکترونها تا هسته است. برای مثال برای اینکه دریابیم حالت پایه اتم هیدروژن در کدام لایه است، کافی است تعداد لایهها و الکترونهای اتم هیدوژن را بیابیم. حالت پایه اتم هیدروژن یک الکترون و یک لایه الکترونی دارد. الکترون اتم هیدروژن در حالت پایه در لایه اول قرار دارد.
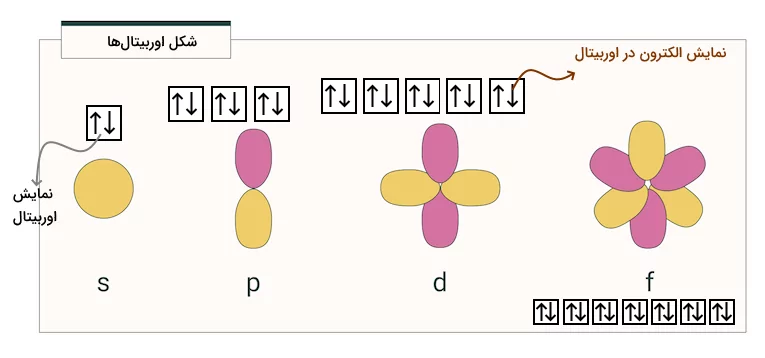
به هریک از لایههای الکترونی اتم، سطح انرژی گفته میشود. در حالت پایه، این سطوح انرژی ثابت و پایدارند. همچنین به این لایهها در حالت پایه، تراز انرژی حالت پایه نیز گفته میشود. هریک از این لایهها از زیرلایههایی (s، p، d و f) تشکیل شده است. هریک از این زیرلایهها از اوربیتالهایی تشکیل شده است و هریک از اوربیتالها ۲ الکترون را در خود جای میدهند. هریک از این اجزا، در ادامه توضیح داده میشوند.
اوربیتالها
علاوه بر اینکه الکترونهای اتم، سطوح انرژی متفاوتی دارند، این سطوح اشکال و ترتیب مشخص و منحصر به فردی نیز دارند. هر اوربیتال با ۲ الکترون اشغال میشود و بیشتر از ۲ الکترون نمیتوانند در یک اوربیتال وجود داشته باشند. برای هر عدد کوانتومی اصلی «n» یک اوربیتال «s»، سه اوربیتال «p»، پنج اوربیتال «d» و هفت اوربیتال «f» وجود دارد. بنابر این، هر زیرلایه s میتواند ۲ الکترون را در خود جای دهد. به همین ترتیب، اوربیتال p شش الکترون، اوربیتال d ده الکترون و اوربیتال f چهارده الکترون را در خود جای میدهند.
در تصویر زیر، شکل هندسی این اوربیتالها و شکل نمایش آنها را مشاهده میکنید.
نمایش اوربیتالها
برای نمایش اوربیتالهای یک اتم و شیوه جایگیری الکترونها در این اوربیتالها میتوان از نمایش نمودار ساختار الکترونی (ساختار الکترون جعبه) استفاده کرد. در این شیوه نمایش، از مربعهایی برای نمایش اوربیتالها و از فلشهایی برای نمایش الکترونها استفاده میشود. در تصویر زیر، نمایش اوربیتالهای خالی زیرلایههای لایههای شماره ۱ تا ۴ را مشاهده میکنید.
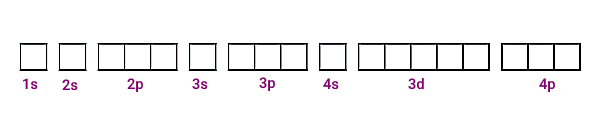
تفاوت اوربیتال و لایه الکترونی
ساختار اتم از سطوح انرژی متفاوتی تشکیل شده است که با هسته اتم فواصل مشخصی دارند. الکترونها تنها در این فواصل میتوانند وجود داشته باشند. به این سطوح انرژی، لایه الکترونی گفته میشود. هریک از این لایهها میتواند انواعی از زیرلایهها را در خود جای دهد که هریک از این زیرلایهها تعداد مشخصی اوربیتال دارد. درواقع اتمها میتوانند د راوربیتالهایی که در زیرلایهها و در لایههای الکترونی قرار دارد وجود داشته باشد.
یکی از مهمترین نکاتی که در بررسی حالت پایه اتم وجود دارد، تشخیص تفاوت بین اوربیتال و لایه الکترونی است. برای تشخیص این موضوع که حالت پایه اتم چیست، باید با روش جایگیری الکترونها در اوربیتالها و لایههای الکترونی آشنا باشیم. در حالت پایه الکترونها طبق قوانینی که توضیح دادیم لایهها و اوربیتالهای الکترونی را پر میکنند و در حالت برانگیخته الکترونها انرژی دریافت کرده و این قوانین را میشکنند. در بررسی مفهوم حالت برانگیخته و پایه اتم، مفاهیم لایه و اوربیتال تعویض پذیر هستند. الکترونها هم میتوانند در لایهها حرکت کنند هم در اوربیتالها جابهجا شوند.
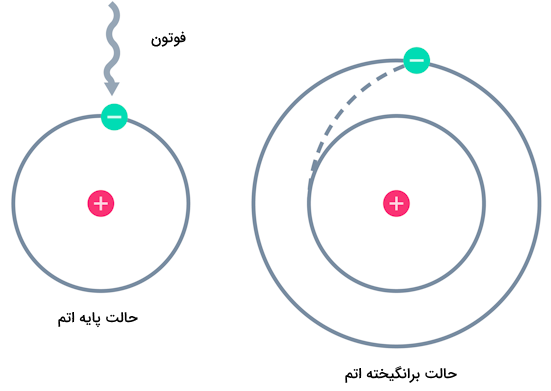
تصویر زیر، نمایش شیوه برانگیخته شدن یک الکترون در ساختار اتم را نمایش میدهد.
اتم کوچکترین ذره سازنده مواد موجود در جهان است و پایه و اساس بسیاری از فرآیندهای شیمیایی، فیزیکی و هستهای را ساختار اتم توجیه میکند. برای یادگیری بیشتر درباره ساختار اتم پیشنهاد میکنیم فیلم آموزش اتم چیست فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
آرایش الکترونی فشرده
آرایش الکترونی فشرده، آرایش الکترونی خلاصه شده اتم با علامت گاز نجیب قبل از آن است. در نمایش ساختار اتم و شیوه قرارگیری الکترونهای اتم در لایهها و زیرلایهها، فرم دیگری از آرایش الکترونی به نام آرایش الکترونی فشرده نیز رسم میشود. این آرایش الکترونی بیشتر برای اتمهایی با عدد اتمی بالا استفاده میشود که نوشتن آرایش الکترونی باز آنها طولانی و وقتگیر خواهد بود. به این شیوه نمایش، ساختار الکترونی فشرده یا ساختار الکترونی گاز نجیب گفته میشود. در این شیوه نمایش، طبق مراحل زیر میتوان ساختار الکترونی را نوشت.
- ابتدا محل قرارگیری عنصر را در جدول تناوبی پیدا کرده و تعداد الکترونهای آن را به دست میآوریم.
- اتم گاز نجیبی که در دوره قبل از عنصر وجود دارد را مشخص میکنیم.
- با توجه به محل قرار گیری گاز نجیب و تعداد الکترون آن، نماد شیمیایی گاز نجیب را در دو علامت براکت نشان داده و سپس باقی ساختار آرایش الکترونی اتم را مینویسیسم.
برای درک بهتر و راحتتر نوشتن آرایش الکترونی فشرده باید به دو نکته توجه داشت.
- در ساختار الکترونی گازهای نجیب، آخرین لایه اتمی، لایهای است که عدد کوانتومی اصلی آن، برابر با شماره ردیف گاز نجیب است.
- آرایش الکترونی گاز نجیب همواره به ختم میشود.
برای مثال، آرایش الکترونی اتم نئون با ۱۰ الکترون و در ردیف دوم جدول تناوبی به و آرایش الکترونی گاز ارگون با ۱۸ الکترون و در ردیف سوم به ختم میشود.
با دانستن این نکات به راحتی میتوانیم باقی آرایش الکترونی را پس از نماد گاز نجیب، ادامه دهیم. برای مثال، آرایش الکترونی اتم سدیم در ردیف سوم، به شکل زیر نوشته میشود.
در تصویر زیر این شیوه نوشتن آرایش الکترونی را مشاهده میکنید.
مثال آرایش الکترونی فشرده
آرایش الکترونی فشرده را برای اتمهای گوگرد، برلیم و سزیم بنویسید.
پاسخ
آرایش الکترونی فشرده برای اتمهای خواسته شده به شکل زیر نوشته میشود.
اصول آرایش الکترونی حالت پایه اتم
نمایش اوربیتالها و الکترونها به ما کمک میکند دریابیم حالت برانگیخته و حالت پایه اتم چیست. در پر کردن اوربیتالهای الکترونی اتم در حالت پایه، سه قانون کلی وجود دارد. این قوانین به شرح زیر هستند.
- اصل آفبا
- قانون هوند
- اصل طرد پائولی
این قوانین در ادامه توضیح داده شدهاند.
اصل آفبا
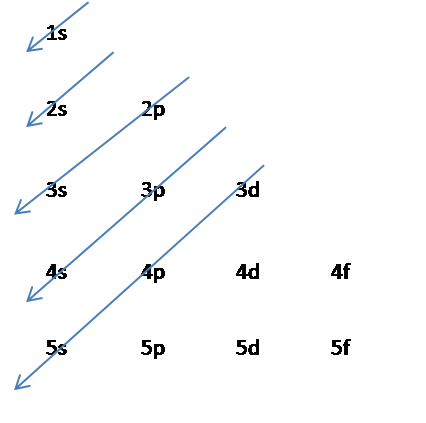
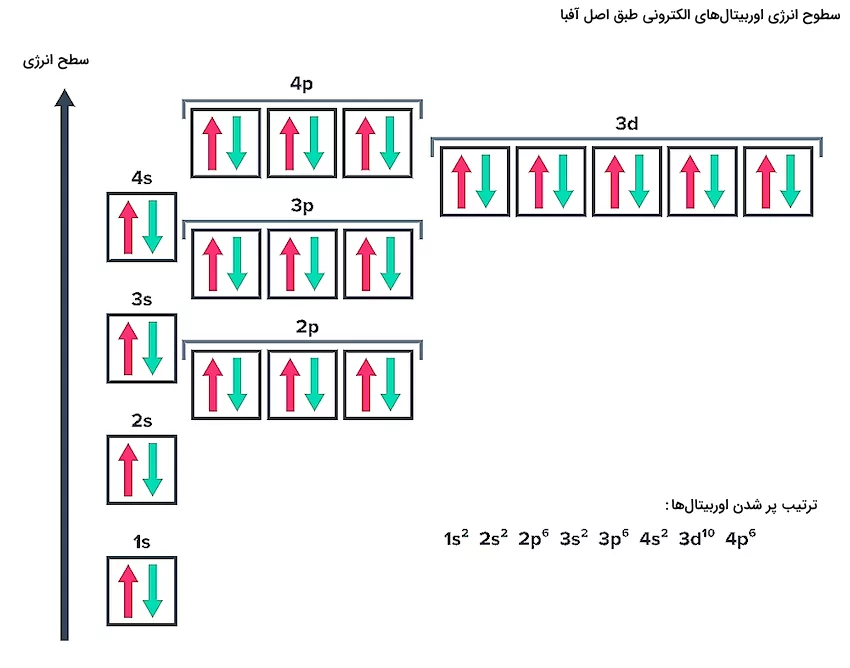
قانون آفبا بیان میکند که الکترونها همواره تمایل دارند اوربیتالهایی که پایینترین سطح انرژی ممکن را دارند اشغال کنند. طبق این قانون الکترونها به ترتیب انرژی از کم به زیاد لایهها و زیرلایههای الکترونی را اشغال میکنند. تصویر زیر نشاندهنده جهت و ترتیب جایگیری الکترونها در لایهها و زیرلایههای مختلف طبق اصل آفبا است.
با استفاده از این الگو طبق اصل آفبا، الکترونها از پایینترین سطح انرژی اوربیتالها و لایههای الکترونی را اشغال میکنند. این ترتیب در تصویر بالا با فلش نشان داده شده است. الکترونها ابتدا زیرلایه 1s سپس 2s و 2p سپس 3s و 3p و 4s و 3d و ... به همین ترتیب اشغال میکنند. ترتیب پر شدن لایهها و زیرلایهها طبق اصل آفبا به شکل زیر است.
برخی از اتمها از اصل آفبا پیروی نمیکنند. این پدیده خصوصا زمانی اتفاق میافتد که پایداری بیشتری با تشکیل اوربیتال d نیمهپر برای اتمها رقم میخورد. این بدان معنا است که اتم در حالتی که لایه d پر یا نیمهپر داشته باشد، پایدارتر از حالتی است که از اصل آفبا پیروی کند. برای مثال اگر ۴ یا ۹ الکترون در اوربیتال d وجود داشته باشد، یک الکترون از اوربیتال s لایه بعدی به اوربیتال d منتقل میشود تا اتم به حالت پایدارتری دست پیدا کند.
برای درک بهتر این موضوع، به آرایش الکترونی اتم کروم دقت کنید. در حالتی که این اتم در آرایش الکترونی از اصل آفبا پیروی کند، آرایش الکترونی آن به شکل زیر خواهد بود.
اما در حالت پایه اتم کروم، آرایش الکترونی به شکل زیر است. این تفاوت به این علت است که اوربیتال d با ۵ یا ۱۰ الکترون، پایدارتر از اوربیتال d با ۴ یا ۹ الکترون است.
اصل طرد پائولی
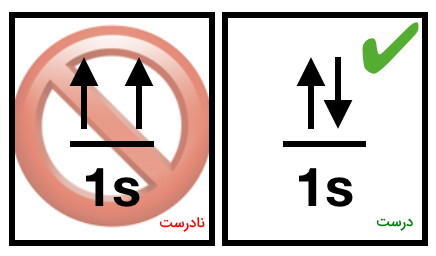
اصل طرد پائولی بیان میکند که در هر اوربیتال تنها دو الکترون میتواند وجود داشته باشد. طبق این اصل، این دو الکترون باید با چرخشهای مخالف هم در یک اوربیتال قرار بگیرند تا به یکدیگر دافعهای وارد نکنند. قانون طرد پائولی در واقع بیان میکند که هیچ دو الکترونی در اتم نمیتوانند اعداد کوانتومی کاملا مشابهی داشته باشند و حداقل اسپین آنها باید خلاف جهت یکدیگر باشد.
قانون پائولی بیان میکند که غیر ممکن است دو الکترون با اعداد کوانتومی کاملا یکسان در یک اتم وجود داشته باشد. دو الکترون در یک اوربیتال مجموعهای از اعداد کوانتومی اصلی، فرعی، مغناطیسی و مغناطیسی هسته دارند. سه عدد کوانتومی اول برای الکترونهای یک اوربیتال مشخص در یک زیرلایه برابر است پس باید عدد کوانتومی مغناطیسی اسپین هسته متفاوتی داشته باشند. الکترونها میتوانند عدد کوانتومی مغناطیسی برابر ۱/۲+ یا ۱/۲- داشته باشند. هنگام رسم ساختار الکترونی باید به قانون طرد پائولی نیز توجه شود. شیوه صحیح و نادرست رسم الکترون طبق این اصل در تصویر زیر نمایش داده شده است.
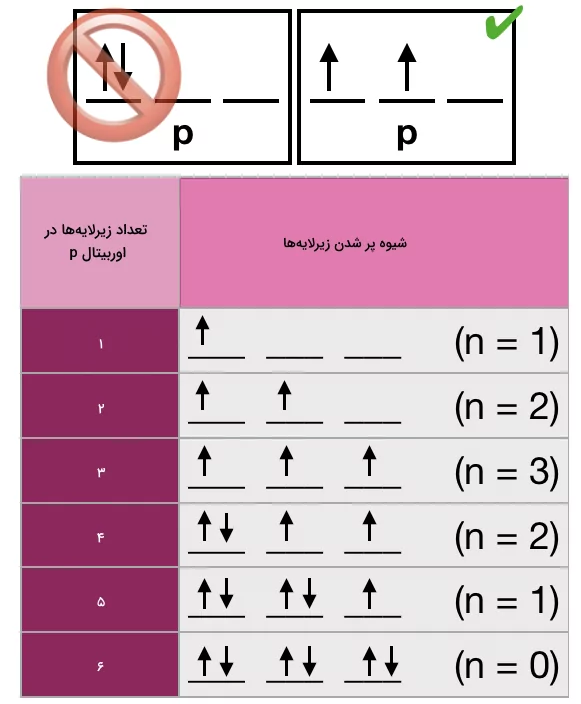
قانون هوند
این قانون بیان میکند که الکترونها ابتدا اوربیتالها و زیرلایهها را به صورت مجزا پر میکنند. پس از نیمهپر شدن اوربیتالهای زیرلایهها، الکترونهای باقی مانده فضای خالی دوم اوربیتالها را پر میکنند و با الکترونهای قبلی جفت میشوند.
شیوهای که در آن الکترونها در طبیعت اوربیتالهای الکترونی را پر میکنند همان حالت پایه اتم است. قانون هوند یکی از قوانین مهم در بررسی حالت پایه اتم و آرایش الکترونی حالت پایه اتم است.
در حالت پایه اتم، مجموع انرژی الکترونها در کمترین حالت ممکن قرار دارد. این انرژی بجز با جابهجا شدن یک یا تعداد بیشتری الکترون به اوربیتالهای دیگر تغییر میکند. برای مثال به آرایش الکترونی اتم کربن در حالت پایه با ۶ الکترون توجه کنید.
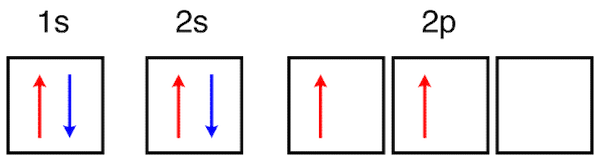
در این حالت آرایش الکترونی، مجموع انرژی الکترونهای اتم کربن در کمترین حالت خود قرار دارد. با جابهجا شدن یک یا تعداد بیشتری الکترون و رفتن آنها به اوربیتالهای دیگر (برای مثال اوربیتال 3s) این اتم به حالت برانگیخته تبدیل میشود. به الکترونهایی که انرژی دریافت کرده و جابهجا شدهاند، الکترون برانگیخته گفته میشود.
قانون هوند بر پایه بررسی طیف اتم اتمهای مختلف بنا شده است. در این بررسیها میزان انرژی لازم برای جفت کردن دو الکترون در یک اوربیتال اندازهگیری شده است. سپس مشخص شده است که این الکترونها در حالت طبیعی ابتدا تمامی اوربیتالهای یک زیرلایه را پر کرده و سپس جفت میشوند. یک تعریف ساده از قانون هوند به این شکل است که آرایش الکترونی اتمها با کمترین انرژی به شکلی است که بیشترین تعداد الکترون جفت نشده را داشته باشند. برای برقرار بودن این قانون در رسم آرایشهای الکترونی کافی است در هر زیرلایه نگذاریم هنگامی که اوربیتال خالی داریم، باقی اوربیتالها الکترون جفت شده داشته باشند. این قانون در تصویر زیر برای اوربیتال p بیان شده است.
مثال آرایش الکترونی پایه
آرایش الکترونی حالت پایه را برای اتمهای زیر بنویسید.
مثال ۱
اتم کلر
پاسخ
اتم کلر ۱۷ عدد الکترون دارد. آرایش الکترونی آن طبق اصل آفبا به شکل زیر است.
مثال ۲
اتم مس
پاسخ
اتم مس ۲۹ عدد الکترون ظرفیت و آرایشی نزدیک با لایه پر دارد. آرایش الکترونی حالت پایه آن به شکل زیر نوشته میشود.
چگونه حالت پایه اتم را نشان دهیم؟
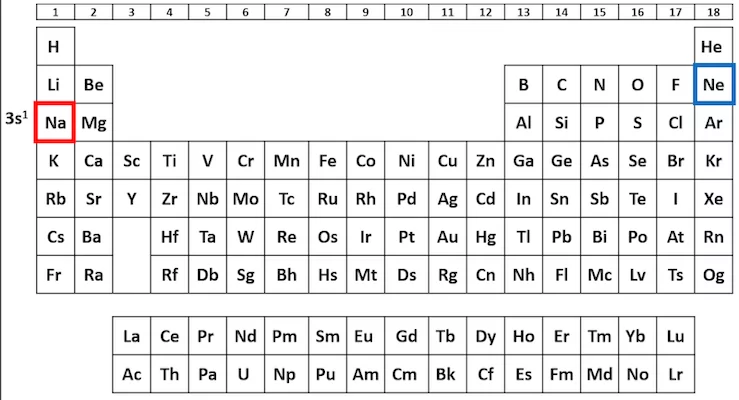
حالت پایه اتم با فرم آرایش الکترونی که اتم در طبیعت وجود دارد نوشته میشود. در نوشتن آرایش الکترونی اتمها، از عدد کوانتومی اصلی «n» اsتفاده میشود. سپس اوربیتالهای s، p، d و f نوشته شده و در آخر تعداد الکترونهای هر زیرلایه به شکل نمادی بالای علامت زیرلایه نوشته میشود. در نوشتن آرایش الکترونی اتمها ابتدا باید تعداد الکترون اتم را پیدا کنیم. تعداد الکترون اتمها با استفاده از جدول تناوبی و با توجه به عدد اتمی آنها مشخص میشود. عدد اتمی اتمها نشان دهنده تعداد الکترونها و پروتونهای آن اتم است. هر اتم تعداد برابری الکترون و پروتون دارد. اگر اتمی الکترونی از دست بدهد یون مثبت (کاتیون) و اگر الکترون دریافت کند یون منفی (آنیون) تشکیل میدهد.
پس از پیدا کردن تعداد الکترونهای اتم، طبق اصل آفبا لایهها و زیرلایهها و تعداد الکترونها را تا جایی مینویسیم که تمامی الکترونهای اتم در زیرلایهها و لایهها نوشته شده باشند. برای مثال اتم سدیم ۱۱ الکترون دارد. با شروع از لایه اول و اوربیتال s دو الکترون این اتم، سپس لایه دوم و اوربیتالهای s و p، نه عدد الکترون این اتم نوشته میشوند. تا اینجا ۱۰ الکترون این اتم نوشته شدهاند. در قدم بعدی تک الکترون باقی مانده در لایه و زیرلایه بعدی یعنی 3s قرار میگیرد. در نهایت آرایش الکترونی حالت پایه اتم سدیم به شکل زیر نوشته میشود.
در مرحله آخر باید حتما چک کنیم که زیرلایهای با آرایش نزدیک به آرایش پر یا نیمهپر نداشته باشیم. برای تمرین بیشتر، آرایش الکترونی حالت پایه اتم کروم را بنویسید.
پاسخ
برای نگارش آرایش الکترونی حالت پایه اتم کروم، ابتدا باید تعداد الکترونهای آن را بیابیم. عدد اتمی اتم کروم ۲۴ است. این بدان معنا است که اتم کروم ۲۴ الکترون دارد. این ۲۴ الکترون به ترتیب تا زیرلایه 3d را پر میکنند. دو الکترون بعدی زیرلایه 4s و ۴ الکترون بعدی زیرلایه 3d را اشغال خواهند کرد.
در آخرین مرحله باید چک کنیم که زیرلایهای آرایشی نزدیک به نیمهپر یا پر را نداشته باشد. در این مورد، لایه 3d دارای ۴ الکترون است که آرایش نزدیک به نیمهپر است. پس یکی از الکترونهای لایه 4s باید به زیرلایه 3d منتقل شود. در نهایت، آرایش الکترونی حالت پایه کروم به شکل زیر نوشته میشود.
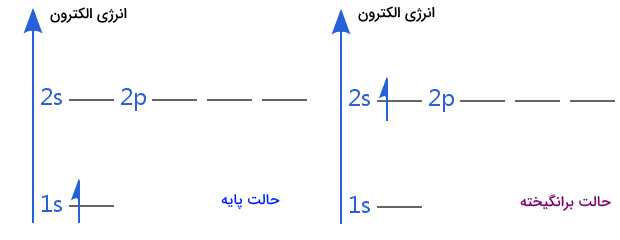
بیشتر اتمها در دمای اتاق در حالت پایه خود هستند. الکترونهای اتم در حالت پایه در کمترین حالت انرژی خود هستند. برای انتقال الکترون به حالت برانگیخته به انرژی بیرونی نیاز است. در تصویر زیر، حالت پایه و برانگیخته الکترون اتم هیدروژن را مشاهده میکنید.
در نمودار شکل سمت راست، الکترون اتم هیدروژن در زیرلایه ای با سطح انرژی بالاتر قرار دارد. در نتیجه اتم هیدروژن دیگر در حالت پایه خود قرار ندارد. اگر به این الکترون انرژی بیشتری بدهیم حتی میتواند به لایهها و زیرلایههای بالاتر نیز برود.
الکترونها در حالت برانگیخته میتوانند دوباره به حالت پایه اتم بازگردند. این بازگشت به حالت پایه با آزاد کردن انرژی همراه خواهد بود. این انرژی به شکل امواج الکترومغناطیسی آزاد میشود و میتواند طول موجی بین فرابنفش تا مرئی داشته باشد. اگر انرژی ارتعاشی الکترونها از دست برود، نور آزاد شده طول موجی در محدوده مادون قرمز خواهد داشت. اگر انرژی آزاد شده مربوط به چرخش الکترونها باشد، طول موجی در محدوده امواج ماکروویو دارد.
مثال نمایش حالت پایه اتم
آرایش الکترونی حالت پایه اتمهای زیر را نوشته و سپس اوربیتالهای آنها را رسم کنید.
مثال ۱
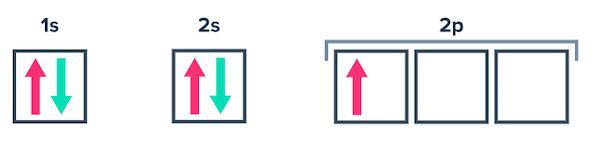
اتم بور
پاسخ
اتم بور ۵ الکترون دارد و آرایش الکترونی آن به شکل زیر نوشته میشود.
نمودار آرایش الکترونی آن به شکل زیر رسم میشود.
مثال ۲
اتم کربن
پاسخ
اتم کربن ۶ الکترون دارد و آرایش الکترونی آن به شکل زیر نوشته میشود.
نمودار آرایش الکترونی اتم کربن در حالت پایه به شکل زیر رسم میشود.

مثال ۳
اتم نیتروژن
پاسخ
اتم نیتروژن ۷ الکترون دارد و آرایش الکترونی حالت پایه آن به شکل زیر نوشته میشود.
نمودار آرایش الکترونی حالت پایه این اتم به شکل زیر رسم میشود.

مثال ۴
اتم اکسیژن
پاسخ
اتم اکسیژن ۸ الکترون دارد و آرایش الکترونی حالت پایه آن به شکل زیر نوشته میشود.
نمودرا آرایش الکترونی حالت پایه اتم اکسیژن به شکل زیر رسم میشود.

مثال ۵
بدون نگاه کردن به جدول تناوبی، آرایش الکترونی باز، فشرده و نمودار جعبهای الکترونها را برای اتمهایی با عدد اتمی ۱۹، ۲۲ و ۳۰ بنویسید و رسم کنید.
پاسخ
با توجه به عدد اتمی ارائه شده توسط صورت سوال، آرایش الکترونی را طبق اصل آفبا رسم کرده و سپس طبق اصول هوند و طرد پائولی، نمودار جعبه ای ساختار الکترونی را رسم میکنیم.
عدد اتمی ۱۹ بدین معنا است که اتم ۱۹ الکترون درارد. آرایش الکترونی حالت پایه طبق اصل آفبا به شکل زیر نوشته میشود.
نمودار جعبهای آرایش الکترونی این اتم طبق اصول هوند و طرد پائولی به شکل زیر رسم میشود.
عدد اتمی ۲۲ بدین معنا است که این اتم ۲۲ الکترون دارد. آرایش الکترونی حالت پایه این اتم طبق اصل آفبا به شکل زیر نوشته میشود.
نمودار جعبه ای آرایش الکترونی این اتم طبق اصول هوند و طرد پائولی به شکل زیر رسم خواهد شد.
عدد اتمی ۳۰ بدین معنا است که این اتم ۳۰ الکترون در ساختار اتمی خود دارد. نمایش آرایش الکترونی این اتم طبق اصل آفبا به شکل زیر نوشته میشود.
نمودار جعبهای آرایش الکترونی این اتم، طبق اصول هوند و طرد پائولی به شکل زیر نوشته میشود.
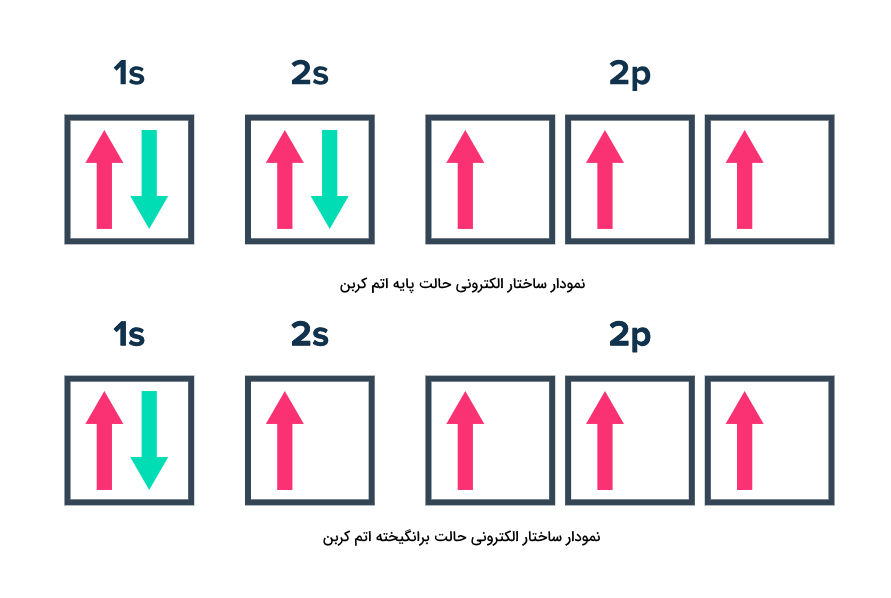
تفاوت حالت پایه و برانگیخته اتم
در حالت پایه، الکترونهای اتم در کمترین حالت انرژی خود قرار دارند. در این حالت، الکترونها طبق اصول آفبا، هوند و پائولی، اوربیتالها و لایههای الکترونی را پر میکنند. اتمها اگر برانگیخته شوند، الکترونهای آنها از حالت پایه خارج شده و دیگر طبق اصول یاد شده اوربیتالهای الکترونی را اشغال نمیکنند. برای درک بهتر این موضوع که تفاوت حالت برانگیخته با حالت پایه اتم چیست، به تصویر زیر توجه کنید.
با توجه به آرایش الکترونی حالت پایه اتم کربن، متوجه میشویم که در این حالت الکترونها از تمامی قوانین آفبا، هوند و پائولی پیروی میکنند. هیچ دو الکترونی در یک جهت نیستند و اوربیتالها به ترتیب پر و جفت شدهاند.
اما با توجه به آرایش الکترونی برانگیخته اتم کربن متوجه میشوید که یکی از الکترونهای زیرلایه 2s از اوربیتال خارج شده و باعث شده است اصل آفبا و هوند برهم بخورد. اوربیتال 2s در حالی که یک الکترون تک جفت نشده دارد، زیرلایه بعدی آن، یعنی زیرلایه 2p پر شده است. الکترون جدا شده از زیرلایه 2s میتواند به هریک از زیرلایهها و لایههای بعدی مانند 3s یا 3p منتقل شده باشد.
در تصویر زیر، نمودار نمایش آرایش الکترونی را تا لایه چهارم مشاهده میکنید. با توجه به این شکل و الگوی انرژی و اوربیتالهای آن میتوانید راحتتر تشخیص دهید که یک اتم در حالت برانگیته ایا حالت پایه اتم قرار دارد.
مدل کوانتومی اتم
حالت پایه آرایش الکترونی اتمها یکی از اصول پایه برای درک پیوندهای مولکولی، ویژگیها و ساختار اتمها و مولکولها است. مطالعه حالت پایه اتم در بسیاری از مباحث مانند ساختار الکترونها در اتم، انرژی اتمها، اوربیتالهای مختلف و ... اطلاعات مهمی را ارائه کرده است.
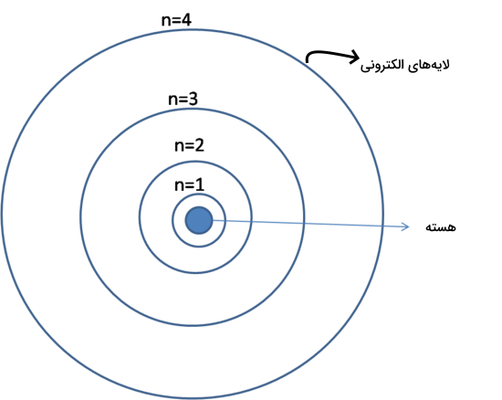
نیلز بور «Niels Bohr» بیان کرد که الکترونها میتوانند در فواصل مشخصی نسبت به هسته اتم وجود داشته باشند و حرکت کنند. این الکترونها در این فواصل باقی میمانند و به هسته اتم نمیچسبند. هر مدار الکترونی اطراف هسته اتم، انرژی خاص خود را دارد. او بیان کرد که اتم ساختاری مانند شکل زیر دارد که در آن هسته اتم به شکلی کوچک و فشرده از پروتونها و نورتونها در مرکز قرار دارد و الکترونها با فواصل مشخص در مدارهایی که به نام لایههای الکترونی شناخته شدند، اطراف هسته در گردش هستند. این لایهها و سطوح الکترونی با حرف انگلیسی «n» نمایش داده میشوند.
در قسمتهای قبل راجع به مدل اتمی بور و لایههای الکترونی توضیح دادیم. الکترونها طبق این مدل در لایههایی با فاصله مشخص از هسته اتم در حال حرکت و چرخش هستند. این مدل اتمی درواقع از بررسی طیف نشری خطی اتمها به دست آمده است. الکترونهای پایه، در صورت برانگیخته شدن، به لایههای الکترونی بالاتر رفته و پس از مدتی دوباره به حالت پایه باز خواهند گشت. این بازگشت الکترونها به حالت پایه با آزادسازی انرژی به صورت امواج الکترومغناطیسی یا نور با طول موجهای مشخص خواهد بود. در اثر برانگیخته کردن اتمهای مختلف و سپس بازگشت آنها به حالت پایه، برای هر اتم یک طیف نشری یا جذبی مشخص به دست میآید که مانند اثر انگشت آن اتم و منحصر به فرد است.
برای مثال طیف جذبی اتم هیدروژن در تصویر زیر نمایش داده شده است.

مدل اتمی بور با وجود اینکه برای تعیین ساختار الکترونی اتمهای پیچیدهتر با تعداد الکترون و زیرلایههای بیشتر کاربردی نداشت. اما زیمنه کشف ساختار دقیقتر اتم و الکترونها به وسیله دانشمندانی چون بروگلی «Broglie» و شرودینگر «Schrödinger» شد. این ساختار را مدل کوانتومی اتم میگویند.
هم ارزی حالت پایه اتم چیست؟
اگر بیش از یک حالت پایه برای یک اتم وجود داشته باشد، حالتهای پایه همارز به وجود میآیند. در این حالتها، الکترونها معمولا زیرلایههای پرنشده دارند و به همین علت الکترونها میتوانند عدد کوانتومی مغناطیسی یا عدد کوانتومی اسپین هسته متفاوت داشته باشند. در پدید آمدن حالتهای پایه همارز، اعداد کوانتومی ml و ms حائز اهمیت هستند. در اوربیتالهای موجود در یک زیرلایه یک لایه اتمی، این اعداد کوانتومی انرژی برابری خواهند داشت. برای درک بهتر این موضوع به تصویر زیر توجه کنید.
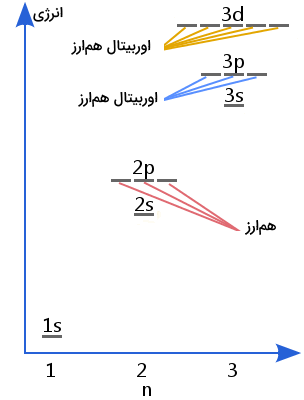
اوربیتالهای 2p در شکل بالا از یک انرژی برخوردارند. بنابراین، اگر ۵ الکترون در این زیرلایه داشته باشیم، میتواند ۳ حالت پایه همارز داشته باشد. همچنین برای باقی زیرلایههای چند اوربیتالی مانند 3p و 3d و به همین ترتیب زیرلایههای بالاتر نیز به همین منوال است.
اهمیت حالت پایه اتم
درک این موضوع که حالت پایه اتم چیست و چه آرایشی دارد، پایه درک بسیاری از مباحث مهم شیمیایی است. درک حالت پایه اتم و مطالعه آن به بررسی مباحثی چون برهمکنش اتمها و مولکولها و چگونگی انجام واکنشهای شیمیایی کمک میکند. حالت پایه اتم حالتی است که الکترونهای اتم تحت هیچ انرژی خارجی قرار نگرفتهاند و بررسی آن در درک برهمکنش بین اتمها بسیار مهم است. همچنین، آموختن این موضوع که حالت پایه اتم چیست، به درک بهتر ساختار الکترونی اتم و بررسی خواص دورهای مواد در جدول تناوبی عناصر، پیوندهای شیمیایی و ویژگیهای عناصر و ترکیبات، کمک شایانی میکند.
خواص عناصر به آرایش الکترونی حالت آنها وابسته است و با تعییر عدد اتمی عناصر، این خواص نیز به شکلی منظم تغییر میکنند. به همین علت قانونی به نام قانون دورهای عناصر بر جدول تناوبی حاکم است. برای یادگیری بیشتر درباره این مبحث، پیشنهاد میکنیم مطلب زیر از مجله فرادرس را مطالعه کنید.
یادگیری شیمی عمومی با فرادرس
شیمی یکی از علوم مهم و پایه است که در مقاطع دوره متوسطه تدریس شده و در مقاطع بالاتر دانشگاهی، پایه و اساس بسیاری از فرآیندها و واکنشهای شیمیایی را توضیح میدهد. در شیمی عمومی دانشجویان با مباحثی چون ساختار اتم، تاریخچه کشف اتم، مدل اتمی بور و نظریه شرودینگر و .. آشنا شده و مفاهیم مربوط به آنها را میآموزند. پیشنهاد میکنیم برای یادگیری بیشتر درباره مباحث شیمی عمومی به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورهده شده است میتوانید به آموزشهای بیشتری در زمینه شیمی عمومی دسترسی داشته باشید.
فیلم آموزش شیمی عمومی جامع و با مفاهیم کلیدی
فیلم آموزش محلول سازی در آزمایشگاه
فیلم آموزش شیمی عمومی ۲ جامع و کاربردی
جمعبندی
در این مطلب از مجله فرادرس آموختیم حالت پایه اتم چیست و چه تفاوتی با حالت برانگیخته اتم دارد. حالت پایه اتم شاره به اتمی دارد که برانگیخته نشده باشد. برانگیخته شدن یک اتم زمانی اتفاق میافتد که الکترونهای آن اتم به لایهها و زیرلایههایی با انرژی بالاتر بروند. حالت پایه یا برانگیخته اتم را میتوان با توجه به آرایش الکترونی و رسم آن تشخیص داد. حالت الکترونی پایه یا برانگیخته اتم را با استفاده از ۳ قانون آفبا، پائولی و هوند میتوان تعیین کرد.