مدل اتمی رادرفورد — به زبان ساده

همانطور که احتمالا میدانید، ساختمان یک اتم، شاملِ الکترونها، پروتونها و نوترونها هستند. این تصور از اتم، پس از ارائه مدلهای اتمی مختلف در طول تاریخ بدست آمده است. مدل کلاسیکِ ساختار اتم توسط ارنست رادرفورد ارائه شد. این مدل تحت عنوان «مدل اتمی رادرفورد» (Rutherford atomic model) شناخته میشود. اگرچه مدل مذکور، پیشبینی کاملا درستی را از ساختار اتم ارائه نمیدهد، اما در سالهای بعد توانست در درک درست ساختمانِ اتم بسیار کمککننده باشد.
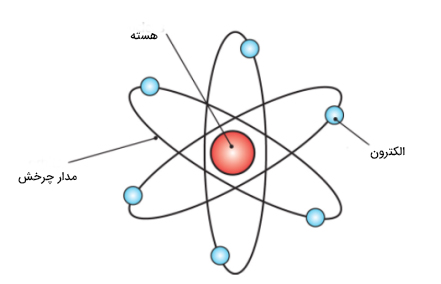
مدل اتمی رادرفورد
رادرفورد، اتم را بهصورت ناحیهای با فضایی خالی تصور کرد که در آن الکترونها به دور هستههایی مثبت در حال دوران هستند. همچنین او این تصور را داشت که مسیرهای الکترونها نیز قابل پیشبینی هستند. در ادامه تصویری از مدل اتمی رادرفورد نشان داده شده است.
مدل اتمی ارائه شده توسط رادرفورد
تاریخچه
مفهوم اتم به ۴۰۰ سال پیش از میلاد بر میگردد. در آن زمان این «دموکریت» (Democritus)، دانشمند یونانی بود که برای اولین بار مفهوم اتم را مطرح کرد. پس از آن و در سال ۱۸۰۳ «جان دالتون» (John Dalton) مدلی متفاوت از ساختار اتم را ارائه کرد. در آن زمان اتم، مفهومی تقسیمناپذیر تلقی میشد. در حقیقت تصور میشد که اتم، کوچکترین ساختمانِ سازنده ماده در جهان است. فرض تقسیمناپذیری اتم تا زمان «جوزف جان تامسون» (Joseph John Thomson) در سال ۱۸۹۷ ادامه پیدا کرد. او ذراتی با بار منفی در اتم را کشف کرد که بعدها آن را الکترون نامید. تامسون مدلی از اتم را ارائه داد که در آن الکترونها به صورتی یکنواخت در بستری از بارهای مثبت پخش شدهاند.
اولین آزمایشی که نقایص مدل اتمی تامسون را روشن کرد، توسط دانشمندی نیوزیلندی به نام «ارنست رادرفورد» (Ernest Rutherford) انجام شد. او صفحهای نازک از اتمهای طلا را با استفاده از پرتوهای آلفا بمباران کرد. رادرفورد به همراه دانشجویانش، مسیر ذرات آلفا را پس از برخورد به صفحه طلا مورد بررسی قرار دادند.
آزمایش رادرفورد
در آزمایش رادرفورد، صفحهای از طلا به ضخامتِ ۱۰۰nm بوسیله ذرات α بمباران شد. هدف اصلی از انجام این آزمایش، مطالعه مسیر ذرات آلفا پس از برخورد به صفحه طلا بود. برای بررسی مسیر انحراف ذرات، رادرفورد صفحهای از جنس روی سولفید را در پشت صفحه طلا قرار داد تا محل برخورد ذراتِ آلفا را مشاهده کند. مشاهدات، خلافِ مدل اتمی تامسون را نشان میداد. در شکل زیر نحوه انجام آزمایش نشان داده شده است.
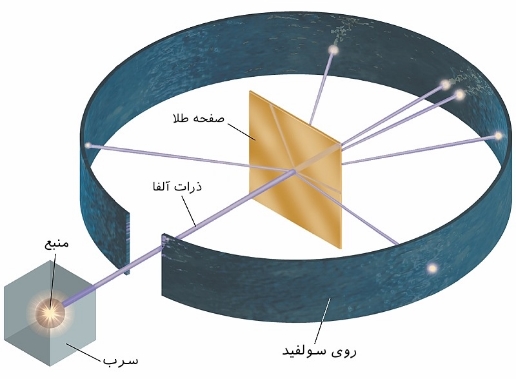
با توجه به محل برخورد ذرات آلفا، رادرفورد نتیجهگیریهای زیر را انجام داد:
- بیشترین بخش از اتم را فضای خالی تشکیل میدهد چرا که اکثرِ ذراتِ آلفا بدون تغییر مسیر، از اتمهای طلا عبور کردهاند.
- بخش مثبتِ تشکیل دهنده اتم، به شکلی یکنواخت توزیع نشده و تعداد کمِ ذرات منحرف شده، نشان میدهند که این بخش در فضایی بسیار کوچک متمرکز شده است.
- تعداد بسیار اندکی از ذرات با زاویه ۱۸۰ درجه و یا با زوایای بالا منحرف شدهاند؛ بنابراین بخش باردار اتم نسبت به فضای خالی اتم، حجم بسیار کمتری را اشغال کرده است.
رادرفورد با توجه به مشاهداتش، بهمنظور ارائه مدل اتمی خود، فرضیاتِ زیر را در نظر گرفت:
- یک اتم، ترکیبی از بارهای مثبت است. بخش بسیاری از جرمِ اتم در فضایی بسیار اندک متمرکز شده. این بخش از اتم، هسته نامیده میشود. بعدها معلوم شد که بخش چگال اتم یا همان هسته از پروتونها و نوترونها تشکیل شدهاند.
- هسته مثبت اتمها، توسط بارهایی منفی احاطه شدهاند که آنها را الکترون مینامند. الکترونها در مسیرهای دایرهای و ثابت در اطراف هسته، با سرعت زیاد در حال چرخش هستند. این مسیرهای ثابت را مدار مینامند.
- یک اتم دارای بار خالص مثبت یا منفی نیست و مجموع بار منفی الکترونها برابر با بارِ مثبت هسته است. نیروی الکترواستاتیکی قوی، الکترونها و هسته را در کنار یکدیگر نگه داشته.
- حجم هسته یک اتم در مقابل کل فضای اتم بسیار اندک است.
توجه داشته باشید که مدل اتمی رادرفورد نیز دارای محدودیتهایی است. در ادامه مهمترینِ این محدودیتها بیان شدهاند:
- مدل اتمی رادرفورد نمیتواند توجیهی برای پایداریِ اتم ارائه دهد. طبق فرضیات رادرفورد، الکترونها در مسیرهایی ثابت، با سرعتی بسیار بالا در اطراف هسته اتم دوران میکنند. این در حالی است که ماکسول نشان داد که ذرات باردار شتابگرفته، موج الکترومغناطیسی از خود ساطع میکنند. از این رو الکترونها نیز باید میدان الکترومغناطیسی از خودشان ساطع کنند.
- تابش الکترومغناطیسی منجر به از دست رفتن انرژی الکترونها میشود، در نتیجه پس از گذشت مدت زمانی، انرژی الکترونها به کلی از دست رفته و آنها روی هسته اتم می افتند. طبق معادلات ماکسول، هر اتم تنها ۰.۰۰۰۰۰۰۰۱ ثانیه میتواند پایدار باشد.
- نظریه رادرفورد از این منظر کامل نیست چون هیچ توصیفی از شکل مدارهای الکترون و نحوه حرکت آنها را ارائه نمیدهد.
همانند آنچه که در ابتدای متن نیز ذکر شد، هرچند مدل اتمی رادرفورد دارای محدودیتهایی است، اما این مدل، زمینه شناخت بهتر اتم در سالهای بعد و ایجاد مکانیک کوانتومی را فرآهم کرد.
در صورت علاقهمندی به مباحث مرتبط در زمینه فیزیک، آموزشهای زیر نیز به شما پیشنهاد میشوند:











خیلی مطلب مفیدی بود واقعا ممنون
سلام. من دانشجو ترم یک هستم. مطالب شما، درک دروس را برایم ساده میکند. تشکر میکنم. تدریس در دانشگاه ها باید به روز شود و از اسلاید و نمایش فیلم آموزشی بهره ببرند.
خیلی خوب است.
سلام ممنون از کار خوبتون.فقط ی اشکال،تو شکلی که برا مدل اتمی رادرفورد گذاشتین،نوترون هم قرار دادین،تا اون موقع هنوز نوترون کشف نشده بودش.
با سلام،
تصویر موردنظر اصلاح شد،
با تشکر از همراهی شما با مجله فرادرس