کایرالیته چیست؟ – به زبان ساده + تعریف و مثال
کایرالیته مفهومی کاربردی و بسیار مهم در «شیمی آلی» (Organic Chemistry) به حساب میآيد. این ویژگی به مولکولهایی نسبت داده میشود که دارای تصویر آينهای انطباقناپذیر بر خود باشند. در این مطلب از مجله فرادرس میخواهیم کمی بیشتر با کایرالیته و مفاهیم مرتبط با آن آشنا شویم. همچنین در ادامه با بررسی تعدادی مثال، نحوه تشخیص مولکولهایی با ویژگی کایرالیته را مورد بررسی قرار میدهیم.
- ویژگیهای کایرالیته و نقش آن در شیمی آلی را میآموزید.
- انواع ایزومرهای فضایی و ویژگیهای هریک را یاد میگیرید.
- نحوه شناسایی مراکز کایرال را به صورت عملی خواهید آموخت.
- با شیوه پیکربندی «R/S» و قواعد آن آشنا میشوید.
- تفاوت میان انانتیومر، دیاسترومر و ترکیبات مزو را در مییابید.
- تکنیکهای تشخیص مخلوط راسمیک و تأثیرات آن در خواص مواد را یاد میگیرید.


کایرالیته چیست؟
«کایرالیته» (Chirality) مفهومی است که برای توصیف مولکولهایی با تصویر آينهای و انطباقناپذیر به کار میرود. در واقع زمانی که به مولکولی کایرال بودن را نسبت میدهیم، منظور این است که تصویر آينهای آن با خودش یکسان نیست.
شیمی فضایی چیست؟
«شیمی فضایی» (Stereochemistry) زیرشاخهای از علم شیمی و شامل مطالعه آرایش فضایی نسبی اتمهای تشکیل دهنده مولکولها میشود. شیمی فضایی به مطالعه رابطه بین ایزومرهای فضایی متفاوت میپردازد که دارای فرمول مولکولی یکسان و پیوندهای شیمیایی یکسان اما جهتگیری هندسی متفاوت در فضا هستند. از شیمی فضایی با عنوان شیمی سهبعدی نیز یاد میشود.
آرایش فضایی
برای درک مفهوم کایرالیته ابتدا باید با مفهوم «آرایش فضایی» (Spatial Arrangement) آشنا شویم. آرایش فضایی در مورد تفاوت قرارگیری اتمها و مولکولهای ترکیبات آلی در فضا است. در این صورت اگر اتمی در مکان فضایی خود تنها به میزان ۱ درجه نیز با اتم دیگری متفاوت باشد، این دو، دارای آرایش فضایی متفاوتی هستند. در این صورت امکان وجود مولکولها با آرایشهای فضایی بسیار متنوعی وجود دارد که در هر کدام اتمها در فضای سهبعدی جهتگیری متفاوتی نسبت به یکدیگر دارند.

ایزومر فضایی چیست؟
مولکولهایی که دارای اتصالهای یکسان اما آرایش فضایی متفاوت اتمها هستند را «ایزومر فضایی» (Stereoisomer) مینامیم. بهطور کلی دو نوع ایزومر فضایی وجود دارد.
- ایزومر فضایی نوری
- ایزومر فضایی هندسی
در ادامه میخواهیم در مورد هر کدام از این ایزومرها، نحوه تشخیص آنها و ویژگیهای منحصر به فردشان صحبت کنیم.
ایزومر هندسی چیست؟
ایزومرهای هندسی در موقعیت استخلافهای خود متفاوت هستند اما خود مولکول صلب است. برای مثال میتوانیم به چرخش حول پیوند سیگمای کربن-کربن در آلکنها اشاره کنیم. این چرخش به دلیل وجود پیوند ممکن نخواهد بود. بنابراین استخلافهای مولکول در آرایش فضایی به خصوصی قفل شدهاند و امکان تغییر جهتگیری آنها وجود ندارد. بنابراین در پیوندهای دوگانه و سهگانه کربن-کربن و در برخی موارد حلقههای کربنی از تبدیل هندسه یک مولکول به هندسهای دیگر جلوگیری میکنند.
برای نامگذاری ایزومرهای هندسی از دو عبارت پیشوند «سیس» (Cis) و «ترانس» (Trans) استفاده میشود و این دو تنها در حالتی قابل تبدیل به یکدیگر هستند که پیوندی گسسته شود. ایزومرهای سیس و ترانس به دلیل تفاوتی که در ساختار خود دارند، ویژگیهای فیزیکی و شیمیایی متفاوتی نیز از خود بروز میدهند. در واقع ایزومرهای سیس و ترانس را باید به عنوان دو مولکول کاملا مجزا از یکدیگر در نظر گرفت. در تصویر زیر مثالی از این نوع ایزومرها را مشاهده میکنید.
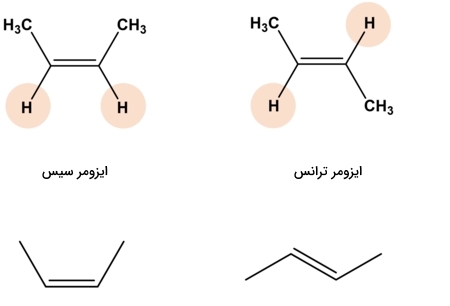
نکتهای که باید به خاطر داشته باشید این است که ایزومرهای سیس و ترانس نیز با یکدیگر دیاسترومر هستند. در ادامه در مورد مفهوم دیاسترومری صحبت خواهیم کرد.
ایزومر نوری چیست؟
ایزومرهای نوری، مولکولهایی با تصویر آينهای هستند. با این حال این نوع مولکولها ویژگی مهم دیگری نیز دارند و آن این است که بر هم «انطباقناپذیر» (Nonsuperimposible) هستند. توجه داشته باشید که ایزومرهای نوری ویژگیهای فیزیکی یکسانی دارند اما ویژگیهای شیمیایی آنها در محیطها غیرمتقارن ممکن است با یکدیگر متفاوت باشد.
به مولکولهایی که تصویر آينهای یکدیگر هستند اما بر هم منطبق نمیشوند، «کایرال» (Chiral) میگوییم، یعنی این مولکولها دارای ویژگی کایرالیته هستند. کایرال از کلمهای یونانی به معنای دست گرفته شده است زیرا رایجترین مثالی که میتوان توسط آن مفهوم کایرالیته را توضیح داد، دو دست چپ و راست انسان هستند. در ادامه به بررسی آن میپردازیم.
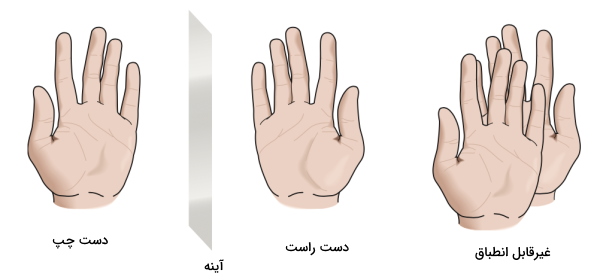
دست راست و چپ انسان تصویر آينهای یکدیگر است، این را میتوانید در تصویر بالا مشاهده کنید. با این حال دو دست بر هم منطبق نمیشوند. یعنی اگر دست راست و چپ خود را به سمت بالا یا پایین نگه دارید، در هیچ زاویهای بر یکدیگر قابل انطباق نیستند. این ویژگی در پاها و گوش انسان نیز به چشم میآید.
مولکول کایرال چیست؟
«مولکول کایرال» (Chiral Molecule)، مولکول یا یونی است که بر تصویر آینهای خودش قابل انطباق نباشد. به این ویژگی هندسی مولکولها، کایرالیته گفته میشود. در تصویر زیر نمونهای از یک مولکول کایرال را مشاهده میکنید.
همانطور که گفتیم اگر تصویر آینهای این مولکول را رسم کنیم، نمیتوان آن را بر این مولکول منطبق کرد. همچنین توجه داشته باشید که به کربن مرکزی این مولکول، ۴ استخلاف متفاوت متصل است که باعث به وجود آمدن این ویژگی میشود. این تفاوت با رنگهای متفاوت نشان داده شده است. در بخشهای بعدی از این ویژگی برای تشخیص مولکول کایرال بهره میبریم.

مرکز کایرال چیست؟
مولکولهای کایرال آلی دارای اتم کربنی هستند که به ۴ اتم یا گروه متفاوت دیگر متصل باشد. در تصویر زیر میتوانید نمونهای از این مولکول را مشاهده کنید که برمو کلرو فلورو متان نامیده میشود. به کربنی که دارای چنین موقعیتی باشد، «مرکز کایرال» (Chiral Center) یا «کربن کایرال» (Chiral Carbon) نیز گفته میشود. از مفهوم کایرالیته برای توصیف مولکولهایی استفاده میشود که دارای مرکز کایرال باشند.
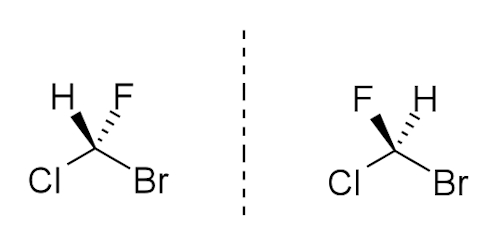
در صورتی که در این مولکول، اتم برم را با یک اتم کلر دیگر جایگزین کنیم، این مرکز کایرال از بین میرود زیرا میتوان آن را با یک چرخش ساده روی تصویر آينهای خود منطبق کرد. کربنهای کایرال در بسیاری از ترکیبات طبیعی وجود دارند که از این بین میتوان به لاکتیک اسید و نیکوتین اشارره کرد. برای تشخیص کایرال یا آکایرال بودن یک مولکول، یکی از سادهترین روشها این است که دنبال صفحه تقارن در آن باشیم. تمامی مولکولهای کایرال چه ساده باشند، چه پیچیده، عاری از صفحه تقارن هستند.
مولکول آکایرال چیست؟
مولکولی که دارای تصویر آينهای باشد و بر آن منطبق نیز شود را مولکول «آکایرال» (Achiral) مینامیم. این مفهوم را میتوان به اشیاء نیز تعمیم داد. مثلا میتوانیم به یک ارلن مایر اشاره کنیم. ارلن از آنجا که ساختار متقارنی دارد، دارای تصویر آینهای است و بر آن منطبق نیز میشود.
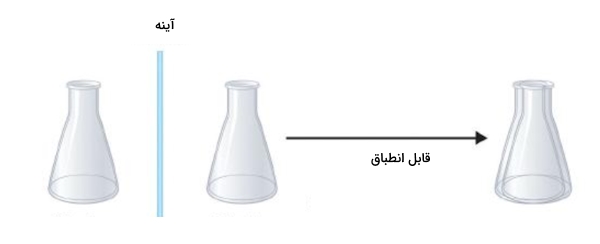
یکی از ویژگیهای بارز مولکولهای آکایرال این است که از یک اتم یا گروه، بیش از ۱ عدد به کربن مرکزی متصل باشد. همچنین مولکولهای آکایرال دارای صفحه تقارن نیز هستند بهصورتی که آنها را به دو بخش کاملا مساوی و مشابه تقسیم میکند. مولکولهای کایرال فاقد ویژگی کایرالیته هستند.
تفاوت مولکول کایرال و آکایرال
تا اینجا به معرفی مولکولهای کایرال و آکایرال پرداختیم. در این بخش میخواهیم به برخی از مهمترین تفاوتهایی که این دو خانواده از مولکولها با یکدیگر دارند، بهصورت مختصر اشاره کنیم.
- مولکولهای کایرال فاقد تقارن هستند اما در مولکولهای آکایرال شاهد تقارن هستیم.
- مولکولهای کایرال روی تصویر آينهای خود منطبق نمیشوند در صورتی که مولکولهای آکایرال میشوند.
- مولکولهای کایرال نور قطبیده را بهصورت ساعتگرد یا پادساعتگرد میچرخانند اما مولکولهای آکایرال تاثیری روی نور قطبیده ندارند.
- تصویر آینهای مولکول کایرال، مولکول متفاوتی است. در صورتی که تصویر آینهای یک مولکول آکایرال با خودش یکسان است.
انانتیومر چیست؟
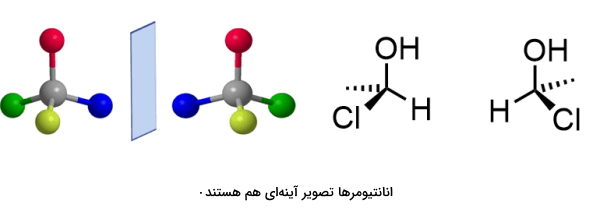
به مولکولی که دارای مرکز کایرال باشد و روی تصویر آينهای خود منطبق نشود، «انانتیومر» (Enantiomer) میگویند. برای شناسایی انانتیومرها میتوان آنها را در معرض نور قطبیده قرار داد. انانتیومرهای دارای نقطه ذوب و نقطه جوش یکسانی هستند. انانتیومرها با توجه به صورتبندی مطلقی که دارند به «راست دست» (Right Handed) و «چپ دست» (Left Handed) طبقهبندی میشوند.
به این ویژگی انانتیومرها «دستسانی» نیز گفته میشود. دستسانی و کایرالیته دو مفهوم مشابه یکدیگر هستند. انانتیومرها از خود ویژگیهای شیمیایی یکسانی نشان میدهند اما در واکنش خود با مولکولهای کایرال دیگر متفاوت عمل میکنند. در تصویر زیر دو مولکول را مشاهده میکنید که انانتیومر یکدیگر هستند.
تعیین مرکز کایرال
برای مشخص کردن مولکولهایی که در آنها مراکز کایرال وجود دارد از سیستم نامگذاری استفاده میشود که این مراکز را بهصورت و مشخص میکند. این روش نامگذاری به تعیین رابطه بین دو مولکول کمک بهسزایی میکند. در ادامه میخواهیم به قوانین مسلط بر این سیستم نامگذاری بپردازیم.
صورت بندی مطلق R و S
در این روش برای نامگذاری انانتیومرهای مختلف باید کایرالیته آنها مشخص باشد. این روش توسط سه شیمیدان توسعه پیدا کرده است و با نامهای آنها نیز شناخته میشود. «کان اینگولد پرلوگ» (Cahn Ingold Prelog) نامی است که این روش را با آن میشناسیم. برای پی بردن به «صورتبندی مطلق» (Absolute Configuration) انانتیومرها بهصورت تجربی میتوان از روش زیر استفاده کرد. توجه داشته باشید که از جهت چرخش نور توسط یک انانتیومر نمیتوان در مورد صورتبندی مطلق آن اظهار نظر کرد زیرا علامت چرخش نوری ممکن است با تغییر دما دستخوش تغییر شود.
نامگذاری مراکز کایرال
در این بخش میخواهیم بدانیم چطور میتوان دو صورتبندی و را به مرکز کایرالی نسبت داد. این کار را با بررسی ساختار دو مولکول زیر انجام میدهیم.

در این روش ابتدا اتمها و گروههای متصل به یک مرکز فضایی با توجه به اولویت خود شمارهگذاری میشوند و سپس از استخلافی با بالاترین اولویت، فلشی به پایینترین اولویت رسم میشود. در صورتی که این فلش جهتی ساعتگرد داشته باشد، صورتبندی مطلق را مینامیم. این را میتوانید در مولکول سمت راست مشاهده کنید.
همچنین در صورتی که جهت فلش مانند تصویر سمت چپ بهصورت پادساعتگرد باشد، صورتبندی آن را مینامیم. بنابراین یکی از مهمترین کارهایی که باید در این روش انجام داد، تعیین اولویت گروههای متصل به کربن کایرال در یک ساختار است. برای این کار مجموعهای از قوانین توسط کان اینگولد پرلوگ تهیه شده است که در ادامه به بررسی آنها خواهیم پرداخت.
تخصیص اولویت استخلافها
برای تخصیص صورتبندی مطلق، اولویت استخلافهای متصل را با توجه به قوانین زیر مشخص میکنیم.
قانون اول
در ابتدا اتمهایی که بهصورت مستقیم به مرکز فضایی متصل هستند را مورد بررسی قرار میدهیم. در این مورد هر اتمی که دارای عدد اتمی بالاتری باشد از اولویت بیشتری برخوردار است. بنابراین اتم هیدروژن که کمترین عدد اتمی را دارد در این سیستم دارای آخرین اولویت خواهد بود. برای تخصیص اولویت بهصورت صحیح از نکتههای زیر استفاده میکنیم.
- در صورتی که در دو استخلاف، دو ایزوتوپ متفاوت از یک عنصر حضور داشته باشند، اولویت با ایزوتوپی است که عدد جرمی بالاتری دارد.
- در ترسیم مولکول، توجه داشته باشید که استخلافی با پایینترین اولویت باید به دور از بیننده قرار بگیرد. این استخلافها توسط نقطهچین نمایش داده میشوند. درواقع این استخلاف باید به گونهای باشد که در پشت صفحه مولکول قرار بگیرد.
- بعد از مشخص کردن اولویت استخلافها، فلشی از اولویت ۱ به ۲ و سپس به ۳ رسم میکنیم. در صورتی که این فلش ساعتگرد باشد، صورتبندی از نوع و در صورتی که پادساعتگرد باشد، صورتبندی از نوع خواهد بود.
توجه داشته باشید که در صورتی که با مولکولی مواجه شویم که در ساختار آن استخلاف با اولویت آخر در پشت صفحه و دور از بیننده نباشد، باید پیش از رسم فلش آن را بچرخانیم. بهطور کلی «گوه» (Wedge) نشاندهنده استخلاف به سمت بیننده و نقطهچین نشاندهنده استخلاف دور از بیننده است.
قانون دوم
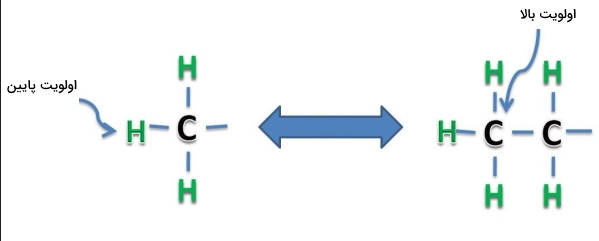
در صورتی که دو استخلاف مشابه وجود داشته باشد، تا جایی در زنجیره آن پیش میرویم که به اولین تفاوت موجود برسیم. استخلافی که نزدیکترین پیوند را با اتمی با عدد اتمی بالاتر داشته باشد، اولویت بیشتری دارد. در صورتی که زنجیرهها نیز یکسان باشد، پیگیری را تا رسیدن به اولین نقطه تفاوت ادامه میدهیم. برای درک بهتر به مثال زیر توجه کنید.
به دو استخلاف موجود در تصویر زیر دقت کنید. استخلاف اتیل از اولویت بیشتری نسبت به متیل برخوردار است. در نقطه اتصال با کربن کایرال هر دو دارای یک اتم کربن هستند. با پیشروی در این دو استخلاف متوجه میشویم که به اتم کربن متیل تنها ۳ اتم عنصر هیدروژن متصل است در حالی که در استخلاف اتیل، یکی از اتمهای هیدروژن با کربن جایگزین شده است و خود این کربن به ۳ اتم هیدروژن دیگر وصل است. این کربن اولین تفاوت بین این دو استخلاف به حساب میآيد و از آنجا که عدد اتمی بالاتری نسبت به هیدروژن دارد، اولویت استخلاف اتیل نسبت به متیل بیشتر خواهد بود.
قانون سوم
اگر زنجیره مورد نظر دو یا سه اتصال به یک اتم واحد داشت، باید اتمهای متصل به این اتم واحد را مورد بررسی قرار دهیم تا ببینیم کدام یک دارای عدد اتمی بالاتری هستند.
- اگر تفاوتی در عدد اتمی وجود نداشته باشد، زنجیرهای که چندین بار اتصال داشته باشد از اولویت بالاتری برخوردار است.
- اگر در زنجیره، اتمی با عدد اتمی بالاتر یافت شود، آن زنجیره را دارای اولویت بالاتری میدانیم.
نکتهای که باید مد نظر قرار دهید این است که در نامگذاری این مولکولها، صورتبندی مراکز فضایی باید حتما پیش از نام آورده شود. برای تشخیص بهتر به مثالهایی که در ادامه میآیند توجه کنید.
مثال اول
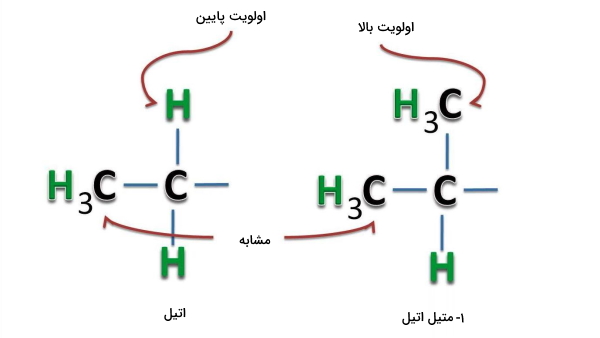
با توجه به تصویر زیر استخلاف ۱-متیل اتیل نسبت به استخلاف اتیل برتری دارد. به اولین کربن اتیل، ۱ اتم کربن دیگر و به کربن ساختار دیگر، ۲ اتم کربن متصل است. این نقطه اولین تفاوت بین این دو استخلاف است و به همین دلیل همانطور که در تصویر زیر ملاحظه میکنید، اولویت گروه سمت راست بالاتر است.
مثال دوم
دو استخلاف موجود در تصویر زیر به مثال بالا بسیار شبیه هستند با این حال در استخلاف سمت چپ اتم برمی وجود دارد که نسبت به کربن اولویت بالاتری دارد زیرا دارای عدد اتمی بیشتری است. به همین دلیل استخلاف سمت چپ نسبت به سمت راست الویت بیشتری در شمارهگذاری برای تعیین صورتبندی مطلق دارد.
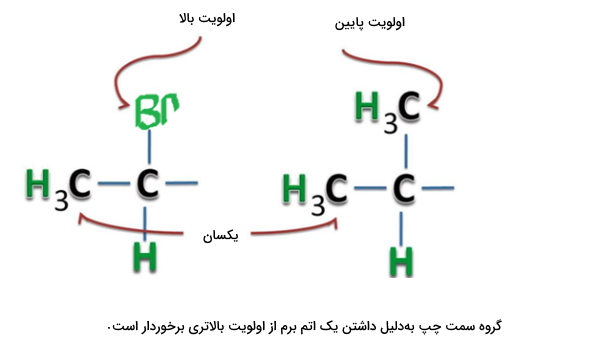
مثال سوم
توجه داشته باشید که وجود پیوند دوگانه و سهگانه به این معنا است که اتم مرکزی دو یا سه بار به آن اتم متصل شده است. این تناظر را میتوان بهصورت زیر برای پیوند دوگانه کربن-کربن نشان داد.
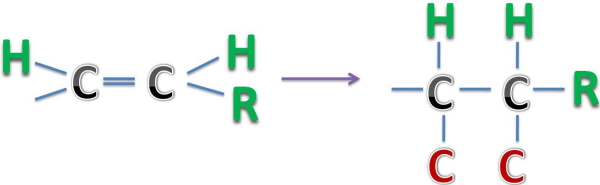
همچنین این تناظر برای پیوند سهگانه کربن کربن بهصورت زیر خواهد بود.
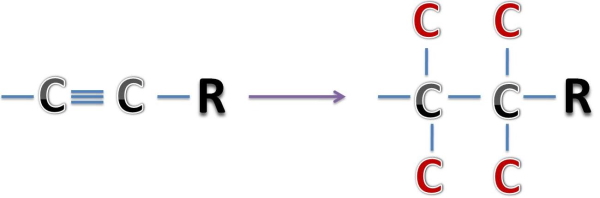
مثال چهارم
توجه به این نکته ضروری است که برای تعیین اولویت استخلافها تنها به اولین نقطه تفاوت اهمیت میدهیم و بعد از آن وجود تفاوتهای دیگر بیتاثیر هستند. در این مورد به تصویر زیر دقت کنید. در این دو استخلاف اولین نقطه تفاوت، وجود هیدروژن در ترکیب سمت چپ و متیل در ترکیب سمت راست است. بنابراین اولویت با استخلاف سمت راست است. وجود اتم کلر در استخلاف سمت چپ تاثیری روی قضاوت ما ندارد زیرا در اولین جایگاه تفاوت قرار ندارد.
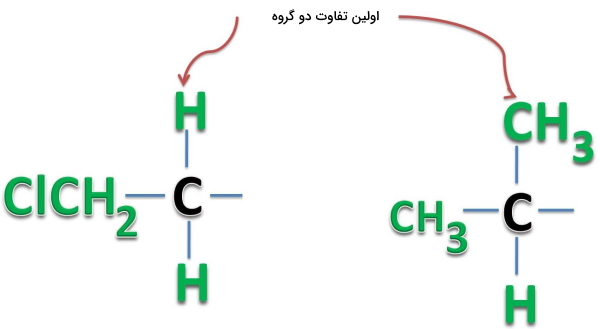
مثال پنجم
زمانی که در استخلافهای یکسان به دنبال تفاوت هستیم، ممکن است شاهد شاخههایی در آن باشیم. در این صورت استخلافی با شاخه دارای اولویت، در اولویت بالاتری قرار خواهد گرفت. در صورتی که این شاخههای نیز مشابه یکدیگر باشند، مانند موراد پیشین به دنبال اولین تفاوت در اتمهای متصل به آن میگردیم. این مورد را میتوانید در تصویر زیر مشاهده کنید که در آن استخلاف سمت راست اولویت بالاتری دارد.
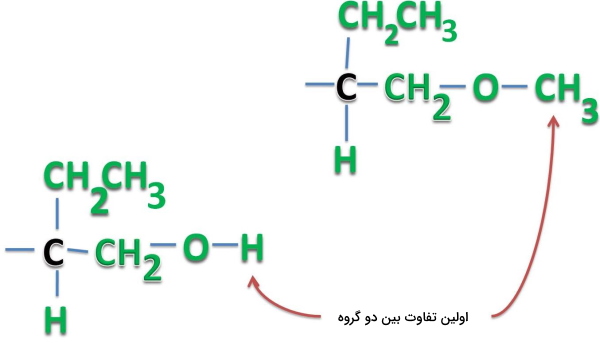
دیاسترومر چیست؟
تمامی ایزومرهای فضایی انانتیومر نیستند و ممکن است به دستههای دیگری تعلق داشته باشند. به دو مولکول زیر دقت کنید و رابطه بین مراکز فضایی آن را مشخص کنید.
در این مولکول دو مرکز فضایی وجود دارد، به طوری که صورتبندی یکی از آنها ثابت باقی مانده و دیگری دستخوش تغییر شده است. بنابراین میتوان با اطمینان گفت که این دو مولکول تصویر آينهای یکدیگر نیستند و دیاسترومر یکدیگر هستند. «دیاسترومرها» (Diastereomers) ایزومرهای فضایی هستند که تصویر آینهای یکدیگر نیستند و همانطور که در این مثال مشاهده کردید، صورتبندی آن در حداقل یکی از مراکز فضایی با دیگری متفاوت است.
در واقع دیاسترومرها حداقل یک مرکز فضایی دارند که در آن صورتبندی و یکسان و در مرکز دیگری خلاف یکدیگر هستند. بنابراین برای تشخیص انانتیومرها از دیاسترومرها باید به قوانین تعیین صورتبندی که پیش از این به آن پرداختیم، تسلط کافی داشته باشیم.
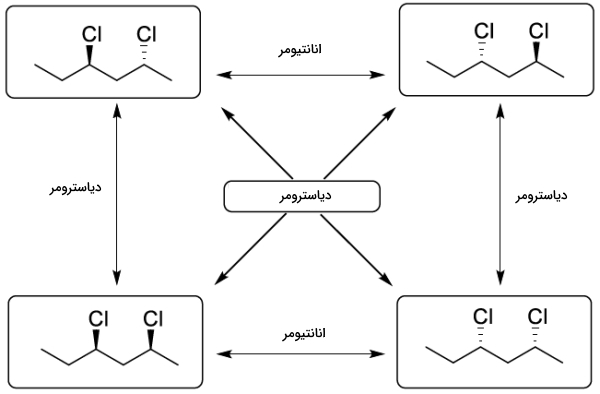
رابطه انانتیومر و دیاسترومر چیست؟
حال که میدانیم انانتیومرها و دیاسترومرها چه مولکولهایی هستند میخواهیم به تفاوتهای این دو با یکدیگر، بپردازیم. در زیر به برخی از آنها اشاره کردهایم.
- انانتیومرها زوج مولکولی هستند که به دو فرم وجود دارند. آنها تصویر آینهای یکدیگر و بر هم انطباقناپذیر هستند. دیاسترومرها ترکیباتی با فرمول مولکولی و توالی پیوند عنصری یکسان هستند اما فاقد تصویر آينهای هستند و برهم منطبق نیز نمیشوند.
- انانتیومرها دارای ویژگیهای فیزیکی مشابهی هستند، تنها تفاوت آنها برهمکنشی است که با نور قطبیده دارند. دیاسترومرها دارای ویژگیهای فیزیکی متفاوتی هستند.
- انانتیومرها بهصورت زوج حضور دارند اما دیاسترمرها میتوانند بیش از ۲ عدد باشند.
- انانتیومرها دارای شکل مولکولی یکسان هستند ولی دیاسترومرها فاقد این ویژگیهستند.
در تصویر زیر رابطه بین دیاسترومر و انانتیومر را به خوبی مشاهده میکنید.
ترکیباتی با چند مرکز کایرال
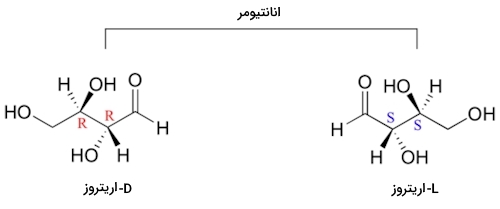
برخی از ترکیبات آلی وجود دارند که در آنها بیش از ۱ مرکز فضایی یا کایرال وجود دارد. بررسی این مورد را روی مولکولی بسیار رایج به نام D-اریتروز شروع میکنیم. این مولکول قندی است که از ۴ اتم عنصر کربن تشکیل شده است.
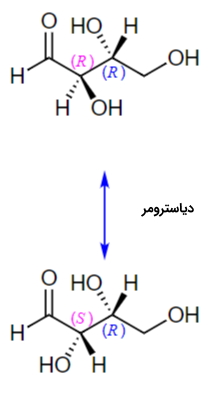
در تصویر زیر مولکول D-اریتروز را مشاهده میکنید که دارای دو مرکز فضایی در کربن شماره ۲ و ۳ خود است. هر دو مرکز فضایی دارای صورتبندی هستند. انانتیومر دیگر این مولکول L-اریتروز نام دارد و هر دو مرکز فضایی در آن دارای صورتبندی هستند. در زوج انانتیومری که دارای بیش از ۱ مرکز فضایی باشند، صورتبندی تمام مراکز فضایی تغییر خواهد کرد.
در صورتی که صورتبندی کربن ۲ و صورتبندی کربن ۳ باشد، بین این دو مولکول رابطه دیاسترومری برقرار میشود. این رابطه را در مولکولهای زیر مشاهده میکنید. بنابراین میتوان اینطور بیان کرد که در دو دیاسترومر حداقل یکی و نه تمامی مراکز کایرال باید دارای صورتبندی مخالف با زوج دیگر باشد.
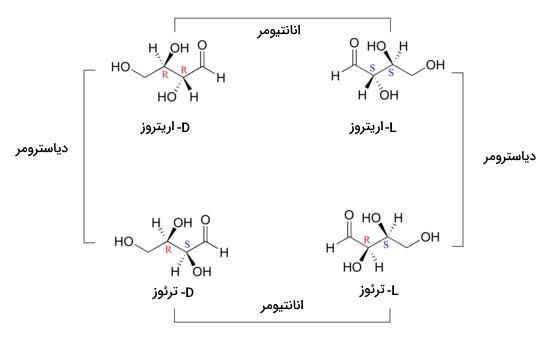
ترکیب مزو چیست؟
مولکولهایی وجود دارند که با وجود داشتن مرکز کایرال، دارای صفحه تقارن هستند. نکته مهم در مورد این ترکیبات این است که با وجود داشتن مرکز کایرال، خود مولکول آکایرال است. در تصویر زیر میتوانید نمونهای از این ترکیبات را مشاهده کنید.
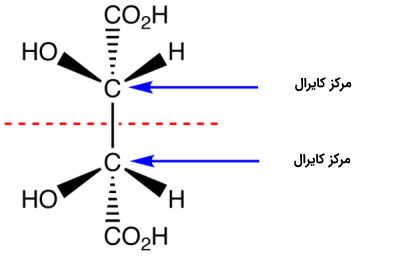
بنابراین در صورتی که با دو مولکول برخورد کردید که در آنها صورتبندی تمام مراکز کایرال تغییر کرده بود، باید پیش از دستهبندی آنها به عنوان انانتیومر، وجود یا عدم وجود صفحه تقارن را در آنها بررسی کنید. توجه داشته باشید که در صورت وجود صفحه تقارن، مولکول نمیتواند کایرال باشد، بنابراین انانتیومر نیز نیست.
اپیمر چیست؟
«اپیمرها» (Epimers) دیاسترومرهایی هستند که بیش از ۱ مرکز کایرال در خود دارند و تنها در یکی از مراکز کایرال دارای صورتبندی متفاوت با یکدیگر هستند. نمونهای از این ترکیبات را میتوانید در تصویر زیر مشاهده کنید.
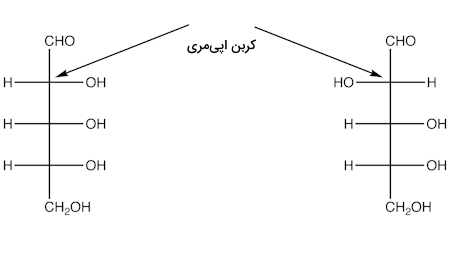
به کربنی که در ساختار اپیمری حضور دارد و صورتبندی مطلق آن با دیگری متفاوت است، کربنی اپیمری گفته میشود.
مخلوط راسمیک چیست؟
«مخلوط راسمیک» (Racemic Mixture) یا «راسمات» (Racemate) ترکیبی است که در آن به میزان برابری از انانتیومر چپگرد و انانتیومر راستگرد یک مولکول کایرال وجود داشته باشد. مخلوطهای راسمیک به ندرت در طبیعت یافت میشوند اما در فرآيندهای صنعتی به دست میآيند.
از مهمترین ویژگیهای مخلوط راسمیک میتوان به این نکته اشاره کرد که از نظر نوری غیرفعال است، یعنی توانایی چرخاندن نور قطبیده را ندارد. همانطور که پیشتر گفتیم دو انانتیومر نور قطبیده را به مقدار برابر اما در دو جهت مختلف میچرخانند، بنابراین زمانی که در مخلوطی به میزان برابر وجود داشته باشند میتوانند یکدیگر را خنثی کنند.
یک مخلوط راسمیک میتواند نسبت به انانتیومرهای خالص از خود ویژگیهای متفاوتی را بروز دهد. مثلا تفاوت در نقطه ذوب نسبت به اناتیومر خالص در مخلوطهای راسمیک بسیار متدوال است. از ویژگیهای دیگری که در این ترکیبات متفاوت است، میتوان به نقطه جوش و انحلالپذیری اشاره کرد.
مخلوطهای راسمیک در داروسازی از اهمیت بهسزایی برخوردارند. برخی از مولکولهای دارویی کایرال هستند و انانتیومرهای متفاوت آنها تاثیرات بیولوژیکی متفاوتی روی بدن خواهند داشت. از داروهای مخلوط راسمیک میتوان به ایبوپروفن، سیتریزین و سالبوتامول اشاره کرد.
فعالیت نوری چیست؟
«فعالیت نوری» (Optical Activity) برهمکنشی است که یک انانتیومر با نور قطبیده دارد و آن را در یک جهت با مقدار خاصی میچرخاند. اولین فردی که به وجود این ویژگی پی برد، «ژان باتیست بیو» (Jean Baptiste Biot) فرانسوی بود. او متوجه شد که این مولکولها توانایی تغییر جهت نور قطبیده را دارند. فعالیتهای او توسط «لویی پاستور» (Louis Pasteur) ادامه یافت. پاستور متوجه شد که از تارتاریک اسید، دو بلور متفاوت وجود دارد. زیرا یکی از این بلورها نور قطبیده را بهصورت ساعتگرد و دیگری نور قطبیده را بهصورت پادساعتگرد میچرخاند.
به علاوه مقدار این چرخش نوری توسط آنها با یکدیگر برابر بود. او همچنین متوجه شد که مخلوطی از این دو بلور، برهمکنشی با نور قطبیده ندارد. به همین دلیل میگوییم که مخلوطهای راسمیک فاقد فعالیت نوری هستند. به مولکولهایی که دارای ویژگی کایرالیته باشند، «فعال نوری» (Optical Active) گفته میشود.
چرخش نوری
به انانتیومری که نور قطبیده را در جهت مثبت یا ساعتگرد بچرخاند، راستگرد با علامت و به انانتیومر دیگر که نور قطبیده را در جهت منفی یا پادساعتگرد میچرخاند، چپگرد با علامت گفته میشود.

اندازهگیری فعالیت نوری
فعالیت نوری را به کمک یک «پلاریمتر» (Polarimeter) اندازهگیری میکنند و عوامل متعددی روی آن تاثیرگذار هستند که در زیر به آنها اشاره کردهایم.
مقدار فعالیت نوری با دو علامت مثبت و منفی گزارش میشود. فعالیت نوری مثبت مربوط به انانتیومتر و فعالیت نوری منفی مربوط به انانتیومتر است. در صورتی که میزان چرخش نوری یک نمونه تحت شرایط استاندارد اندازهگیری شود به آن «چرخش ویژه» (Specific Rotation) میگویند. چرخش ویژه زاویه اندازهگیری شده در طولی برابر با ۱ دسیمتر و غلظتی برابر با ۱ گرم بر میلیلیتر است. به دست آوردن چرخش ویژه از اهمیت بالایی برخوردار است زیرا مقدار آن برای هر ترکیب شیمیایی منحصر به فرد است. در صورتی که نمونه محلول باشد، چرخش ویژه از رابطه زیر به دست میآيد.
در ادامه میخواهیم بدانیم هر کدام از مولفههایی که در این رابطه هستند، چه معنایی دارند.
- : چرخش ویژه با واحد سانتیمتر معکب بر دسیمتر در گرم
- : طول موج بر حسب نانومتر
- : زاویه چرخش یک ماده
- : درجه دما
- : طول مسیر بر حسب دسیمتر
- : غلظت نمونه بر حسب گرم بر میلیلیتر
مثال و حل تمرین
حال که میدانیم کایرالیته چیست، میخواهیم به بررسی تعدادی مثال بپردازیم. توجه داشته باشید که درک مفهوم کایرالیته، در صورتی باارزش است که توانایی تشخیص حضور یا عدم حضور آن را در مولکولهای آلی داشته باشیم.
مثال از کایرالیته
در این بخش به بررسی تعدادی مثال پیرامون مفهوم کایرالیته در مولکولهای آلی خواهیم پرداخت. با توجه به پاسخهای تشریحی آورده شده در هر بخش، میتوانید به سوالهای مشابه آنها پاسخ دهید.
مثال اول
به کمک مجموعه قوانین بررسی شده، صورتبندی مطلق ساختارهای زیر را بهصورت یا بیان کنید.
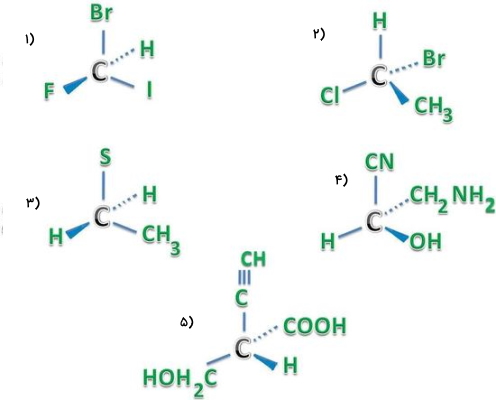
مولکول ۱
برای تعیین صورتبندی مطلق یک مرکز فضایی ابتدا باید استخلافهای آن را به ترتیب اولویت مرتب کنیم. در صورتی که این استخلافها اتمی باشند، میتوان تنها از روی عدد اتمی آنها این کار را انجام داد. در این مولکول ۴ اتم متفاوت به مرکز کایرال متصل است که اولویت آنها بهصورت زیر خواهد بود.
با توجه به اینکه اتم هیدروژن در موقعیت دور از صفحه قرار دارد میتوان شمارهگذاری را بدون چرخاندن مولکول انجام داد. فلش رسم شده به ترتیب اولویت پادساعتگرد است و صورتبندی از نوع نامیده میشود.
مولکول ۲
ترتیب اولویت استخلافهای متصل به کربن کایرال در این مولکول بهصورت زیر است.
در این مورد نیاز است با چرخاندن مولکول، جای هیدروژن و برم با یکدیگر عوض شود تا هیدروژن با پایینترین اولویت، در موقعیت دور از بیننده قرار بگیرد. سپس فلشی از اولویت بالا به پایین رسم میکنیم که چون ساعتگرد است، صورتبندی این مولکول از نوع نامیده میشود.
مولکول ۳
در این مولکول به کربن مرکزی، ۲ اتم هیدروژن متصل است. بنابراین باعث میشود آکایرال باشد. توجه داشته باشید که صورتبندی $ و تنها برای مولکولهای کایرال با مرکز کایرال است. بنابراین این مولکول نه از نوع است، نه از نوع .
مولکول ۴
استخلافهای این مولکول بهصورت گروه هستند و ترتیب اولویت آنها را میتوان بهصورت زیر نشان داد.
پیش از رسم فلش، باید مولکول را چرخاند تا هیدروژن با کمترین اولویت در پشت صفحه قرار بگیرد. سپس فلشی از اولویت ۱ به ۲ و سپس ۳ رسم میکنیم و چون ساعتگرد است، صورتبندی این مولکول از نوع خواهد بود.
مولکول ۵
استخلافهای متصل به کربن مرکزی در این مولکول را میتوان به ترتیب زیر اولویت بندی کرد.
با رسم فلشی از اولویت بالا به پایین، جهت حرکت بهصورت پاساعتگرد است و صورتبندی از نوع خواهد بود.
مثال دوم
دو مولکول داریم با نامهای (R)-بوتان ۲-ال و (S)-بوتان ۲-ال. رابطه بین این دو مولکول به چه صورت است؟
پاسخ
این دو مولکول با یکدیگر انانتیومر هستند زیرا نحوه اتصال آنها مشابه است و تنها دارای یک مرکز کایرال هستند که در آن دارای صورتبندی خلاف یکدیگر هستند.
مثال سوم
رابطه بین دو مولکول زیر از چه نوعی است؟
(R و R)-تارتاریک اسید و (R و S)-تارتاریک اسید
پاسخ
این دو ساختار با یکدیگر دیاسترومر هستند زیرا حداقل در یکی از مراکز فضایی دارای صورتبندی متفاوت از یکدیگر هستند.
مثال چهارم
در تصویر زیر یک مولکول کایرال را مشاهده میکنید. صورتبندی مطلق مرکز فضایی آن را مشخص کنید.
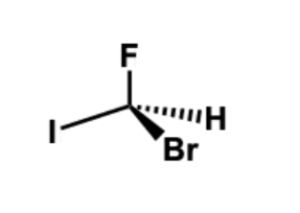
پاسخ
ابتدا اتمهای متصل به مرکز کایرال را به ترتیب اولویت آنها مشخص میکنیم. همانطور که میدانید اتمی با عدد اتمی بیشتر در اولویت بالاتری قرار دارد.
برای سادگی کار میتوانیم شمارهگذاری را روی ساختار مشخص و فلش را رسم کنیم.
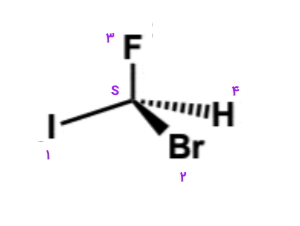
همانطور که مشاهده میکنید در صورت رسم فلش از اولویت ۱ به ۲ و سپس ۳، جهت آن پادساعتگرد است و صورتبندی از نوع خواهد بود.
مثال پنجم
در مولکول حلقوی زیر ۲ مرکز کایرال وجود دارد. صورتبندی مطلق هر کدام از آنها را با توجه به قوانین بیان شده، مشخص کنید.
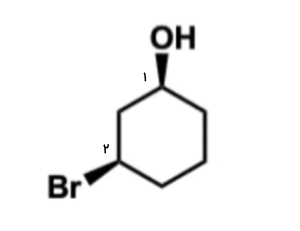
پاسخ
در هر مرکز فضایی اولویت استخلافها و پیوندهای موجود را مشخص میکنیم. در تصویر زیر میتوانید این را مشاهده کنید.
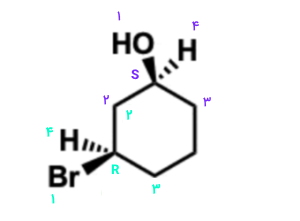
در صورتی که فلشی از اولویت بالای مرکز فضایی ۱ به اولویت پایین آن رسم کنیم، جهت فلش پادساعتگرد و صورتبندی از نوع خواهد بود. در حالی که با رسم فلش برای اولویتهای مرکز فضایی ۲، جهت ساعتگرد و صورتبندی از نوع خواهد بود.
مثال ششم
در تصویر زیر ۸ مولکول آلی وجود دارد. کدام یک از آنها کایرال و کدام آکایرال است؟
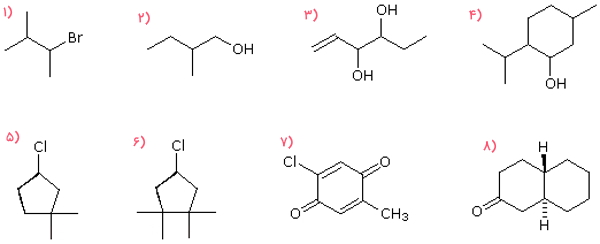
پاسخ
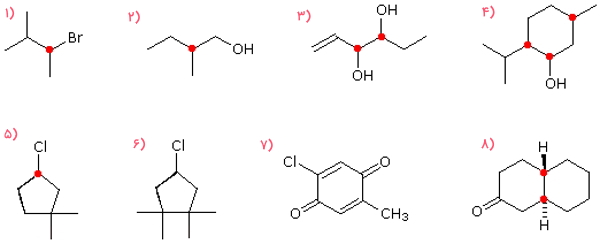
مولکول ۱ و ۲ و ۵، هر کدام دارای ۱ مرکز کایرال هستند که در تصویر زیر با رنگ قرمز مشخص شده است. بنابراین هر ۳ آنها مولکولهایی کایرال هستند. مولکول ۳ و ۸ هر کدام دارای ۲ مرکز کایرال است و آنها نیز کایرال هستند. در مولکول ۴، ۳ مرکز کایرال وجود دارد که آنها را با رنگ قرمز مشخص کردهایم، بنابراین مولکول شماره ۴ نیز کایرال است. مولکول ۶ فاقد مرکز کایرال است و میتوان صفحه تقارنی از اتم کلر به پیوند روبهروی آن رسم کرد که آن را به دو قسمت کاملا مشابه و متقارن تقسیم کند، بنابراین آکایرال است. مولکول شماره ۷ فاقد صفحه تقارن است اما مرکز کایرالی نیز ندارد و آکایرال است.
مثال هفتم
از ۶ مولکول تصویر زیر کدام یک کایرال و کدام آکایرال است؟ در صورت وجود کایرالیته، مرکز کایرال را نیز مشخص کنید.
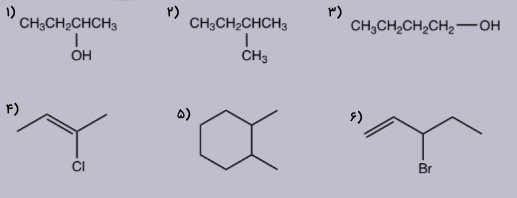
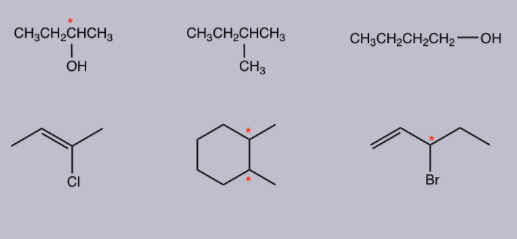
پاسخ
از ۶ مولکول زیر، مولکول شماره ۱، ۵ و ۶ دارای مرکز کایرال هستند که در تصویر زیر به رنگ قرمز مشخص شده است. همچنین مولکولهای شماره ۲، ۳ و ۴ فاقد مرکز کایرال و آکایرال هستند. همانطور که مشاهده میکنید در آنها هیچ اتم کربنی حضور ندارد که به ۴ استخلاف متفاوت متصل باشد.
مثال هشتم
مرکز کایرالی داریم که به ۴ استخلاف زیر متصل است. میخواهیم این مرکز کایرال را با توجه به قوانین موجود برای صورتبندی و اولویتبندی کنیم. ترتیب اولویت آنها چگونه خواهد بود؟
و و و
پاسخ
با توجه به قوانین کان اینگولد پرلوگ، اولویت بالا به استخلافی اختصاص دارد که در نزدیکترین موقعیت دارای اتمی با عدد اتمی بالاتر باشد. بنابراین اولویت اول به استخلاف تعلق دارد که داری اتم کلر است. در اولویت دوم استخلاف قرار دارد زیرا در آن یک پیوند دوگانه بین کربن و اکسیژن وجود دارد و مانند این است که کربن با دو اتم اکسیژن پیوند دوگانه برقرار کرده باشد. در جایگاه سوم استخلاف با اتصال به اتم اکسیژن است. در نهایت نیز استخلاف قرار میگیرد که تنها به اتم هیدروژن با کوچکترین عدد اتمی متصل است. این ترتیب را میتوان بهصورت زیر نمایش داد.
حل تمرین از کایرالیته
در این بخش تعدادی تمرین چند گزینهای را مورد بررسی قرار میدهیم. در صورتی که برای پاسخگویی به تمرینی نیاز به توضیحات بیشتر باشد، آن را در بخش پاسخ تشریحی آوردهایم.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
تمرین نهم
تمرین و آزمون
تمرین دهم
تمرین و آزمون
تمرین یازدهم
تمرین و آزمون
تمرین دوازدهم
تمرین و آزمون
تمرین سیزدهم
تمرین و آزمون
تمرین چهاردهم
تمرین و آزمون
تمرین پانزدهم
تمرین و آزمون
تمرین شانزدهم
تمرین و آزمون
تمرین هفدهم
تمرین و آزمون
تمرین هجدهم
تمرین و آزمون
سوالات متدوال
حال که میدانیم کایرالیته چیست و چگونه قابل تشخیص است، میخواهیم در این بخش به تعدادی از سوالات متدوال پیرامون آن پاسخ دهیم.
مخلوط راسمیک چیست؟
مخلوط راسمیک ترکیبی است که در آن به میزان برابری از انانتیومر چپگرد و انانتیومر راستگرد یک مولکول کایرال وجود داشته باشد.
انانتیومر چیست؟
به مولکولی که دارای مرکز کایرال باشد و روی تصویر آينهای خود منطبق نشود، انانتیومر میگویند.
کایرالیته یا دستسانی چیست؟
این دو مفاهیمی مشابه هستند که برای توصیف مولکولهایی با مرکز کایرال به کار میروند. کربنی را دارای مرکز کایرال میدانیم که به ۴ استخلاف متفاوت متصل باشد.
دیاسترومر چیست؟
دیاسترومرها ایزومرهای فضایی هستند که تصویر آینهای یکدیگر نیستند و صورتبندی آنها در حداقل یکی از مراکز فضایی با دیگری متفاوت است.
فعالیت نوری چیست؟
فعالیت نوری برهمکنشی است که یک انانتیومر با نور قطبیده دارد و آن را در یک جهت با مقدار خاصی میچرخاند.
مولکول آکایرال چیست؟
مولکولی که دارای تصویر آينهای باشد و بر آن تصویر منطبق نیز شود را مولکول آکایرال مینامند.
آیا آمینواسیدها دارای مرکز کایرال هستند؟
بله، یکی از ویژگیهای کلیدی آمینواسیدها این است که کربن آلفای موجود در ساختار آنها به دلیل اتصال به ۴ استخلاف متفاوت، کایرال است.
جمعبندی
هدف از این مطلب مجله فرادرس آشنایی با مفهوم کایرالیته و نحوه تشخیص آن بود. همچنین با مفاهیم مرتبط با آن مانند مرکز کایرال، آرایش فضایی و ایزومرهای هندسی نیز آشنا شدیم. در نهایت نیز با بررسی تعدادی مثال روی ترکیبات آلی، تلاش کردیم تا این مفهوم را روی مولکولها تشخیص دهیم.