هالوژن ها – به زبان ساده
هالوژنها گروه 17 از عناصر در جدول تناوبی را با نامهای فلوئور، کلر، برم، ید و اَستاتین تشکیل میدهند. در زمان واکنشِ هالوژنها با فلزات، نمکهای بسیاری از جمله «کلسیم فلوراید» ، «سدیم کلرید» ، «نقره برمید» و «پتاسیم یدید» تولید میشوند. تمامی هالوژن ها موادی بسیار سمی هستند و در زمان پیوند با هیدروژن، تولید اسید میکنند. یک هالوژن معمولا از نمکها و مواد معدنی بدست میآید. از کلر، برم و ید در ضدعفونیکنندهها استفاده میشود.

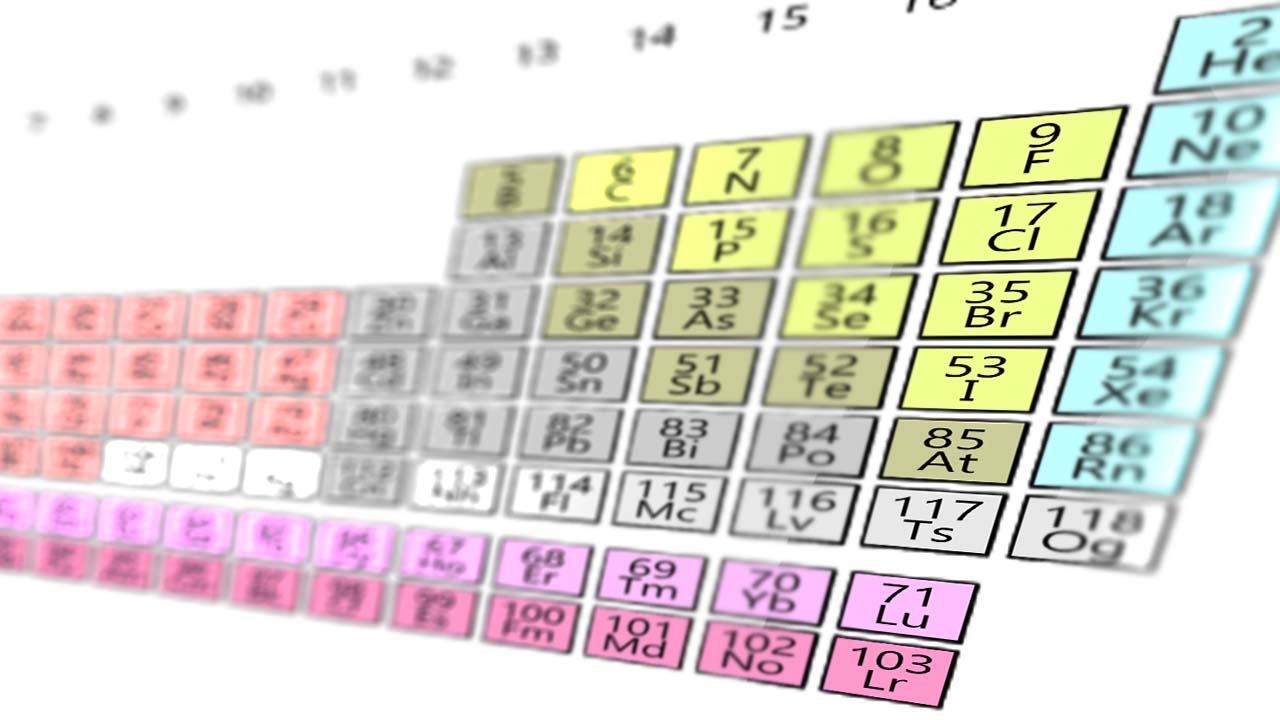

هالوژنها از بالا به پایین روندهای تناوبی در پیوندهای شیمیای از خود نشان میدهند. البته فلوئور از این قاعده به طور کامل پیروی نمیکند؛ به طوریکه در ترکیب با اتمهای دیگر، بیشترین انرژی پیوند را دارد اما مولکول پیوند بسیار ضعیفی دارد؛ در نتیجه در جدول تناوبی از بالا به پایین، واکنشپذیری عناصر به دلیل افزایش شعاع اتمها کاهش مییابد. هالوژنها به شدت واکنشپذیرند و در مقادیر زیاد میتوانند برای اورگانیسمهای زنده مرگآفرین باشند.

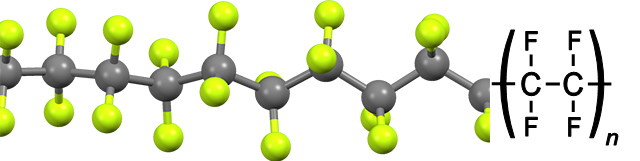
بار موثر هسته در این عناصر بالا بوده و سبب الکترونگاتیوی و واکنشپذیری بالا در آنها شده است. هالوژنها با گرفتن تنها یک الکترون در واکنش با عناصر دیگر به پایداری میرسند. واکنشپذیری بسیار بالای فلوئور سبب تشکیل پیوندهایی با گازهای نجیب و حتی اثرگذاری بر روی موادی همچون شیشه شده است. اگر این عنصر در شیشه نگهداری شود، در حضور آب، با شیشه واکنش میدهد و تشکیل «سیلیکون تترافلوئورید» میدهد. در نتیجه به علت خورندگی بالای این عنصر و واکنش با شیشه، حملونقل و نگهداری آن باید در ظروف تفلون انجام شود. واکنشپذیری بالای فلوئور به طور معجزهآسایی سبب تشکیل پیوندهای بسیار قوی به خصوص با کربن شده است. به عنوان مثال، تفلون حاصل پیوند کربن با فلوئور، با نقطه ذوب بالا و به شدت در مقابل حملات شیمیایی مقاوم است.
ترکیبات هالوژن ها
هالوژنها ترکیبات مختلفی همچون «هیدروژن هالیدها» (Hydrogen Halides)، «متال هالیدها» (Metal Halides)، «ترکیبات بینهالوژنی» (Interhalogen Compunds) و «ترکیبات اورگانوهالوژن» (Organohalogen Compounds) تشکیل میدهند که در ادامه به بررسی آنها میپردازیم.
هیدروژن هالیدها
تمامی یونهای هالید در واکنش با هیدروژنها، تشکیل هیدروژن هالید میدهند. واکنشپذیری در فرآیندهای هیدروژن-هالوژن، با افزایش جرم هالوژنها کاهش مییابد. حتی در نبود نور و گرما، واکنش فلوئور-هیدورژن به صورت انفجاری رخ میدهد.
واکنش کلر-هیدروژن هم انفجاری است اما به نور و گرما احتیاج دارد. واکنش برم با هیدروژن، تنها در حضور شعله به صورت انفجاری است. ید و استاتین نیز به صورت جزیی با هیدروژن واکنش میدهند و به تعادل میرسند.

هیدروژن هالیدها یک ترکیب دوتایی از هالوژن و هیدروژن است. ترکیباتی همچون «هیدروژن فلورید» ، «هیدروژن کلرید» و «هیدروژن برمید» از این دستهاند که در ترکیب با آب تشکیل اسید میدهند. تنها هیدروژن هالیدِ با پیوند هیدروژنی، هیدروژن فلورید است. در طبقهبندی اسیدها، هیدروکلریک اسید، هیدروبرمیک اسید و هیدرواَستاتیک اسید همگی به عنوان اسید قوی و هیدروفلوریک اسید، اسید ضعیف طبقهبندی میشوند. هیدروژن هالیدها همگی حساسیتزا هستند. هیدروژن فلورید سبب ورم ریوی و از بین رفتن سلولها میشود. تنفس گاز هیدروژن کلرید در مقدار بسیار کم کافی است تا به مرگ شخص بیانجامد.
متال هالیدها
تمامی هالوژنها با سدیم واکنش و به ترتیب تشکیل «سدیم فلورید» ، «سدیم کلرید» ، «سدیم برومید» ، «سدیم یدید» و سدیم اَستاتید میدهند. گرمادهی به واکنش سدیم با هیدروژنها سبب تولید شعله نارنجیِ روشن میشود.
آهن نیز در واکنش با فلوئور، کلر و برم تشکیل آهن (III) هالید میدهد که واکنش آن در زیر آورده شده است:
سیم ظرفشویی حتی در دمای پایین به سرعت با فلوئور واکنش و تشکیل ترکیب سفیدرنگ آهن (III) فلورید میدهد. واکنش کلر با آهن در حضور گرما سبب تشکیل ترکیب سیاهرنگ آهن (III) کلرید میشود. آهن در واکنش با برم، ترکیب قرمز-قهوهای آهن (III) برمید تولید میکند. واکنشپذیری آهن با برم کمتر از واکنشپذیری آن با فلوئور و کلر است. واکنش آهن با ید نسبت به واکنش با دیگر هالوژنها کمتر است اما در حضور گرما تشکیل آهن (II) یدید میدهد.

ترکیبات بین هالوژنی
ترکیبات بینهالوژنی با فرمول عمومی شناخته میشوند. در این رابطه X و Y هالوژن است و n، اعداد صحیح ۱، ۳، ۵ یا ۷ را میپذیرد. این ترکیبات، دو هالوژن متفاوت در ساختار مولکولی خود دارند. تمامی این ترکیبات به غیر از ، با ترکیب هالوژنهای خالص تحت شرایط مختلف تولید میشوند.
واکنشپذیری ترکیبات بینهالوژنی نسبت به مولکولهای دو اتمی هالوژنها بیشتر است. البته مولکول از این قانون پیروی نمیکند.
اروگانو هالوژنها
برخی مواد در طبیعت و بسیاری از ترکیبات آلی سنتز شدهاند که همچون پلاستیکهای پلیمری شامل اتمهای هالوژن هستند. این نوع از مواد با نام «ترکیبات هالوژندار شده» (Halogenated) یا «هالیدهای آلی» (Organic Halides) شناخته میشوند. کلر با بیشترین فراوانی در آب دریا در بهبود عملکرد مغز انسان و تولید اسید معده فعالیت دارد. ید نیز در تولید هورمونهای تیروئید همچون تیروکسین نقش اساسی دارد.
واکنش هالوژن ها
واکنش فلوئور با آب و تولید اکسیژن و هیدروژن فلورید:
واکنش کلر با آب و تشکیل مخلوط هیدروکلریک اسید و هیپوکلروس اسید. از این محلول در سفیدکنندهها و ضدعفونی کنندهها استفاده میشود:
واکنش آهسته مولکول برم با آب و تشکیل هیدروژن برمید و هیپوبرموس اسید:
لازم به ذکر است در این دسته از واکنشها، ید حلالپذیری بسیار کمی در آب دارد و با آن واکنش نمیدهد.
ایزوتوپها
فلوئور تنها یک ایزوتوپ پایدار با نام فلوئور 19 و در کل 18 ایزوتوپ با جرم اتمی از 14 تا 31 دارد. ایزوتوپهای پایدار کلر، کلر 35 و کلر 37 است. تعداد 24 ایزوتوپ با جرم اتمی 28 تا 51 برای کلر کشف شده است. برم، ۲ ایزوتوپ پایدار و ید، یک ایزوتوپ پایدار در طبیعت دارند. استاتین هیچ ایزوتوپ پایداری ندارد اما در واپاشی رادیواکتیو اورانیوم، نپتونیوم و پلوتونیوم، سه ایزوتوپ با نامهای استاتین 215، استاتین 217 و استاتین 219 تولید شده است.

کاربردها
هالوژنها کاربردهای متعددی در ضدعفونیکنندهها، لامپها و ترکیبات دارویی دارند.
ضدعفونی کنندهها
از کلر و برم در ضدعفونی کردن آب آشامیدنی، استخر، سونا، ظرفها و سطوح استفاده میشود. در طی فرآیند «استرلیزه کردن» (Sterilization)، این مواد سبب کشته شدن باکتریها و دیگر میکروارگانیسمها میشوند. «سدیم هیپوکلریت» ، ماده اصلی در ترکیبات بیشتر سفیدکنندهها است. در برخی موارد، این سفیدکنندها در تولید محصولات سلولوزی استفاده میشوند.
لامپها
لامپهای هالوژنی نوعی از لامپهای فیلامنتی است که در آن از مقادیر اندکی هالوژن همچون برم و ید استفاده شده است. این کار باعث میشود تا بتوان لامپهایی کوچکتر با همان قدرت لامپهای فیلامنتی تولید کرد. لامپهای هالوژنی در دمای بیشتری نسبت به لامپهای فیلامنتی شروع به نوردهی میکنند و به همین دلیل برای جلوگیری از شکست شیشه در این لامپها باید از نوع خاصی از کوارتز استفاده کرد.

ترکیبات دارویی
از اتمهای هالوژن برای نفوذ از طریق غشای لیپید و بافتها استفاده میشود. همچنین داروهای هالوژندار شده تمایل به تجمع در بافتهای چربی دارند. گروههای آروماتیکی هالوژنها، واکنشپذیری بسیار کمتری نسبت به گروههای آلیفاتیک دارند. از ویژگی واکنشپذیری هالوژنها در ساخت داروهای ضدسرطان نیز استفاده میشود.
نقش بیولوژیکی
یون فلوراید در استخوانها، دندانها، خون، اوره و موی جانداران یافت میشود. مقادیر بسیار کمی از این یون برای انسان ضروری است. در هر لیتر از خون انسان، 0/5 میلیگرم از فلوئور وجود دارد. این مقدار در استخوانها 0/2 تا 1/2 درصد و در بافتهای بدن حدود است. در حدود 3 تا ۶ گرم از این عنصر در بدن یک شخص 70 کیلوگرمی یافت میشود. یون کلر برای انسان و بسیاری از موجودات ضروری است. غلظت کلر در غلات حدود و در سیبزمینی در حدود 0/5 درصد است. رشد گیاهان وابستگی شدیدی به غلظت کلر دارد. در خون انسان 0/3 درصد و در استخوانها از کلر وجود دارد. میزان کلر در بافتهای بدن به حدود 0/2 تا 0/5 درصد میرسد. حدود 95 گرم از این عنصر در بدن یک شخص 70 کیلوگرمی یافت میشود.

برم به صورت یون در تمام جانداران یافت میشود. نقش آن در بدن انسان هنوز درک نشده است اما یک انسان در روز، حدود 1 تا ۲۰ میلیگرم از برم را مصرف میکند. خون انسان شامل برم است. این میزان در استخوانها و بافت انسان به میرسد. شخصی با وزن 70 کیلوگرم، در حدود 260 گرم از این عنصر را در بدن خود دارد.
مصرف ید در بدن انسان، روزانه کمتر از 100 میکروگرم است. کمبود ید در بدن موجب ناتوانی ذهنی میشود. «ترکیبات آلی یددار» (Organoiodine Compounds) در غدد انسان، معده، پوست و سیستم ایمنی یافت میشوند. این عنصر در میگو، صدف، گل آفتابگردان، بذر گیاهان و قارچها یافت موجود است؛ اما نقش ید در فعالیت بیولوژیکی گیاهان شناخته شده نیست. در هر لیتر از خون انسان 0/06 میلیگرم ید وجود دارد. این عنصر در استخوانها و در بافتهای انسان حدود است. در بدن یک شخص 70 کیلوگرمی، 10 تا ۲۰ میلیگرم از این عنصر یافت میشود. لازم به ذکر است که استاتین هیچ نقش بیولوژیکی در بدن انسان ندارد.
سمی بودن هالوژنها
میزان سمی بودن هالوژنها با افزایش جرم اتمی، کاهش مییابد. گاز فلوئور بسیار سمی و کشنده است و استشمام آن با غلظت تنها منجر به مرگ میشود. هیدروفلوئوریک اسید نیز بسیار سمی است و موجب نفوذ در پوست بدن و بروز سوختگیهای شدید میشود. یونهای فلوئور به اندازه فلوئور خالص سمی نیستند. میزان 5 تا ۱۰ گرم از یون فلورید کشنده است و استفاده از آن در غلظتهای بیش از باعث فلوروز دندان میشود. غلظتهای بالاتر از از این یون سبب شکنندگی استخوانها در اثر سخت شدن میشود. برای جلوگیری از پوسیدگی دندانها میزان به آب آشامیدنی اضافه میکنند تا هم موجب فلوروز نشود و هم از پوسیدگی دندانها جلوگیری کند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش محلول سازی در آزمایشگاه
- گاز نجیب — به زبان ساده
- فلزات قلیایی — به زبان ساده
^^













از زحماتتون سپاسگزارم.پاینده باشید
سلام وقت بخیر
در واکنش هالوزناسیون که در ۳ مرحله آغاز وگسترش و پایان است وبه صورت رادیکالی در حضور نور صورت می گیرد .
چرا بروماسیون گرماگیر و کلراسیون گرماده است؟
سلام کلر در چه دمایی با هیدروژن واکنش میدهد؟؟
با سلام؛
گاز کلر با گاز هیدروژن در دمایی بالاتر از ۲۵۰ درجه سانتیگراد واکنش و تشکیل اسید قوی هیدروکلریک اسید میدهد. رطوبت نیز سرعت این واکنش را افزایش میدهد.
از همراهی شما با مجله فرادرس سپاسگزاریم
سلام خسته نباشید
هالوژن ها در هر دمایی می توانند با هیدروژن واکنش بدهند ؟
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. سرعت واکنش هالوژنها با هیدروژن ممکن است متفاوت باشد. به طور مثال، ید و هیدروژن به راحتی با یکدیگر حتی در دماهای بالا واکنش نمیدهند به همین دلیل نمیتوان به صورت کلی گفت که در هر دمایی واکنش میدهند مگر اینکه ید را از این قانون کلی جدا کنیم. البته در بخش «واکنش هالوژنها» نیز این مطلب بیان شده است.
با تشکر