نیروی الکتروموتوری چیست؟ – به زبان ساده + نکات مهم
نیروی الکتروموتوری یا emf، بیشترین حد تفاوت پتانسیل الکتریکی بین دو الکترود یک سلول الکتروشیمیایی، در غیاب جریان است. در واقع نیروی الکتروموتوری توانایی یک عنصر، ترکیب یا یون برای دریافت یا از دست دادن یا آزاد کردن الکترون است. اگر هیچ جریان الکتریکی خارجی از سلول الکتروشیمیایی عبور نکند، میزان نیروی الکتروموتوری بر حسب ولتاژ به دست میاید و به کمک اختلاف پتانسیل دو الکترود یا دو نیم واکنش اکسایش و کاهش، محاسبه میشود. این پارامتر به عوامل مختلفی از جمله غلظت مواد موجود در الکترولیت، دما و فشار گاز وابسته است. در این مطلب از مجله فرادرس، مفهوم شیمیایی نیروی الکتروموتوری را توضیح خواهیم داد و مثالهایی را برای فهم بهتر آن بررسی میکنیم.
- نحوه محاسبه emf و بررسی ارتباط آن با پتانسیل سلول را یاد خواهید گرفت.
- میتوانید نقش اجزا و عملکرد سلولهای الکتروشیمیایی را بهخوبی توضیح دهید.
- میآموزید تأثیر غلظت، دما و فشار بر emf را ارزیابی کنید.
- با کاربردهای عملی و صنعتی نیروی الکتروموتوری در فناوریهای نوین آشنا میشوید.
- روش تشخیص تفاوتهای مهم میان پتانسیل سلول و emf را خواهید آموخت.
- نحوه اندازهگیری emf با ابزارهای تخصصی را یاد میگیرید.

در این مطلب به مفاهیم اساسی و کاربردی در زمینه نیروی الکتروموتوری میپردازیم. ابتدا تعریف سلول الکتروشیمیایی و ساختار آن را توضیح میدهیم و به تفاوت میان سلول گالوانی و سلول الکترولیتی اشاره میکنیم. سپس به موضوع مهم نیروی الکتروموتوری و روش محاسبه آن میپردازیم و با ارائه یک مثال ساده، نحوه محاسبه میزان نیروی الکتروموتوری سلول را شرح میدهیم. در ادامه واحد اندازهگیری این نیرو معرفی و تفاوت پتانسیل سلول و نیروی الکتروموتوری را بررسی میکنیم. همچنین توضیحاتی در مورد پتانسیل الکترود و نحوه تاثیر عوامل مختلف بر نیروی الکتروموتوری و ولتاژ سلول را ارائه میدهیم. علاوه بر این، کاربردهای عملی محاسبه نیروی الکتروموتوری در صنایع و فرایندهای مختلف را توضیح میدهیم. با مطالعه این مطلب تا انتها با این مبحث مهم آشنا شوید.
نیروی الکتروموتوری سلول الکتروشیمیایی
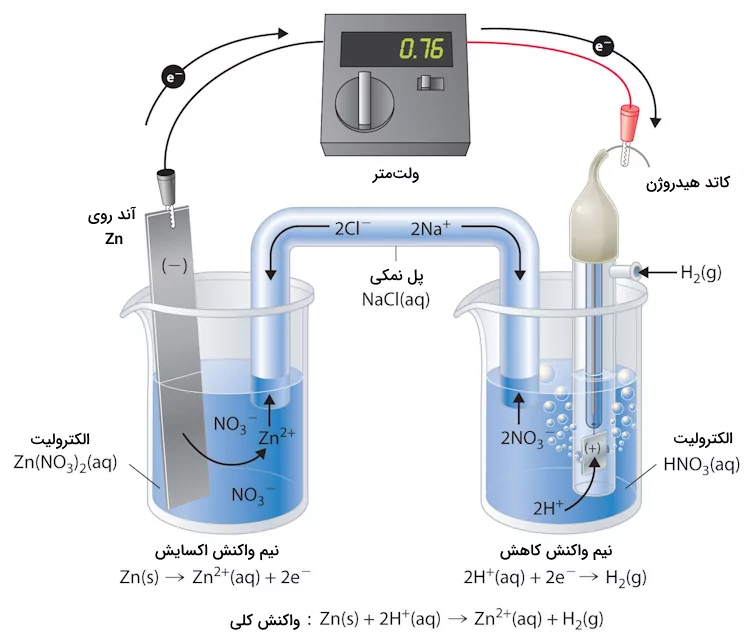
یکی از مهمترین مفاهیم الکتروشیمی، نیروی الکتروموتوری است. نیروی الکتروموتوری یک سلول، اندازهگیری میزان پتانسیل یا ولتاژ الکتریکی آن است. این مقدار در واقع تفاوت بین پتانسیلهای دو نیم سلول است. میتوان به پتانسیل emf سلولهای الکتروشیمیایی به چشم پتانسیل سلولهای الکتریکی نگاه کرد. جریان الکترونی از چگالی الکترونی بیشتر به سمت کمتر حرکت میکند و این تبادلات الکترونی را در سلول الکتروشیمیایی، الکترودها انجام میدهند که اعداد اکسایش متفاوتی دارند. به همین دلیل نمیتوان از دو الکترود از جنس یکسان استفاده کرد زیرا در آن صورت جریان الکتریکی به وجود نمیآید.
یکی از این الکترودها باید به عنوان کاتد عمل کند که در آن الکترونها را دریافت کرده (واکنش کاهش) و دیگری به عنوان تولیدکننده الکترون (واکنش اکسایش) عمل کند. در صورت وجود تفاوت بزرگی میان اعداد اکسایش آند و کاتد، جریان الکتریکی از الکترود با عدد اکسایش بیشتر به سمت الکترود با عدد اکسایش کمتر حرکت میکند.
اندازهگیری emf یک سلول الکتروشیمیایی میتواند به فهم این موضوع که سلول مورد بررسی گالوانی است یا دارای جریان است کمک کند. این خاصیت همچنین برای طراحی باتریها مفید است و میتواند به محاسبه میزان سلولهای مورد نیاز برای رسیدن به ولتاژی مشخص کمک کند.
روش محاسبه نیروی الکتروموتوری
روش محاسبه نیروی الکتروموتوری emf بسیار ساده است. برای این کار کافی است میزان پتانسیل احیای کمتر را از مقدار پتانسیل احیای بیشتر، کم کنیم. میزان پتانسیل اکسیداسیون میتواند مثبت یا منفی باشد. مقادیر منفی پتانسیل نشاندهنده این است که واکنش کاهش الکترود در جهت عکس حرکت میکند. هر الکترودی که میزان پتانسیل اکسایشی اش بیشتر دارای میزان پتانسیل کاهشی کمتری است.
این بدان معنی است که حتی اگر میزان پتانسیل هردو الکترود مثبت باشد، الکترود با پتاسیل کمتر به عنوان کاتد و دیگری به عنوان آند عمل میکند و بههر حال نیروی الکتروموتوری وجود خواهد داشت. فرمول محاسبه نیروی الکتروموتوری که یکی از مهمترین فرمولهای شیمی دوازدهم است، به شکل زیر از تفاوت بین پتانسیل کاتد و آند به دست میآید.
مقادیر ولتاژی که روی باتریها نوشته میشود در واقع همان emf باتری است. معادله بالا معمولا با نام معادله نرنست شناخته میشود.

واحد اندازهگیری نیروی الکتروموتوری
میزان نیروی الکتروموتوری با واحد ولت اندازهگیری میشود که یک واحد استاندارد SI است. میزان emf در فیزیک همچنین به عنوان میزان کار انجام شده در واحد ژول برای حرکت دادن یک کولن بار از یک نقطه به نقطهای دیگر است. در نتیجه میزان نیروی الکتروموتوری بر حسب ژول بر کولن نیز اندازهگیری میشود.
بدین ترتیب هر یک ولت برابر با یک ژول بر کولن میشود. ولت همچنین برای اندازهگیری پتانسیل استاندارد کاهش هم استفاده میشود.
مثال محاسبه نیروی الکتروموتوری
همانطور که در قسمت قبل اشاره شد، با به دست آوردن اختلاف ولتاژ دو الکترود میتوان میزان emf را محاسبه کرد. در مثال زیر میتوانید این روش محاسبه را مشاهده کنید.
مثال اول محاسبه emf
میزان ولتاژ سلول زیر را با مقادیر پتانسیل داده شده به دست آورید.
و
پاسخ
معادله به دست آوردن نیروی الکتروموتوری به شکل زیر است:
با انجام شدن واکنش اکسایش در آند، میزان پتانسیل زینک که از عدد اکسایش صفر به +۲ رسیده است، مسئول تولید الکترون سلول است. بدین ترتیب، واکنش تبدیل نقره با یک بار مثبت به نقره خنثی، به عنوان کاتد عمل میکند. میزان نیروی الکتروموتوری از تفاوت پتانسیل بین الکترودهای نقره و روی بهدست میآید. با جایگذاری این مقادیر در معادله، میزان emf سلول به دست میآید.
مثال دوم محاسبه emf
سلولهای نیکل کادمیوم در وسایل الکترونیکی قابل حمل استفاده میشوند. واکنشهای انجام شده در هر نیم سلول به شکل زیر هستند. با توجه به اطلاعات داده شده، واکنش کلی سلول را نوشته و میزان نیروی الکتروموتوری آن را محاسبه کنید.
پاسخ
در واکنش نیکل، یک الکترون دریافت شده و کادمیوم دو الکترون تولید میکند، پس در واکنش کلی، نیم واکنش نیکل باید ضریب ۲ بگیرد. از آنجا که پتانسیل استاندارد الکترود کادمیوم منفی است، واکنش کاهش آن در جهت عکس انجام میشود. نیکل الکترود کاتد و کادمیوم الکترود آند هستند.
سلول الکتروشیمیایی چیست؟
یک سلول الکتروشیمیایی وسیلهای است که میتوان برای تولید الکتریسیته از یک واکنش شیمیایی یا انجام دادن یک واکنش شیمیایی استفاده شود. به بیان دیگر، سلول الکتروشیمیایی وسیلهای برای تبدیل انرژی شیمیایی به انرژی الکتریکی و بالعکس است. باتری از یک یا تعداد بیشتری سلول الکتروشیمیایی تشکیل شده است. این سلولها یک پتانسیل الکتریکی یا ولتاژی تولید میکنند که به جریان الکتریکی تبدیل میشود. میزان قدرت پتانسیل الکتریکی و جریان به واکنشهای شیمیایی که در سلولها انجام میشود و مواد موجود در فرایند الکتروشیمیایی آنها بستگی دارد.
کاربردهایی که سلول الکتروشیمیایی دارد بسیار گسترده است و اگر میخواهید به شکل بهتری با این علم آشنا شوید، میتوانید فیلم آموزش الکتروشیمی کاربردی – جامع و با مفاهیم کلیدی فرادرس را مشاهده کنید که لینک آن را در زیر درج کردهایم.
واکنشهای شیمیایی درون سلولهای الکتروشیمیایی شامل انتقال الکترون بین الکترودها هستند. این انتقال الکترون به این شکل انجام میگیرد که یک الکترود الکترون آزاد میکند و الکترود دیگر الکترون را جذب میکند. الکترودی که الکترون از دست میدهد آند است و الکترودی که الکترون دریافت میکند با نام کاتد شناخته میشود. در الکترود آند واکنش اکسایش و در الکترود کاتد واکنش کاهش انجام میگیرد. در سلولهای گالوانی آند به عنوان الکترود منفی و الکترود کاتد به عنوان الکترود مثبت عمل میکند. این مسئله در سلولهای الکترولیتی برعکس است. یعنی آند قطب مثبت و کاتد قطب منفی است.
میزان نیروی الکتروموتوری emf را میتوان به وسیله مواد شیمیایی که در سلول استفاده شده است اندازهگیری کرد. هرچند ولتاژ به دست آمده از روابط ریاضی میزان ولتاژ ایدهآل است که با مقادیر حقیقی به دلیل وجود عواملی مانند دما و غلظت الکترولیت متفاوت است.
اجزای سازنده سلول الکتروشیمیایی
پیشتر اشاره کردیم که نیروی الکتروموتوری، بیشترین تفاوت بین دو الکترود سلول الکتروشیمیایی است هنگامی که جریان وجود نداشته باشد. این پارامتر با استفاده از ولتاژ خالص بین نیم واکنشهای اکسایش کاهش اندازهگیری میشود. الکترونها به صورت کلی از محلی که پتاسیل بیشتری دارد به محلی که پتانسیل کمتری دارد حرکت میکنند. به جریان حرکت الکترونها الکتریسیته یا جریان گفته میشود.
یک سلول الکتروشیمیایی از دو الکترود، یک محلول الکترولیت، یک پل و یک ظرف نگهدارنده تشکیل شده است. خیلی ساده میتوان با استفاده از لیمو و دو الکترود (دو فلز متفاوت) یک سلول الکتروشیمیایی کوچک ساخت. فلزات استفاده شده در سلولهای الکتروشیمیایی آزمایشگاهی معمولا مس و روی هستند. در ادامه این اجزا سلول الکتروشیمیایی را توضیح میدهیم.
الکترولیت
الکترولیتها مواد شیمیایی هستند که در صورت حل شدن و تفکیک در آب میتوانند یون با بار مثبت و منفی ایجاد کنند. در واقع این مواد با حل شدن در آب به یونهای سازندهشان شکسته میشوند. این یونها در حضور یک نیروی خارجی مانند میدان الکتریکی میتوانند حرکت کرده و باعث بهوجود آمدن جریان الکتریکی شوند. مهمترین انواع الکترولیت اسیدها، بازها و نمکهای یونی هستند. برای مثال سدیم کلرید در آب یونهای سدیم مثبت و کلر منفی تولید میکند و یک الکترولیت محسوب میشود.
الکترود
الکترودها پایانههای الکتریکی در سلولهای الکتروشیمیایی مانند باتریها هستند. این مواد معمولا از جنس فلز هستند و در یک بستر رسانای الکتریکی مانند الکترولیت قرار میگیرند. این الکترودها بسته به تولید یا جذب الکترون از دو نوع مثبت و منفی هستند.
پل
پل در سلولهای الکتروشیمیایی وظیفه وصل کردن دو نیم سلول به یکدیگر و ارتباط الکترودها را بر عهده دارد. گاهی اوقات نیم سلولهای اکسایش و کاهش جداگانه تهیه شده و توسط یک پل نمکی برای انتقال یونها و الکترونها به یکدیگر متصل میشوند.
پل نمکی یک لوله U شکل وارونه است که با محلول غلیظ یک الکترولیت خنثی پر شده است. این الکترولیت خنثی با محلولهای موجود در دو نیمسلول واکنش نمیدهد و در تغییرات شیمیایی شرکت نمیکند. نمکهایی مانند ، و معمولا به عنوان الکترولیت استفاده میشوند.
نحوه ساخت پل نمکی
برای ساخت یک پل نمکی، یکی از مواد آگار یا ژلاتین با محلول غلیظ الکترولیت گرمشده مخلوط میشود و به لوله U شکل ریخته میشود. پس از خنکشدن، محلول به شکل ژل در میآید و از اختلاط مایعات جلوگیری میکند. برای کاهش پراکندگی، دو سر لوله با پنبه پر میشود.
اهمیت پل نمکی
- هدف اصلی آن جلوگیری از ایجاد اختلاف پتانسیل بین دو محلول هنگام تماس است.
- با پیوند دادن الکترولیتهای دو نیمسلول، مدار الکتریکی را تکمیل میکند.
- مانع از انتشار محلولها از یک نیمسلول به نیمسلول دیگر میشود.
- باعث حفظ خنثی بودن الکتریکی محلولها در دو نیمسلول میشود.
وقتی یونهای مثبت تولید شده وارد محلول میشوند، بار مثبت در نیمسلول آندی تجمع مییابد. پل نمکی یونهای منفی را برای حفظ خنثی بودن الکتریکی فراهم میکند. در نیمسلول کاتدی، کاهش یونهای مثبت منجر به تجمع یونهای منفی میشود. پل نمکی یونهای مثبت را برای حفظ خنثی بودن الکتریکی فراهم میکند.

پتانسیل سلول الکتروشیمیایی
پتانسیل سلول الکتروشیمیایی میزان تفاوت بین پتانسیل استاندارد دو نیم واکنش اکسایش و کاهش است. این پتانسیل به پتانسیل الکترودها مرتبط است که مستقیما با تمایل آنها در دفع یا جذب الکترون ارتباط دارد. پتانسیل استاندارد الکترودها نسبت به الکترود هیدروژن سنجیده شده و با علامت نشان داده میشود.
پتانسیل الکترود به اختلاف پتانسیل ایجادشده در سطح مشترک فلز و محلول هنگام فرو بردن یک الکترود فلزی در محلولی حاوی یونهای فلز آن گفته میشود. پتانسیل سلول تفاوت پتانسیل بین دو الکترود را نشان میدهد.
به عنوان مثال، وقتی یک میله روی در محلولی حاوی یونهای غوطهور میشود، فرایند اکسیداسیون رخ میدهد و یونهای از میله روی وارد محلول میشوند و الکترونهای اضافی در میله روی باقی میمانند. این باعث میشود که میله روی نسبت به محلول بار منفی داشته باشد، و در نتیجه اختلاف پتانسیل بین میله روی و محلول ایجاد میشود که به آن پتانسیل الکترود روی میگویند.
در مقابل، زمانی که یک میله مس در محلولی حاوی یونهای غوطهور میشود، یونهای الکترونها را از میله مس جذب میکنند و باعث میشوند که میله مس بار مثبت بگیرد. این اختلاف پتانسیل بین میله مس و محلول به عنوان پتانسیل الکترود مس شناخته میشود.
انواع سلولهای الکتروشیمیایی
سلولهای الکتروشیمیایی بر اساس سیستم کار و کاربردشان به دو دسته سلولهای گالوانی (ولتایی) و سلولهای الکترولیتی تقسیم میشوند. این سلولها در ادامه توضیح داده شدهاند.
سلول گالوانی
این سلولها با استفاده از واکنشهای شیمیایی خودبهخودی کار کرده و نیروی الکتریکی تولید میکنند. این سلولها از دو فلز متفاوت تشکیل شدهاند که به وسیله یک پل نمکی یا صفحهی متخلخل به یکدیگر متصل هستند. با عبور یونها بین این دو الکترود نیروی الکتریکی تولید میشود. از مثالهای این نوع سلول میتوان به انواع باتریهای وسایل مختلف اشاره کرد.
در سلولهای گالوانی (ولتایی)، واکنش اکسایش در الکترود آند انجام میگیرد و واکنش کاهش در الکترود کاتد انجام میگیرد. الکترونها از الکترود آند به سمت الکترون کاتد مهاجرت کرده و باعث ایجاد جریان الکتریکی و نیروی الکتروموتوری میشوند. در این سلولها الکترود مثبت کاتد و الکترولیت منفی آند است.
به شکلی قراردادی، هنگامیکه سلول با علامتهای اختصاری نشاندهنده سلول نوشته میشود، اگر مقدار نیروی الکتروموتوری داده شده مقداری مثبت داشته باشد، واکنش شیمیایی سلول داده شده به شکل خودبهخودی انجام میشود. به این معنی که الکترود سمت چپ الکترون ازاد کرده و الکترود سمت راست الکترود دریافت میکند. از طرف دیگر، اگر نیم سلول سمت چپ مشخص شده در علامت سلول الکترون دریافت کرده و عنصر سمت راست الکترون آزاد کند، میزان نیروی الکتروموتوری سلول منفی شده و نشان دهنده این موضوع است که واکنش شیمیایی آن به شکل خودبهخودی انجام نمیشود.
مثال
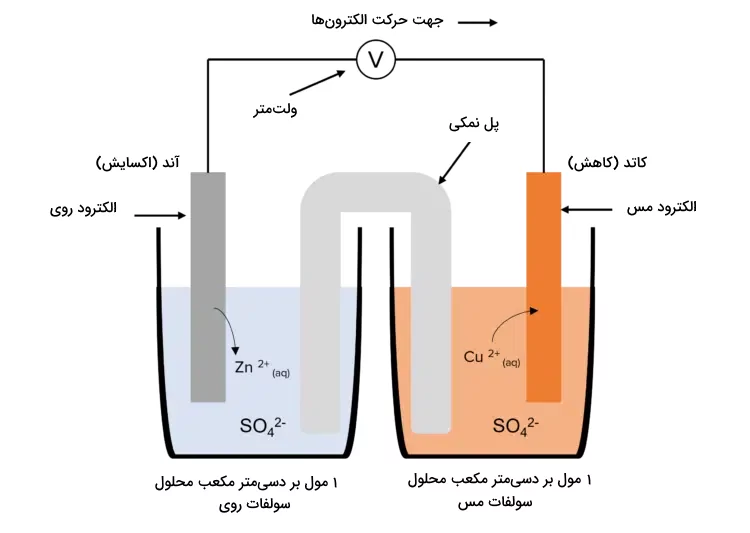
اگر ولت متر میزان ولتاژ برای سلول دانیل را برابر با ۱٫۱۰ ولت نشان دهد، مقدار نیروی الکتروموتوری این سلول چقدر است؟
با توجه به اینکه در این سلول (سلول دانیل) فلز روی به عنوان آند (آزاد کننده الکترون) و فلز مس به عنوان کاتد (دریافت کننده الکترون) عمل میکنند، عبارت بالا به صورت عکس نوشته شده و واکنش آن خودبهخودی نیست، پس میزان نیروی الکتروموتوری آن برابر با ۱٫۱۰- ولت میشود.
سلول الکترولیتی
سلولهای الکترولیتی مشابه سلولهای گالوانی هستند زیرا هر دو به یک پل نمکی، دو الکترود و جریان الکترونها از آند به کاتد نیاز دارند. با این حال، تفاوتهای مهمی بین این دو نوع سلول وجود دارد. در یک سلول الکترولیتی، انرژی الکتریکی به انرژی شیمیایی تبدیل میشود، برخلاف سلولهای گالوانیکی که در آنها انرژی شیمیایی به انرژی الکتریکی تبدیل میشود. در سلول الکترولیتی، یک منبع خارجی ولتاژ الکتریکی باعث میشود که واکنشهای غیرخودبخودی رخ دهند.
تفاوت سلول گالوانی و سلول الکترولیتی
سلولهای گالوانی و الکترولیتی هر دو از انواع سلولهای الکتروشیمیایی هستند و تفاوت این سلولها در روش تولید جریان است. در سلولهای گالوانی، الکترودها از فلزهایی با اعداد اکسایش متفاوت تشکیل شدهاند و واکنشهای اکسایشی در این سلولها همواره در حال رخ دادن هستند. به همین دلیل این سلولها بدون وجود نیروی خارجی، دارای انرژی هستند.
سلولهای الکترولیتی برای انجام واکنشهای شیمیایی به وجود یک میدان الکتریکی خارجی نیاز دارند و واکنشهای اکسایشی و کاهشی به شکل متوالی در این سلولها انجام نمیگیرد. این سلولها همواره برای انتقال جریان نیاز به نیروی خارجی دارند.
در سلوا الکترولیتی الکترود مثبت آند و الکترود منفی کاتد است.
یادگیری مفاهیم الکتروشیمی با فرادرس
الکتروشیمی نقش کلیدی در فناوریهای مختلف مانند باتریها و سلولهای سوختی دارد. برای یادگیری آن، ابتدا باید با انتقال الکترون در واکنشها آشنا شوید، چون این فرآیند منجر به تولید جریان الکتریسیته میشود. سپس، سلولهای گالوانی و نحوه تولید انرژی الکتریکی از واکنشهای شیمیایی را یاد بگیرید. همچنین، عدد اکسایش و ارتباط آن با واکنشهای اکسایش کاهش را مطالعه کنید، زیرا این موضوع برای درک فرآیندهایی مانند خوردگی و آبکاری که از فرایندهای مهم الکتروشیمی هستند، ضروری است. برای درک عمیقتر این مفاهیم پیشنهاد میکنیم به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح و بررسی این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه نیروی الکتروموتوری دسترسی داشته باشید.
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور
- فیلم آموزش الکتروشیمی تجزیه ای ۱
- فیلم آموزش مفاهیم بنیادی الکتروشیمی
پتانسیل سلولها
پتانسیل استاندارد سلول، میزان توانایی آن در احیای الکترود هیدروژن در دمای ۲۹۸ کلوین، فشار ۱۰۰ کیلوپاسکال و غلظت یون ۱ مول بر دسیمتر مکعب است. پتانسیل نیم سلولها با مقایسه آنها با الکترود استاندارد هیدروژن به دست میآید. پتانسیل استاندارد نیم سلولها میتواند مثبت یا منفی باشد. میزان یک پتانسیل استاندارد نشان میدهد که نیم سلول دچار اکسایش شده است یا کاهش یافته است.
هرچه پتانسیل یک سلول منفیتر باشد، برای سلول راحتتر است که دیگر مواد را اکسید کند و به عنوان یک عامل اکسنده عمل کرده و خود دچار کاهش شود. هرچه میزان پتانسیل یک نیم سلول مثبتتر باشد، به عنوان کاهنده مواد دیگر عمل کرده و خود اکسید میشود.
نکته
پتانسیل سلول ها و نیم سلولها به صورت عملی نمیتواند مقدار منفی داشته باشد و این علامت تنها در مقادیر محاسباتی صحیح است. مقادیر منفی پتانسیل واکنشها و نیم سلولها نشاندهنده این امر است که واکنش کاهش آنها در جهت عکس (از فراورده به واکنش دهنده میرود.)
الکترود هیدروژن
نیم سلول هیدروژن شامل یک الکترود و موادی است که اکسایش یا کاهش مییابند. اگر مادهای رسانای الکتریسیته باشد، میتواند به عنوان الکترود استفاده شود. الکترود هیدروژن از یک الکترود پلاتین Pt، گاز هیدروژن و یون هیدروژن تشکیل شده است. این نیم سلول به شکل زیر نمایش داده میشود.
در این نمایش خطوط عمودی نشاندهنده مرز بین فازهای مختلف هستند. به طور قراردادی، پتانسیل سلول الکترود هیدروژن برابر با صفر ولت در نظر گرفته میشود. طبق این قرارداد شرایط زیر باید برقرار باشد.
همانطور که مشاهده می کنید در این قرارداد، هیدروژن باید به شکل گاز و در فشار ۱ اتمسفر باشد. همچنین الکترولیت حاوی یون هیدروژن باید با غلظت ۱ مولار در سلول وجود داشته باشد.
پتانسیل کاهش (احیا) سلول چیست؟
پتانسیل کاهش سلولها در واقع همان پتانسیل نیم واکنش کاهش نیم سلولها است که نسبت به پتانسیل الکترود هیدروژن سنجیده میشود. به عبارت دیگر، تمایل به انجام شدن واکنش کاهش عناصر، توسط پتانسیل کاهش آنها اندازهگیری میشود.
برای مثال پتانسیل کاهش فلز مس به شکل زیر است.
همانطور که قبلا اشاره شد، پتانسیل کاهش برای الکترود استاندارد هیدروژن (SHE) به طور قراردادی برابر با صفر در نظر گرفته شده است و به عنوان نقطه مرجع برای اندازهگیری پتانسیل استاندارد کاهش سایر عناصر به کار میرود. برای مثال اگر نیم سلول با الکترود استاندارد هیدروژن جفت شود، سلول زیر تشکیل میشود که پتانسیل استاندارد آن برابر با ۰٫۳۳۹ ولت اندازهگیری شده است.
در این سلول الکترود مس به عنوان کاتد و الکترود هیدروژن به عنوان آند عمل میکند. این مسئله نشان میدهد یونهای نسبت به یونهای هیدروژن آسانتر کاهش مییابند. این عبارت معمولا به صورت زیر نمایش داده میشود.
پتانسیل مثبت سلول نشان میدهد واکنش کاهش، واکنشی خودبهخودی است. در مثالی دیگر هنگامی که الکترود روی با الکترود هیدروژن جفت میشود، فلز روی اکسید میشود و فلز آن به عنوان آند عمل میکند.
پتانسیل اندازهگیری شده برای این سلول برابر با ۰٫۷۶ ولت است. با این حال در این سلول فلز روی اکسید شده و الکترود آن آند است. پس پتانسیل کاهش برای این سلول منفی خواهد بود.
این مسئله نشان میدهد که یونهای نسبت به یونهای هیدروژن تمایل کمتری برای پذیرش الکترون دارند.
به طور قراردادی برای نمایش پتانسیل نیم سلولها همواره نیم واکنش کاهش الکترودها نوشته میشود. آن نیم واکنشها به همراه پتانسیل کاهش آنها در جدولی به نام سری الکتروشیمیایی به عنوان مرجعی برای محاسبات مربوط به سلولها به کار میروند.

سری الکتروشیمیایی
میزان پتانسیل استاندارد بسیاری از نیم سلولها در جدولی به نام سری الکتروشیمیایی قرار میگیرند که نیم واکنشهای اکسایش کاهش و میزان پتانسیل استاندارد آنها در این جدول نمایش داده میشود. سری الکتروشیمیایی با اندازهگیری و محاسبه میزان پتانسیل استاندارد فلزات مختلف و قراردادن آنها به ترتیب و به نسبت پتانسیل استاندارد هیدروژن تهیه شده است. سری الکتروشیمیایی نقشی مهم در اندازهگیریهای مربوط به پتانسیل شیمیایی سلولهای مختلف و همچنین انتخاب الکترودهای فلزی مختلف برای تولید جریان الکتریکی را ایفا میکند.
سری الکتروشیمیایی محل قرارگیری عناصر مختلف را بر اساس پتانسیل کاهش آنها به ترتیب قرار گیری کم به زیاد نشان میدهد. عموما لیتیوم کمترین پتانسیل استاندارد و فلوئور بیشترین پتانسیل استاندارد کاهش را دارد. میزان ولتاژ واکنشهای اکسایش هیدروژن برابر با صفر است و برای اندازهگیری نسبی ولتاژ نیروی الکتروموتوری باقی الکترودها مورد استفاده قرار میگیرد. برای مثال چند مورد از این واکنشها در ادامه آورده شده است.
| میزان نیروی الکتروموتوری (ولتاژ) | نیم واکنش اکسایش یا کاهش |
| ۱.۳۹۶ | |
| ۰٫۵۳۵۵ | |
| ۰٫۳۴۱۹ | |
| ۰٫۰۰۰۰ | |
| ۰٫۴۴- | |
| ۲٫۸۴- | |
| ۲٫۹۸- |
اندازهگیری پتانسیل استاندارد سلول
در جدول بالا مشاهده کردیم که پتانسیل استاندارد الکترود هیدروژن برابر با ۰ ولت است. به همین علت، از این الکترود برای اندازهگیری پتانسیل استاندارد باقی الکترودها استفاده میشود. الکترود استاندارد هیدروژن با نام «الکترود SHE» نیز شناخته میشود. برای اندازهگیری پتانسیل استاندارد یک الکترود باید میزان اختلاف پتانسیل آن با الکترود هیدروژن در یک سلول گالوانی اندازهگیری شود.
الکترود استاندارد هیدروژن، از یک لوله که گاز هیدروژن از آن میگذرد تشکیل شده است و یک تکه پلاتین نیز برای اتصال الکتریکی و همچنین کاتالیز کردن واکنش هیدروژن در آن قرار میگیرد. پلاتین موجود در سلول استاندارد هیدروژن، در میزان پتانسیل استاندارد سلول دیگر و نیروی الکتروموتوری سلول هیچ تاثیری نمیگذارد. این الکترود در یک الکترولیت حاوی یونهای قرار میگیرد و یک نیم سلول را تشکیل میدهد. نیم سلول دیگر، از یک الکترود دیگر که میخواهیم پتانسیل استاندارد آن را محاسبه کنیم تشکیل شده است. شکل زیر، سلول گالوانی ساخته شده برای اندازهگیری پتانسیل استاندارد الکترود روی نشان داده شده است.
در نهایت میزان پتانسیل استاندارد سلول با تفریق پتانسیل الکترود کاتد از آند به دست میآید.
نمایش سلولهای الکتروشیمیایی
سلولهای الکتروشیمیایی با نمادها و علامتهای مشخصی نشان داده میشوند. این علامتها و عبارات اطلاعات ارزشمندی درباره الکترودهای سلول الکتروشیمیایی و ترتیب قرارگیری آنها ارائه میکند. برای مثال «سلول الکتروشیمیایی دانیل» که از دو الکترود روی و مس تشکیل شده است میتواند به شکل زیر نوشته شود.
این علامتها نشان دهنده این هستند که در این سلول آند از فلز روی تشکیل شده است که دو الکترون آزاد کرده و به کاتیون روی ۲ بار مثبت تبدیل میشود. علامت 1M نشان دهنده غلظت محلول الکترولیت روی است. خط پایینی نشان دهنده این است که کاتد این سلول از الکترود مس تشکیل شده که یون مس ۲ بار مثبت تولید کرده و دو الکترون دریافت میکند و غلظت محلول الکترولیت آن نیز یک مولار است.
برای متصل کردن و ترکیب کردن این دو نیم سلول و نمایش آن به صورت کلی، دو علامت باره عمودی بین دو عبارت قرار می گیرد و نهایتا علامت سلول کلی به شکل زیر نوشته میشود.
واکنشهای اکسایش کاهش
واکنش اکسایش کاهش واکنشی است که در آن همزمان هردو واکنش اکسایش و کاهش در حال انجام هستند. تشخیص این واکنشها معمولا با بررسی شیوه انتقال الکترون از اتمی به اتم دیگر و همچنین با نوشتن دو نیم واکنش اکسایش و کاهش انجام میگیرد.
برای مثال دو واکنش زیر را درنظر بگیرید. اگر این واکنشها با یکدیگر ترکیب شوند و دو نیم واکنش دو نیم سلول الکتروشیمیایی در نظر گرفته شوند، یکی از واکنشها باید الکترون تولید و دیگری دریافت کند. با نگاه کردن به سری الکتروشیمیایی این مواد میتوانیم دریابیم که مس تمایل به دریافت الکترون و وانادیوم تمایل به تولید الکترون دارد.
مادهای که در واکنشهای اکسایش کاهش الکترون را دریافت میکند کاهش یافته و مادهای که الکترون را آزاد میکند اکسایش یافته است. به عبارتی دیگر در واکنشهای بالا کاتیون مس کاهش مییابد و اتم وانادیوم اکسایش مییابد.
واکنش کلی این دو ماده پس از تزکیب به فرم زیر نوشته می شود.
پس از حذف الکترونهای اضافه این واکنش به شکل زیر در میآید.
پتانسیل استاندارد سلول برای این دو واکنش برابر با پتانسیل استاندارد کاهش منهای پتانسیل استاندارد اکسایش است.
دو نیم واکنش (دو نیم سلول) در این موارد با یکدیگر ترکیب شده و یک واکنش کامل اکسایش کاهش به دست میآید. پتانسیل استاندارد این موارد در واقع همان نیروی الکتروموتوری آنها (emf) است. این مجموعهها به نام باتری نیز شناخته میشوند. در مطلب زیر از مجله فرادرس، درباره واکنشهای اکسایش کاهش (ردوکس) توضیح دادهایم و این واکنشها را همراه با مثال بررسی کردهایم.
واکنشهای کاهش
واکنش کاهش کلی یک سلول الکتروشیمیایی به کمک سری الکتروشیمیایی مشخص میشود. این کار با استفاده از مقایسه پتانسیل استاندارد مواد صورت میگیرد. نیم واکنشهای سری الکتروشیمی همواره در جهت واکنش کاهش نوشته میشوند. برای مثال واکنش نیکل به شکل زیر نوشته میشود.
جهت واکنش نیم سلول دیگر به این بستگی دارد که انرژی پتانسیل استاندارد آن کمتر است یا بیشتر از مادهای که دارد با آن واکنش میدهد.
مثال اول واکنشهای اکسایش کاهش
در باتری تشکیل شده از دو الکترود مس و روی، نیم واکنشهای اکسایش و کاهش و پتانسیل استاندارد آنها را با استفاده از سری الکتروشیمیایی نوشته و سپس نیروی الکتروموتوری آن را محاسبه کنید.
پاسخ
دو نیم واکنش روی و زینک با توجه به سری الکتروشیمیایی به شکل زیر است.
با توجه به علامتهای پتانسیل استاندارد این نیمواکنشها میتوانیم دریابیم کدام ماده دچار اکسایش و کدام ماده دچار کاهش میشود. از آنجا که علامت پتانسیل استاندارد واکنش مس، مثبت است پس واکنش در جهت رفت پیش میرود و الکترون دریافت میکند (کاهش مییابد) و روی در جهت برگشت پیش رفته و الکترون آزاد میکند. (اکسید میشود) واکنش کلی این باتری به شکل زیر نوشته میشود.
با توجه به مقادیر داده شده برای هر یک از نیم واکنشها، میزان نیروی اکتروموتوری به شکل زیر محاسبه میشود.
مثال دوم واکنشهای اکسایش کاهش
عبارات زیر نمایش قراردادی یک سلول لیتیومی است. نیم واکنشی را که در الکترود مثبت این سلول رخ می دهد بنویسید.
پاسخ
با توجه به سری الکتروشیمیایی و مقایسه پتانسیلهای لیتیوم و منگنز درمییابیم که لیتیوم به عنوان کاتد عمل میکند.
پتانسیل الکترود چیست؟
تمایل یک الکترود فلزی برای اکسید شدن یا کاهش یافتن که به ایجاد تفاوت بین پتانسیل الکترود و آنالیت میانجامد را پتانسیل الکترود میگویند. تمایل فلز آند برای اکسید شدن را پتانسیل اکسایش و تمایل فلز کاتد برای کاهش یافتن را پتانسیل کاهش میگویند. اگر میزان پتانسیل الکترود در شرایط استاندارد اندازهگیری شود، به آن پتانسیل الکترود استاندارد گفته میشود.
نیروی الکتروموتوری و حرکت الکترون
برای حرکت کردن الکترونها باید یک انرژی برای هدایت آنها وجود داشته باشد. میزان تفاوت پتانسیل الکترودها یا همان emf باعث حرکت الکترون ها میشود. الکترونها درون خود انرژی نهانی دارند. با افزایش تعداد الکترونها، پتانسیل کلی سلول افزایش مییابد. طی این فرایند، آند منطقهای میشود که دانسیته بار الکترونی یا پتانسیل آن بیشتر است. همچنین، انباشتگی الکترونها باعث ایجاد دافعه بین آنها شده و به این علت الکترونها حرکت میکنند. از طرف دیگر، در سمت کاتد دانسیه الکترونی کم است و انرزی پتانسیل کمی دارد.
حال این اختلاف پتانسیل بالا و پایین آند و کاتد باعث حرکت الکترونها از سمت آند با پتانسیل زیاد به کاتد با پتانسیل کم میشود. این فرایند مانند حرکت آب از محلی که فشار آب در آن زیاد است به محلی با فشار کمتر است. این حرکت الکترون ها باعث تولید الکتریسیته میشود.
نیروی الکتروموتوری که همان اختلاف پیتانسیل بین کاتد و آند است، با میزان الکتریسیته تولید شده حاصل از حرکت الکترونها مرتبط است.
وسایل اندازهگیری نیروی الکتروموتوری
دو دستگاه برای اندازهگیری نیروی الکتروموتوری یا emf استفاده میشوند. یکی از این دستگاهها پتانسیومتر و دیگری ولتسنج (ولتمتر) است. به طور کلی، استفاده از پتانسیومتر به ولتسنج ترجیح داده میشود. این بدین دلیل است که پتانسیومتر هیچ جریانی از مدار را برای اندازهگیری emf نمیگیرد و در نتیجه عملکرد مدار را مختل نمیکند.
از طرف دیگر ولتسنج، مقداری جریان از مدار برای اندازهگیری پتانسیل دریافت میکند. بنابراین پتانسیومتر نسبت به ولتمتر قابل اعتمادتر و دقیقتر است. تنها مشکل این دستگاه این است که نسبت به ولت متر قیمت بسیار بالاتری دارد.

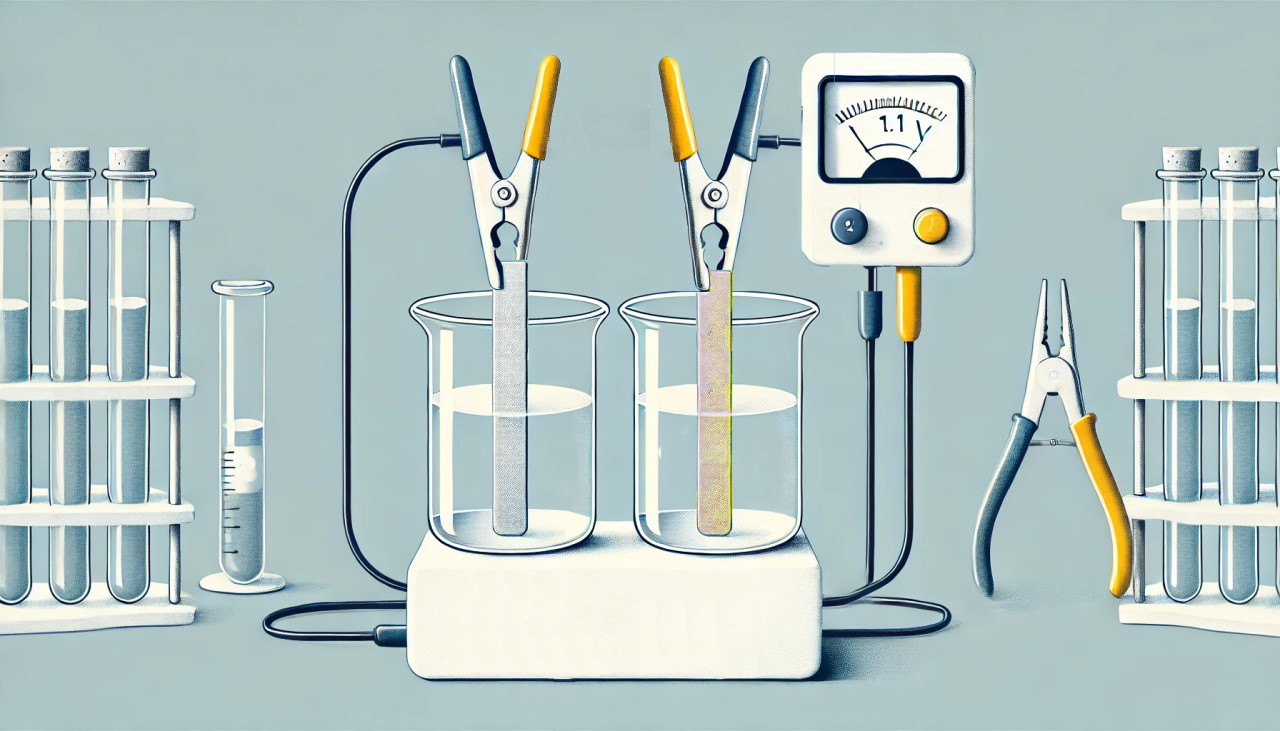
آزمایش اندازهگیری نیروی الکتروموتوری
برای اندازهگیری نیروی الکتروموتوری در یک سلول میتوان یک آزمایش ساده طراحی کرد. در این آزمایش ابتدا باید دو نوار باریک فلزی انتخاب شده تا به عنوان الکترودهای سلول الکتروشیمیایی عمل کنند. این فلزات میتوانند روی، مس، نقره یا آهن باشند.
در قدم بعدی، سطوح این فلزات باید با کاغذ سمباده تمیز شوند تا اطمینان حاصل شود که لایه اکسید شدهای روی سطح آنها نباشد. همچنین این فلزات نباید آغشته به چربی یا هرگونه آلودگی دیگر باشند.
سپس هریک از فلزهای انتخاب شده باید در بشری که حاوی ۵۰ میلیلیتر از محلولی حاوی یونهای فلز انتخاب شده است، قرار بگیرند. برای مثال الکترود روی میتواند در محلول سولفات روی و الکترود مس در محلول سولفات مس قرار بگیرد.
یک تکه کاغذ صافی را درون محلولی نمکی مانند پتاسیم نیترات غوطهور کرده و سپس هر طرف آن را درون هریک از بشرها قرار میدهیم. این کاغذ به عنوان پل نمکی سلول عمل میکند. با استفاده از سیمهای اتصال و گیرههای کلیپسی، هر فلز را به یک سر یک ولتمتر وصل می کنیم. در نهایت میزان ولتاژ سلول اندازهگیری میشود.
تصویر زیر سیستم این ازمایش را برای دو فلز مس و روی نشان میدهد.
تأثیر عوامل مختلف بر نیروی الکتروموتوری (ولتاژ سلول)
عوامل مختلفی میتواند بر میزان پتانسیل سلولها تاثیر بگذارند. از این عوامل میتوان به غلظت الکترولیت، فشار و دما اشاره کرد. از آنجا که واکنشهای اکسایش و کاهش سلولهای الکتروشیمیایی پس از مدتی به تعادل میرسند، اصل لوشاتلیه میتواند در بررسی اثر عوامل مختلف بر ولتاژ سلول ها بکار رود.
میزان نیروی الکتروموتوری یک سلول اگر مثبت باشد، واکنش مربوط به آن به شکل خودبهخودی انجام میشود. هرچند در شرایط عملی، ممکن است یک واکنش با emf مثبت به شکل خودبهخودی انجام نگیرد. زیرا برخی از واکنشها بسیار آرام انجام شده یا نیاز به انرژی فعالسازی زیادی دارند.
اثر غلظت بر نیروی الکتروموتوری
تغییر و افزایش غلظت یک واکنشدهنده، باعث افزایش میزان emf آن میشود. این بدان دلیل است که تعادل واکنش به سمت فراوردههای واکنش حرکت میکند.
اثر دما بر نیروی الکتروموتوری
بیشتر واکنشهای سلولهای الکتروشیمیایی گرماده هستند. در نتیجه افزایش دما در این واکنشها میزان نیروی الکتروموتوری را کاهش میدهد.
اثر فشار بر نیروی الکتروموتوری
افزایش فشار در یک سلول باعث کاهش میزان نیروی الکتروموتوری میشود زیرا الکترونهای بیشتری در این شرایط تولید میشوند و تعادل به سمت واکنش دهندهها میل میکند.
از آنجا که میزان اندازهگیری شده نیروی الکتروموتوری سلولها به شکل تجربی به غلظت مواد موجود در سلولها، دما و فشار گازها وابسته است، این اندازهگیریها باید در شرایط خاصی انجام شود. نیاز است که هنگام اعلام میزان نیروی الکتروموتوری سلولها، میزان غلظتها ۱ مول بر دسیمتر مکعب و فشار، ۱ اتمسفر در نظر گرفته شود.
نیروی الکتروموتوری سلول های ترکیبی
یکی از کاربردهای سری الکتروشیمیایی و نیروی الکتروموتوری، محاسبه ولتاژ سلولهای ترکیبی است. میزان نیروی الکتروموتوری سلولهای مختلف میتواند با یکدیگر جمع شود. برای مثال اگر میزان نیروی الکتروموتوری دو سلول را جداگانه اندازهگیری کنیم، میتوان از پتانسیل استاندارد الکترود تکرار شونده صرف نظر کرد و در نتیجه میزان نیروی الکتروموتوری دو سلول با یکدیگر جمع شده و نشان دهنده میزان ولتاژ حاصل از ترکیب این دو سلول است.
به دو سلول زیر توجه کنید.
اگر الکترود سمت راست یک سلول با الکترود سمت چپ سلول دیگر یکسان باشد، میتوان از آن صرف نظر کرد و به نیروی الکتروموتوری حاصل از قرار گرفتن دو الکترود دیگر در یک سلول رسید.
برای مثال به سلول الکتروشیمایی زیر توجه کرده و مقدار نیروی الکتروموتوری استاندارد را برای آن پیدا کنید.
با توجه به جدول سری الکتروشیمیایی نیم واکنشهای مربوط یه الکترودهای جیوه و برم را در تبادل با الکترود هیدروژن/پلاتین مینویسیم.
حال با صرف نظر کردن از الکترود هیدروژن و جمع مقادیر نیروی الکتروموتوری، میتوان مقدار emf سلول صورت سوال را محاسبه کرد.
محاسبه نیروی الکتروموتوری خارج از شرایط استاندارد
تا اینجا نیروی الکتروموتوری را برای مواد در شرایط استاندارد دما و فشار و غلظت ثابت محاسبه کردیم و آموختیم مقدار آن پتانسیل کاتد منهای پتانسیل آند است. اما ممکن است همواره استاندارد نگه داشتن شرایط اندازهگیری ممکن نباشد. در چنین شرایطی میزان نیروی الکتروموتوری از طریق معادله زیر به دست میآید.
در معادله بالا حروف معادله نشان دهنده پارامترهای زیر هستند.
- E میزان نیروی الکتروموتوری سلول است.
- نشان دهنده پتانسیل استاندارد سلول برای الکترودهای راست (کاتد) و چپ (آند) است.
- R مقدار ثابت گازها است.
- T میزان دما بر حسب درجه کلوین است.
- Z تعداد الکترونهای جابهجا شده است.
- F نشان دهنده ثابت فارادی است.
- Q برابر با خارج قسمت واکنش است.

تفاوت پتانسیل سلول و نیروی الکتروموتوری
پتانسیل سلول و نیروی الکتروموتوری (emf) هر دو به اختلاف پتانسیل الکتریکی در سلولهای الکتروشیمیایی اشاره دارند، اما در زمینههای متفاوتی استفاده میشوند.
پتانسیل سلول (یا پتانسیل الکترودی) اختلاف ولتاژ بین دو نیمسلول در یک سلول گالوانیک است. این مقدار نشاندهنده تفاوت در پتانسیل کاهش دو واکنش نیمسلولی در سلول است و میتواند مثبت یا منفی باشد. پتانسیل سلول در شرایط جریان الکتریکی اندازهگیری میشود و در واحد ولت (V) بیان میشود.
نیروی الکتروموتوری حداکثر اختلاف پتانسیلی است که بین دو الکترود سلول زمانی که جریان الکتریکی در مدار وجود ندارد، ایجاد میشود. این نیروی الکتروموتوری نوعی فشار است که الکترونها را از آند به کاتد میبرد. emf همواره یک مقدار مثبت است و در واحد ولت (V) اندازهگیری میشود، زیرا نشاندهنده کاری است که برای انتقال یک واحد بار از آند به کاتد انجام میشود.
تفاوت کلیدی بین این دو در این است که:
- پتانسیل سلول در حضور جریان الکتریکی تعریف میشود و میتواند مثبت یا منفی باشد.
- emf حداکثر ولتاژ ممکن بدون وجود جریان است و همیشه مثبت است.
کاربردهای نیروی الکتروموتوری
تا اینجا آموختیم که نیروی الکتروموتوری چیست و چگونه محاسبه میشود. نیروی الکتروموتوری میتواند از منابع مختلفی مانند باتریها، ژنراتورها و سلولهای خورشیدی تولید شود. هرچه این نیرو قویتر باشد، اختلاف پتانسیل و جریان الکتریکی قویتر خواهد بود. از جریان الکتریکی به دست آمده در وسایل الکترونیکی مختلفی استفاده میشود که در ادامه این مطلب از مجله فرادرس این کاربردها را توضیح میدهیم.
تولید نیرو
از نیروی الکتروموتوری برای تولید برق در سیستمهای مختلف مانند ژنراتورهای برق، سیستمهای تولید برق از آب، سیستم های تولید برق از انرژی باد و سلولهای فوتوولتاییک استفاده میشود.
دستگاههای الکترونیکی
مهمترین استفاده از نیروی الکتروموتوری شیمیایی سلولهای الکتروشیمی، استفاده از جریان تولید شده توسط آنها در وسایل مختلف الکترونیکی است. از این وسایل میتوان به باتری دستگاههای مختف، مدارهای الکترونیکی، حسگرها و محرکهای الکتریکی اشاره کرد.
حمل و نقل
از نیروی الکتروموتوری در مقیاسهای بزرگتر در تولید انرژی برای خودروهای التریکی و لوکوموتیوهای برقی استفاده میشود.
کاربردهای محاسبه نیروی الکتروموتوری
با محاسبه این نیرو میتوان به بسیاری از اطلاعات ارزشمند در زمینههای مختلف دسترسی پیدا کرد. به برخی از این موارد در ادامه اشاره شده است.
- میزان ثابت تعادل واکنشهای نیم سلولها
- میزان انرژی آزاد گیبس
- حاصلضرب انحلال نمکهای کم محلول
- میزان ظرفیت تعداد الکترون های منتقل شده در واکنشهای نیم سلول
- میزان انرژی آزاد
- میزان pH محلولها
- خودبهخودی بودن واکنشها