محلول اشباع (سیر شده) و غیر اشباع | به زبان ساده
جزء بیشتر یک محلول را حلال و جزء کمتر را به عنوان حلشونده میشناسند. عبارات «کمتر» و «بیشتر» به معنی جرم یا تعداد مول بیشتر حلال و حلشونده است. البته این نوع تعریف در برخی از مواد با جرمهای مولی متفاوت، قدری گمراهکننده خواهد بود. بعد از اینکه با محلولها و خواص آنها آشنا شدیم باید به بررسی محلول اشباع و غیر اشباع بپردازیم. زمانیکه یک محلول به نقطهای برسد که در آن حالت، هیچ حلشونده دیگری نتوان به آن اضافه کرد، محلول اشباع یا سیرشده داریم و تا قبل از رسیدن به این نقطه، محلول غیر اشباع خواهیم داشت. در این آموزش قصد داریم به تعریف محلول اشباع و غیر اشباع بپردازیم و ویژگیهای هریک را بیان کنیم.


محلول غیر اشباع چیست ؟
برای تشکیل یک محلول، حلشونده و حلال باید با یکدیگر ترکیب شوند. محلولهای مختلفی در طبیعت وجود دارند و حلال و حلشونده هریک با دیگری متفاوت است. به طور مثال، نمک و شکر را میتوان به طور جداگانه در حلال حل کرد. در ابتدا با حل شدن حلشونده، محلولی یکنواخت بدست میآید و به چنین محلولی که میتوان حلشونده را در آن حل کرد، محلول غیر اشباع میگویند.
محلول غیر اشباع میتواند حلشونده بیشتری را در خود حل کند اما این امر تا زمانی اتفاق میافتد که به نقطه اشباع برسد. بعد از رسیدن به نقطه اشباع، حلشونده بیشتری را نمیتوان در حلال حل کرد. بیشتر محلولها در طبیعت به صورت غیر اشباع هستند و با اضافه کردن حلشونده به آنها میتوان آنها را به محلول اشباع تبدیل کرد.
محلول اشباع چیست ؟
همانطور که در ابتدا نیز به آن اشاره شد، زمانی که به نقطه اشباع برسیم، دیگر نمیتوان حلشوندهای به حلال اضافه کرد و اضافه کردن حلشونده بعد از این حالت سبب میشود تا حلشونده به صوت جامد رسوب کند یا به صورت گاز آزاد شود.
تهیه محلول سیر شده
برای تهیه محلول اشباع باید به طور پیوسته به آن حلشونده اضافه کنیم تا به نقطه برسیم که ذرات حلشونده در ظرف به صورت رسوب یا بلورهایی ظاهر شوند. البته توجه داشته باشید که این کار باید در دمای ثابت انجام بگیرد چراکه ممکن است تغییر دما بر انحلالپذیری تاثیر بگذارد.
به همین دلیل در ادامه همین متن به بررسی عوامل تاثیرگذار بر انحلالپذیری نیز خواهیم پرداخت. با این وجود، برای محلولسازی محلول اشباع میتوانید مراحل زیر را در نظر داشته باشید.

میخواهیم به ظرفی از آب، شکر اضافه کنیم و محلولی اشباع را بدست آوریم. در ابتدا با هم زدن محلول و اضافه کردن شکر، حلشونده به خوبی در حلال حل خواهد شد. در نهایت، با اضافه کردن بیشتر شکر به نقطهای میرسیم که پس از آن، هم زدن سبب حل شدن شکر نخواهد شد. در این مرحله، شکرِ اضافه شده به صورت رسوب در انتهای ظرف جمع میشود و در اینجاست که میگوییم یک محلول اشباع تهیه کردهایم.
در جدول زیر، انواع محلولها به لحاظ حالت اشباع نشان داده شدهاند.
| نوع محلول | تعریف | مثال |
| محلول اشباع | محلولی که در تعادل با ماده حلشونده قرار دارد. | آب گازدار |
| محلول غیر اشباع | محلولی که همچنان میتوان به آن ماده حلشونده اضافه کرد. | آبنمک |
| محلول فوق اشباع | محلولی که شامل ماده حلشدهای بیش از محلول اشباع است. | محلول شکر در آب که برای حل کردن شکر، آب را حرارت داده باشند. |
عوامل موثر بر اشباع محلول
در ادامه، عواملی را بررسی میکنیم که در رسیدن به نقطه اشباع و تهیه یک محلول اشباع موثر هستند.
- با افزایش دما، در بیشتر موارد، انحلالپذیری محلولهای یونی افزایش پیدا میکند.
- حلشوندههایی که اندازه کوچکتری داشته باشند، انحلالپذیری بیشتری دارند. علاوه بر این، نرخ تبلور به مقدار حلشونده و سطح بلورها مرتبط است.
- در یک محلول ثابت، افزایش غلظت در سطح حلشونده اتفاق میافتد. در نتیجه، با هم زدن محلول، سرعت خالص انحلال افزایش پیدا میکند. «نرخ خالص انحلال» (Net Dissolving Rate) به صورت سرعت انحلال منهای سرعت تبلور تعریف میشود.
- اگر سرعت انحلال و تبلور یکسان باشد، محلول اشباع خواهیم داشت و به شرایط تعادل (تعادل پویا) خواهیم رسید.
در نهایت، با بررسی اصل لوشاتلیه میتوان تغییر فشار، غلظت و دما را به عنوان عوامل موثر بر نقطه اشباع در نظر گرفت.

بررسی دقیق تر محلول اشباع و غیر اشباع
زمانی که یک حلشونده در محلول حل شود، اتمها، مولکولها یا یونهای آن با حلال برهمکنش انجام میدهند و این امکان وجود دارد که این ذرات به شکلی مستقل در محلول انتشار پیدا کنند. البته این انتشار تنها در یک جهت انجام نمیشود. اگر مولکولها یا یونها با سطح ذرات حل نشده برخورد کنند، تبلور رخ میدهد. انحلال و تبلور تا زمان وجود ماده جامد ادامه پیدا میکند.
این شرایط، حالت تعادلی پویا (دینامیک) را بوجود میآورد که مشابه با فشار بخار تعادلی در یک مایع است. با وجود اینکه برای توصیف جداشدن ذرات جامد حلشونده از محلول، از عبارات تبلور و رسوب (تهنشینی) استفاده میکنند اما تبلور، به تشکیل جامد با ساختار بلوری مشخصی اشاره دارد درحالیکه «رسوب» (Precipitation) با تشکیل هر نوع فاز جامد حتی به میزان کم، مرتبط میشود.
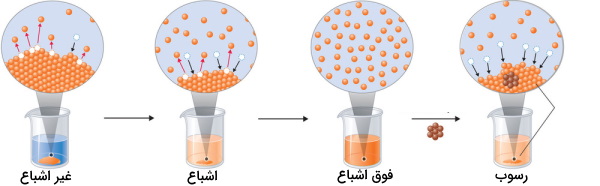
در تصویر زیر میتوانید مراحل انحلال و تهنشینی را مشاهده کنید. در تصویر اول (سمت چپ)، زمانیکه حلشونده را به حلال اضافه میکنیم، ذرات آن به بیان ساده سطح جامد را ترک میکنند و توسط حلال، حلالپوشی میشوند. این کار در ابتدا یک محلول غیر اشباع را پدید میآورد. در تصویر دوم، زمانیکه بیشینه مقدار ماده قابل انحلال به بِشر اضافه میشود، محلول اشباع خواهیم داشت. در این حالت اگر مقدار اضافه حلشونده داشته باشیم، سرعت ترک ذرات و حلالپوشی با سرعت بازگشت آنها به حالت جامد برابر خواهد بود و یک تعادل پویا بدست میآید.
در تصویر سوم، محلول «فوق اشباع» (Supersaturated Solution) مشاهده میشود. اگر به کمک فیلتراسیون محلول اشباع و خارج کردن حلشونده اضافی و کاهش دما، محلولی مشابه تصویر سوم بدست آوریم، به محلول فوق اشباع دست پیدا کردهایم. اگر یک بلور به محلول فوق اشباع اضافه شود، ذرات حلشونده با ترک محلول، بلور بزرگتری را شکل میدهند.
به طور کلی اگر یک محلول اشباع تهیه کنیم و بدون وارد کردن انرژی اضافی، فرصت دهیم تا محلول سرد شود، محلولی فوق اشباع بدست میآید که با اضافه کردن یک بلور و انرژی اضافی، محلول از حالت فوق اشباع خارج میشود.
عوامل موثر بر انحلال پذیری
بیشترین مقداری که یک حلشونده میتواند در دما و فشار مشخص محیط حل شود را انحلالپذیری میگویند. انحلالپذیری را به طور معمول به صورت جرم حلشونده به ازای حجم یا جرم حلشونده به ازای جرم حلال (g/g) تعریف میشود. البته در برخی موارد، تعریف انحلالپذیری به صورت مول بر لیتر (غلظت) نیز مورد استفاده قرار میگیرد.
حتی برای موادی که انحلالپذیری بالایی دارند، محدودیتی برای مقدار انحلال یک ماده در حلال وجود دارد. به طور کلی، انحلالپذیری مواد نه تنها به انرژی که به عوامل دیگری همچون دما و فشار (در گازها) مرتبط است.
به طور مثال در دمای ۲۰ درجه سانتیگراد، ۱۷۷ گرم سدیم یدید، ۹۱/۲ گرم سدیم برمید و 35/9 گرم سدیم کلرید و تنها ۴/1 سدیم فلوئورید در آب حل میشود اما اگر دما را به ۷۰ درجه سانتیگراد برسانیم، میزان جرمهای حل شده مواد به ترتیب به صورت زیر خواهد بود:
- سدیم یدید: ۲۹۵ گرم
- سدیم برمید: ۱۱۹ گرم
- سدیم کلرید: ۳۷/۵ گرم
- سدیم فلولوئورید: ۴/۸ گرم
محلول فوق اشباع
از آنجایی که انحلالپذیری بسیاری از جامدات با افزایش دما افزایش پیدا میکند، یک محلول اشباع که در دمای بالاتری تهیه شده باشد، به طور معمول، ماده حلشده بیشتری نسبت به همان محلول در دمای پایینتر دارد. زمانی که محلول، سرد شود، محلولی فوق اشباع خواهیم داشت. همانند سیالات فوق گرم یا فوق سرد، محلول فوق اشباع نیز محلولی ناپایدار است. به همین دلیل است که با افزودن یک بلور به چنین محلولی، تبلور یا تهنشینی به سرعت رخ خواهد داد.
از آنجایی که تبلور، معکوس انحلال است، مادهای که برای تشکیل محلول به گرما نیاز دارد ، زمانی که دچار تبلور شود، آن گرما را آزاد میکند و خواهیم داشت. مقدار گرمای آزاد شده متناسب با مقدار ماده حلشونده اضافه است. دو مادهای که آنتالپی انحلال مثبت دارند سدیم تیوسولفات با فرمول و سدیم استات با فرمول است که از هر دو ماده در بستههای کمپرس سرد و گرم استفاده میشود.
مثال محلول غیر اشباع
در زندگی روزمره خود با محلولهای بسیاری برخورد داریم که بخش بیشتری از آنها محلولهای غیراشباع هستند. به طور مثال، شکری که در چای به هنگام صرف صبحانه حل میکنیم یا نمکی که به غذا اضافه میشود محلولهایی غیر اشباع را بوجود میآورند. به یاد داشته باشید که هر نوع حلشونده بسته به عوامل ذکر شده، انحلالپذیری متفاوتی نسبت به دیگری دارند.
محلولهای گازی، محلولهایی با حلشونده گاز هستند که میتوانند در حالتهای جامد، مایع و حتی گاز وجود داشته باشند. هوا و مه را میتوان از جمله محلولهای گازی غیراشباع به شمار آورد. در یک محلول غیر اشباع، غلظت حلشونده بسیار پایینتر از غلظت آن در شرایط تعادل است. همچنین، هر نوع حلشونده، محدودیت مشخصی برای حل شدن در یک نوع حلال خاص دارد.

مثال محلول اشباع
نوشابههای گازدار از معمولترین محلولهای اشباع به شمار میآیند. در این نوشیدنیها، آب به عنوان حلال در نظر گرفته میشود و کربن (گاز دیاکسید کربن) تا رسیدن به نقطه اشباع، به محلول تزریق میشود. در آشپزخانه، بسیاری از دستورهای پخت شیرینیها و غذا شامل تهیه محلول اشباع است. این فرآیندها وابستگی مستقیمی به دما دارند و همانطور که میدانید، با افزایش دما، انحلالپذیری برخی از این مواد همچون شکر و سایر چاشنیها افزایش مییابد. زمانیکه در این مرحله به نقطه اشباع میرسیم، لایهای بوضوح روی محلول را میپوشاند که این امر را در تهیه مربای خانگی بارها مشاهده کردهاید.
حتی خاک روی زمین را میتوان نوعی محلول اشباع از نیتروژن در نظر گرفت که بعد از رسیدن به نقطه اشباع، مقدار اضافی آن به صورت گاز خارج میشود.
معرفی فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی
محلول اشباع یا سیرشده و محلولهای سیرنشده از جمله مباحثی هستند که در دوره دبیرستان مورد بررسی قرار میگیرند. به همین دلیل «فرادرس» دورهای ۵ ساعته را در قالب ۶ درس تدوین کرده است که در ادامه به توضیح دروس آن خواهیم پرداخت. درس یکم این آموزش به مخلوطها اختصاص دارد که از جمله مباحث مهم آن میتوان به کلوئیدها، سوسپانسیونها و شناساگرهای اسید و باز اشاره کرد. در درس دوم و سوم، تغییرات شیمیایی بررسی میشوند و تغییرات فیزیکی نیز در همین دروس مرور خواهند شد. مثلث آتش، اجزای تشکیلدهنده هوا و واکنشهای گرماده و گرماگیر همگی مباحث مهم این درس را تشکیل میدهند.
در درس چهارم، ساختار اتم بررسی خواهد شد و درس پنجم نیز در ادامه درس چهارم به درون اتم، نظریه اتمی و تعاریف مرتبط با عنصرها اختصاص دارد. عدد اتمی، عدد جرمی و همچنین مفاهیم مربوط به آن مانند ایزوتوپ، در این دو درس بررسی خواهند شد. درس ششم از این آموزش نیز به یونها و کاتیونها و آنیونها و همچنین نحوه تشکیل نمک طعام پرداخته میشود.
طرز تهیه محلول اشباع آب نمک
برای اینکه یک محلول اشباع آبنمک داشته باشیم بهتر است از آب مقطر استفاده کنیم تا اگر بخواهیم میزان انحلالپذیری آنرا محاسبه کنیم، با مشکلات کمتری روبرو باشیم. انحلالپذیری نمک در آب مقطر در حدود ۳۵ گرم در هر ۱۰۰ میلیلیتر است، بنابراین اگر ۲۰۰ میلیلیتر آب داشته باشیم، میزان ۱۰۰ گرم NaCl برای تهیه محلول اشباع آب نمک کفایت میکند. نمک را آهسته به ظرف آب اضافه میکنیم و آنرا هم میزنیم. زمانیکه با هم زدن آب، هیچ نمک اضافهای تولید نشد، با فیلتراسیون نمک اضافی میتوانیم به محلول اشباع آب نمک دست پیدا کنیم.













ببخشید من هنوز فرمول به دست آوردن محلول اشباع و غیراشباع را نفهمیدم؟
با سلام؛
فرمول جامعی برای به دست آوردن روش تهیه محلول اشباع و غیراشباع برای همهی مواد وجود ندارد. روش تهیه محلولهای مختلف از مواد مختلف را میتوانید با استفاده از منابع و مراجع درباره حلالیت مختلف مواد حل شونده و محلولها پیدا کنید. برای مثال، میزان حلالیت سدیم کلرید در آب در دمای ۲۵ درجه سانتیگراد، ۳۵ گرم حل شونده در ۱۰۰ میللیتر محلول است پس خواهید دانست که با حل کردن ۳۵ گرم نمک در ۱۰۰ میلیلیتر آب در دمای ۲۵ درجه سانتیگراد، به محلول اشباع دست خواهید یافت. مقادیر کمتر از ۳۵ گرم در ۱۰۰ میلیلیتر آب، محلول اشباع نشده و مقادیر بیشتر از ۳۵ گرم محلول فوق اشباع میسازند.
با تشکر از همراهی شما با مجله فرادرس.
سلام و تشکر بابت توضیح کاملتون.
یک سوال، اگر برفرض من یک محلول اب و نمک (پتاسیم نیترات) رو با افزایش دما باهم محلول کنم تا به حد اشباع برسه و بعد اب رو خنک کنم و دما رو بیارم پایین، ایا اضافه نمک پتاسیم نیترات از محلول جدا میشه و کف ظرف ته نشین میشه یا بصورت محلول باقی میمونه؟
با سلام؛
با توجه به اینکه در چنین شرایطی، محلول فوقاشباع داریم، در نتیجه اگر انرژی به محلول داده نشود، رسوبی هم تشکیل نخواهد شد.
با تشکر
سپاسگزارم بابت مطالب مفیدتون
فقط یک قسمت از متن برای بنده قابل درک نبود:
چنین محلولی که میتوان حلشونده را در آن حل کرد، محلول غیر اشباع میگویند
یعنی اون محلول یکنواخت و ساده ای که بدست اومده در اون محلول ساده مجدد یک مادهی حل شونده ریخته بشه و یک محلول دیگه بدست بیاد؟
با سلام؛
نه منظور این است که همچنان میتوان به محلول، حل شونده قبلی را اضافه کرد.
با تشکر از همراهی شما با مجله فرادرس
بسیار مفید و آموزنده چطور میتونم با آقای بحری صحبت کنم
ببخشید اونجا بجای محلول نوشنید محول تصحیح شود
با سلام؛
از توجه شما بسیار سپاسگزاریم. متن بازبینی و اصلاح شد.
با تشکر