انحلال پذیری مواد در آب – به زبان ساده + فهرست
انحلال پذیری مواد در آب یکی از مهمترین مسائلی است که در زندگی روزمره و در روند فرآیندهای شیمیایی با آنها سروکار داریم. برای مثال هنگام حل کردن شکر در آب برای تهیه شربت، انحلال پذیری شکر در آب مطرح میشود. انحلال پذیری یک حلال به میزان ظرفیت آن برای پذیرفتن مادهای حلشونده در خود و تولید محلول گفته میشود. آب یکی از مهمترین حلالهایی است که بسیار استفاده میشود. انحلال پذیری حلال در واقع توانایی آن برای تولید پیوندهای بین مولکولی بین ذرات حلال با حلشونده است. واکنش انحلال پذیری مواد در آب یک تغییر فیزیکی است نه شیمیایی زیرا ویژگیهای مواد طی فرآیند انحلال از بین نمیروند و تغییر نمیکنند. در این مطلب از مجله فرادرس، به توضیح انحلال پذیری مواد در آب و مفاهیم مربوط به آن میپردازیم.
- تعریف علمی محلولها و انواع مختلف آن را یاد خواهید گرفت.
- نقش دما، فشار و ساختار مولکولی در حلشدن مواد را میآموزید.
- روش تشخیص محلول، کلوئید و سوسپانسیون را خواهید آموخت.
- میآموزید که قوانین حلالیت چگونه در پیشبینی واکنشها بهکار میروند.
- تأثیر نیروهای بینمولکولی و قطبیت را بر میزان حلشدن بررسی میکنید.
- نحوهی محاسبه Ksp و استفاده از آن برای مواد کممحلول را یاد میگیرید.


در این مطلب، به بررسی تعریف حلالیت و انحلال پذیری مواد در آب میپردازیم. بررسی میکنیم چه موادی در آب حل میشوند و چه موادی در آب نامحلول هستند. سپس توضیح میدهیم چه عواملی روی انحلال پذیری مواد در آب تأثیرگذار است و تأثیر هرکدام از این عوامل به چه صورت است. مفهوم ثابت حاصلضرب حلالیت و محاسبه آن را میآموزیم و یاد میگیریم انحلال پذیری مواد در آب چگونه افزایش مییابد. در انتها نیز مفاهیم کلوئید، سوسپانسیون و امولسیون و رابطه آنها با انحلال پذیری مواد در آب را توضیح میدهیم. با مطالعه این مطلب تا انتها این مفاهیم کاربردی را به زبانی ساده و عمیق بیاموزید.
انحلال پذیری مواد در آب
آب یکی از مهمترین حلالهای موجود در طبیعت است و مواد زیادی را در خود حل میکند. یک محلول آبی به محلولی گفته میشود که حلال آن آب باشد و یک یا چند ماده را در خود حل کرده باشد. ماده حل شده در آب میتواند به فرم جامد، مایع یا گاز باشد. اقیانوسها، محلولهایی از نمکهای حل شده در آب هستند. بالاترین غلظتی از یک ماده که میتواند در آب در یک دمای معین حل شود به عوامل مختلفی بستگی دارد.
براساس این عوامل، سه دسته از مواد حلشونده در طبیعت وجود دارند که عبارتند از بسیار حلشونده، تا قسمتی حلشونده و انحلال ناپذیر. واحد اندازهگیری انحلال پذیری مواد در آب میلیگرم بر لیتر ماده حلشونده در لیتر آب است. گاهی وقتها نیز این پارامتر با واحد ppm که قسمت در میلیون است نیز اندازهگیری میشود.
جدول انحلال پذیری مواد در آب
در جدولی زیر روند انحلال پذیری مواد مختلف در آب نشان داده شده است. انواع مختلف ماده از جمله مایع، جامد و گازها می توانند در آب حل شوند. حلالیت این مواد در آب به عوامل مختلفی بستگی دارد که در جدول زیر به آنها اشاره شده است.
| نوع انحلال | عوامل تأثیرگذار بر انحلال پذیری |
| حلالیت مایعات در آب | اثر برهمکنش بین ذرات حلشونده و حلال: نیروی جاذبه قوی بین ذرات ماده حلشونده و حلال باعث انحلال بهتر آنها میشود.
اثر دما: مایعات کممحلول در آب، با افزایش دما به طور کامل حل میشوند. اثر نیروها و پیوندها: مواد مشابه از نظر قطبیت در یکدیگر حل میشوند. اثر فشار: حلالیت مایعات در آب به سختی تحت تأثیر تغییرات فشار قرار میگیرد. |
| حلالیت جامدات در آب | اثر دما: در واکنشهای گرماده افزایش دما باعث کاهش انحلالپذیری و در واکنشهای گرماگیر، افزایش دما باعث افزایش انحلال پذیری می شود.
اثر فشار: حلالیت جامدات به سختی تحت تأثیر فشار قرار میگیرد. |
| حلالیت گازها در آب | اثر فشار: حلالیت گازها در مایعات با افزایش فشار افزایش مییابد.
اثر دما: حلالیت گازها در مایعات با افزایش دما کاهش مییابد. |
تعریف حلالیت
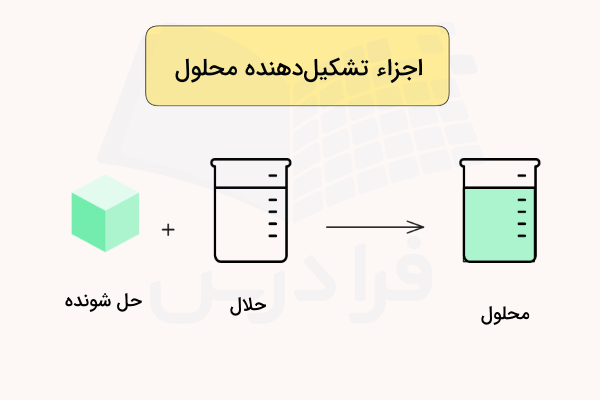
حلالیت حداکثر غلظت حلشونده است که در غلظت معینی از حلال در دمای معین حل میشود. یکی از مهمترین پارامترهایی که در مورد ترکیبات یونی وجود دارد، انحلال پذیری آنها در آب است. در یک مخلوط، دو یا تعداد بیشتر از مواد با یکدیگر مخلوط شدهاند اما در یکدیگر حل نشدهاند. برای مثال ماسه در آب حل نمیشود و یک مخلوط ایجاد میکند. یک محلول، مخلوط همگن دو یا چند ماده است که در یک حلال مایع حل شدهاند.
محلولها میتوانند در فرمهای مختلفی به وسیله حلالها و حلشوندههای مختلف ایجاد شوند. مواد حل شده در آب میتوانند به فرم گاز، مایع یا جامد باشد. از مثالهای این موارد میتواند به انحلال شکر در آب، سرکه در آب و گاز کربن دیاکسید در آبهای گازدار اشاره کرد. برای اینکه یک ماده در آب حل شود، باید به ذرات کوچکتر شکسته شود تا این ذرات بتوانند بین فضاهای مولکولهای آب جایگیرند. همچنین باید پیوندی بین مولکولهای آب و ذرههای ماده حل شده به وجود بیاید تا آب بتواند ماده را در خود به صورت محلول نگه دارد و ذرات ته نشین یا جدا نشوند. یک حلال واقعی همچنین باید پایدار باشد و ذرات حلشونده و حلال پس از مدتی از یکدیگر جدا نشوند.
مفاهیم و اصطلاحات مربوط به انحلال پذیری
در ادامه مفاهیم و اصطلاحات مربوط به انحلال پذیری به زبانی ساده در جدول توضیح داده شدهاند.
| مفهوم | توضیح |
| حلالیت | قابلیت یک حلال مانند آب در حل کردن مواد حلشونده درون خود |
| انواع حلشونده | جامد (شکر، نمک و ...)، مایع (آب، سرکه، استون و ...)، گاز (کربن دی اکسید، اکسیژن و ...) |
| فرآیند حل شدن | حلشونده به ذرات کوچک شکسته شده و با مولکولهای حلال پیوندهای بین مولکولی تشکیل میدهد. |
| عوامل تأثیرگذار بر حلالیت | دما، خواص حلال و حلشونده، برهمکنشهای بین مواد حلشونده و حلال |
| واحد اندازهگیری حلالیت | میلیگرم بر لیتر «mg/L» یا واحد در میلیون «ppm» |
| انواع حلشونده | بسیار حلشونده، کممحلول، انحلال ناپذیر |
| محلول | یک مخلوط همگن از حلشونده و حلال که در آن حلشونده به شکل یکنواختی در حلال پخش شده است. |
| محلول آبی | محلولی که حلال آن آب باشد. |
| خواص حلال | یک حلال باید پس از حلکردن مواد در خود، پایدار باشد و ذرات حلشونده پس از مدتی تهنشین نشوند. |
یادگیری شیمی پایه دهم با فرادرس
یکی از پایهایترین مباحث شیمی بررسی انحلال پذیری مواد خصوصا در مورد آب است. یادگیری این مباحث از اهمیت بالایی برخوردار است. برای یادگیری انحلال پذیری مواد باید با مفاهیمی مانند یونهای چند اتمی، محلول و مقدار حلشوندهها، مفهوم انحلال، رفتار آب و سایر مولکولها در میدان الکتریکی آشنا شد. این مفاهیم به طور کامل و با زبانی ساده در مجموعه آموزش پایه دهم و در بخش آموزش شیمی پایه دهم آموزش داده شدهاند. همچنین مثالهای فراوان برای تمرین بیشتر این مباحث در این آموزشها آورده شده است. پیشنهاد میکنیم برای یادگیری بیشتر این مباحث به مجموعه فیلم آموزش پایه دهم خصوصا فیلم آموزش شیمی ۱ پایه دهم مراجعه کنید. در فهرست زیر به چند نمونه از این آموزشها اشاره کردهایم.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آن در زیر آورده شده میتوانید به آموزشهای بیشتری در زمینه انحلال پذیری مواد در آب، دسترسی داشته باشید.
- آموزش علوم تجربی پایه هشتم بخش شیمی
- آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله
- آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی
فرآیند انحلال پذیری مواد در آب
در قسمت قبل گفتیم که حلالیت در واقع بیشترین مقداری است که از یک حلشونده در حلال، حل میشود. مولکولهای آب بیشتر مواد و ترکیبات یونی و قطبی را درخود حل میکنند. این بدین علت است که مولکولهای آب خود قطبی هستند. ترکیبات غیرقطبی به راحتی در آب حل نمیشوند. با در نظر نگرفتن موارد استثنایی که در آب حل نمیشوند، گفته میشود که آب یک حلال عمومی است زیرا میتواند بسیاری از مواد را در خود حل کند.
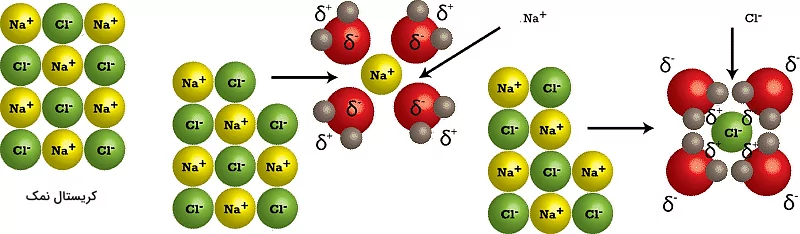
انحلال پذیری مواد در آب، به وسیله عبارتی به نام قطبیت مولکول آب اتفاق میافتد. مولکول آب از دو سر با قطبیت مثبت و منفی تشکیل شده است که باعث میشود مولکولهای ماده حلشونده از یکدیگر جدا شده و در آب حل شوند. برای مثال در فرآیند حل شدن نمک در آب، اتمهای سدیم که نسبتا مثبت هستند توسط قسمت منفی آب که سمت اکسیژن است، و اتمهای کلر توسط قسمت مثبت آب که سمت هیدروژن است جذب میشوند.
در فرآیند بالا یونهای کلر و سدیم هیدراته شدهاند. هیدراته شدن در فرآیند انحلال پذیری به این معناست که یونها توسط مولکولهای آب احاطه شوند. این اتفاق از ترکیب شدن دوبارهی یونها و رسوب دادن آنها جلوگیری میکند.
مثال انحلال پذیری مواد در آب
مواد حلشونده در آب که بیشتر شناخته شدهاند و در زندگی روزمره استفاده میشوند موادی مانند شکر، نمک، شیر خشک، پودر کاکائو، رنگهای خوراکی، سرکه و .. هستند. همچنین احتمالا عبارت ویتامینهای محلول در آب را شنیدهاید. این ویتامینها نیز از مواردی هستند که به سادگی در آب حل میشوند و توسط ارگانهای بدن جذب میشوند.
حل شدن مولکولهای شکر در آب نیز یکی دیگر از فرآیندهای انحلال شناخته شده است. مولکولهای شکر از ترکیبات ساکارز با فرمول مولکولی تشکیل شده است. شکر جامد از مولکولهای ساکارز جداگانهای تشکیل شده که با پیوندهای بین مولکولی کنار هم نگه داشته شدهاند. هنگامی که شکر در آب حل میشود، پیوندهای بین مولکولی مولکولهای شکر شکسته شده و این مولکولها بین مولکولهای آب گیر میافتند.
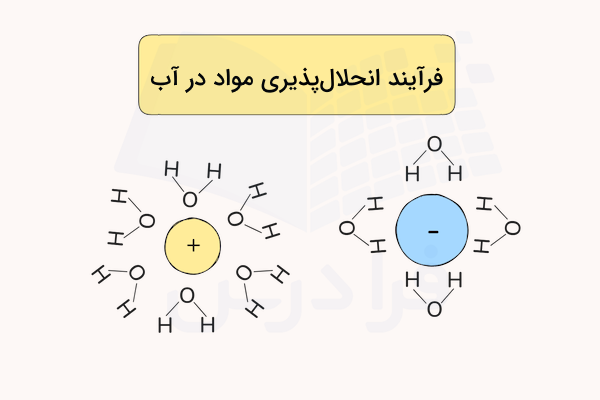
در فرآیند انحلال پیوندهای بین اتمی کووالانسی شکسته نمیشود. برای مثال در مورد شکر پیوندهای بین اتمهای اکسیژن، هیدروژن و کربن تغییری نمیکنند. مولکولهای شکر توسط مولکولهای آب هیدراته میشود به این صورت که قسمت نسبتا مثبت مولکولهای شکر توسط اکسیژن آب و قسمت نسبتا منفی آن توسط هیدروژن جذب میشود.
میزان حلالیت مواد در آب
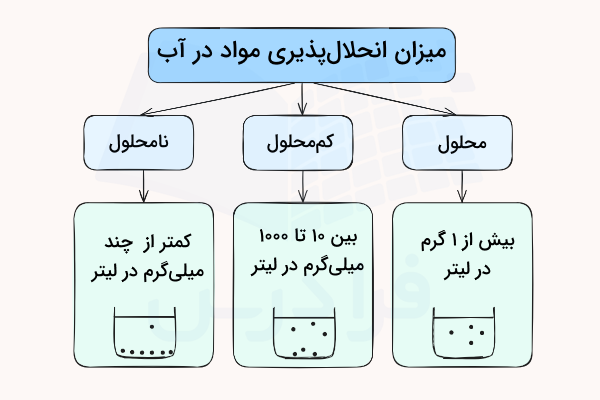
میزان حلالیت مواد در آب به صورت میلیگرم یا گرم ماده حل شده در یک لیتر آب بیان میشود. میزان انحلال پذیری مواد در آب به سه دسته محلول، کممحلول و نامحلول تقسیم میشود. در ادامه این موارد را توضیح میدهیم.
- مواد محلول در آب: اگر بیشتر از ۱۰۰۰ میلیگرم (۱ گرم) ماده حلشونده در یک لیتر آب حل شود به آن ماده محلول گفته میشود. شکل زیر حرکت ذرات محلول را در آب نشان میدهد.
- مواد کممحلول در آب: اگر میزان ماده حل شده در آب بین ۱۰ تا ۱۰۰۰ میلیگرم در یک لیتر آب باشد، به آنها کممحلول گفته میشود. این مواد ممکن است در مواردی بسته به شرایط در آب رسوب دهند. شکل زیر حرکت ذرات کممحلول را در آب نشان میدهد.
- مواد نامحلول در آب: اگر میزان ذرات حل شده در آب کمتر از چند میلیگرم در یک لیتر آب باشد، به آنها نامحلول در آب گفته میشود. شکل زیر حرکت ذرات نامحلول را در آب نشان میدهد.
انحلال ترکیبات مولکولی در آب
انحلال پذیری مواد در آب تا حدود بسیار زیادی به ماهیت شیمیایی ماده حلشونده در آب بستگی دارد. مواد میتوانند به فرمها مولکولی قطبی و غیرقطبی یا یونی باشند. انحلال ترکیبات مولکولی به وسیله نیروهای واندروالسی لاندن قابل توضیح است. حرکتهای کوتاه مدت در الکترونهای درگیر بین اتمها و مولکولهای غیرقطبی، میتوانند به تشکیل گشتاورهای دوقطبی با عمر کوتاه منجر شوند، که نیروهای جاذبه لاندن را بین ترکیبات ناقطبی به وجود میاورد.
پیوندهای هیدروژنی که مولکولها به یکدیگر نزدیک نگه میدارد معمولا ضعیف هستند. اما با این حال به یک انرژی برای شکستن این پیوندها نیاز است. این انرژی را نیروی کشش مولکولهای آب تامین کرده و این ذرات را از یکدیگر جدا میکند به این ترتیب ترکیبات مولکولی غیرقطبی نیز میتوانند در آب حل شوند.
توضیح فرآیند حل شدن نمک در آب
در یک محلول، یک یا چند ماده در یک مایع مخلوط میشوند و این مخلوط به یک مایع کاملاً همگن تبدیل میشود. محلولها شفاف هستند، نه کدر، و ممکن است رنگی یا بیرنگ باشند. آب نمک، یک مثال از محلول، در شکل زیر به تصویر کشیده شده است. قطعات نمک در صورت حل شدن در محلول قابل مشاهده نیستند. در شکل زیر دایرههای سبز و زرد اتمهای سدیم و کلر را در بین مولکولهای آب (آبیرنگ) نشان میدهد.

نمک به یونهای جداگانه تفکیک شده و توسط مولکولهای آب احاطه میشود. در صورت هم زدن محلول فرآیند انحلال با سرعت بیشتری انجام میشود زیرا مولکولهای آب راحتتر میتوانند ذرات نمک را در بر بگیرند. همچنین هم زدن محلول باعث افزایش حرکتهای ذرات میشود که این عامل نیز به فرآیند انحلال کمک میکند. در نهایت مقدار بیشتری از نمک در آب حل میشود.
اگر مقدار کافی نمک اضافه شود، سیستم ممکن است به تعادل برسد. بدین صورت که آب تمام نمکی را که میتواند حل کرده است و بقیه نمک به صورت جامد باقی میماند. این تعادل پویا است زیرا یونها در حالی که در آب حل میشوند، به طور همزمان از محلول به حالت جامد رسوب میکنند. با این حال، نسبت کلی یونهای حل شده به آب ثابت میماند.
قوانین انحلال پذیری مواد در آب
با در نظر نگرفتن موارد استثنایی که در آب حل نمیشوند، گفته میشود که آب یک حلال عمومی است زیرا میتواند بسیاری از مواد را در خود حل کند. موادی که در آب حل نمیشوند، روغنها، فراوردههای نفتی، پلاستیکها و ... هستند. قابل توجه است که بسیاری از موادی که در آب انحلال ناپذیر هستند در هر صورت میتوانند در آب وجود داشته باشند و تشکیل مخلوط امولسیون یا سوسپانسیون دهند.
همچنین تمامی ترکیبات یونی در آب حل نمیشوند. برای مثال ترکیب یونی کلسیم کربنات و کلرید نقره در آب تقریبا انحلال ناپذیر هستند. این پدیده به این علت است که نیروهای بین مولکولی این ترکیبات احتمالا از نیروی بین مولکولی آب قویتر است و آب نمیتواند مولکولهای ترکیب را از یکدیگر جدا کند. انحلال پذیری ترکیبات یونی در آب یک امر قابل پیشبینی است که با استفاده از قوانین انحلال پذیری و بر اساس نیروهای بین مولکولی این ترکیبات قابل تشخیص است. جدول قوانین انحلال پذیری برای ترکیبات یونی در ادامه آمده است.
| ترکیبات یونی انحلال پذیر در آب شامل یونهای زیر هستند. | بجز مواقعی که با این یونها ترکیب شوند. |
| کاتیونهای فلزات گروه ۱ جدول تناوبی، یون | -- |
| -- | |
| ترکیبات یونی انحلالناپذیر در آب شامل یونهای زیر هستند. | بجز مواقعی که با این یونها ترکیب شوند. |
| ، کاتیونهای گروه ۱ جدول تناوبی | |
| ، کاتیونهای گروه ۱ جدول تناوبی | |
مواد غیرقطبی نیز در آب حل نمیشوند. نیروهای بین مولکولی این مواد بسیار ضعیف هستند و برای حل شدن در آب باید نیروهای بین مولکولی مولکولهای آب و اتمهای هیدروژن را بشکنند و توانایی این کار را ندارند. هنگامی که یک ماده غیرقطبی مانند روغن با آب مخلوط میشود دو لایهی مجزا در محلول ایجاد میشود زیرا این مایعات در یک دیگر حل نمیشوند.

به مایعاتی که در آب حل میشوند امتزاجپذیر و به مایعاتی که در صورت مخلوط شدن با آب دو فاز مجزا تشکیل میدهند مایعات امتزاج ناپذیر میگویند. برای مثال الکل در آب امتزاج پذیر و روغن در آب امتزاج ناپذیر است.
مثال قوانین انحلال پذیری
برای تمرین بیشتر قوانین جدول بالا به مثالهای زیر توجه کنید.
مثال اول قوانین انحلال پذیری
پیشبینی کنید که آیا در اثر انجام شدن واکنش زیر در آب، رسوبی تشکیل میشود یا خیر؟
فراورده این واکنش از دو ترکیب تشکیل شده است. فراورده اول حاوی یون سولفید است که در آب حل نمیشود. پس سولفید نقره در آب رسوب میدهد. ترکیب دوم حاوی یون نیترات است که با توجه به جدول در آن حل میشود.
مثال دوم قوانین انحلال پذیری
پیشبینی کنید که آیا در اثر انجام شدن واکنش زیر در آب، رسوبی تشکیل میشود یا خیر؟
فراوردههای این واکنش حاوی یونهای هیدروکسید و کرومات و همچنین فلز قلیایی پتاسیم هستند. پس در مورد فراورده اول، با توجه به جدول میدانیم با اینکه یونهای هیدروکسید در آب نامحلول هستند اما فلزات قلیایی در هر ترکیبی بجز در ترکیب با یون آمونیوم در آب محلول هستند پس پتاسیم هیدروکسید در آب حل میشود. از طرف دیگر، نیز یک ترکیب یونی از فلز قلیایی سدیم است، پس در آب محلول است. پس این واکنش هیچ گونه رسوبی در آب تشکیل نمیدهد.
عوامل تأثیرگذار بر حلالیت مواد در آب
در قسمتهای قبل فرآیند حل شدن نمک در آب را بررسی کردیم و حال میخواهیم بدانیم چرا نمکها در آب حل میشوند. آب یک ترکیب مولکولی است. اتمها مستقیما به هم متصل هستند و به جای اینکه یونهایی باشند که به هم جذب شوند، به یکدیگر پیوستهاند. به دلیل تفاوت الکترونگاتیوی، اتم اکسیژن در آب دارای بار جزئی منفی و اتمهای هیدروژن دارای بار جزئی مثبت هستند. ترکیبات یونی میتوانند در مایعات قطبی مانند آب حل شوند زیرا یونها به بخش مثبت یا منفی مولکول جذب میشوند.
در این فرآیند نوعی برهمکنش بین ذرات حلشده در آب وجود دارد. آب یونهای منفرد را از جامد جدا میکند. جامد نیز سعی میکند یونهای منفرد را از آب خارج کند. بر اساس این که آب چقدر قوی یونها را جذب میکند در مقابل اینکه جامد یونی چقدر قوی یونهای خود را جذب میکند، یک تعادل وجود دارد.

اثر یون مشترک
یکی از عوامل تأثیرگذار بر حلالیت مواد در آب اثر یون مشترک است. اثر یون مشترک به اثری گفته میشود که اضافه شدن یک یون به محلولی که قبلا حاوی آن یون بوده است باعث کاهش انحلال پذیری آن میشود. این اثر با قانون لوشاتلیه قابل توضیح است. طبق اصل لوشاتلیه که بیان میکند وقتی تعادل یک سیستم مختل میشود، سیستم خود را به گونهای تنظیم میکند که اثر تغییر تعادل را جبران کند. برای درک بهتر این موضوع به مثال زیر توجه کنید.
تصور کنید یک ترکیب یونی کلسیم سولفات به آب اضافه شده است. معادله ساده این یونها در آب به شکل زیر است.
کلسیم سولفات در آب کممحلول است. بیشتر یونهای کلسیم و سولفات در فرم جامد ترکیب کلسیم سولفات وجود خواهند داشت. حال تصور کنید میخواهیم ترکیب مس (II) سولفات را به این ترکیب آب و کلسیم سولفات اضافه کنیم. ترکیب سولفات مس در آب محلول است پس تنها اثر معادله تفکیک یون آن در این محلول افزایش یونهای سولفات به یونهای سولفاتی که از قبل داشتیم است.
این افزایش یون به وجود آمده بر تعادلی که از قبل در محلول وجود داشته فشار آورده و طبق اصل لوشاتلیه تعادل برهم میخورد. این اصل بیان میکند در صورت برهمخوردن تعادل، واکنش به سمت واکنش دهندهها بیشتر میل میکند تا تعادل برهم خورده جبران شده و دوباره تعادل جدیدی در واکنش برقرار شود. از آنجا که ازدیاد یونهای سولفات در محلول باید جبران شود، یونهای سولفات آزاد شده از کلسیم سولفات کممحلول دوباره به فاز جامد برگشته و از حلالیت این ماده در آب کم میشود. برای آشنایی بیشتر با مفهوم اثر یون مشترک پیشنهاد میکنیم مطلب زیر از مجله فرادرس را مطالعه کنید.
برای درک بهتر اثر یون مشترک به مثالهای زیر توجه کنید.
مثال اول اثر یون مشترک
هر دو سیستمی که دارای بار الکتریکی باشند، به یکدیگر نیرو وارد خواهند کرد. در حقیقت این نیرو برآیند نیروهایی است که ذرات باردار به یکدیگر وارد میکنند. نیروی موجود بین دو تکذره باردار را میتوان با استفاده از «قانون کولن» (Coulomb's law) محاسبه کرد. با استفاده از اصول قانون کولن میتوان درجات مختلفی از حلالیت ترکیبات یونی در آب را پیشبینی کرد. هرچه یونها کوچکتر باشند، فاصله آنها کمتر است و برای مولکولهای آب سختتر است که یونها را از هم جدا کنند. پیشبینی کنید که کدام یک از جفتهای زیر باید بر اساس جاذبه کولنی بین یونها در آب محلولتر باشند.
- LiF یا NaF
- NaK یا KF
- BeO یا LiF
پاسخ:
برای پیشبینی میزان حلالیت این ترکیبات یونی در آب باید فاکتورهایی مانند الکترونگاتیوی اتمها را در نظر بگیریم. LiF در گزینه اول حلالیت بیشتری دارد. در گزینه دوم KF و در گزینه سوم LiF حلالیت بیشتری دارند. برای درک بهتر روند حلالیت مواد در آب به خواندن ادامه مطلب بپردازید.
مثال دوم اثر یون مشترک
اگرچه لیتیوم فلوئورید و اکسید منیزیم کاتیونها و آنیونهایی با اندازه تقریبا مشابه دارند، لیتیوم فلوئورید در دمای اتاق بسیار بیشتر در آب محلول است (2.7 گرم در لیتر) نسبت به اکسید منیزیم (0.087 گرم در لیتر). دلیلی برای این تفاوت پیشنهاد کنید.
پاسخ:
ترکیب MgO شامل یونهایی با ۲ بار مثبت و منفی است اما LiF دو یون با بارهای +۱ و -۱ دارد. پس جداکردن ترکیبات منیزیم اکسید سخت تر است و در آب کمتر محلول است.

روندهای نقطه ذوب در ترکیبات یونی در ارتباط با حلالیت پیچیدهتر هستند. حلالیت در آب کلریدهای قلیایی از یک روند ساده پیروی نمیکند. کلرید لیتیوم کمترین حلالیت را در آب بین سه ترکیب دارد. این قابل درک است، زیرا یونهای لیتیوم کوچک هستند و جاذبه آنها برای کلرید در این فاصله کوتاه قویتر است. با این حال، انتظار میرفت که کلرید پتاسیم بیشترین حلالیت را داشته باشد، اما حلالیت آن کمی کمتر از کلرید سدیم است.
مثال سوم اثر یون مشترک
توضیحی برای اینکه چرا حلالیت کلریدهای قلیایی در آب به سادگی با بزرگتر شدن کاتیون افزایش نمییابد، پیشنهاد دهید.
| حلالبت در ۱۰۰ میلیلیتر آب در دمای ۲۰ درجه سانتیگراد | ترکیب |
| ۸۳ | LiCl |
| ۳۵۹ | NaCl |
| ۳۴۴ | KCl |
پاسخ:
برهمکنش بین یونها و مولکولهای آب به وسیله واکنشهای الکترواستاتیک انجام میشود. همان اثر فاصله بین یونها که باعث میشود ذرات کوچکتر پیوندهای یونی قویتری داشته و کمتر حل شوند، باعث میشود این یونها با ذرات آب نیز بیشتر پیوندهای بین مولکولی تشکیل دهند. پس لزوما افزایش شعاع اتمی این مواد قرار نیست حلالیت آنها را در آب افزایش دهد و این عامل با عوامل بسیاری و به صورت پیچیدهتر کم و زیاد میشود.
اگر یون هالید نیز تغییر کند، روندهای مشابه مشاهده میشود. قابل توجه است که کلرید لیتیوم کمترین حلالیت را دارد، اما بهجای یدید لیتیوم، برمید لیتیوم بیشترین حلالیت را دارد.
این نوع رفتار نشان میدهد که بیش از یک عامل بر پدیده حلالیت تأثیر میگذارد. در مورد حلالیت، عوامل مختلفی وجود دارند که برخی از آنها پیچیدهتر هستند. یکی از این عوامل شامل این است که دو تعامل باید در نظر گرفته شود. حل شدن این ترکیبات نیاز به بیش از عامل غلبه بر جاذبه جامد یونی برای یونهای منفرد دارد، همانطور که ذوب شدن نیز همینطور است و جاذبه آب به یون نیز باید در نظر گرفته شود. آن جاذبه نیز بر اساس قانون کولن تنظیم میشود. در یک مرحله، یک نقطه تعادل وجود دارد که عواملی که جاذبه بین یونها را افزایش میدهند، جاذبه بین یون و آب را نیز افزایش میدهند. یکی از این عوامل تحت شرایط مختلف تأثیر بیشتری پیدا میکند.
چندین تعامل در فرآیند حل شدن تأثیرگذار هستند.
- جاذبه کاتیون-آنیون فقط یکی از این تعاملات است.
- تعاملات کاتیون-آب و آنیون-آب نیز مهم هستند.
- تعاملات آب-آب نیز نقشی ایفا میکنند.
حاصلضرب حلالیت
در بررسی انحلالپذیری مواد در آب، ممکن است به واژه حاصلضرب حلالیت برخورد کنیم. واژه حاصلضرب حلالیت عموما برای نمکهای کممحلول به کار میرود. این محصول حداکثر حاصلضرب غلظت مولار یونها (به توانهای مناسب آنها) است که به دلیل تجزیه ترکیب تولید میشود.
در دمای معین، حاصلضرب حلالیت ثابت است. مقدار کمتر حاصلضرب حلالیت نشاندهنده حلالیت پایینتر و مقدار بالاتر حاصلضرب حلالیت نشاندهنده حلالیت بیشتر است. بر اساس حلالیت، عواملی که بر حلالیت تأثیر میگذارند بسته به وضعیت حلشونده متفاوت است. این وضعیت به صورت زیر دستهبندی میشود.
- مایعات در مایعات
- جامدات در مایعات
- گازها در مایعات
حلالیت انواع ماده در آب
پیشتر اشاره شد که آب به عنوان حلال جهانی شناخته میشود زیرا تقریبا تمام حلشوندهها را به جز چند مورد حل میکند. عوامل خاصی میتوانند بر حلالیت یک ماده تأثیر بگذارند. انواع مختلف مایع، جامد و گاز میتوانند در آب حل شوند. در ادامه این مطلب از مجله فرادرس، هریک از این موارد را بررسی کرده و عوامل تأثیرگذار بر حلالیت این مواد در آب را بررسی میکنیم.
حلالیت مایعات در آب
حلالیت به تشکیل پیوند جدید بین مولکولهای حلشونده و مولکولهای حلال اشاره دارد. از نظر مقداری، حلالیت حداکثر غلظت حلشونده است که در غلظت معینی از حلال در دمای معین حل میشود. بر اساس غلظت حلشونده در حلال، حلشوندهها به سه دسته بسیار محلول، کمی محلول یا غیرمحلول تقسیم میشوند. اگر غلظت ۰.۱ گرم یا بیشتر از یک حلشونده در ۱۰۰ میلیلیتر حلال حل شود، گفته میشود که حلشونده محلول است. در حالی که غلظت کمتر از ۰.۱ گرم در حلال حل شود، گفته میشود که کمی محلول است. بنابراین، حلالیت یک بیان کمی است و با واحد گرم/لیتر (g/L) بیان میشود.
بر اساس حلالیت، انواع مختلفی از محلولها میتوانند به دست آیند. محلولهای اشباع، غیر اشباع، و فوق اشباع انواع مختلف محلول هستند. تعاریف هریک از این محلولها در ادامه آورده شده است.
- محلول اشباع، محلولی است که مقدار معینی از حلشونده کاملا در حلال در دمای معین حل شده است.
- محلول فوق اشباع، محلی است که حلشونده پس از حل شدن به غلظت خاصی در همان دما شروع به رسوب دادن میکند.
- محلول غیراشباع محلولی است که ظرفیت آب برای حلکردن ماده حلشونده هنوز پر نشده است.

عوامل تأثیرگذار بر حلالیت مایعات در آب
عواملی که بر حلالیت مایعات در مایعات تأثیر میگذارند به صورت زیر است.
حلالیت یک ماده به خصوصیات فیزیکی و شیمیایی آن ماده بستگی دارد. علاوه بر این، شرایطی نیز وجود دارد که میتواند آن را تغییر دهد. دما، فشار و نوع پیوند و نیروهای بین ذرات از جمله آنها هستند. در ادامه نوع اثرگذاری این عوامل توضیح داده شده است. همچنین برهمکنش بین ذرات حلشونده و حلال یکی از مهمترین عوامل تاثیر گذار بر میزان انحلال در آب است.
اثر برهمکنش بین ذرات حلشونده و حلال
روابط بین حلشونده و حلال یکی از عوامل بسیار مهم در اندازهگیری حلالیت مواد در آب است. جاذبههای قویتر بین ذرات حلشونده و حلال باعث حلالیت بیشتر آنها در آب میشود در حالی که جاذبههای ضعیف بین این موارد باعث کم شدن حلالیت آنها میشود. همچنین در بررسی انواع حلال و حلشونده مشاهده میکنیم که مواد قطبی بهتر و بیشتر در حلالهای قطبی و مواد غیرقطبی بیشتر در حلالهای غیرقطبی حل میشوند. برای مثال کره که یک ماده غیرقطبی است به خوبی در آب حل نمیشود اما در روغن حل میشود. اما آنحلال پذیری آمونیاک در آب زیاد است.
اثر دما
با تغییر دما میتوانیم خاصیت حلالیت یک حلشونده را افزایش دهیم. به طور کلی، آب حلشوندهها را در دمای ۲۰ درجه سانتیگراد یا ۱۰۰ درجه سانتیگراد حل میکند. مواد جامد یا مایع کمی محلول میتوانند با افزایش دما به طور کامل حل شوند. اما در مورد مواد گازی، دما به طور معکوس بر حلالیت تأثیر میگذارد. یعنی با افزایش دما، گازها منبسط شده و از حلال خود خارج میشوند.
اثر نیروها و پیوندها
مواد مشابه از نظر قطبیت در یکدیگر حل میشوند. نوع نیروهای بینمولکولی و پیوندها در هر مولکول متفاوت است. احتمال حلالیت بین دو ماده نامشابه دشوارتر از مواد مشابه است. به عنوان مثال، آب یک حلال قطبی است که یک حلشونده قطبی مانند اتانول به راحتی در آن حل میشود.
اثر فشار
مواد گازی نسبت به جامدات و مایعات تحت تأثیر فشار بیشتری قرار دارند. وقتی فشار جزئی گاز افزایش مییابد، احتمال حلالیت آن نیز افزایش مییابد. بطریهای نوشابه نمونهای از جایی است که تحت فشار بالا بستهبندی میشود.
حلالیت جامدات در آب
مشاهده شده است که حلالیت جامدات به ماهیت حلشونده و همچنین حلال بستگی دارد. معمولا میبینیم که موادی مانند شکر، نمک معمولی (NaCl) و غیره به راحتی در آب حل میشوند، در حالی که موادی مانند نفتالن در آب حل نمیشوند. از مشاهدات و نتایج آزمایشات مختلف مشخص شده است که تنها حلشوندههای قطبی تمایل به حل شدن در حلالهای قطبی دارند و حلالهای غیرقطبی تنها حلشوندههای غیرقطبی را حل میکنند. بنابراین، ماهیت حلال یکی از عوامل برجستهای است که بر حلالیت تأثیر میگذارد. حلالهای قطبی حلشوندههای قطبی را حل میکنند و حلالهای غیرقطبی حلشوندههای غیرقطبی را حل میکنند.
اکنون بیایید فرآیند حل شدن یک جامد در حلال را بررسی کنیم. زمانی که یک حلشونده جامد به حلال اضافه میشود، ذرات حلشونده در حلال حل میشوند و این فرآیند به نام حل شدن شناخته میشود. ذرات حلشونده در محلول با یکدیگر برخورد میکنند و برخی از این ذرات از محلول جدا میشوند که این فرآیند به نام کریستالیزاسیون شناخته میشود.
وضعیت تعادل پویا بین این دو فرآیند برقرار میشود و در این مرحله، تعداد مولکولهای حلشوندهای که به محلول وارد میشوند با تعداد ذراتی که از محلول خارج میشوند برابر میشود. در نتیجه، غلظت حلشونده در محلول در دمای و فشار معین ثابت خواهد ماند.
محلولهایی که در آنها هیچ حلشوندهای نمیتواند در حلال حل شود در دمای و فشار معین به نام محلول اشباع شده شناخته میشوند زیرا محلول حداکثر میزان حلشونده را داراست. غلظت حلشونده در چنین محلولی به عنوان حلالیت آن در آن دما و فشار نامیده میشود. اگر بتوان حلشونده بیشتری به محلول اضافه کرد، به آن محلول اشباع نشده گفته میشود.

عوامل تأثیرگذار بر حلالیت جامدات در آب
عواملی که بر حلالیت جامدات در آب تأثیر میگذارند به صورت زیر است.
اثر دما
علاوه بر ماهیت حلشونده و حلال، دما نیز به طور قابل توجهی بر حلالیت جامد تأثیر میگذارد. اگر فرآیند حل شدن اندوترمیک باشد، حلالیت باید با افزایش دما طبق اصل لوشاتلیه افزایش یابد. در واکنشهای اندوترمیک(گرماگیر) افزایش دما، فشار تعادل روی واکنشدهندهها را زیاد میکند. برای از بین بردن این برهم خوردگی تعادل، باید واکنشدهندههای بیشتری به فراورده تبدیل شوند پس حلالیت افزایش مییابد. اگر فرآیند حل شدن اگزوترمیک (گرماده) باشد، حلالیت جامد باید کاهش یابد. در این واکنشها افزایش فشار بر تعادل در سمت فراوردهها صورت میگیرد پس واکنشدهندهها باید با سرعت کمتری به فراورده تبدیل شوند و انحلال پذیری کاهش مییابد.
اثر فشار
حلالیت جامد به سختی تحت تأثیر تغییرات فشار قرار میگیرد. این به دلیل این است که جامدات و مایعات بسیار غیرقابل فشردن هستند و عملا تحت تأثیر تغییرات فشار قرار نمیگیرند.
حلالیت گازها در آب
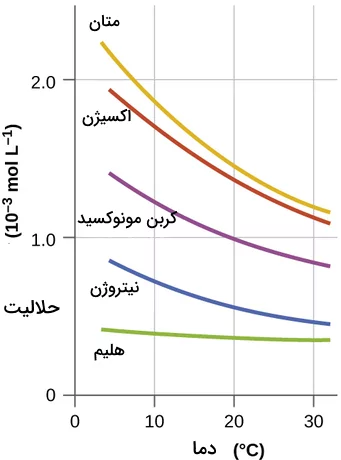
حلالیت گازها در مایعات به مفهوم حل شدن گاز در یک حلال مربوط میشود. برای هر مادهای، حلالیت حداکثر مقدار حلشوندهای است که میتواند در حلال معین در دمای خاصی حل شود. حلالیت گازها در مایعات به شدت تحت تأثیر دما و فشار و همچنین ماهیت حلشونده و حلال قرار دارد. برخی از گازها به راحتی در آب حل میشوند، در حالی که برخی دیگر تحت شرایط معمولی در آب حل نمیشوند. اکسیژن تنها به مقدار کم در آب حل میشود، در حالی که HCl یا آمونیاک به راحتی در آب حل میشوند.

عوامل تأثیرگذار بر حلالیت گازها در آب
عواملی که بر حلالیت گازها در مایعات تأثیر میگذارند به صورت زیر است.
اثر فشار
مشخص شده است که حلالیت گاز در مایعات با افزایش فشار افزایش مییابد. برای درک بهتر تأثیر فشار بر حلالیت گاز، سیستم گاز در محلول را در یک ظرف بسته در حالت تعادل پویا در نظر بگیریم. در این حالت، محلول در تعادل است و بنابراین نرخ ورود مولکولهای گازی به محلول برابر با نرخ خروج مولکولهای گازی از محلول است.
اکنون فرض کنید فشار سیستم را با فشردهسازی مولکولهای گاز موجود در محلول افزایش دهیم. به دلیل افزایش فشار، مولکولهای گاز در حجم کوچکتری متمرکز خواهند شد. این باعث افزایش تعداد مولکولهای گاز در واحد حجم محلول میشود. از آنجا که تعداد مولکولهای گاز محلول افزایش یافته است، نرخ ورود مولکولهای گاز به محلول نیز افزایش خواهد یافت. نتیجه نهایی این است که تعداد مولکولهای گاز در محلول افزایش مییابد تا زمانی که نقطه تعادل جدیدی به دست آید. بنابراین، حلالیت گازها با افزایش فشار گاز محلول افزایش مییابد. قانون هنری رابطه کمی بین فشار و حلالیت گاز در مایع را ارائه میدهد. این قانون بیان میکند که:
حلالیت یک گاز در مایع به طور مستقیم متناسب با فشار جزئی گاز موجود بالای سطح مایع یا محلول است.
عمومیت استفاده از قانون هنری به این صورت است که فشار جزئی گاز بالای محلول به مولار فاکتور گاز در محلول متناسب است.
که در آن:
- ( p ) = فشار جزئی گاز
- ( x ) = مولار فاکتور گاز در محلول
- = ثابت قانون هنری
اثر دما
حلالیت گازها در مایعات با افزایش دما کاهش مییابد. مولکولهای گاز در مایع از طریق فرآیند حل شدن حل میشوند. در این فرآیند، گرما آزاد میشود. طبق اصل لوشاتلیه که بیان میکند وقتی تعادل یک سیستم مختل میشود، سیستم خود را به گونهای تنظیم میکند که اثر تغییر تعادل را جبران کند. از آنجایی که حل شدن گازها در مایعات یک فرآیند گرمازا است، حلالیت باید با افزایش دما کاهش یابد تا اصل لوشاتلیه تایید شود. باید توجه داشته باشیم که انحلال گازها در آب مانند انحلال پذیری نیتروژن در آب، یک فرآیند گرماده است پس گرما سمت فراوردههای واکنش است و افزایش دما فشار تعادل را در سمت فراوردهها زیاد میکند و در نتیجه انحلال پذیری کم میشود.
ثابت حاصلضرب حلالیت و محاسبه انحلال پذیری مواد در آب
یکی از راههای به دست اوردن میزان انحلال پذیری مواد در آب، بررسی تابت حاصلضرب حلالیت است. ثابت حاصلضرب حلالیت() ثبت تعادلی است که در مورد انحلال یک ترکیب جامد در آب بیان میشود. این پارامتر مقادیری را که ترکیب در یک حلال حل میشود را مشخص میکند. هرچه میزان انحلال پذیری ماده بیشتر باشد میزان () بالاتر است. برای درک بهتر این پارامتر، واکنش کلی زیر را در نظر بگیرید.
برای به دست آوردن مقدار ثابت حاصلضرب حلالیت لازم است تا غلظت مولار فراوردهها به توان ضرایب استوکیومتری آنها در هم ضرب شود. فرمول به دست آوردن () به شکل زیر است.
توجه کنید که غلظت واکنش دهنده A در این معادله نوشته نشده است. مواد جامد در بررسی میزان () تاثیر گذار نیستند. به این دلیل که غلظت آنها در طی واکنش تغییر نمیکند یا تغییر غلظت آنها قابل صرفنظر است. بنابراین فرمول بالا بیشترین میزانی که یک ماده جامد میتواند در یک حلال مایع مانند آب حل شود را نشان میدهد.
برای درک بهتر این پارامتر، مثال زیر را در نظر بگیرید.
میزان () را برای ترکیب در واکنش زیر محاسبه کنید.
معادله تعادلی انحلال منیزیم فلوئورید در آب به شکل بالاست پس میزان ثابت انحلال آن به روش زیر به دست میاید.
افزایش انحلال پذیری مواد در آب
مانند سایر حلالها، افزایش فشار و دما بر حلالیت آب تاثیر میگذارد و باعث افزایش انحلال پذیری آن میشود. افزایش فشار به وسیله افزایش تعداد ذرات ماده حل شوند وارد شده به فاز مایع حلال و افزایش انحلال پذیری میشود. همچنین افزایش دما باعث افزایش حرکتهای ذرات و انرژی واکنش ذرات حلشونده شده و این امر باعث میشود راحتتر در آب حل شوند. باید توجه داشت افزایش دما و فشار در مورد همه حلالها باعث افزایش انحلال پذیری نمیشود. برای مثال در واکنشهای گرماده، افزایش دما باعث کاهش انحلال پذیری میشود. در ادامه این مطلب از مجله فرادرس این مفاهیم را به اختصار توضیح دادهایم.
کلوئیدها، سوسپانسیونها و امولسیونها
گفتیم که هنگامی که یک ماده در آب حل میشود میتواند محلولی اشباع یا غیر اشباع تولید کند. به هرحال در هر محلول تشکیل شده طبق قانون لوشاتلیه تعادل وجود دارد. در برخی از محلولهای همگن ذرات به دام افتاده بین مولکولهای آب میتوانند فرم جامد یا مایع خود را حفظ کنند. تصور کنید مقداری خاک در آب ریختهاید. مشاهده میشود که خاک در آب حل نمیشود اما برای لحظاتی ممکن است خاک در آب همگن بنظر برسد. به قسمت گلآلود آب که شفاف نیست یک سوسپانسیون گفته میشود.

تعریف سوسپانسیون
سوسپانسیون محلول ناهمگن یک حلال و حلشونده است که قسمتی از آن از حلال جداشده و به ته ظرف تهنشنین میشود. ذرات موجود در یک سوسپانسیون عموما درشت هستند و نیروی جاذبه بر آنها غلبه کرده و باعث تهنشین شدن آنها میشود. بر خلاف محولهای همگن که پس از فرآیند انحلال جداسازی ذرات حلشونده از آن امکانپذیر نیست، ذرات سوسپانسیون با عبور از یک فیلتر میتوانند جدا شوند.
به محلولهای سوسپانسیون محلولهای ناهمگن گفته میشود زیرا پخش شدگی ذرات حلشونده در آنها در صورتی که هم زده نشوند به شکل یکنواخت نیست. در یک سوسپانسیون، یک یا چند ماده در یک مایع مخلوط میشوند و این مخلوط به طور نسبی همگن میشود. به جای اینکه لایههای قابل تشخیص به راحتی دیده شوند، مایع ظاهری یکنواخت در تمام قسمتها دارد. با این حال، سوسپانسیونها معمولا مایعات کدر هستند. شیر یک سوسپانسیون است که شامل آب، چربیها و پروتئینها است. این مواد ممکن است در نهایت به لایههای جداگانهای تفکیک شوند، اما این کار زمان میبرد.
تعریف کلوئید
کلوئیدها مخلوطهای ناهمگنی هستند که پخش شدگی ذرات حلشونده در آنها بین ذرات حلال یکنواخت است و ته نشین نمیشوند. مواد حلشونده در کلوئیدها میتوانند به فرم گاز، مایع با جامد باشند. به این دلیل که اندازه ذرات حلشونده در مخلوطهای کلوئید به بزرگی ذرات سوسپانسیونها نیست، این ذرات ته نشین نمیشوند. این مواد با فیلتراسسیون قابل جداسازی نیستند اما ذرات آنها به اندازهای بزرگ هست که با محلولها تفاوت داشته باشند. دود و گرد و خاک هوا، مه، خامههای هم زده همه اینها کلووییدهای تشکیل شده با هوا هستند. ذرات آنها بین مولکولهای هوا به شکل یکنواختی پخش شده است.
تعریف امولسیون
کره و سس میونز نمونههایی از مخلوط امولسیون هستند. امولسیونها کلوئیدهای یک مایع در مایع یا جامد هستند. این مواد با مادهای به نام امولسیفایر پایدار میشوند و از تهنشینی آنها جلوگیری میشود. در سس مایونز دو ماده روغن و سرکه با یکدیگر ترکیب شدهاند. به این دلیل که سرکه یک مایع قطبی و روغن یک ماده غیرقطبی است، در حالت عادی با یکدیگر مخلوط نشده و دو لایه جداگانه را تشکیل میدهند. اضافه کردن سفیده تخم مرغ به این ترکیبات باعث میشود این مواد از یکدیگر جدا نشوند و پایدار بمانند. سفیده تخم مرغ در اینجا در واقع یک امولسیفایر است.
جمعبندی
حلالیت آب عبارت است از حداکثر غلظت حلشونده به فرم مایع، جامد یا گاز که در دمای معین در یک لیتر آب حل میشود. اگر غلظت حلشونده در آب بیشتر از ۱ گرم در یک لیتر باشد آن ماده محلول در آب، اگر کمتر از ۱۰ میلیگرم باشد نامحلول و اگر بین این دو مقدار باشد کممحلول است. انحلال پذیری مواد در آب به عواملی مانند فشار و دما بستگی دارد اما مهمترین عامل ماهیت ماده حلشونده و برهمکنش آن با مولکولهای آب است. طی فرآیند حل شدن مواد در آب ممکن است محلولهای شفاف، دوفاز، کدر، امولسیون یا کلويید تولید شود.