نقطه ذوب و اندازه گیری آن – از صفر تا صد
مایعات و جامدات از آن جهت مشابه یکدیگرند که هردو در حالتی فشرده قرار دارند و ذرات این دو نسبت به گازها بسیار به هم نزدیک هستند. البته مایعات، به دلیل جاری بودن، شکل ظرف را به خود میگیرند اما این مورد در جامدات صدق نمیکند. ذرات بیشتر جامدات با یک نظم خاصی در کنار یکدیگر قرار گرفتهاند و حرکت هر اتم، یون یا مولکول در جامد، محدود به حرکت ارتعاشی است. زمانی که یک جامد را حرارت میدهیم، ذرات تشکیلدهنده آن شروع به ارتعاش میکنند. در اثر این ارتعاش، ماده مورد نظر انرژی جنبشی جذب میکند. در نهایت، آرایش منظم ذرات جامد از بین میرود و جامد شروع به ذوب شدن خواهد کرد. نقطه ذوب دمایی است که در آن، یک جامد شروع به ذوب شدن میکند.


مقدمه
در نقطه ذوب یک جامد، که یک تغییر فیزیکی است، ارتعاش تخریبی ذرات، بر نیروهای جاذبه حاکم در یک جامد غلبه میکنند. جامدات همچنین «تراکمناپذیر» (Incompressible) هستند. لازم به ذکر است که این مواد جزو چگالترین مواد در بین حالتهای مختلف ماده به شمار میآیند. نمک طعام (سدیم کلرید) ترکیبی یونی متشکل از تعداد زیادی پیوند قدرتمند یونی است.
این ماده در 801 درجه سانتیگراد ذوب میشود. یخ، با فرمول شیمیایی یک ترکیب مولکولی است که مولکولهای آن توسط پیوندهای هیدروژنی در کنار یکدیگر قرار گرفتهاند. با وجود اینکه پیوند هیدروژنی جزو قویترین پیوند بینمولکولی شناخته میشود اما قدرت این پیوند، بسیار کمتر از پیوند یونی است به طوریکه نقطه ذوب یخ، صفر درجه است.
نقطه ذوب یک جامد با نقطه انجماد یک مایع برابر است. در این دما، حالتهای جامد و مایع با یکدیگر در تعادل قرار دارند. این تعادل برای آب در صفر درجه اتفاق میافتد.
زمانی که از واژه جامد استفاده میکنیم، معمولا به مادهای اشاره داریم که در دمای اتاق به حالت جامد قرار داشته باشد. البته مواد مختلف، نقطه ذوب متفاوتی دارند. گازها در دماهای بسیار بسیار پایین به جامد تبدیل و مایعات تنها زمانی که دما به اندازه کافی پایین باشد، منجمد میشوند. جدول زیر، دمای ذوب برخی مواد معروف را نشان میدهد.
کاربردهای نقطه ذوب
دلایل مختلفی برای تعیین نقطه ذوب وجود دارند. نقطه ذوب در شناسایی مواد و همچنین مشخص کردن خلوص نسبی یک نمونه موثر است.
استفاده از نقطه ذوب در مشخص کردن یک ماده
از آنجایی که نقطه ذوب ترکیب، یک ثابت فیزیکی قلمداد میشود، از آن میتوان برای مشخص کردن جامدی ناشناخته استفاده کرد. کافی است تا نگاهی به جداول نقطه ذوب مواد بیاندازیم و آن را با عدد بدست آمده از آزمایشات خود مقایسه کنیم. البته به هنگام بررسی این موضوع باید دقت داشت که نمیتوان به سادگی و تنها با بررسی نقطه ذوب، به ماهیت یک جامد پی برد.
ترکیبات بسیاری از مواد آلی وجود دارند که دمای ذوب آنها کمتر از 250 درجه سانتیگراد است و بعید نیست که این دمای ذوب در مواردی با دیگر مواد همپوشانی داشته باشد. در نتیجه، نمیتوان نقطه ذوب را به عنوان دادهای قابل استناد برای ماهیت یک ماده در نظر گرفت.
البته در برخی موارد، مخصوصا زمانی که در حال بررسی فرآوردههای یک واکنش شیمیایی هستیم، نقطه ذوب میتواند نقش مهمی در شناخت نوع ماده داشته باشد. به طور مثال، فرآوردههای احتمالی در فرآیند «نیتراسیون» (Nitration) بنزآلدهید عبارتند از: ۳،۲ یا ۴-نیتروبنزآلدهید. از آنجایی که این فرآوردهها نقطه ذوب متفاوتی دارند، در صورت خلوص جامد حاصل، به کمک نقطه ذوب آن میتوان نوع فرآورده را تعیین کرد.
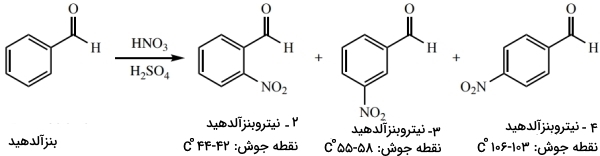
کاربرد نقطه ذوب در صنعت
نقطه ذوب مواد در صنعت نیز کاربردهای فراوانی دارد چراکه با دانستن نقطه ذوب مواد مختلف، میتوان از این اطلاعات در فرآوری سنگهای معدن و تولید فلزات مختلف همچون طلا، مس، آلومینیوم و آهن استفاده کرد.
عوامل موثر بر نقطه ذوب
عوامل متعددی بر نقطه ذوب تاثیرگذار هستند که از آنجمله میتوان به ترکیب مولکولی، نیروی جاذبه و وجود ناخالصی اشاره کرد.
ترکیب مولکولی
زمانی که مولکولها با فشردگی کنار یکدیگر قرار گرفته باشند، نقطه ذوب بالاتری خواهیم داشت. به طور مثال، مولکولهای نئوپنتان، نقطه ذوب بالاتری نسبت به مولکولهای ایزوپنتان دارند. اندازه مولکول نیز بر نقطه ذوب تاثیرگذار است. زمانی که همه شرایط یکسان باشند، مولکولهای کوچکتر در دمای پایینتری ذوب خواهند شد.
درشتمولکولها، ساختار بسیار بزرگی دارند که در آنها، اتمهای نافلزی با اتمهای مجاور خود از طریق پیوند کووالانسی، مولکولهای بزرگی را تشکیل دادهاند. موادی با ساختار کووالانسی بزرگ همچون الماس، گرافیت و سیلیس، نقاط ذوب بالایی دارند.

نیروهای جاذبه
جاذبه قوی بین نیروها، نقطه ذوب بالایی را به همراه دارد. در کل، ترکیبات یونی به دلیل وجود نیروهای الکترواستاتیک متصلکننده یونها، نقطه ذوب بالایی دارند. در ترکیبات آلی، وجود قطبیت، مخصوصا پیوند هیدروژنی، موجب افزایش نقطه ذوب میشود. اگر اندازه مولکولهای یکسان باشد، نقطه ذوب مواد قطبی، بیشتر مواد ناقطبی خواهد بود.
تاثیر ناخالصی بر نقطه ذوب
دلیل دیگری که میتوان از نقطه ذوب استفاده کرد، سنجش نسبی خلوص یک ماده است. به طور کلی، ناخالصی سبب کاهش نقطه ذوب میشود. به عبارت دیگر، وجود ناخالصی در یک ماده، دامنه ذوب آن را گسترده میکند. به طور مثال، در جدول زیر، نقاط ذوب بنزوییک اسید را با درجات خلوص مختلف ملاحظه میکنید که خلوص آن به کمک اضافه کردن استانیلید تغییر کرده است.
| درصد مولی بنزوییک اسید | درصد مولی استانیلید | نقطه ذوب (درجه سانتیگراد) |
| 100 | 0 | 122-120 |
| 95 | 5 | 121-114 |
| 90 | 10 | 120-109 |
| 85 | 15 | 117-105 |
| 80 | 20 | 116-94 |
در تصویر زیر، ذوب شدن مرحله به مرحله سه نمونه با درجات خلوص مختلف نشان داده شده است. در سمت چپ، بنزوییک اسید خالص، در وسط، بنزوییک اسید ۱۰ با درصد مولی از ناخالصی استانیلید و در سمت راست، بنزوییک اسید با ۲۰ درصد مولی ناخالصی دیده میشود. همزمان با گرم کردن نمونهها، ابتدا، ماده با بیشترین ناخالصی ذوب خواهد شد. هر دو ماده ناخالص، قبل از اینکه ماده خالص شروع به ذوب شدن کند، ذوب خود را تکمیل کردهاند.
لازم به ذکر است که نقطه ذوب یک جامد در حضور ناخالصی کاهش پیدا میکند به گونهای که حتی ممکن است در دمای اتاق به حالت مایع برسد. به طور مثال، زمانی که «پیپرونال» (Piperonal) با فرمول شیمیایی و دامنه ذوب 35-39 درجه سانتیگراد را با «رزورسینول» با نقطه ذوب 109-112 درجه سانتیگراد و با نسبت ۴ به ۱ مخلوط کنیم، مخلوط حاصل به صورت یک دوغاب خواهد بود که در نهایت، در دمای اتاق ذوب میشود. این نوع از رفتار ذوب، برای جامداتی که نقطه ذوب آنها کمی بالاتر از دمای اتاق باشد، رفتاری معمول است.
نمودارهای نقطه ذوب
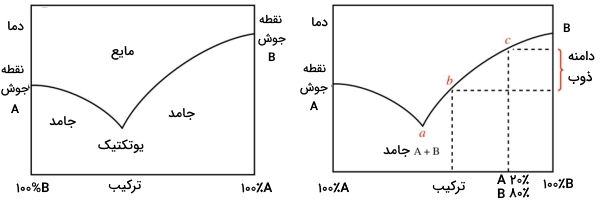
رفتار عمومی یک جامد ناخالص شامل دو جزء را به صورت نموداری نشان میدهند که در تصویر زیر دیده میشود. قسمت چپ نمودار، نشاندهنده جزء خالص A است. قسمت راست نمودار هم، جزء خالص B را نشان میدهد. خطوط موجود در نمودار، بیانگر حالت گذار (ذوب) از جامد به سمت مایع هستند.
این نمودار بیان میکند که هرقدر، اجزا از حالت خالص خود خارج میشوند، نقطه ذوب نیز کاهش مییابد. در بسیاری از مخلوطها، کمترین نقطه ذوب، در ترکیب خاصی از اجزا صورت میگیرد که به این نقطه، «نقطه یوتکتیک» (Eutectic Point) میگویند. برخی از سیستمها چندین نقطه یوتکتیک دارند درحالیکه در بعضی سیستمها نقطه یوتکتیک وجود ندارد.
مراحل ذوب یک مخلوط
یک جامد ناخالص، در سطوح ماکروسکوپی به صورت مخلوطی ناهمگن وجود دارد به گونهای که مناطق خالصی از هر جزء، در توده جامد توزیع شدهاند. نمونهای از این توزیع را میتوان در گرانیت مشاهده کرد. زمانی که یک جامد ناخالص گرم شود، در ابتدا، «ذوب میکروسکوپی» (Microscopic Melting) در نواحی خالص جزء با نقطه ذوب پایینتر اتفاق میافتد. البته این ذوب میکروسکوپی با چشم قابل رویت نیست.
ذوب اولیه جزء A، قطرات کوچکی از مایع را تشکیل میدهد که جزء B در توده جامد را در خود حل میکنند. این ذوب شدن جزء B، موجب افزایش ناخالصی جامد و کاهش نقطه انجماد خواهد بود. این جزء، تا زمانی که به ترکیب یوتکتیک برسد، در این قطرات ذوب میشود و این ذوب تا زمان انحلال کامل ناخالصی ادامه مییابد. زمانی که انحلال جزء کمتر به پایان برسد، کل توده شروع به ذوب شدن میکند. در این حالت، خلوص ماده ذوب شده افزایش مییابد که همین امر، تا حدی افزایش نقطه ذوب را به همراه دارد.
بسته به اینکه عمل ذوب، از کدام بخش از نمودار شروع شده باشد، سیستم مورد نظر، از خط ذوب سمت چپ یا راست دمای نقطه یوتکتیک تبعیت میکند و دمای ذوب خود را با افزایش غلظت اجزای ذوبشده در توده، تنظیم میکند.
با وجود اینکه ذوب میکروسکوپی، در دمای یوتکتیک آغاز میشود، اولین مقدار «بازه ذوب» (Melting Range)، یعنی زمانی که اولین قطره از مایع با چشم دیده شود را لزوما نمیتوان در این دما ثبت کرد. قطره مایع زمانی قابل مشاهده است که در حدود 10-20 درصد نمونه ذوب شده باشد. بسته به نوع ناخالصی، قبل از اینکه چشم، قطره مایع را ببیند، سیستم ممکن است از دمای یوتکتیک خود فراتر رفته باشد که این حالت به طور مثال، نقطه b در تصویر بالا خواهد بود. مقدار نهایی بازده ذوب، بالاترین نقطه ذوب یک جامد خالص است اما به دلیل انعکاس تاثیر نقطه ذوب کاهشیافته در توده جامد، این مقدار کمتر خواهد بود.
به طور مثال، اگر جامدی شامل ۲۰ درصد جزء A و 80 درصد جزء B باشد، دمای نهایی ذوب آن، نقطه c خواهد بود. دامنه ذوب برای چنین سیستمی را از دمای a تا دمای c در نظر میگیرند اما اگر اولین قطره از مایع، در نقطهای همچون نقطه b، دیده شود، دامنه ذوب را بین b و c ذکر میکنند.
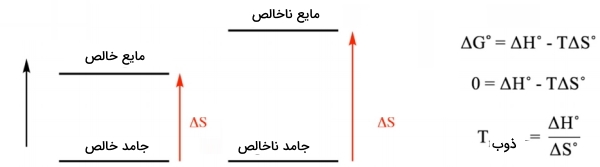
تاثیر ناخالصی بر نقطه ذوب از نگاه ترمودینامیک
همانطور که پیشتر نیز اشاره شد، ذوب یک جامد خالص، در دمای بیشتری نسبت به یک جامد ناخالص رخ میدهد. به این مفهوم، «نزول نقطه ذوب» (Melting Point Depression) میگویند. نقطه ذوب، دمایی است که در آن، جامد و مایع به حال تعادل قرار دارند. در این حالت، تغییرات انرژی آزاد گیبس ، برای فرآیند تبدیل جامد به مایع، صفر و به تغییرات آنتالپی و آنتروپی وابسته است. البته تغییرات آنتالپی به هنگام ذوب یک جامد خالص و ناخالص یکسان است چراکه در هر دو، نیروهای یکسان بینمولکولی شکسته میشوند. به عبارت دیگر، نزول نقطه انجماد، نتیجه تغییرات آنتروپی، به هنگام ذوب جامد خالص و ناخالص است.
از آنجایی که حرکات اتم در جامدات، محدودیت دارد، تفاوت کمی در آنتروپی بین جامد خالص و ناخالص وجود دارد. اگرچه، بین یک مایع خالص و ناخالص، تفاوت آنتروپی بسیاری دیده میشود و مایع ناخالص، بینظمی و آنتروپی بیشتری دارد. در نتیجه، ذوب یک جامد ناخالص و تبدیل آن به یک مایع ناخالص، در مقایسه با ذوب یک جامد خالص، تغییرات آنتروپی بیشتری را به همراه دارد. تغییرات بیشتر آتروپی، متناظر با کاهش دمای ذوب است.
پدیده فوق را میتوان به صورت مفهومی و ریاضی توجیه کرد. در یک توضیح ریاضی، میتوان نمودار زیر را نشان داد به طوریکه در رابطه بدست آمده، آنتروپی در مخرج قرار دارد. هرقدر بیشتر باشد، دمای ذوب کمتر خواهد بود. از نگاه مفهومی باید اینطور بیان کرد که ذوب زمانی اتفاق میافتد که عبارات و با یکدیگر برابر شوند، یعنی زمانی که . در این حالت، بزرگتر به این معنی است که دمای کمتری برای برقراری تساوی با عبارت مورد نیاز خواهد بود.
گستردگی نقطه ذوب
گستردگی نقطه ذوب اندازهگیری شده در آزمایشگاه را میتوان با خلوص یک جامد مرتبط کرد. همانطور که پیشتر نیز به آن اشاره شد، تمامی نمونهها در دمای یوتکتیک شروع به ذوب شدن میکنند اما این فرآیند تنها زمانی قابل رویت است که 10-20 درصد از نمونه، به طور میکروسکوپی ذوب شده باشد. دمای ذوب، تا زمانی که کل ناخالصی ذوب نشود، از دمای یوتکتیک بالاتر نمیرود. از اینرو، مقدار ناخالصی، تعیین میکند که یک سیستم، چه مقدار قبل از رسیدن به مقدار قابل رویت ذوب، در طول خط ذوب دیاگرام فازی پیشرفت داشته است.
به طور مثال، اگر جامدی، مقادیر کمی ناخالصی داشته باشد، این ناخالصی به سرعت در دمای یوتکتیک ذوب خواهد شد. این دما با حرف a در نمودار نشان داده شده است. در نتیجه این امر، دمای ذوب در طول خط ذوب بالا خواهد رفت. زمانی که ۱0-20 درصد جامد ذوب و قطره مایع قابل رویت شود، سیستم ممکن است فراتر از «ترکیب یوتکتیک» (Eutectic Composition) و مثلا در نقطه b نمودار زیر قرار داشته باشد. این جامد به ذوب شدن خود تا رسیدن به جایی همچون نقطه c ادامه میدهد. در نتیجه یک بازه ذوب کوچکی از b تا c خواهد داشت.
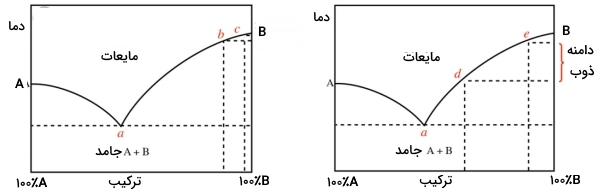
در عوض، اگر جامد، مقدار قابل توجهی ناخالصی داشته باشد، ممکن است با ذوب شدن ۱۰ درصد از جامد خالص، تمامی ناخالصیها نیز ذوب شوند. این امر بدین معنی است که برخلاف حالت قبل، دمای ذوب، به هنگام مشاهده قطره مایع، فاصله چندانی از دمای یوتکتیک نخواهد داشت. به عبارت دیگر، قطره مایع به هنگام ذوب جامد با ناخالصی بیشتر، زودتر و در نقطهای همچون d مشاهده خواهد شد و پس از اتمام ذوب در نقطه c، نتیجه حاصل، گستردگی بیشتر بازه دمای ذوب خواهد بود.
از توضیحات بالا این نتیجه قابل درک است که اگر بازه دمای ذوب، کمتر از ۲ درجه سانتیگراد باشد، ماده مورد نظر را میتوان خالص در نظر گرفت. البته این نکته را باید مد نظر قرار داد که ممکن است جامد مورد نظر، ترکیبی نزدیک به ترکیب نقطه یوتکتیک داشته باشد. به طور مثال، اگر ترکیب یوتکتیک، 40 درصد ماده A و 60 درصد ماده B را شامل شود و جامد مورد نظر دارای ترکیبی با ۴۵ درصد A و ۵۵ درصد B باشد، قبل از اینکه دمای ذوب از دمای یوتکتیک فاصله بگیرد، کل جامد ناخالص ذوب خواهد شد. بنابراین، مخلوطهایی که ترکیبی نزدیک به ترکیب یوتکتیک داشته باشند، با وجود ناخالصی بالا نیز ممکن است بازه کوچکی از نقطه ذوب را شامل شوند.
اندازهگیری نقطه ذوب
روشهای متنوعی برای اندازهگیری نقطه ذوب وجود دارند. معمولترین و پایهایترین روش اندازهگیری، «روش مویینگی» (Capillary Method) است. این روش شامل قرار دادن نمونه در یک لوله مویین و انجام آزمایش است که در آن، نمونه را حرارات میدهند تا به نقطه ذوب خود برسد.
در روشی جدیدتر، از ابزاری به نام «دستگاه نقطه ذوب» (Melting Point Apparatus) استفاده میکنند. این روش به شکلی سادهتر اما از همان مفهوم قبلی حرارت دادن نمونه در لوله مویین بهره میگیرد. دستگاههای مختلفی وجود دارند که در کاربرد و نوع دقت با یکدیگر تفاوت دارند. در سطح پایه این دستگاهها، طراحی آنها به گونهای است که بتوان لوله مویین را به راحتی در دستگاه قرار داد و آن را به سرعت گرم کرد.
نقطه ذوب یک جامد آلی را میتوان به کمک یک لوله مویین بدست آورد. روش کار به اینصورت است که جامد را به لوله مویین اضافه و لوله را به دنباله یک دماسنج متصل میکنند. این دماسنج داخل یک «حمام گرمایی» (Heating Bath) قرار داده شده است. حمام به آرامی گرم میشود و دمای آغاز و پایان ذوب نیز قابل دسترس خواهد بود. نمونههای خالص، نقاط ذوب مشخصی دارند به طور مثال دمای ذوب یک ماده خالص ممکن است بین 149/5 تا 150 درجه سانتیگراد ذکر شود. اما نمونههای ناخالص، دامنه ذوب وسیعتری دارند، مثلا ممکن است دمایی بین ۱۴۵ تا ۱۴۸ درجه سانتیگراد برای آنها ذکر شود.
در یک روش استاندارد، بهتر است با گرم کردن سریع جامد، یک تخمین سریع از دمای ذوب آن بدست آورد. روش کلی در اندازه گیری نقطه ذوب به این صورت است که نمونه را به طور غیر مستقیم حرارت دهیم. به طور معمول از دو دستگاه با نامهای «Mel-Temp Apparatus» و «Fisher-Johns Apparatus» بهره میگیرند. به یاد داشته باشید که برخلاف نقطه جوش، نقطه ذوب نسبت به فشار حساس نیست و لزومی ندارد که برای فشار، اصلاحاتی در نظر بگیریم.

در اندازهگیری نقطه ذوب، رعایت چه نکاتی ضروری است
در زیر، نکاتی در خصوص انجام آزمایش تعیین نقطه ذوب آورده شده است:
- هیچ نمونهای را دوباره ذوب نکنید و همواره از نمونه تازه به همراه لوله مویین جدید استفاده کنید.
- همواره از لولههای مویین یکسان استفاده کنید چرا که لولههای مویین مختلف با یکدیگر تفاوت دارند و از آنها نمیتوان برای انجام دوباره آزمایشها استفاده کرد.
- قبل از راهاندازی دستگاه، حتما لوله را تمیز کنید. عدم انجام این مرحله ممکن است سبب اندازهگیری نقطه جوش پایین یا بدست آوردن دامنه ذوب وسیعتر باشد.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- تغییر شیمیایی — به زبان ساده
- میعان — به زبان ساده
^^














سلام آیا کلیه اجسام دارای نقطه ذوب هستند؟دلیلشو هم بگین لطفا
با سلام
بینهایت از مطالبتان بهره گرفتم از اینکه خیلی شفاف و کامل توضیح دادید حسن کار شما رو نشون میده و این عالیه..
فقط لطفا نام چند تا از دستگاه های رایج ازمایشگاهی(ایرانی و خارجی) که برای تعیین نقطه ذوب(تیتر) انواع روغن ها کاربرد داره نام ببرید چون میخوام بخرم،خیلی خیلی ممنونم
برای اندازه گیری نقطه ذوب حرارت حمام آب گرم چگونه باید تنظیم شود؟
با سلام؛
از همراهی شما با مجله فرادرس بسیار سپاسگذاریم.
حمام آب گرم یک روش گرمایشی است که در آزمایشگاهها برای کاربردهای متنوعی از جمله اندازهگیری دمای ذوب مورد استفاده قرار می گیرد. در این دستگاه از آب به عنوان محیط انتقالدهنده حرارت استفاده میشود، ظرفی که در آب قرار میگیرد تا دماهای پایینتر از ۱۰۰ درجه سانتیگراد گرم میشود زیرا دمای جوش آب ۱۰۰ درجه سانتیگراد است. سپس ظرفهای نگهدارنده نمونه در حمام آب گرم قرار میگیرند و دمایی که نمونهها شروع به ذوب شدن میکنند را به عنوان دمای ذوب نمونه در نظر میگیریم. در این باره دو نکته وجود دارد:
۱. این روش را میتوان در دماهای بین ۳۰ تا ۱۰۰ درجه سانتیگراد به کار برد.
۲. در صورتیکه ظروف نگهدارنده نمونهها از جنس شیشه غیر قابل حرارت یا سرامیکی باشند به دلیل شیب حرارتی غیر یکسان ممکن است ترک بخورند و آسیب ببینند.
با تشکر.
3- درتعیین نقطه ذوب ازچه حمام های مايع استفاده می شود و از بین آن ها کدام يک مناسب تر است؟
“هیچ نمونهای را دوباره ذوب نکنید .”
دلیل این رو میشه بگید ؟
ممنون
با سلام؛
سادهترین دلیلی که میتوان برای این جمله ذکر کرد این است که ذوب کردن یک نمونه تازه بسیار سادهتر از نمونه ذوب شده است زیرا کنترل نحوه سرد و جامد شدن یک مایع با دشواریهایی روبرو است. همچنین با ذوب شدن مواد آلی و سرد شدن آنها (بویژه در حضور اکسیژن) ممکن است مادهای متفاوت را بدست دهد یا اینکه ناخالصی زیادی داشته باشیم.
با تشکر از همراهی شما با مجله فرادرس
دو ماده که نقطه ذوب یکسانی دارندرا چگونه می توان از روش اندازگیری نقطه ذوبشان را شناسایی کرد؟؟،
چرا هنگام ذوب یک جامد خالص معمولا دما در حین ذوب ثابت میماند؟
لطفا کامل توضیح بدین برای گزارش کار احتیاج دارم??
با سلام؛
نقطه ذوب به تنهایی روش مناسبی برای شناسایی مواد به شمار نمیآید و روشهای مختلفی همچون طیفسنجی و کروماتوگرافی پیشنهاد میشود. برای اطلاعات بیشتر، مطالعه مطالب زیر مفید خواهند بود.
کروماتوگرافی چیست؟ — به زبان ساده
تعیین گروه عاملی به کمک طیف سنجی مادون قرمز — از صفر تا صد
با تشکر از همراهی شما با مجله فرادرس
برای موادی که دمای ذوب زیر 300 دارند از روش میکرو استفاده میکنیم ولی برای مواد با دمای ذوب بالای 300 از چه روشی استفاده میکنیم ؟
بسیار عالی و کاربردی بود