شعاع اتمی عناصر چیست؟ – به زبان ساده
شعاع اتمی یک عنصر شیمیایی، معیاری برای سنجش اندازه اتمهای آن است که به طور معمول به صورت میانگین فاصله از مرکز هسته تا مرز لایه الکترونی اطراف آن تعریف میشود. از آنجایی که این مرز، ماهیت فیزیکی تعریف شدهای ندارد، تعریفهای متعددی برای شعاع اتمی ارائه شده است. سه مورد از مهمترین تعاریف در خصوص شعاع اتمی عبارتند از: شعاع واندروالس، شعاع یونی و شعاع کووالانسی. از شعاع اتمی میتوان برای توصیف بسیاری از جنبههای علم شیمی همچون خواص فیزیکی و شیمیایی استفاده کرد. در تعیین شعاع اتمی، یکی از کاربردیترین ابزارها، جدول تناوبی و روندهای معمول در آن است.

تعریف شعاع اتمی
شعاع اتمی به طور معمول به صورت فاصله از هسته اتم تا خارجیترین اوربیتال الکترونی تعریف میشود. در بیانی سادهتر، شعاع اتمی را میتوان مشابه با شعاع یک دایره تعریف کرد. در این تعریف، مرکز دایره، هسته و لبه خارجی آن، خارجیترین اوربیتال الکترونی خواهد بود. زمانی که در جدول تناوبی از چپ به راست یا در هر گروه از بالا به پایین حرکت کنیم، میتوانیم روندهای معمول شعاع اتمی را در جدول تناوبی پیدا کنیم که البته به کمک حفظ کردن جدول تناوبی، این فرآیند، سادهتر نیز خواهد بود.
بار موثر هسته
بار موثر هسته در یک اتم، بار خالص مثبتی است که توسط الکترون لایه ظرفیت احساس میشود. مقداری از این بار مثبت توسط الکترونهای داخلی پوشش داده میشوند و به همین دلیل، تمامی بار الکتریکی توسط الکترون لایه ظرفیت احساس نمیشود. به طور ویژهای بر روی اندازه یک اتم تاثیر دارد.
بنابراین، در صورتیکه بار موثر هسته کاهش پیدا کند، شعاع اتمی افزایش مییابد چراکه در اینصورت، الکترونهای لایههای داخلی، اثر پوششی بیشتری خواهند داشت و همین امر موجب میشود که جاذبه بین هسته و الکترون لایه ظرفیت کاهش پیدا کند که نتیجه آن، افزایش شعاع اتمی خواهد بود. از آنجایی که در هر گروه جدول تناوبی از بالا به پایین و در هر تناوب از راست به چپ کاهش پیدا میکند، شعاع اتمی نیز به همین ترتیب در هر گروه از بالا به پایین و در هر تناوب از راست به چپ افزایش مییابد.
انواع شعاع اتمی
همانطور که در ابتدای متن به آن اشاره شد، تعاریف مختلفی برای شعاع اتمی ارائه شده است که این تعریفها بسته به نوع پیوند شیمیایی، متفاوت هستند. در حقیقت، تعیین شعاع اتمی امر دشواری است زیرا در خصوص محل الکترون لایه آخر، عدم قطعیت وجود دارد و اطلاع دقیق از محل الکترون نداریم. این پدیده در اصل عدم قطعیت هایزنبرگ توضیح داده شده است.
بمنظور اندازهگیری دقیق شعاع اتمی، این شعاع را بر اساس فاصله بین هستههای دو اتم در یک پیوند تعیین میکنیم. در نتیجه، شعاع اتمی بر اساس پیوندهای تشکیل دهنده اتمها تعیین میشود. یک اتم، بسته به نوع پیوندهایی که تشکیل میدهد، شعاع متفاوتی خواهد داشت و به همین دلیل برای یک اتم، نمیتوان شعاع اتمی ثابتی تعیین کرد.
شعاع کووالانسی
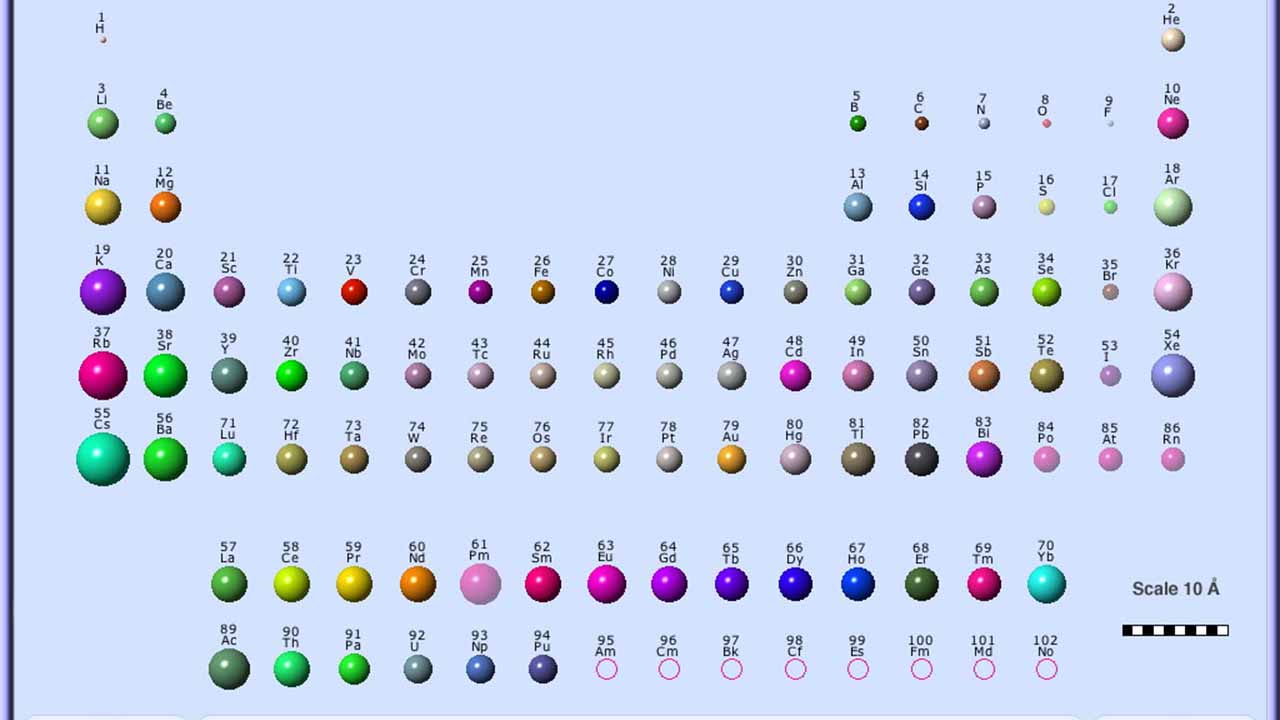
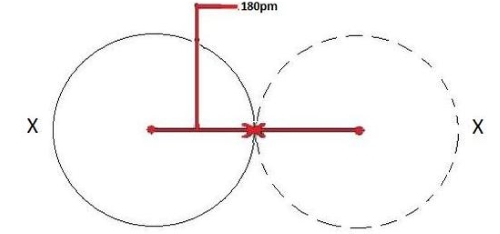
زمانی که بین دو اتم، پیوند کووالانسی برقرار باشد، میتوان شعاع کووالانسی را تعیین کرد. زمانی که دو اتم از یک عنصر به صورت کووالانسی با یکدیگر پیوند تشکیل داده باشند، شعاع هر اتم برابر با نصف فاصله بین دو هسته خواهد بود چراکه هر دو اتم به یک میزان الکترونها را جذب میکنند.
شعاع کووالانسی با همان الگوی شعاع اتمی افزایش پیدا میکند زیرا هرقدر شعاع اتمی بیشتر باشد، فاصله بین دو هسته نیز بیشتر خواهد بود. شعاع کووالانسی در تصویر زیر برای هر دو اتم برابر است زیرا این دو اتم، یکسان هستند و با حرف نشان داده شدهاند.
شعاع یونی
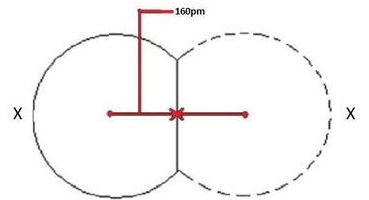
شعاع یونی به شعاع یک اتم به هنگام تشکیل یک یون یا پیوند یونی میگویند. لازم به ذکر است که شعاع یک اتم در پیوند یونی با شعاع آن در پیوند کووالانسی تفاوت دارد و مفهومی مهم را ایجاد میکند. دلیل این تفاوت هم این است که اتمها در پیوند یونی، اندازههای متفاوتی دارند. در پیوند یونی، یکی از اتمها کاتیون است و اندازه کوچکتر و اتم دیگر یعنی آنیون، اندازه بزرگتری دارد.
بنابراین، بمنظور توضیح این اختلاف، بعد از اندازهگیری فاصله بین دو هسته، باید آنرا بر اندازه اتم تقسیم کنیم. هرقدر اندازه اتم، بزرگتر باشد، شعاع آن نیز بیشتر خواهد بود. این موضوع را در تصویر زیر مشاهده میکنید. در این تصویر، کاتیون در سمت چپ و آنیون در سمت راست قرار دارد. در این تصویر به طور واضح مشخص است که شعاع اتمی کوچکتری در کاتیون نسبت به آنیون داریم.
مثال برای شعاع یونی
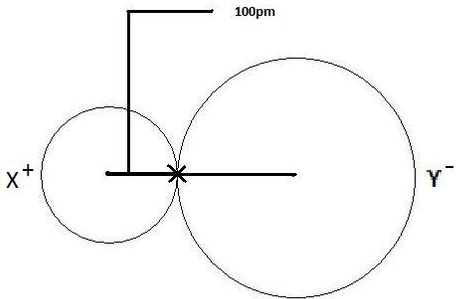
به طور مثال فرض کنید میتوانستیم شعاع اتمی یک اتم همچون Se را از طریق آزمایش تعیین کنیم و این شعاع برابر با 178 پیکومتر بود. از این طریق میتوانستیم شعاع اتمی هر اتم دیگر تشکیل دهنده پیوند با این اتم را تعیین کنیم. اگر ترکیبی همچون با فاصله بین دو هسته برابر با 278 پیکومتر داشتیم، شعاع اتمی اتم کلسیم از اختلاف دو مقدار 278 و 178 پیکومتر بدست میآمد و برابر با 100 پیکومتر بود.
تغییرات اندازه در کاتیون
کاتیونها شعاع یونی کوچکتری نسبت به اتمهای خنثی دارند. در مقابل، برای آنیونها شعاع بزرگتری نسبت به اتمهای متناظر آنها ذکر میشود. دلیل این امر به تفصیل در زیر بیان شده است:
- یک کاتیون طبق تعریف، الکترون کمتری نسبت به تعداد پروتونها دارد. در صورت از دست دادن الکترون، تغییر محسوسی در اندازه اتم، نسبت به حالت خنثی بوجود میآید.
- از دست دادن یک الکترون به این معنی است که تعداد بیشتری پروتون نسبت به الکترون در اتم داریم. همین امر موجب کاهش اندازه اتم خواهد شد زیرا در این حالت، الکترون کمتری وجود دارد و در نتیجه، پروتونها جاذبه بیشتری را بر روی این تعدادِ کمتر الکترون اعمال میکنند. همچنین، به دلیل کاهش تعداد الکترون در لایه آخر نیز، اندازه اتم کاهش مییابد.
- برای توصیف بهتر میتوان به مثال آهنربا و شئ فلزی اشاره کرد. اگر ده آهنربا و ده شئ فلزی داشته باشیم که بیانگر اتم خنثی باشند. در این حالت، آهنربا را پروتون و اشیا فلزی را الکترون فرض میکنیم. در نتیجه، با حذف یک شئ فلزی، گویی یک الکترون از اتم حذف کردهایم. این امر سبب میشود تا آهنرباها، اشیا فلزی باقیمانده را با قدرت بیشتری به طرف خود جذب کنند چراکه تعداد اشیا کاهش پیدا کرده اما قدرت جاذبه ثابت مانده است. همین امر را میتوان به طور مشابه برای پروتونها بکار برد که الکترونها را به طرف هسته جذب میکنند و در نتیجه این کار، شعاع اتمی کاهش پیدا میکند.
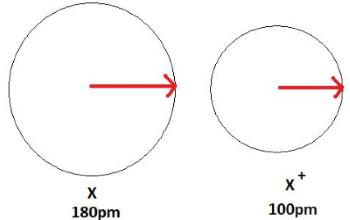
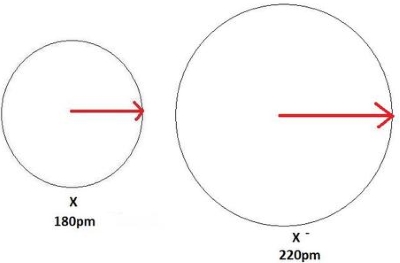
در تصویر زیر، فرآیند تشکیل کاتیون و کاهش اندازه اتم را مشاهده میکنید. در این تصویر، یک اتم خنثی، طول پیوندی برابر با 180 پیکومتر دارد و کاتیون ، شعاع کوچکتر و برابر با 100 پیکومتر دارد.
تغییرات اندازه در آنیون
در مقابل، اندازه یک آنیون در اثر اضافه شدن یک الکترون، افزایش پیدا میکند. این امر را میتوان در تصویر زیر مشاهده کرد. دریافت الکترون سبب افزایش تعداد الکترون در لایه آخر میشود که این مورد موجب افزایش شعاع خواهد شد چراکه در این حالت، تعداد الکترونهای بیشتری در خارجیترین لایه قرار دارند و پروتونها، جاذبه کمتری را نسبت به این الکترونهای بیشتر، اعمال میکنند.
شعاع فلزی
شعاع فلزی، به شعاع یک اتم در پیوند فلزی میگویند. شعاع فلزی به صورت نیمی از فاصله کل بین هسته دو اتم مجاور در یک توده فلزی تعریف میشود. با توجه به اینکه یک فلز شامل گروهی از اتمهای یکسان است، فاصله هر اتم با دیگری نیز در پیوند، یکسان خواهد بود.
شعاع واندروالس
شعاع واندروالس یک اتم به شعاع فرضی یک کره سخت میگویند که این کره بیانگر نزدیکترین فاصله به اتم دیگر و به صورت ناپیوندی است. به بیان سادهتر، شعاع واندروالس، معیاری برای سنجش اندازه اتمی است که فاقد پیوند شیمیایی باشد. به طور کلی، شعاع واندروالس را به صورت نزدیکترین فاصله بین دو اتمِ برابر و ناپیوندی ذکر میکنند. شعاع واندروالس در موادی مشاهده میشود که دارای نیروی واندروالسی باشند که گاهی از آن با عنوان «پیوند واندروالسی» نیز یاد میشود.
این شعاع بر اساس نام «یوهان دیدریک واندروالس» (Johannes Diderik van der Waals) نامگذاری شده است. او اولین شخصی بود که متوجه شد اتمها به صورت نقطههایی ساده نیستند و اندازه آنها را در معادله حالت واندروالس دخیل کرد. در جدول زیر، شعاع واندروالس برخی از عناصر بر حسب انگستروم نشان داده شده است.
| عنصر | شعاع |
| هیدروژن | 1/2 |
| کربن | 1/7 |
| نیتروژن | 1/55 |
| اکسیژن | 1/52 |
| فلوئور | 1/47 |
| فسفر | 1/8 |
| گوگرد | 1/8 |
| کلر | 1/75 |
| مس | 1/4 |
در جدول زیر شعاع واندروالس عناصر، نشان داده شده که واحد مقادیر این جدول بر حسب پیکومتر نوشته شده است. خانههای خاکستری بیانگر نبودِ اطلاعات کافی در خصوص شعاع واندروالس هستند. هرقدر این شعاع افزایش پیدا کند، رنگ خانههای جدول از قرمز به زرد تغییر خواهند کرد.
حجم واندروالس
حجم واندروالس که به حجم اتمی یا حجم مولکولی نیز شناخته میشود، نوعی خاصیت اتمی است که به طور مستقیم با شعاع واندروالس ارتباط دارد و به صورت حجم اشغال شده توسط یک اتم یا مولکول مجزا تعریف میشود. در صورتیکه شعاع واندروالس را داشته باشیم، میتوان حجم واندروالس را اندازهگیری کرد که در خصوص مولکولها باید فواصل و زاویههای بین مولکولی را هم لحاظ کنیم. برای یک اتم منفرد، حجم واندروالس عبارتست از حجم یک کره با شعاع واندروالس که از رابطه زیر بدست میآید:
حجم واندروالس یک مولکول، همواره کوچکتر از مجموع حجمهای واندروالس اتمهای سازنده آن است. در حقیقت میتوان گفت که به هنگام تشکیل پیوندهای شیمیایی، اتمها با یکدیگر همپوشانی میکنند.
حجم واندروالس را همچنین میتوان از طریق سنجشهای آزمایشگاهی بر روی گازها به کمک ثابت واندروالس (b)، قطبشپذیری یا حالت انکسار مولی تعیین کرد. در هر سه حالت، اندازهگیریها بر اساس نمونههای ماکروسکوپی انجام میشوند و نتایج را به صورت کمیات مولی بیان میکنند. برای پیدا کردن حجم واندروالس یک اتم یا مولکول منفرد، باید آنرا بر عدد آووگادرو تقسیم کنیم.
حجم مولی واندروالس را نباید با حجم مولی یک ماده اشتباه بگیریم. به طور کلی، در دما و فشار معمول آزمایشگاه، اتمها یا مولکولهای یک گاز، تنها 0/001 حجم یک محفظه را اشغال میکنند و بقیه، فضای خالی است. بنابراین، حجم مولی واندروالس که تنها شامل حجم اتمها یا مولکولهای اشغال شده است، در حدود ۱۰۰۰ برابر کوچکتر از حجم مولی یک گاز در شرایط دما و فشار استاندارد خواهد بود.

روش های تعیین شعاع واندروالس
شعاع واندروالس را میتوان به کمک روشهای زیر تعیین کرد:
- خواص مکانیکی گازها
- نقطه بحرانی
- اندازهگیری فاصله اتمها بین یک جفت اتم ناپیوندی در بلور
- اندازهگیری خواص نوری و الکتریکی همچون قطبش پذیری و انکسار
این روشها هر کدام مقادیر نزدیک به هم برای شعاع واندروالس بدست میدهند اما با یکدیگر یکسان نیستند. به همین دلیل، برای ارائه مقادیر شعاع واندروالس در قالب یک جدول، از میانگین وزنی مقادیر مختلف آزمایشگاهی بهره میگیرند. در نتیجه، جداول مختلف، مقادیر مختلفی از شعاع واندروالس را برای یک اتم بدست میدهند. علاوه بر این، لزومی هم ندارد که شعاع واندروالس را به عنوان یک خاصیت ثابتِ اتم در تمامی شرایط در نظر بگیریم چراکه در محیطهای شیمیایی مختلف، یک اتم، مقادیر متفاوتی از شعاع واندروالس را به خود اختصاص میدهد.
شعاع بور
یکی دیگر از تعریفهایی که در خصوص شعاع اتمی بکار میرود، شعاع بور خواهد بود. شعاع بور که یک ثابت فیزیکی است به صورت محتملترین فاصله بین هسته و الکترون در اتم هیدروژن و در حالت پایه آن تعریف میشود. مقدار شعاع بور برابر با است. در واحد SI، شعاع بور را به کمک رابطه زیر میتوان تعیین کرد:
- : شعاع بور
- : ثابت گذردهی خلأ
- : ثابت پلانک کاهش یافته
- : جرم الکترون
- : بار الکترون
- : سرعت نور در خلأ
- : «ثابت ساختار ریز» (Fine Structure Constant)
روندهای تناوبی در خصوص شعاع اتمی
در ادامه به توضیح روندهای تناوبی موجود در رابطه با شعاع اتمی خواهیم پرداخت. روند تغییرات شعاع را میتوان به طور خلاصه در زیر بیان کرد:
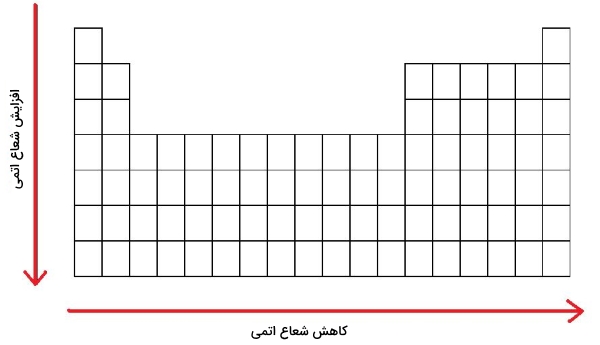
- هرقدر تعداد لایههای الکترونی افزایش پیدا کنند، اندازه اتم نیز بزرگتر خواهد شد. بنابراین، شعاع اتمی در هر گروه از بالا به پایین افزایش پیدا میکند.
- به طور کلی، اندازه اتم در هر تناوب از چپ به راست کاهش پیدا میکند.
موارد استثنا در روندهای تناوبی
البته این روندها همواره یکسان نیست و اتمهایی هستند که از قاعده بالا پیروی نکنند. با توجه به اینکه الکترونهای اضافه شده به فلزات واسطه، به لایه الکترونی داخلی اضافه میشوند و تعداد الکترون لایه آخر، ثابت میماند، در نتیجه، هسته، جاذبه خود را به الکترونهای داخلی اعمال میکند. دلیل این امر را باید در نحوه آرایش الکترونی عناصر واسطه جستجو کرد.
جمع بندی
در این آموزش سعی کردیم تا به طور کامل به مبحث شعاع اتمی بپردازیم. دیدیم که فارغ از شعاع بور، چهار نوع اصلی از شعاع اتمی موسوم به شعاع کووالانسی، شعاع یونی، شعاع فلزی و شعاع واندروالس داریم. در بررسی شعاع یونی، به اندازه اتمها و یونها پرداختیم و تغییرات اندازه در کاتیون و آنیون را مورد بررسی قرار دادیم. در ادامه مطلب، شعاع واندروالس را به طور دقیقتری بررسی کردیم و به کمک آن به توصیف مفهوم حجم واندروالس پرداختیم. در پایان مطلب نیز روندهای تناوبی مرتبط با شعاع اتمی را به طور دقیق بررسی کردیم.















با سلام در قسمت شعاع یونی بالای عکس باید نوشته می شد بزرگتر نه کوچکتر اگر اشتباه نکنم
با سلام؛
از ارائه بازخورد شما سپاسگزاریم. متن بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس
با سلام نقد نظر نویسنده
برای توصیف بهتر میتوان به مثال آهنربا و شئ فلزی اشاره کرد. اگر ده آهنربا و ده شئ فلزی داشته باشیم که بیانگر اتم خنثی باشند. در این حالت، آهنربا را پروتون و اشیا فلزی را الکترون فرض میکنیم. در نتیجه، با حذف یک شئ فلزی، گویی یک الکترون از اتم حذف کردهایم. این امر سبب میشود تا آهنرباها، اشیا فلزی باقیمانده را با قدرت بیشتری به طرف خود جذب کنند چراکه تعداد اشیا کاهش پیدا کرده اما قدرت جاذبه ثابت مانده است.
در مثال بالا توجیه و تشبیه نویسنده درست نیست اول قدرت جاذبه ثابت نمی ماند بلکه میدان مغناطیسی ثابت می ماند ثانیا چون الکترونها و پروتونها بار الکتریکی دارند افزایش هر کدام سبب افزایش نیروی جاذبه کولنی می شود
علت کاهش شعاع یون مثبت نسبت به اتم خنثی این است که با کاهش الکترون لایه آخر کاهش جاذبه بین هسته و لایه آخر صورت می گیرد ولی از طرفی کاهش دافعه بین لایه های الکترونی با لایه آخر صورت می گیرد و چون کاهش دافعه خیلی بیشتر از کاهش جاذبه است (چون فاصله الکترونها از هم کمتر از فاصله پروتونها از هم است)در نتیجه شعاع یون مثبت کوچکتر خواهد بود .
سلام..یه سوال داشتم در مورد شعاع اتمی عناصر گروه اول..
ما میدونیم با افزایش دوره، شعاع اتمی هم افزایش پیدا میکنه..اما نه با شیب ثابت..یعنی وقتی نمودار شعاع اتمی عناصر گروه اول رو بررسی میکنیم متوجه میشیم که از پتاسیم ببعد شیب صعودی کمتر و شکسته تر میشه..دلیلش چیه؟
ممنون میشم راهنمایی کنید…
در بخش مربوط به روندهای تناوبی در شعاع نوشتید که به طور کلی اندازه ی اتم در هر تناوب جدول از چپ به راست کاهش پیدا میکنه.نباید برعکس باشه و افزایش پیدا کنه؟چون تعداد الکترون که زیاد میشه.
سلام. در پاسخ به اقای امیرحسین لینکی ارائه کردید که متن زیر رو از همون لینک برداشتم. بنظرم با توجه به متن، روند افزایش شعاع اتمی از چپ به راست در تناوب را اصلاح فرمایید.
“بررسی مختصر روندهای تناوبی در جدول
در هر گروه از بالا به پایین، عدد اتمی عنصرها افزایش پیدا میکند. الکترونگاتیوی در هر گروه از بالا به پایین کاهش (به جز گروه 1۱) پیدا میکند. در هر تناوب از چپ به راست، شعاع اتم افزایش پیدا میکند. این افزایش شعاع سبب افزایش انرژی یونش و الکترونگاتیوی از چپ به راست در هر تناوب میشود.”
سلام و روز شما بهخیر؛
از دقت شما دوست عزیز به مطالب مجله بسیار ممنونیم. متن اصلاح شد.
خوشحالیم که با مجله فرادرس همراه هستید.
با سلام؛
در پاسخ به این سوال میتوان گفت در هر تناوب از چپ به راست، شعاع اتمی کاهش پیدا میکند زیرا در هر دوره یا تناوب، تمامی الکترونها تنها به یک لایه اضافه میشوند. به طور همزمان نیز پروتون به هسته اضافه خواهد شد. در نتیجه این اتفاق، اثر جاذبه هسته افزایش پیدا میکند. این امر بدان معنی است که هسته با شدت بیشتری الکترونها را به سمت خود جذب میکند و در نهایت، لایههای الکترونی به هسته نزدیکتر میشوند. با نزدیکی این لایهها به هسته، الکترونهای لایه ظرفیت نیز به هسته نزدیک خواهند شد و شعاع اتمی کاهش پیدا میکند. برای مطالعه بیشتر پیشنهاد میکنیم مطلب «جدول تناوبی — به زبان ساده، رایگان و کامل + دانلود PDF و عکس فارسی» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام من معلم شیمی هستم میتوانم از مطالبتون در جزوم استفاده کنم