تیتراسیون فاجانس چیست؟ – به زبان ساده + محاسبات
در این مطلب از مجله فرادرس میخواهیم به یکی از روشهای تیتراسیون رسوبی، به نام تیتراسیون فاجانس بپردازیم. تیتراسیون فاجانس در کنار روش مور و روش ولهارد، یکی از روشهایی است که در تیتراسیون رسوبی به کار گرفته میشود. پس از بررسی تیتراسیون رسوبی و تیتراسیون فاجانس، محاسبات مورد نیاز برای آنها را مرور میکنیم. همچنین در ادامه تعدادی مثال و تمرین آوردهایم که به درک بهتر مطلب کمک بسیاری میکنند.
- یاد میگیرید تیتراسیون فاجانس چیست و چه تفاوتی با روشهای دیگر دارد.
- خواهید آموخت چطور الگوریتم محاسبه حجم و غلظت را در تیتراسیون رسوبی بهکار ببرید.
- میآموزید با استفاده از رنگ شناساگر و تغییرات «pCl» یا «pAg» نقطه پایان را پیدا کنید.
- یاد خواهید گرفت منحنی تیتراسیون رسوبی را رسم و با سایر منحنیها مقایسه کنید.
- با مزایا و محدودیتهای روشهای تعیین نقطه پایان آشنا میشوید.
- تاریخچه و روند رشد علمی تیتراسیون رسوبی و اهمیت آن در شیمی تجزیه را میآموزید.


تیتراسیون فاجانس چیست ؟
«تیتراسیون فاجانس» (Fajans Method) اولین بار در ۱۹۲۰ میلادی توسط «کاژیمیش فاجانس» (Kasimir Fajans) مورد استفاده قرار گرفت. این تیتراسیون یکی از روشهای زیرشاخه تیتراسیون رسوبی است که در ادامه به آن نیز خواهیم پرداخت.
در این روش برای تیتراسیون یون کلرید به کمک تیترانت ، مقداری از رنگدانه آنیونی «دیکلرو فلورسئن» (Dichlorofluorscein) به محلول آنالیت افزوده میشود.
تشخیص نقطه پایانی تیتراسیون فاجانس
پیش از رسیدن به نقطه همارزی، سطح رسوب نقره کلرید دارای بار منفی است زیر مقدار مازاد یون کلرید موجود در محیط را به خود جذب میکند. از آنجا که خود دیکلرو فلورسئن نیز حامل بار منفی است، توسط رسوب نقره کلرید دفع میشود و در محلول با رنگ زرد متمایل به سبز باقی میماند. پس از نقطه همارزی، سطح رسوب دارای بار مثبت است زیرا مقدار مازاد کاتیون نقره را به خود جذب میکند. بنابراین دیکلرو فلورسئن روی سطح رسوب جذب میشود و شاهد رنگ صورتی خواهیم بود. همین تغییر رنگ در تیتراسیون فاجانس فرارسیدن نقطه پایانی تیتراسیون را نشان میدهد.
تیتراسیون چیست؟
تیتراسیون روشی در شیمی تجزیه کمی است که از آن برای اندازهگیری غلظت مادهای با غلظت نامشخص مورد استفاده قرار میگیرد.
به جزئی با غلظت نامشخص آنالیت میگوییم که توسط محلولی با غلظت مشخص به نام تیترانت مورد محاسبه قرار میگیرد. روشهای بسیار متنوعی برای اندازهگیری غلظت یک گونه به روش تیتراسیونی وجود دارد.
در زیر فهرستی از انواع تیتراسیونهای متدوال و پرکاربرد را مشاهده میکنید. همچنین با آوردن تعریفی بسیار کوتاه از آنها، با اصول انجام آنها نیز آشنا خواهید شد.
- «تیتراسیون اسید و باز» (Acid Base Titration): از این تیتراسیون برای به دست آوردن غلظت یک اسید یا باز به کمک یک باز یا اسید بهره برده میشود. واکنشی که این تیتراسیون انجام میشود، از نوع «واکنش خنثیشدن» است.
- «تیتراسیون اکسایش کاهش» (Redox Titration): در این تیتراسیون، واکنش اکسایش و کاهش بین دو گونه اکسنده و کاهنده صورت میگیرد و غلظت جزء مجهول، به دست میآید.
- «تیتراسیون رسوبی» (Precipitation Titration):در این تیتراسیون پایه و اساس بر واکنشی است که در آن از آنالیت و تیترانت، محصولی به دست بیاید که در آب نامحلول باشد. از روی همین رسوب میتوان به غلظت آنالیت مجهول پی برد.
- «تیتراسیون کمپلکسومتری» (Complexation Titratoon): در این تیتراسیون از واکنش بین آنالیت و یک لیگاند، کمپلکسی به دست میآید که میتوان از آن برای به دست آوردن غلظت آنالیت استفاده کرد.
- «تیتراسیون پتانسیومتری» (Potentiometric Titration): در تیتراسیون پتانسیومتری برخلاف دیگر روشها، به جای استفاده از شناساگر شیمیایی برای سنجش نقطه پایان، از الکترود شناساگر کمک گرفته میشود. این الکترود تفاوت پتانسیل به وجود آمده را در تغییر مقدار تیترانت اضافه شده، نشان میدهد.
- «تیتراسیون یدومتری» (Iodometrix Titration): تیتراسیون یدومتری نوعی تیتراسیون برگشتی یا غیرمستقیم است که در آن میزان ید به کار رفته در واکنش اکسایش و کاهش مورد محاسبه قرار میگیرد تا غلظت گونه مجهول به دست بیاید.
- «تیتراسیون منگانومتری» (Manganometry Titration): این روش نیز زیرشاخه تیتراسیون اکسایش و کاهش است و در آن از مقدار پرمنگنات مورد استفاده، برای محاسبه غلظت آنالیت استفاده میشود.
- «تیتراسیون برگشتی» (Indirect Titration): در این تیتراسیون ابتدا مقدار مازادی از تیترانت، با آنالیت وارد واکنش میشود و سپس از تیتراسیون مقدار مازاد تیترانت، به مقدار آنالیت اولیه پی میبرند. به همین دلیل به این تیتراسیون غیرمستقیم یا برگشتی گفته میشود.
اجزای یک تیتراسیون
گرچه تیتراسیون به روشهای متفاوتی انجام میشود با این حال در هر کدام اجزایی وجود دارند که باید برای فهم روش، با آنها آشنایی داشته باشیم. در این بخش میخواهیم به مرور این اجزا بپردازیم. ذکر این نکته خالی از لطف نیست که ترکیبات به کار رفته به عنوان هر یک از این اجزا با توجه به نوع و شرایط تیتراسیون میتواند کاملا متفاوت از دیگری باشد.
تیترانت
«تیترانت» (Titrant) محلولی است با غلظت مشخص که در روند تیتراسیون به آنالیت اضافه میشود. همانطور که گفتیم غلظت این جزء مشخص است و با داشتن حجم مصرفی آن تا رسیدن به نقطه همارزی، میتوانیم غلظت آنالیت را به دست آوریم. در تیتراسیون اسید و باز بهطور مثال، تیترانت یک اسید یا باز است که از آن برای واکنش خنثیشدن با آنالیت، کمک میگیریم. این جزء در بورت نگهداری میشود.
تیتراند
«تیتراند» (Titrand) که از آن با نام «آنالیت» (Analyte) نیز یاد میشود، محلولی است که در روند تیتراسیون مورد مطالعه قرار میگیرد. غلظت این جزء مجهول است و درواقع هدف نهایی از تیتراسیون، به دست آوردن همین غلظت است. در تیتراسیون، آنالیت در ارلنی ریخته میشود و برای افزودن تیترانت زیر بورت حاوی آن گذاشته میشود.
در فهرست زیر به برخی از مهمترین تفاوتهای تیترانت و آنالیت اشاره کردهایم.
- غلظت تیترانت مشخص است اما در آغاز تیتراسیون از غلظت آنالیت اطلاعی نداریم.
- تیترانت با دقت و قطرهقطره به آنالیت افزوده میشود در حالی که آنالیت از ابتدا در ارلن قرار دارد.
- حجم تیترانت توسط مقیاسهای بورت اندازهگیری میشود اما حجم آنالیت از ابتدا در دسترس است.
شناساگر
«شناساگر» (indicator) مادهای است که در پاسخ به تغییرات شیمیایی محیط خود، دستخوش تغییر رنگ میشود. مثلا در تیتراسیونهای اسید و بازی، از فنول فتالیین استفاده میشود. در ابتدای تیتراسیون قطرهای از آن به ارلن حاوی آنالیت افزوده میشود. این شناساگر در حضور اسید و باز رنگهای متفاوتی خواهد داشت و میتوان از آن برای پی بردن به نقطه پایان تیتراسیون کمک گرفت.
مهمترین ویژگی یک شناساگر در بازه است که در آن تغییر رنگ میدهد که به ساختار و قدرت آن بستگی دارد. شناساگر باید طوری انتخاب شود که در نزدیک نقطه همارزی، تغییر رنگ خوبی داشته باشد.
نقطه همارزی
«نقطه همارزی» (Equivalence Point) نقطهای است که در آن واکنش در جریان بین تیترانت و آنالیت به پایان میرسد. به همین دلیل در نقطه همارزی تعداد مولهای تیترانت با تعداد مولهای آنالیت مساوی هستند. در بسیاری موارد نقطه همارزی با نقطه پایانی اشتباه میشود، گرچه این دو نقطه مفاهیم بسیار نزدیکی به یکدیگر هستند با این حال تفاوتهایی دارند که باید به آنها توجه کرد.
نقطه پایانی
نقطه پایانی، نقطهای است که در محاسبات حجم مصرف شده از تیترانت را تا آنجا در نظر میگیریم. در عمل در بسیاری از تیتراسیونها، رسیدن نقطه پایانی را با توجه به تغییر رنگ شناساگر تشخیص میدهند که در بخش قبلی در مورد آن صحبت کردهایم. برای مثال در تیتراسیون کمپلکسومتری، اگر از شناساگر «اریوکروم بلک تی» (Eriochrom Black T) استفاده شود، در نقطه پایانی رنگ زرشکی به آبی تغییر میکند که نشاندهنده تمام شدن فرآیند تیتراسیون است.
تفاوت نقطه همارزی و نقطه پایانی تیتراسیون
نقطه پایانی و نقطه همارزی انواع تیتراسیون در بسیاری موارد معادل با یکدیگر در نظر گرفته میشوند با این حال نیاز است که به تفاوتهای بین آنها آگاه باشیم. در فهرست زیر به برخی از این تفاوتها اشاره کردهایم.
- نقطه پایانی تیتراسیون پس از نقطه همارزی تیتراسیون خواهد بود و به همین صورت نقطه همارزی تیتراسیون پیش از نقطه پایانی تیتراسیون اتفاق میافتد.
- در نقطه پایانی تیتراسیون تغییر رنگ محلول مشاهده میشود این در حالی است که در نقطه همارزی مقدار تیترانت و آنالیت از نظر تئوری در ظرف واکنش با یکدیگر برابر خواهد بود.
- اسیدهای ضعیف تنها یک نقطه پایانی تیتراسیون اما چند نقطه همارزی دارند.
تیتراسیون رسوبی چیست؟
«تیتراسیون رسوبی» (Precipitation Titration) روشی است که طی آن یک رسوب نامحلول در آب به وجود میآيد. این رسوب از واکنش بین آنالیت و تیترانت به دست میآيد. تشکیل رسوب تا زمانی اتفاق میافتد که آنالیت بهصورت کامل مصرف شود. از همین مورد میتوان فرا رسیدن نقطه همارزی تیتراسیون را نتیجهگیری کرد.
نحوه محاسبات تیتراسیون رسوبی
در این بخش میخواهیم روش انجام محاسبات مربوط به تیتراسیون رسوبی را با بررسی یک مثال مورد بررسی قرار دهیم. با توجه به الگوی انجام این محاسبات، میتوان به مثالهای مشابه پاسخ گفت.
در تیتراسیونی رسوبی، ۵۰ میلیلیتر از سدیم کلرید با فرمول شیمیایی با مولاریته ۰٫۰۵ به وسیله نقره نیترات ۰٫۱ مولار با فرمول شیمیایی تیتر میشود.
واکنش صورت گرفته در این تیتراسیون را میتوان بهصورت زیر نمایش داد.
«ثابت تعادل واکنش» (Reactions's Equilibrium Constant) برای این مورد بسیار بزرگ است. آن را در زیر آوردهایم.
به دلیل بزرگ بودن مقدار ثابت تعادل، فرض بر این است که واکنش بین کاتیون و آنیون و کامل میشود. در ادامه محاسبات مورد نیاز را مرحله به مرحله دنبال میکنیم.
مرحله اول: محاسبه حجم نقره نیترات مورد نیاز برای رسیدن به نقطه همارزی
اولین کاری که باید برای رسم منحنی تیتراسیون انجام دهیم، محاسبه مقدار مورد نیاز تیترانت برای رسیدن به نقطه همارزی است. بنابراین در این مورد حجم یون مورد نیاز است.
با توجه به استوکیومتری اجزای این واکنش، تعداد مولهای آنالیت و تیترانت با یکدیگر برابر است و میتوان آن را بهصورت تساوی زیر نشان داد.
این رابطه را برای حجم یون نقره تا رسیدن به نقطه همارزی واکنش، مینویسیم.
بنابراین متوجه میشویم که برای رسیدن به نقطه همارزی این تیتراسیون، به ۲۵ میلیلیتر از یون نقره نیاز داریم.
مرحله دوم: محاسبه مقدار پیش از نقطه همارزی به کمک غلظت واکنش نداده
پیش از رسیدن به نقطه همارزی، مقدار آنالیت یعنی مازاد است. بنابراین میتوان مقدار آن را بعد از افزودن ۱۰ میلیلیتر از یون نقره بهصورت زیر به دست آورد.
به این صورت مقدار پیش از رسیدن به نقطه همارزی برابر با ۱٫۶ است.
مرحله سوم: محاسبه مقدار در نقطه همارزی به کمک برای تعیین غلظت
میدانیم که در نقطه همارزی تیتراسیون، غلظت کاتیون و آنیون با یکدیگر برابر است. برای محاسبه غلظت از مقدار استفاده میکنیم که نشاندهنده غلظت نقره کلرید است. به رابطه زیر توجه کنید.
با حل این معادله و به دست آوردن مقدار ، غلظت یون کلرید برابر با و مقدار برابر با ۴٫۸۹ خواهد بود.
مرحله چهارم: محاسبه مقدار پس از نقطه همارزی با محاسبه غلظت نقره نیترات مازاد
در این مرحله ابتدا غلظت نقره نیترات مازاد را به دست میآوریم و سپس به کمک مقدار برای نقره کلرید، غلظت یون کلرید را به دست میآوریم.
پس از نقطه همارزی، مقدار تیترانت بهصورت مازاد است. بنابراین ابتدا مقدار مازاد یون نقره را محاسبه میکنیم و سپس به کمک مقدار ، غلظت یون کلرید را به دست میآوریم. برای مثال پس از افزودن ۳۵ میلیلیتر از تیترانت، رابطه زیر صادق است.
بنابراین مقدار برابر با ۷٫۸۱ است.
به کمک همین روش میتوان نقاط بیشتری را پیش و پس از نقطه همارزی به دست آورد و از آنها برای رسم منحنی تیتراسیون بهره برد. تعدادی از این نقاط را در جدول زیر آوردهایم.
| حجم نقره نیترات (میلیلیتر) | مقدار |
| ۰ | ۱٫۳ |
| ۵ | ۱٫۴۴ |
| ۱۰ | ۱٫۶ |
| ۱۵ | ۱٫۸۱ |
| ۲۰ | ۲٫۱۵ |
| ۲۵ | ۴٫۸۹ |
| ۳۰ | ۷٫۵۴ |
| ۳۵ | ۷٫۸۲ |
| ۴۰ | ۷٫۹۷ |
| ۴۵ | ۸٫۰۷ |
| ۵۰ | ۸٫۱۴ |
با استفاده از نقاطی که محاسبه کردهایم، میتوانیم منحنی این تیتراسیون رسوبی را بهصورت زیر رسم کنیم. توجه کنید که در نقطه همارزی شاهد یک جهش در منحنی هستیم. نقاط قرمز رنگ را میتوانید در جدول بالا نیز بیابید.
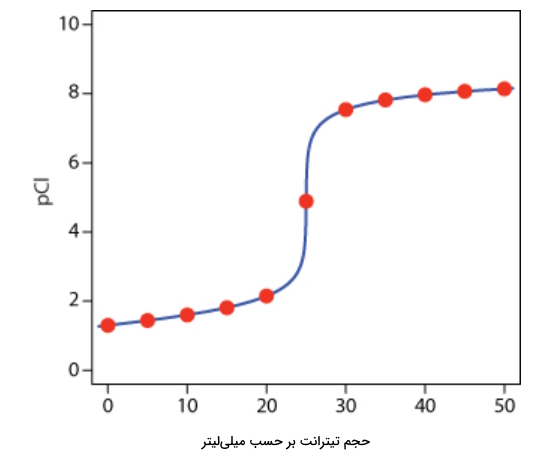
رسم منحنی تیتراسیون رسوبی
از منحنی تیتراسیون برای نمایش رابطه بین نقطه پایانی و نقطه همارزی تیتراسیون بهره میبریم. در این بخش میخواهیم نحوه رسم تیتراسیون رسوبی را مرحله به مرحله انجام دهیم. تیتراسیون مورد نظر ما در اینجا، شامل ۵۰ میلیلیتر از سدیم کلرید ۰٫۰۵ مولار و نقره نیترات ۰٫۱ مولار است. توجه داشته باشید که محاسبات مورد نیاز برای این تیتراسیون در بخش قبل عینا انجام شده است و در اینجا از تکرار آن پرهیز میکنیم.
مرحله اول: محاسبه حجم تیترانت در نقطه همارزی
در ابتدا نیاز داریم تا بدانیم با افزودن چه حجمی از تیترانت، واکنش بین آن با آنالیت تکمیل میشود و به نقطه همارزی تیتراسیون میرسیم. همانطور که پیشتر مشاهده کردید با افزودن ۲۵ میلیلیتر از تیترانت، نقطه همارزی فرا میرسد. سپس نموداری رسم میکنیم و به محور عمودی آن مقدار و به محور افقی آن حجم تیترانت را نسبت میدهیم.
مرحله دوم: مشخص کردن نقطه همارزی و پس از نقطه همارزی
برای مشخص کردن نقطه همارزی که برابر با ۲۵ میلیلیتر از تیترانت است، از حجم ۲۵ میلیلیتر نقره نیترات خطی عمودی رسم میکنیم. این را میتوانید در نمودار سمت چپ تصویر زیر مشاهده کنید. پیش از رسیدن به نقطه همارزی، مقدار یون کلرید بهصورت مازاد است و میتوان مقدار را از مقدار کلرید واکنشنداده، به دست آورد. انجام این محاسبه، همانطور که در بخش قبلی دیدید، آسان است و آن را برای حجم ۱۰ و ۲۰ میلیلیتر تیترانت به دست میآوریم. این دو نقطه را با رنگ قرمز در نمودار سمت راست تصویر زیر آوردهایم.
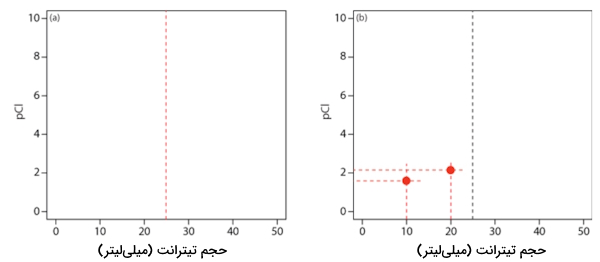
مرحله سوم: پس از نقطه همارزی
پس از رسیدن به نقطه همارزی، مقدار یون نقره بهصورت مازاد است و میتوان غلظت یون کلرید را از ثابت انحلالپذیری رسوب نقره کلرید به دست آورد. این محاسبات را پس از افزودن ۳۰ و ۴۰ میلیلیتر از تیترانت نقره نیترات، مطابق با بخش قبل، به دست آوردهایم که در نمودار چپ تصویر زیر با رنگ قرمز قابل مشاهده است.
در مرحله بعد از هر جفت نقطه، یک خط راست عبور میدهیم.این خط را امتداد میدهیم تا خط عمودی مربوط به نقطه همارزی را قطع کند. این را میتوانید در نمودار سمت راست تصویر زیر مشاهده کنید.
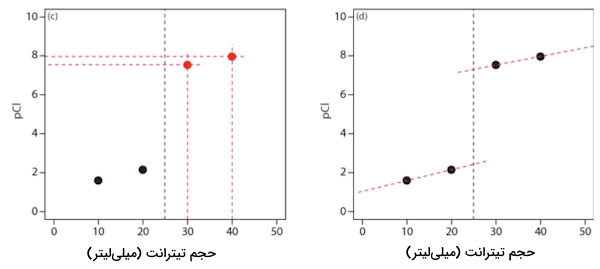
مرحله چهارم: تکمیل منحنی تیتراسیون
در نهایت باید منحنی را بهصورتی رسم کنیم که سه خط موجود در نمودار را به یکدیگر متصل کند. همانطور که در منحنی سمت راست تصویر مشاهده میکنید، دو نمودار با تقریب بسیار خوبی بر یکدیگر منطبق هستند. کافی است منحنی رسم شده با رنگ قرمز و منحنی مشکی را با یکدیگر مقایسه کنید.
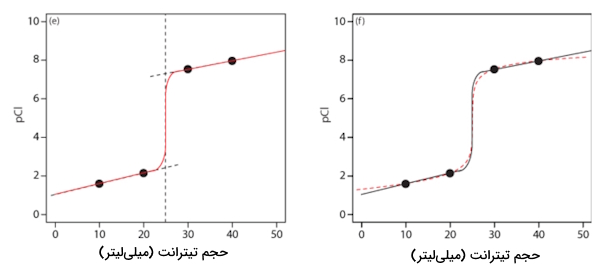
مثال تیتراسیون رسوبی
برای رسم منحنی تیتراسیون رسوبی، میتوان تغییرات مربوط به غلظت تیترانت یا آنالیت را مدنظر قرار داد. منحنی تیتراسیون ۵۰ میلیلیتر از نقره نیترات ۰٫۰۵ مولار را در مقابل سدیم کلرید ۰٫۱ مولار رسم کنید. نقاط مربوط به هر دو منحنی و در مقابل حجم سدیم کلرید را رسم کنید.
پاسخ
همانطور که پیشتر اشاره کردیم، در ابتدا باید حجم سدیم کلرید مورد نیاز تا رسیدن به نقطه همارزی را به دست بیاوریم. این کار را به کمک رابطه زیر انجام میدهیم.
پیش از رسیدن به نقطه همارزی، مقدار یون نقره بهصورت مازاد است. میتوان مقدار یون نقره واکنش نداده را پس از افزودن ۱۰ میلیلیتر از سدیم کلرید بهصورت زیر به دست آورد.
بنابراین مقدار برابر با ۱٫۶ است. برای محاسبه غلظت یون کلرید از مقدار مربوط به نقره کلرید استفاده میکنیم. به رابطه زیر دقت کنید.
بنابراین مقدار برابر با ۸٫۱۴ است.
میدانیم که در نقطه همارزی تیتراسیون، غلظت یون نقره و کلرید با یکدیگر برابر است. برای محاسبه غلظتها، میتوانیم از عبارت مربوط به برای نقره کلرید استفاده کنیم که بهصورت زیر خواهد بود.
با حل این معادله، مقدار غلظت یونها برابر با و مقدار و برابر با ۴٫۸۹ خواهد بود.
همچنین پس از نقطه همارزی، مقدار تیترانت بهصورت مازاد در محیط حضور دارد. برای مثال پس از افزودن ۳۵ میلیلیتر از تیترانت خواهیم داشت:
در این صورت مقدار برابر با ۱٫۹۳ است. برای به دست آوردن مقدار غلظت یون نقره از مقدار مربوط به نقره کلرید استفاده میکنیم و نتیجه بهصورت زیر خواهد بود.
در این صورت مقدار نیز برابر با ۷٫۸۲ است. به همین روش تعداد نقاط بیشتری را در مسیر تیتراسیون به دست آوردهایم که میتوان به کمک آنها، منحنیهای مورد نظر را رسم کرد.
| حجم سدیم کلرید (میلیلیتر) | مقدار | مقدار |
| ۰ | ۱٫۳ | - |
| ۵ | ۱٫۴۴ | ۸٫۳۱ |
| ۱۰ | ۱٫۶ | ۸٫۱۴ |
| ۱۵ | ۱٫۸۱ | ۷٫۹۳ |
| ۲۰ | ۲٫۱۵ | ۷٫۶ |
| ۲۵ | ۴٫۸۹ | ۴٫۸۹ |
| ۳۰ | ۷٫۵۴ | ۲٫۲ |
| ۳۵ | ۷٫۸۲ | ۱٫۹۳ |
| ۴۰ | ۷٫۹۷ | ۱٫۷۹ |
| ۴۵ | ۸٫۰۷ | ۱٫۶۸ |
| ۵۰ | ۸٫۱۴ | ۱٫۶ |
تشخیص نقطه پایانی تیتراسیون رسوبی
در تاریخچه تیتراسیون رسوبی خواهید خواند که اولین تیتراسیونها را با پیگیری توقف رسوب تشکیل شده مورد مطالعه قرار میدادند و فرا رسیدن نقطه همارزی را حدس میزدند. با این حال این روش بسیار دشوار است و از اطمینان و دقت کافی برخوردار نیست. به همین منظور روشهایی ابداع شدند. توجه داشته باشید که روش تیتراسیون فاجانس که پیش از این به آن اشاره کردیم نیز یکی از همین روشها است.
تشخیص نقطه پایانی به کمک شناساگر
برای تشخیص نقطه پایانی تیتراسیون رسوبی از سه شناساگر شیمیایی میتوان استفاده کرد که یکی از آنها همان تشخیص نقطه پایانی به روش فاجانس است. در ادامه میخواهیم دو روش دیگر را نیز مورد بررسی و مطالعه قرار دهیم.
روش مور
«روش مور» (Mohr Method) نخستین بار در سال ۱۸۵۵ توسط «کارل فردریش مور» (Larl Friedrich Mohr) به کار گرفته شد .در روش مور مقدار یون کلرید در محلول به کمک یون نقره به عنوان تیترانت اندازهگیری میشود. در این تیتراسیون مقدار اندکی از به محلول آنالیت افزوده میشود. با مشاهده رسوب قرمز نارنجی متوجه رسیدن نقطه پایانی تیتراسیون میشویم.
از آنجا که به محلول، رنگی زرد میدهد و باعث کدر شدن محلول در نقطه پایانی تیتراسیون میشود، حتما باید مقدار اضافه شده از آن را کنترل کنیم تا بسیار محدود باشد. از همین جهت همیشه نقطه پایانی این تیتراسیون دیرتر از نقطه همارزی مشاهده میشود. در جهت حذف این خطای مثبت، از یک محلول «بلانک» (Blank) عاری از آنالیت، برای اندازهگیری حجم تیترانت مورد نیاز تا مشاهده تغییر رنگ شناساگر، استفاده میشود. سپس حجم مورد نیاز برای رسیدن به نقطه همارزی تیتراسیون بلانک را از تیتراسیون اصلی کم میکنند و حجم واقعی به دست میآید.
از آنجا که بازی ضعیف است، محلول آنالیت نیز دارای اندکی خاصیت بازی خواهد بود. اگر محیط بسیار اسیدی باشد، کرومات به جای به فرم حضور خواهد داشت و نقطه پایانی تیتراسیون به تاخیر میافتد. همچین در تیتراسیون مور مقدار باید کمتر از ۱۰ باشد تا از تشکیل رسوب توسط نقره هیدروکسید جلوگیری شود.
روش ولهارد
«روش ولهارد» (Volhard Method) اولین بار در سال ۱۸۷۴ و توسط «جیکوب ولهارد» (Jacob Volhard) به کار گرفته شد. در این روش از گونهای به عنوان شناساگر استفاده میشود که با تیترانت یا آنالیت یک کمپلکس رنگی ایجاد میکند. برای مثال در تیتراسیون یون نقره به کمک به عنوان تیترانت، مقدار بسیار اندکی از به محلول آنالیت افزوده میشود. نقطه پایانی تیتراسیون برابر با تشکیل رسوب قرمز رنگ کمپلکس است. همچنین این تیتراسیون را باید حتما در محیطی اسیدی انجام داد تا از تشکیل رسوب جلوگیری شود.
روش فاجانس
سومین روشی که میتوان از آن برای تشخیص نقطه پایانی تیتراسیون رسوبی بهره برد، روش فاجانس است که پیشتر در مورد آن به تفصیل توضیح دادهایم.
تشخیص نقطه پایانی به کمک پتانسیومتر
یکی دیگر از روشهایی که توسط آن میتوان به نقطه پایانی تیتراسیون پی برد، تیتراسیون پتانسیومتری است. در این روش تغییر غلظت تیترانت و آنالیت توسط «الکترود یونگزین» (Ion Selective Electrode) و یک پتانسیومتر رصد میشود. سپس از منحنی حاصل از این تغییرات، نقطه پایانی تیتراسیون را به دست میآورند.
کاربرد تیتراسیون رسوبی و فاجانس
در بسیاری موارد از تیتراسیون رسوبی و تیتراسیون فاجانس به عنوان روشی استاندارد آنالیزی استفاده نمیشود. با این حال میتوان از این روش در کنار روشهای دیگر سود برد. در بیشتر تیتراسیونهای رسوبی، یون نقره به عنوان آنالیت یا تیترانت حضور دارد. به تیتراسیونی که در آن تیترانت باشد، «تیتراسیون آرژنتومتری» (Argentometric Titration) گفته میشود.
در جدول زیر تعدادی از تیتراسیونهای رسوبی متداول آورده شده است و میتوانید آنهایی که به روش تیتراسیون فاجانس انجام میشوند را مشاهده کنید. در مواردی که دو ماده به عنوان تیترانت آورده شدهاند، تیتراسیون بهصورت برگشتی انجام میشود. ماده اول به مقدار مازاد اضافه میشود و با ماده دوم تیتراسیون انجام میشود. در مواردی که کنار روش ولهارد یک ستاره وجود دارد، حتما باید پیش از انجام تیتراسیون برگشتی، نقره رسوبداده را از محیط خارج کنید.
| آنالیت | تیترانت | روش تشخیص نقطه پایانی |
| و | ولهارد | |
| ، و | مور، فاجانس، ولهارد* | |
| ، و | ولهارد* | |
| و | ولهارد* | |
| و | ولهارد* | |
| و | ولهارد* | |
| ، و | فاجانس، ولهارد | |
| و | ولهارد* | |
| و | ولهارد* | |
| و | ولهارد* |
تاریخچه تیتراسیون رسوبی و فاجانس
اولین تیتراسیونهایی که به روش رسوبی انجام شد به اواخر قرن هجدهم برمیگردد. در این تیتراسیون، محلول و موجود در پتاس مورد مطالعه و آنالیز قرار گرفت. تیترانت مورد استفاده در این تیتراسیون کلسیم نیترات با فرمول شیمیایی بود که منجر به تشکیل دو رسوب و میشد. زمانی به نقطه پایانی تیتراسیون میرسیم که با اضافه کردن تیترانت، رسوب بیشتری تشکیل نشود. گسترش این روش تیتراسیونی در قرن نوزدهم بسیار چشمگیر بود و به کمک آن یون نقره و یون هالید اندازهگیری شدند.
مثال و حل تمرین از تیتراسیون فاجانس
حال که میدانیم تیتراسیون فاجانس چیست و چگونه قابل انجام است، میخواهیم ابتدا تعدادی مثال را مورد بررسی قرار دهیم تا بر روش انجام محاسبات مسلط شویم. در ادامه تعدادی تمرین چندگزینهای نیز خواهیم داشت.
مثال از تیتراسیون فاجانس
در این بخش میخواهیم تعدادی مثال کاربردی را به همراه پاسخ تشریحی آنها مورد بررسی قرار دهیم. با توجه به پاسخهای تشریحی آنها، میتوانید به سوالهای مشابه در این زمینه پاسخ دهید.
مثال اول
نمونهای ۱٫۹۶۳ گرمی حاوی یک آلیاژ در حل و در یک بالن ژوژه تا حجم ۱۰۰ میلیلیتر رقیق میشود. ۲۵ میلیلیتر از آن را با با مولاریته ۰٫۱۰۷۸ مورد تیتراسیون قرار میدهیم که تا رسیدن به نقطه پایانی ۲۷٫۱۹ میلیلیتر از آن مصرف میشود. درصد جرمی نقره را در این آلیاژ محاسبه کنید.
پاسخ
در قدم اول میخواهیم تعداد مولهای مصرفی تیترانت را به دست بیاوریم. برای این کار به روش زیر عمل میکنیم.
استوکیومتری و بهصورت ۱:۱ است، بنابراین رابطه زیر را میتوانیم برای آنها بنویسیم.
توجه داشته باشید که این محاسبات برای ۲۵ میلیلیتر است که یک چهارم مقدار کل نمونه به حساب میآید. بنابراین باید ۰٫۳۱۶۲ را در عدد ۴ ضرب کنیم که برابر با ۱٫۲۶۵ گرم میشود. بنابراین میتوان درصد جرمی نقره در نمونه را بهصورت زیر به دست آورد.
مثال دوم
منحنی زیر مربوط به تیتراسیون رسوبی مخلوطی ۵۰ میلیلیتری از یونهای و ، هر دو با مولاریته ۰٫۰۵۰۰ است. در این تیتراسیون از به عنوان تیترانت استفاده میشود. بگویید هر نقطه مربوط به تیتراسیون کدام گونه است؟ و چرا یکی زودتر از دیگری تیتر میشود؟
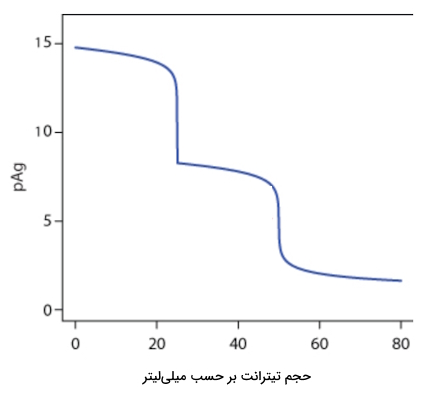
پاسخ
ترتیب تیتراسیون یون یدید و کلرید در تصویر زیر مشخص شده است و ید زودتر از کلر مورد تیتراسیون قرار میگیرد. دلیل این اولویت انحلالپذیری کمتر نسبت به است.
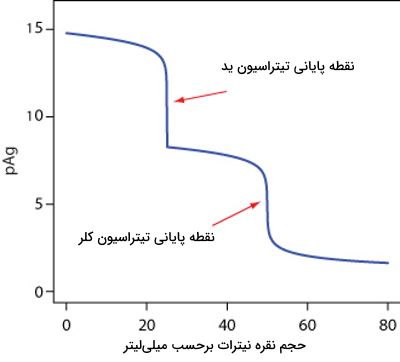
مثال سوم
تیتراسیون رسوبی چه کاربردهایی دارد؟
پاسخ
از تیتراسیون به روش رسوبی در موارد متعددی استفاده میشود که در فهرست زیر تعدادی از آنها را آوردهایم.
- برای اندازهگیری غلظت یونهای هالید در محلول
- برای اندازهگیری مقدار نمک موجود در غذا، نوشیدنی و آب
- برای تهیه مواد شیمیایی مانند دیکرومات، تیوسیانات و گوگرد
- در روند تهیه مواد دارویی مانند کاربامول و سرم نمکی
مثال چهارم
تفاوت روشهای مختلف تیتراسیون رسوبی، مور، فاجانس و ولهارد در چیست؟
پاسخ
مهمترین تفاوت تیتراسیون مور و ولهارد در این است که در روش مور، واکنش بین نقره و یون هالید در حضور شناساگر کرومات صورت میگیرد در حالی که در روش ولهارد، واکنش بین یونهای نقره مازاد و یونهای هالید در جریان است. همچنین در روش فاجانس، واکنش نقره هالید و جذب سطحی فلورسئن صورت میگیرد.
مثال پنجم
محدودیتهای تیتراسیون رسوبی را نام ببرید.
پاسخ
تیتراسیون رسوبی با وجود مزایایی که دارد، محدودیتهای مهمی نیز پیش پا میگذارد که در فهرست زیر برخی از آنها را مشاهده میکنید.
- روش تیتراسیون رسوبی تنها قادر به تیتر کردن مقدار اندکی از یونهای هالیدی است.
- در این روش «همرسوبی» (Coprecipitation) میتواند صورت بگیرد و ایجاد اختلال کند.
- تشخیص نقطه پایانی تیتراسیون در آن مشکلتر از باقی روشها است.
حل تمرین از تیتراسیون فاجانس
حال که تعدادی مثال را مورد بررسی قرار دادیم، میخواهیم به مرور تعدادی تمرین با پاسخ چندگزینهای بپردازیم.
تمرین اول
تمرین و آزمون
تمرین دوم
تمرین و آزمون
تمرین سوم
تمرین و آزمون
تمرین چهارم
تمرین و آزمون
تمرین پنجم
تمرین و آزمون
تمرین ششم
تمرین و آزمون
تمرین هفتم
تمرین و آزمون
تمرین هشتم
تمرین و آزمون
سوالات متدوال تیتراسیون فاجانس
حال که میدانیم تیتراسیون فاجانس چیست و با نحوه انجام آن آشنا شدیم، میخواهیم به برخی از مهمترین و پرتکرارترین سوالهای پیرامون آن پاسخ دهیم.
تیتراسیون فاجانس به کدام دسته از تیتراسیونها تعلق دارد؟
تیتراسیون فاجانس روشی است که در آن طی تیتراسیون رسوب تشکیل میشود. بنابراین زیرشاخه تیتراسیون رسوبی است.
شناساگر تیتراسیون فاجانس چیست ؟
در تیتراسیون به روش فاجانس از شناساگر دیکلرو فلورسئن برای پی بردن به نقطه پایان تیتراسیون استفاده میشود.
به غیر از روش فاجانس، چه روشهایی برای انجام تیتراسیون رسوبی وجود دارد؟
برای انجام تیتراسیون رسوبی میتوان از سه روش، ولهارد، مور و فاجانس استفاده کرد.
تفاوت نقطه پایانی و نقطه همارزی تیتراسیون در چیست؟
در نقطه همارزی واکنش بین تیترانت و آنالیت از نظر تئوری تکمیل میشود، در حالی نقطه پایانی تیتراسیون نقطهای است که تغییر رنگ حاصل از پایان واکنش در آن مشاهده میشود.
جمعبندی
در این مطلب از مجله فرادرس در مورد یکی از انواع روشهای انجام تیتراسیون به نام تیتراسیون فاجانس صحبت کردیم. تیتراسیون فاجانس یکی از زیرشاخههای تیتراسیون رسوبی است که در آن طی تیتراسیون رسوبی نامحلول تشکیل میشود. در ادامه به بررسی تعدادی مثال از این روش پرداختیم و نحوه انجام محاسبات مورد نیاز برای آن را مرور کردیم.












