تیتراسیون اکسایش کاهش – از صفر تا صد
تیتراسیونهای تحلیلی با استفاده از واکنشهای ردوکس، مدت کوتاهی بعد از توسعه تیتراسیون اسید و باز معرفی شدند. تیتراسیون اکسایش کاهش در ابتدا از قدرت اکسندگی کلر استفاده میکرد. در سال ۱۷۸۷، «کلاود برتولت» روش جدیدی برای تحلیل مقداری مخلوطی از ، و موسوم به «آب کلرزده» (Chlorine Water) ارائه داد. این روش بر اساس قدرت اکسندگی رنگ «نیل» (Indigo) بیان شده، که در حالت اکسید، بیرنگ بود. در سال 1814 نیز «ژوزف گیلوساک» (Joseph Gay-Lussac)، روشی مشابه را توسعه داد که برای تعیین کلر موجود در پودر سفیدکننده موثر بود. در هر دو روش، نقطه پایانی با تغییر رنگ همراه بود. پیش از نقطه تعادل (نقطه همارزی یا اکیوالان)، محلول به دلیل اکسیداسیون نیل، بیرنگ میشود. بعد از نقطه تعادل، نیلی که در واکنش شرکت نکرده است، رنگ ثابتی را به محلول میدهد.


مقدمه
در اواسط دهه 1800 بود که روشهای تیترسنجی با معرفی ، و ید به عنوان تیترانت اکسنده و و به عنوان تیترانت کاهنده افزایش یافت. حتی با وجود تیترانتهای جدید، سرعت توسعه تیتراسیون اکسایش کاهش به دلیل فقدان معرفهای مناسب، پایین بود. البته ذکر این نکته ضروری است در صورتیکه رنگ تیترانتها در حالت کاهیده یا اکسید، تفاوت زیادی داشته باشند، میتوان از آنها به عنوان معرف استفاده کرد.
به طور مثال، رنگ بنفش یون به عنوان معرف عمل میکند چراکه نوع کاهشیافته آن یعنی ، تقریبا بیرنگ است. سایر تیترانتها به یک معرف جداگانه نیاز دارند. چنین موادی در دهه 1920، با معرفی دیفنیل آمین به دنیای تیتراسیون اکسایش کاهش راه پیدا کردند. با افزایش و توسعه سایر معرفها، کاربرد عملی تیتراسیون اکسایش کاهش نیز افزایش یافت.
نمودارهای تیتراسیون اکسایش کاهش
برای فهم بهتر تیتراسیون اکسایش کاهش باید شکل نمودارهای آن را بدانیم. در تیتراسیونهای اسید و باز یا تیتراسیون تشکیل کمپلکس، نمودار تیتراسیون، نشاندهنده تغییر غلظت (به عنوان pH) یا غلظت (به عنوان pM) است. در تیتراسیون اکسایش کاهش به طور معمول، به جای کنترل غلظت یک جزء، پتانسیل واکنش تیتراسیون را رصد میکنند.
به طور مثال، واکنش زیر را در نظر بگیرید که در آن، یک آنالیت (تیتراند) در حالت کاهشیافته با یک تیترانت در حالت اکسید شده واکنش میدهد.
برای واکنش بالا، پتانسیل واکنش را میتوان به کمک رابطه زیر محاسبه کرد که در واقع، اختلاف بین پتانسیلهای کاهش برای هر نیمواکنش است:
بعد از هر بار اضافه کردن تیترانت، واکنش بین تیترانت و آنالیت به یک حالت پایدار میرسد. از آنجایی که پتانسیل در حالت تعادل برابر با صفر است، پتانسیل کاهش تیترانت و آنالیت با یکدیگر برابر هستند:
با توجه به عبارت بالا در مییابیم که به کمک یکی از نیمواکنشها میتوانیم پیشرفت تیتراسیون را رصد کنیم. پیش از نقطه تعادل، مخلوط تیتراسیون حاوی مقادیر قابل توجهی از اشکال اکسیدشده و کاهشیافته آنالیت است. در این حالت، غلظت تیترانتی که در واکنش شرکت نکرده است، مقدار کمی را در بر میگیرد. در نتیجه، برای محاسبه پتانسیل، بهتر است از «رابطه نرنست» (Nernst Equation) در نیمواکنش آنالیت استفاده کنیم:
بعد از نقطه تعادل، محاسبه پتانسیل برای نیمواکنش تیترانت، سادهتر است:
ذکر این نکته ضروری است با وجود اینکه معادله نرنست بر اساس پتانسیل حالت استاندارد نیم واکنش نوشته شده است، اما به طور معمول از پتانسیلی موسوم به «پتانسیل فرمال» (Formal Potential) استفاده میشود.
پتانسیل فرمال
پتانسیل فرمال که آنرا با نشان میدهند، پتانسیل کاهشی است که به نیمواکنشها تحت شرایط خاصی همچون pH، قدرت یونی و ... مرتبط میشود. به طور مثال، پتانسیل فرمال واکنشهایی الکتروشیمیایی مهم بیولوژیکی را در pH برابر با 7 اندازهگیری میکنند چراکه به مقدار فیزیولوژیکی pH نزدیکتر است.
محاسبات نمودار تیتراسیون اکسایش کاهش
میخواهیم نمودار را برای تیتراسیون 50 میلیلیتر محلول 0/1 مولار با محلول 0/1 مولار در محلول ۱ مولار را محاسبه کنیم. واکنش مربوطه به شرح زیر است:
در محلول ۱ مولار ، پتانسیل فرمال کاهش به برابر با و پتانسیل فرمال کاهش به برابر با است. از آنجایی که ثابت تعادل برای واکنش بالا، عدد بسیار بزرگی در حدود است، اینطور فرض میکنیم که آنالیت و تیترانت به طور کامل با یکدیگر واکنش میدهند.
در مرحله اول، مقدار حجم تیترانت مورد نیاز برای رسیدن به نقطه تعادل را محاسبه میکنیم. به عبارت دیگر، اولین مرحله، محاسبه حجم خواهد بود. با توجه به استوکیومتری واکنش، میدانیم که تعداد مول با تعداد مول برابر است. بنابراین، خواهیم داشت:
اگر معادله را برای حجم محاسبه کنیم، مقدار حجم نقطه تعادل بدست خواهد آمد:
در مرحله دوم، پتانسیل را پیش از نقطه تعادل محاسبه میکنیم. این کار با تعیین غلظتهای حالت اکسید شده و کاهشیافته آنالیت به کمک استفاده از رابطه نرنست برای نیمواکنش کاهش آنالیت انجام میشود. قبل از نقطه تعادل، محاسبه غلظتهای و ساده است. در نتیجه، برای نیمواکنش با استفاده از رابطه نرنست خواهیم داشت:
به طور مثال، غلظتهای و بعد از اضافه کردن 10 میلیلیتر تیترانت عبارتست از:
حجم کل/(تعداد مول اضافه شده - تعداد مول اولیه) =
با جایگذاری این عبارات در معادله اصلی، مقدار پتانسیل را محاسبه میکنیم:

در مرحله سوم، مقدار پتانسیل را بعد از نقطه تعادل به کمک تعیین غلظتهای اکسایش و کاهش یافته تیترانت و به کمک رابطه نرنست محاسبه خواهیم کرد. بعد از نقطه تعادل، محاسبه غلظتهای و ساده خواهد بود. با استفاده از رابطه نرنست برای نیمواکنش خواهیم داشت:
به طور مثال، بعد از اضافه کردن 60 میلیلیتر تیترانت، برای محاسبه غلظتهای و خواهیم داشت:
حجم کل/ تعداد مول اولیه =
با جایگذاری مقادیر محاسبه شده در معادله اصلی، پتانسیل را محاسبه میکنیم:
در مرحله چهارم، پتانسیل را در نقطه تعادل محاسبه میکنیم. در نقطه تعادل ، مقدار پتانسیل برای و با یکدیگر برابر خواهند بود. بنابراین، با اضافه کردن این دو رابطه به یکدیگر خواهیم داشت:
با توجه به برابری غلظتها و صفر شدن مولفه شامل لگاریتم، پتانسیل را محاسبه میکنیم:
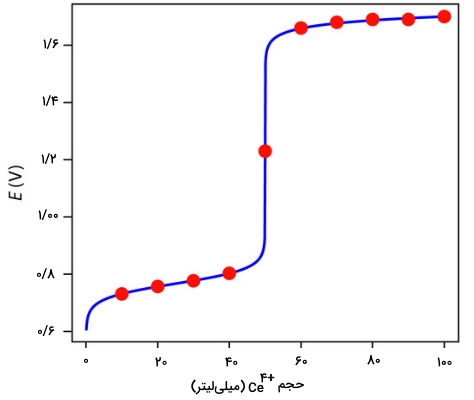
با توجه به مراحلی که توضیح داده شد، میتوان نقاط مختلف دیگری را بعد و قبل از نقطه تعادل محاسبه و به کمک آن، نمودار تیتراسیون را رسم کرد. جدول زیر، این نقاط را نشان میدهند که در ادامه، نمودار مربوطه نیز دیده میشود:
| حجم (میلیلیتر) | حجم (میلیلیتر) | ||
| 10 | 0/731 | 60 | 11/66 |
| 20 | 0/757 | 70 | 1/68 |
| 30 | 0/777 | 80 | 1/69 |
| 40 | 0/803 | 90 | 1/69 |
| 50 | 1/23 | 100 | 1/70 |
انتخاب و تعیین نقطه پایانی در تیتراسیون اکسایش کاهش
نقطه تعادلی در تیتراسیون اکسایش کاهش زمانی اتفاق میافتد که مقادیر دقیق استوکیومتری از تیترانت و آنالیت را با یکدیگر وارد واکنش کنیم. همانند تیتراسیونهای اسید و باز و تشکیل کمپلکس، نقطه تعادل را با استفاده از نقطه پایانی بدست میآوریم. روشهای مختلفی برای تعیین محل نقطه پایانی وجود دارند که به تغییر شرایط محلول حساس هستند.
محل نقطه پایانی تیتراسیون اکسایش کاهش
در تیتراسیون اسید و باز یا تیتراسیون تشکیل کمپلکس، نقطه تعادل تیتراسیون در حقیقت، نقطه عطفی است که در نمودار بوجود میآید. اگر به نمودار بالا نگاه کنید، خواهید دید که نقطه عطف در میانه محل تغییر جهت نمودار به سمت بالا قرار دارد. این نوع از نقاط تعادل، موسوم به «نقطه تعادل متقارن» (Symmetric Equivalence Point) هستند.
اگر استوکیومتری متقارنی برای تیتراسیون اکسایش کاهش داشته باشیم، یعنی اینکه یک مول از تیترانت با هر مول از آنالیت وارد واکنش شود، نقطه تعادل متقارن خواهیم داشت. اگر استوکیومتری متقارنی نداشته باشیم، نقطه تعادل به بالا یا پایین خط جهشی نمودار تیتراسیون نزدیک میشود و نقطه تعادل نامتقارن خواهیم داشت.
پیدا کردن نقطه پایانی تیتراسیون اکسایش کاهش به کمک معرف
از سه نوع معرف برای مشخص کردن نقطه پایانی بهره میگیرند. اکسایش و کاهش برخی از تیترانتها همچون ، رنگ متفاوتی دارد. به تیتراسیونی که در آن از پرمنگنات بهعنوان تیترانت استفاده شود، منگانومتری گفته میشود. محلول به رنگ بنفش دیده میشود. در یک محلول اسیدی، پرمنگنات کاهشیافته، بیرنگ است. زمانی که از به عنوان تیترانت استفاده کنیم، تا زمان نقطه تعادل، محلول آنالیت، بیرنگ باقی میماند. در این مرحله، اولین قطره اضافی از ، باریکه رنگ بنفشی بدست میدهد که نشاندهنده نقطه پایانی است.
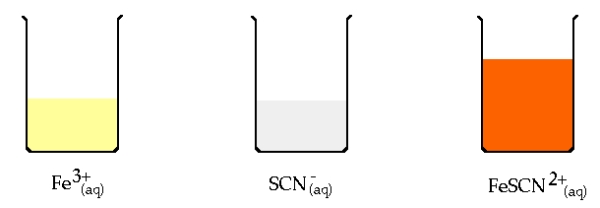
برخی از معرفها با شکل خاصی از تیترانت یا آنالیت که دچار اکسایش و کاهش شدهاند، ترکیبات رنگی تشکیل میدهند. به طور مثال، نشاسته با ، کمپلکسی به رنگ آبی تیره را بوجود میآورد. از این تغییر رنگ (بیرنگ به آبی) میتوانیم برای نشانی از حضور اضافی یون در نقش تیترانت بهره بگیریم. همچنین، زمانی که از به عنوان آنالیت استفاده میکنیم، تغییر رنگ از آبی به بیرنگ را میتوان نشانی از تکمیل واکنش دانست. نوع دیگری از معرفها، تیوسیانات با فرمول است که با کمپلکس محلول قرمز رنگی با فرمول تشکیل میدهد.
مهمترین معرفها در تیتراسیون اکسایش کاهش
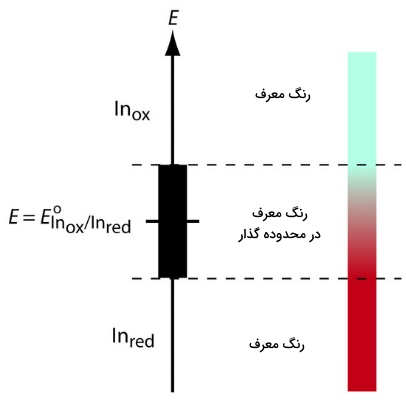
مهمترین نوع از معرفها، آنهایی هستند که در واکنشهای اکسایش کاهش شرکت نمیکنند اما رنگ اکسید و احیا در آنها متفاوت است. زمانی که یک معرف اکسایش کاهش (ردوکس) را به آنالیت اضافه میکنیم، معرف به رنگی تبدیل خواهد شد که با پتانسیل محلول مرتبط باشد. با اضافه کردن تیترانت، پتانسیل محلول تغییر و با تغییر عدد اکسایش معرف، رنگ آن نیز تغییر میکند که از آن میتوان برای تعیین نقطه پایانی استفاده کرد. برای فهم بهتر تغییر رنگ معرف، نیمواکنش زیر را در نظر بگیرید که در این نیمواکنش، عبارت (In) بیانگر «معرف» (Indicator) است و و به ترتیب بیانگر حالات اکسایش و کاهش هستند.
رابطه نرنست برای این نیم واکنش به صورت زیر است:
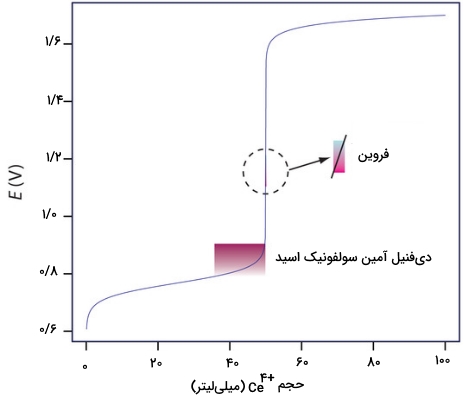
تصویر زیر نشاندهنده ارتباط بین پتانسیل و رنگ معرف است.
در جدول زیر، فهرستی از معرفها نشان داده شدهاند. علاوه بر این، در تصویر زیر نیز تاثیر انتخاب معرف مناسب را برای تیتراسیون با ملاحظه میکنید.
| معرف | رنگ | رنگ | |
| نیل تتراسولفات | آبی | بیرنگ | 0/36 |
| متیلن آبی | آبی | بیرنگ | 0/53 |
| دیفنیل آمین | بنفش | بیرنگ | 0/75 |
| دیفنیل آمین سولفونیک اسید | قرمز-بنفش | بیرنگ | 0/85 |
| «تریس (۲ و ۲ بیپیریدین) آهن» | آبی کمرنگ | قرمز | 1/12 |
| «فروین» (Ferroin) | آبی کمرنگ | قرمز | 1/147 |
| تریس (۵-نیترو-۱-10-فنانترولین) آهن | آبی کمرنگ | قرمز-بنفش | 1/25 |
سایر روشها برای پیدا کردن نقطه پایانی تیتراسیون اکسایش کاهش
روش دیگری که برای تعیین نقطه پایانی تیتراسیون اکسایش کاهش میتوان بکار گرفت، تیتراسیون «پتانسیلسنجی» (Potentiometric) است که در آن، تغییرات پتانسیل به هنگام اضافه کردن تیترانت به آنالیت رصد میشود. در این حالت، نقطه پایانی را با مشاهده نمودار تیتراسیون میتوان پیدا کرد. روشهای دیگر شامل تیتراسیون دماسنجی و تیتراسیون اسپکتروفوتومتری هستند.
محاسبات مقداری تیتراسیون اکسایش کاهش
در این بخش سعی میکنیم کاربردهای تیتراسیون اکسایش کاهش را با تمرکز بر کاربردهای زیستمحیطی و صنعتی بیان کنیم.
تنظیم عدد اکسایش آنالیت
اگر یک تیتراسیون اکسایش کاهش بمنظور تحلیل مقداری مورد استفاده قرار بگیرد، آنالیت باید با یک عدد اکسایش حضور داشته باشد. به طور مثال، آهن را میتوان به کمک و اکسید کردن به تیتر کرد. بسته به نوع نمونه و آمادهسازی آن، آهن ممکن است در هر دو اعداد اکسایش و حضور داشته باشد. در این حالت، باید از عوامل اکسنده یا کاهنده کمکی بمنظور تنظیم عدد اکسایش آنالیت استفاده کرد.
فلزاتی همچون روی، آلومینیوم و نقره که به راحتی اکسید میشوند را میتوان به عنوان «عامل اکسنده کمکی» (Auxilary Reducing Agent) در نظر گرفت. فلز به صورت پودر یا کلاف سیمی به نمونه وارد و موجب کاهش آنالیت میشود. فلز را قبل از شروع تیتراسیون باید از محلول خارج کرد چراکه با تیترانت وارد واکنش خواهد شد که اینکار به راحتی با فیلتراسیون یا خارج کردن کلاف سیمی امکانپذیر است.
روشی دیگر برای بکارگیری عامل اکسنده کمکی، ثابت (فیکس) کردن آن در طول یک ستون است. برای آمادهسازی یک ستون کاهشی، دوغابی از یک پودر فلزی را داخل لولهای شیشهای میریزند که در پایین این لوله، لایهای متخلخل قرار دارد. نمونه را در بالای این ستون قرار میدهند. نمونه تحت تاثیر نیروی گرانش یا خلا در طول لوله به طرف پایین حرکت میکند. به منظور اطمینان از تکمیل فرآیند کاهش، طول ستون و نرخ جریان، به دقت محاسبه و تعیین میشوند. دو نوع از ستونهای کاهشی عبارتند از «کاهنده جونز» (Jones Reductor) و «کاهنده والدن» (Walden Reductor).
در ستون جونز از آمالگام روی بهره میگیرند که آمادهسازی آن از طریق قراردادن دانههای روی در محلول انجام میشود. واکنش اکسیداسیون روی در زیر آورده شده است:
اکسیداسیون روی، الکترون مورد نیاز برای کاهش آنالیت را تامین میکند. در کاهنده والدن، ستون با دانههایی از نقره پر شده است. محلول شامل آنالیت به کمک HCl، اسیدی میشود. با عبور از ستون، واکنش اکسایش نقره به صورت زیر خواهد بود:
اکسیداسیون نقره، الکترون مورد نیاز برای کاهش آنالیت را فراهم میکند. جدول زیر، کاربرد ستونهای مختلف کاهنده را نشان میدهد.
| کاهنده جونز | کاهنده والدن | تیترانت اکسید شده |
| - | ||
| - | ||
واکنشگرهای (ریجنت) مختلفی به عنوان عامل اکسنده کمکی مورد استفاده قرار میگیرند که از میان آنها میتوان به آمونیوم پروکسیدیسولفات با فرمول و هیدروژن پراکسید با فرمول اشاره کرد. پروکسیدیسولفات، اکسندهای قوی است که واکنش آن در زیر آورده شده است:
این ماده توانایی اکسید کردن به و به را دارد. همچنین برای اکسید کردن به نیز میتوان از این ماده استفاده کرد.
روش دیگر برای اکسید کردن آنالیت، کاهش هیدروژن پراکسید در محلولی اسیدی طیق واکنش زیر است:

انتخاب و استانداردسازی تیترانت در تیتراسیون اکسایش کاهش
اگر از تیتراسیون اکسایش کاهش برای محاسبات مقداری استفاده میکنیم، غلظت تیترانت باید در طول فرآیند، پایدار باشد. از آنجایی که تیترانت در حالت کاهیده، در معرض اکسیداسیون هوا قرار دارد، بیشتر تیتراسیونهای اکسایش کاهش از یک عامل اکسنده به عنوان تیترانت استفاده میکنند. تیترانتهای اکسنده مختلفی وجود دارند که برخی از آنها عبارتند از:
پرمنگنات
اینکه از چه نوع تیترانتی استفاده شود به نحوه اکسید کردن آنالیت بستگی دارد. آنالیتی که عامل کاهنده ضعیفی باشد، به یک اکسنده قوی نیاز دارد تا بتوان به یک نقطه پایانی مناسب رسید. دو نوع از قویترین تیترانتهای اکسنده و هستند که نیمواکنشهای مربوط به آنها در ادامه آمدهاند:
محلولهای حاوی یون سریوم
محلولهای را معمولا به کمک سریوم آمونیوم نیترات با فرمول در محلول ۱ مولار تهیه میکنند. زمانی که این آمادهسازی توسط محلولهای خالصی همچون انجام بگیرد، محلول را در مقابل کاهندهای مانند یا استانداردسازی میکنند. در این شرایط، از فروین به عنوان معرف بهره میگیرند. با وجود در دسترس بودن و سادگی آمادهسازی ، از این ماده نسبت به پرمنگنات، کمتر استفاده میشود چراکه مقرونبهصرفه نیست. واکنشهای استانداردسازی در زیر آورده شدهاند:
آمادهسازی محلولهای پرمنگنات به کمک صورت میگیرد. محلولهای آبی پرمنگنات به دلیل قابلیت اکسید کردن آب، از لحاظ ترمودینامیکی ناپایدارند.
این واکنش در حضور دیاکسید منگنز، گرما، نور، اسید و باز کاتالیز میشود. محلول پایدار پرمنگنات را میتوان با جوشاندن آن برای یک ساعت و فیلتر کردن رسوب جامد دیاکسید منگنز بدست آورد. استانداردسازی محلول پرمنگنات در مقابل عوامل کاهنده همچون یا انجام میشود که رنگ صورتی پرمنگنات اضافی نشاندهنده نقطه پایانی است. محلول پرمنگناتی که از این روش تهیه شود، برای یک تا دو هفته پایدار خواهد بود. واکنشهای استانداردسازی پرمنگنات در زیر آورده شدهاند:
پتاسیم دیکرومات
پتاسیم دیکرومات، عامل اکسنده به نسبت قدرتمندی است که از مزایای آن، در دسترس بودن به صورت «استاندارد اولیه» (Primary Standard) و پایداری طولانی مدت محلول آن است. البته قدرت اکسندگی آن به اندازه پرمنگنات یا نیست که از این خاصیت، زمانی استفاده میکنیم که آنالیت، اکسنده ضعیفی باشد. نیمواکنش کاهش آن در زیر آورده شده است:
با وجود اینکه رنگ نارنجی و محلول سبززنگ است اما شدت رنگ هیچکدام به اندازهای نیست که بتوان از آنها به عنوان معرف استفاده کرد. در عوض، دیفنیلآمین سولفونیک اسید، در حالت اکسید به صورت قرمز-بنفش و در حالت کاهیده، بیرنگ است و میتوان برای تعیین نقطه پایانی در تیتراسیون دیکرومات مورد استفاده قرار گیرد.
ید
از دیگر تیترانتهای اکسنده مهم میتوان به ید اشاره کرد. با توجه به اینکه نسبت به سایر اکسندهها قدرت کمتری دارد، تنها زمانی بکار گرفته میشود که آنالیت، عامل کاهنده قوی باشد. این محدودیت موجب شده است تا از آن به عنوان تیترانت مناسب در آنالیز عوامل کاهنده قوی در حضور کاهنده ضعیفتر استفاده شود. نیمواکنش کاهش آن به صورت زیر است:
محلولهای به طور معمول در مقابل استاندارسازی و از نشاسته به عنوان معرف استفاده میشود. معادله استانداردسازی آن در زیر آمده است:
تیتراسیون اکسایش کاهش در مخلوط
همانند تیتراسیونهای اسید و باز و تشکیل کمپلکس، میتوان یک تیتراسیون را برای مخلوطی از آنالیتها نیز انجام داد به شرطی که اختلاف قابل توجهی در پتانسیلهای کاهش یا اکسایش باشد.
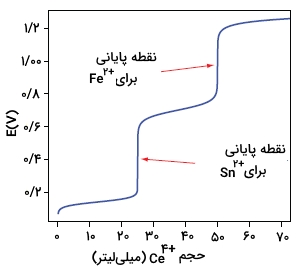
نمودار زیر، نمونهای از نمودار تیتراسیون را برای مخلوطی از و به همراه تیترانت نشان میدهد. انجام تیتراسیون یک مخلوط، زمانی امکانپذیر است که پتانسیل حالت استاندارد یا پتانسیل فرمال در دو ماده، بیش از اختلاف داشته باشند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی تجزیه ۱
- محلول بافر — از صفر تا صد
- الکترولیت و هدایت الکتریکی — از صفر تا صد
^^













با سلام چرا اکسایش اگزالات 2 الکترون تولید میکند درصورتی که تغییر عدد اکسایش آن یک است؟
ممنون بابت این مقاله کامل و دقیق بسیار استفاده کردیم