قانون هنری – از صفر تا صد
در علم شیمی فیزیک، قانون هنری بیان میکند که مقدار گاز حلشده در یک مایع، با فشار جزئی در بالای سطح مایع متناسب است. عامل این تناسب را با نام «ثابت قانون هنری» (Henry's Law Constant) میشناسند که توسط شیمیدان انگلیسی، ویلیام هنری معرفی شد.


از نمونههایی که میتوان در آن قانون هنری را مشاهده کرد، وابستگی انحلال گازهای اکسیژن و نیتروژن در جریان خون شناگران به هنگام شیرجه است. نمونهای دیگر را میتوان در نوشابههای گازدار دید که محتوی دیاکسید کربن محلول هستند. قبل از باز کردن درب بطری، گاز موجود در بالای بطری، دیاکسید کربن خالص است که در فشاری، بالاتر از فشار اتمسفری قرار دارد. بعد از باز کردن درب بطری، با خارج شدن گاز از آن، فشار جزئی دیاکسید کربن کاهش مییابد. در اثر این اتفاق، گاز محلول در نوشابه، طی فرآیندی موسوم به «Degassing» از محلول خارج میشود.

ثابتهای قانون هنری
راههای مختلفی برای تعریف ثابت هنری وجود دارند که میتوان آنها را به دو دسته اصلی تقسیم کرد. در حالت اول، اگر فاز محلول را در صورت کسر و فاز گاز را در مخرج قرار دهیم، به ثابت انحلالپذیری در قانون هنری میرسیم. با افزایش انحلالپذیری، این مقدار نیز افزایش پیدا میکند. در روشی دیگر، صورت و مخرج کسر را میتوان جابجا کرد، در این حالت به ثابت فراریت در قانون هنری میرسیم. با افزایش انحلالپذیری، مقدار افزایش پیدا میکند. این روابط را در ادامه این آموزش بررسی خواهیم کرد.
با تعریفهایی که ارائه شد، کمیتهای مختلفی برای توصیف ترکیب دو فاز بیان میشوند. به طور معمول برای محلولها از غلظت مولی ، مولالیته و نسبت اختلاط مولی استفاده میشود. برای فاز گاز، غلظت مولی و فشار جزئی بکار میرود. در نهایت، برای توصیف دقیقتر قانون هنری، از دو بالانویس بهره می گیریم. به طور مثال، به انحلالپذیری هنری به صورت اشاره دارد.
تعریف انحلالپذیری هنری با غلظت
همانطور که در بالا اشاره شد، رابطه مربوط به قانون هنری برای انحلالپذیری با غلظت به صورت زیر تعریف میشود:
در رابطه بالا، غلظت اجزا در فاز محلول و ، فشار جزئی آن اجزا در فاز گاز تحت شرایط تعادل است. واحد SI برای آن را به صورت تعریف میکنند.
انحلالپذیری بدون بعد هنری
انحلالپذیری هنری را میتوان به صورت نسبت بدون بعد غلظت فاز محلول و گاز یک جزء بیان کرد که رابطه آن به صورت زیر است:
در خصوص گازهای ایدهآل میتوان رابطه زیر را بکار برد که در آن، ثابت گازها و دما است:
در برخی موارد، به این ثابت بدون بعد، «ضریب تقسیم آب-هوا» (Water-air Partitioning Coefficient) میگویند و آن را با نشان میدهند.
تعریف انحلالپذیری هنری با نسبت اختلاط فاز محلول
از دیگر روابط قانون هنری میتوان به ثابت انحلالپذیری با رابطه زیر اشاره کرد:
برای محلولهای رقیق، ضریب تبدیل بین و را به صورت زیر تعریف میکنند:
در این رابطه، صورت کسر بیانگر چگالی آب و مخرج، جرم مولی آب است، در نتیجه، خواهیم داشت:
واحد SI برای را معمولا به صورت بیان میکنند. البته در برخی موارد از نیز استفاده میکنند.
تعریف انحلالپذیری هنری با مولالیته
بهتر است که فاز محلول را به جای غلظت، به کمک مولالیته توصیف کنیم زیرا از آنجایی که این عبارت بر جرم حلشونده دلالت دارد، در نتیجه، مولالیته محلول، با دما تغییر نمیکند. در مقابل، غلظت با دما تغییر میکند زیرا، چگالی یک محلول و به تبع آن، حجم محلول به تغییرات دما وابسته هستند.
با استفاده از مولالیته، انحلالپذیری هنری به صورت زیر تعریف میشود:
در این رابطه، از حرف برای نمایش مولالیته استفاده شده است. تا با به عنوان جرم اشتباه گرفته نشود. واحد SI برای را به صورت تعریف میکنند. راه سادهای برای محاسبه از روی وجود ندارد، چراکه تبدیل غلظت و مولالیته ، شامل تمامی اجزای حلشونده در محلول میشود. برای محلولی با تعداد حلشونده، رابطه بین و به صورت زیر خواهد بود:
در رابطه بالا، چگالی انحلال و جرمهای مولی هستند. اگر تنها یک جز از حلشونده داشته باشیم، رابطه به صورت ساده زیر تبدیل خواهد شد:
لازم به ذکر است که قانون هنری تنها برای محلولهای رقیق صدق میکند که شروط زیر در آن برقرار باشند:
در این حالت، بازهم رابطه فوق، سادهتر میشود. بنابراین، خواهیم داشت:
وابستگی دما در قانون هنری
زمانی که دمای یک سیستم تغییر کند، ثابت هنری نیز تغییر میکند. لازم به ذکر است که وابستگی دمای ثابتهای تعادل را به طور کلی میتوان با «رابطه وانت هوف» (van't Hoff Equation) توصیف کرد که این روش برای ثابتهای قانون هنری نیز صدق میکند:
توجه داشته باشید که در این رابطه،، آنتالپی انحلال است و نباید با در قانون هنری اشتباه گرفته شود. با انتگرالگیری از رابطه بالا و بازآرایی آن بر اساس خواهیم داشت:
رابطه وانتهوف به این شکل، تنها برای بازههای دمایی محدودی قابل محاسبه است که در آن بازه، ، بر اثر تغییر دما، تغییرات زیادی نداشته باشد.
انحلالپذیری گازها
به طور معمول، انحلالپذیری گازها با افزایش دما (در محدوده دمای اتاق) کاهش پیدا میکند. البته در محلولهای آبی، ثابت انحلال قانون هنری دارای یک مقدار حداقلی است. برای گازهایی با قابلیت پایین در مایع شدن، این مقدار، 120 درجه سانتیگراد ذکر میشود. هر قدر اندازه مولکولهای گاز کوچکتر باشند، دمای ماکزیمم ثابت قانون هنری هم پایینتر خواهد بود. این مقدارِ بیشینه برای هلیوم ۳۰ درجه، آرگون، نیتروژن و اکسیژن 92-93 درجه و برای زنون 114 درجه سانتیگراد است.

ثابت قانون هنری موثر
ثابتهای هنری که تا اینجا معرفی شدند، هیچکدام تعادل شیمیایی در فاز محلول را لحاظ نمیکنند. به این نوع از ثابتها، ثابتهای فیزیکی یا ذاتی میگویند. به طور مثال، ثابت انحلال قانون هنری ذاتی در فرمالدهید، به صورت زیر تعریف میشود:
در محلولهای آبی، فرمالدهید را میتوان به طور کامل در واکنشهای آبدهی شرکت داد:
غلظت کلی فرمالدهید محلول عبارتست از:
با استفاده از روابط مطرح شده، میتوان «ثابت قانون هنری موثر» (Effective Henry's Law Constant) را به صورت زیر تعریف کرد:
برای اسیدها و بازها، این ثابت، کمیت مفیدی نیست چراکه به pH محلول وابسته است. برای اینکه به یک ثابتی، مستقل از pH دست پیدا کنیم، از حاصلضرب و برای اسیدهایی قوی همچون هیدروکلریک اسید استفاده میکنیم:
با وجود اینکه را نیز با نام ثابت قانون هنری میشناسند، اما کمیتی متفاوت است که واحد آن با نیز تفاوت دارد.
وابستگی قانون هنری به پیوند یونی
مقادیر ثابتهای قانون هنری برای محلولهای آبی، به ترکیب محلول وابسته و در حقیقت، این ثابت، تابعی از قدرت یونی و ذرات محلول است. به طور معمول، انحلالپذیری یک گاز، با افزایش خاصیت «شوری» (Salinity)، کاهش پیدا میکند.
این اثر را به کمک رابطه «ایوان سِچِنو» (Ivan Sechenov) میتوان توضیح داد. تعاریف مختلفی برای توصیف این رابطه بر اساس ترکیب فاز محلول قابل ارائه است اما از میان آنها، بیشتر، از مولالیته بهره میگیرند چراکه مولالیته مستقل از دما عمل میکند و در مقابل اضافه کردن نمک خشک به محلول تغییر نمیکند. بنابراین، این رابطه را میتوان به صورت زیر نوشت:
- : e: ثابت هنری در آب خالص
- : ثابت قانون هنری در محلول نمکی
- : ثابت سچنو بر پایه مولالیته
- : مولالیته نمک

محلولهای غیر ایدهآل
قانون هنری را میتوان در دامنه وسیعی از ذرات حلشونده و در شرایط «رقت بینهایت» (Infinite Dilution) مورد استفاده قرار داد. در این شرایط باید، پتانسیل شیمیایی را در قانون هنری لحاظ کرد. برای حلشوندهای در یک محلول ایدهآل رقیق، پتانسیل شیمیایی، تنها به غلظت وابسته است. در محلولهای غیر ایدهآل، «ضریب فعالیت» (Activity Coefficient) اجزا را نیز باید در نظر گرفت. رابطه پتانسیل شیمیایی به صورت زیر تعریف میشود:
- برای محلول فرار:
در یک محلول غیر ایدهآل، ضریب فعالیت به غلظت وابسته است و باید بر اساس غلظت مورد نظر تعیین شود. همچنین، برای حلشوندههای غیر فرار که در آنها، فشار بخار ماده خالص قابل صرفنظر باشد، ضریب فعالیت را میتوان به کمک «رابطه گیبس-دوهم» (Gibbs–Duhem Equation) نیز محاسبه کرد:
با اندازهگیری تغییرات فشار بخار و به تبع آن تغییرات پتانسیل شیمیایی یک حلال، پتانسیل شیمیایی حلشونده را میتوان بدست آورد. با در نظر گرفتن رفتار رقت بینهایت، حالت استاندارد یک محلول رقیق را نیز می توان تعریف کرد.
حالت استاندارد، یک محلول فرضی با غلظت است که حلشونده، خواصی مانند رقت بینهایت دارد. در این خصوص، تمامی روابط گفته شده را میتوان بر اساس مولالیته بازنویسی کرد:
- برای محلولهای فرار :
قانون هنری در ژئوشیمی
در ژئوشیمی، نوعی از قانون هنری برای انحلالپذیری یک گاز ایدهآل در تماس با سیلیکات مذاب استفاده میشود که رابطه آن به صورت زیر است:
- : غلظت گاز حلشونده در ماده مذاب و فاز گاز
- : پارامتر معکوس دما
- : ثابت بولتزمن
- : پتانسیل شیمیایی اضافی گاز حلشونده در دو فاز
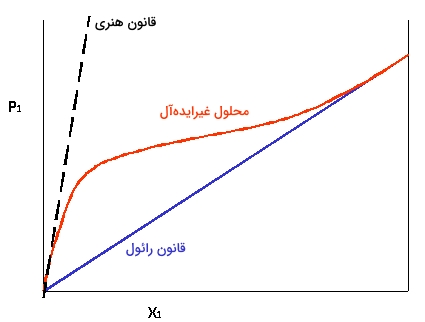
مقایسه قانون هنری و قانون رائول
قانون هنری، قانونی محدود است که در محلولهای رقیق بکار گرفته میشود. درحالیکه قانون رائول در بسیاری از محلولها کاربرد دارد، خاصه زمانی که فاز مایع، خالص یا مخلوطی از مواد مشابه باشد.
هر قدر سیستم از رفتار ایدهآل خود فاصله بگیرد، دامنه غلظتهایی که میتوان در آنها از قانون هنری استفاده کرد، کمتر میشود. به بیان بهتر، در این حالت، حلال، از لحاظ شیمیایی، تفاوت بیشتری نسبت به حلشونده دارد.
برای محلولی رقیق، غلظت یک حلشونده به طور نسبی به کسر مولی وابسته است و قانون هنری را میتوان به صورت زیر نوشت:
این رابطه را میتوان با قانون رائول مقایسه کرد:
در این رابطه، فشار بخار جزء خالص ذکر میشود.
در نگاه اول، قانون رائول، حالت خاصی از قانون هنری است. این نگاه، برای دو ماده شبیه به هم، مانند بنزن و تولوئن صحیح است و در ترکیبات مختلف حاصل از این دو ماده، قانون رائول صدق میکند که به چنین مخلوطهایی، مخلوط ایدهآل میگویند.
در حالت کلی، هرکدام از این قوانین، محدودیتهایی دارند. در حقیقت، زمانی که کسر مولی به سمت ۱ میل کند و غلظت بالایی داشته باشیم، محلول از قانون رائول و زمانی که کسر مولی به صفر میل کند و محلول رقیق باشد، از قانون هنری پیروی میکند. این محدودیتها را میتوان به صورت فرمولی و نموداری نشان داد که در زیر آمدهاند:
- قانون رائول:
- قانون هنری:
حل مثال از قانون هنری
اگر کارخانه نوشابه گازدار، به هنگام پر کردن بطری، از فشار 2/4 اتمسفر استفاده کرده باشد. مقدار جرم (گرم) گاز دیاکسید کربن حلشده در ۱ لیتر آب گازدار را حساب کنید.
دادههای مساله:
زمانی که گاز در مایع حل شود، غلظتها در نهایت به حالتهای تعادلی خود بین منبع گاز و محلول میرسند. قانون هنری نشان میدهد که غلظت یک گاز در محلول، به طور مستقیم به فشار جزئی گاز وابسته است که یعنی:
از آنجایی که یک بطری ۱ لیتری داریم، در نتیجه، 0/08 مول از گاز دیاکسید کربن داریم. در مرحله بعد، باید تعداد مول گاز دیاکسید کربن را به گرم تبدیل کنیم:
: جرم یک مول گاز دیاکسید کربن
جرم گاز حلشده در بطری
کاربرد قانون هنری
همانطور که پیشتر نیز به آن اشاره شد، قانون هنری، تقریبی است که تنها در محلولهای رقیق کاربرد دارد. هر قدر یک سیستم، از حالت ایدهآل فاصله بگیرد، خطای بیشتری در محاسبات با قانون گازها خواهیم داشت. به طور کلی، زمانی قانون هنری به خوبی عمل میکند که حلال و حلشونده به یکدیگر شبیه باشند. از کاربردهای عملی قانون هنری میتوان به تعیین مقدار اکسیژن و نیتروژن حلشده در خون اشاره کرد که این امر برای شناگران حرفهای به هنگام شیرجه از ارتفاع بسیار مهم است.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش ترمودینامیک مهندسی شیمی
- فوگاسیته چیست؟ — به زبان ساده
- استوکیومتری — به زبان ساده
^^













راجع ب گرمای اتصال هم بنویسید سپاس?
با سلام ..خسته نباشد… اگر این متن برای افراد دانشگاهی تهیه شده که احتمالا آنها این مقوله ها را در دانشگاه خوانده اند. واگر برای افرادی تهیه شده که اندک درکی دارند اما میخواهند چیزهایی در مورد حلالیت های گازها بدانند آنقدر مطلب را پیچیده کردید که چیزی عاید آنها نمی شود. بنابراین فکر میکنم نتیجه ی مطلوبی نداشته است
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. در بخشهای ابتدایی این مطلب، مطالب کلی و آسان بیان شده و در ادامه، جزئیات بیشتری مطرح شده است.
با تشکر از همراهی شما با مجله فرادرس
خیلی خوب بود. سپاس از شما
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم.
با تشکر