عدد جرمی چیست؟ – به زبان ساده
عدد جرمی نشاندهنده تعداد پروتونها و الکترونهای یک اتم است. این عدد برای هر اتم مقادیر مشخصی دارد و مقادیر آن در جدول تناوبی عناصر مشخص شده است. از این عدد برای اندازهگیری وزن مولکولی و اتمی مواد و ترکیبات شیمیایی در آزمایشگاه استفاده میشود. در این مطلب از مجله فرادرس با مفهوم عدد جرمی آشنا شده و تفاوت آن را با عدد اتمی میآموزیم.
- میآموزید عدد جرمی چیست و چگونه محاسبه میشود.
- با فرمول عدد جرمی و روش محاسبه تعداد نوترون و پروتون آشنا میشوید.
- نحوه نمایش یک اتم را میآموزید.
- میتوانید علت تغییر جرم در واپاشی پرتوزا را درک کنید.
- تفاوت عدد جرمی و عدد اتمی را درک میکنید.
- با سایر مفاهیم و محاسبات مربوط به عدد جرمی آشنا میشوید.
عدد جرمی چیست؟
عدد جرمی که آنرا با نماد «A» نشان میدهند و به عدد نوکلئون نیز معروف است، به مجموع تعداد پروتونها و نوترونهای هسته یک اتم میگویند. این مقدار به طور تقریبی برابر با جرم اتمی یک اتم یا همان یکای جرم اتمی (amu) است. البته توجه داشته باشید که این عدد برای هر ایزوتوپ یک عنصر با دیگری متفاوت است.
مواقعی پیش میآید که یک دانشآموز یا دانشجو بخواهد برای انجام یک آزمایش در آزمایشگاه شیمی، مادهای شیمیایی را وزن کند. اگر او بخواهد برای این کار طبق روش وزنسنجی از یک شیشه ساعت استفاده کند، باید وزن آن را نیز در نظر بگیرد. سپس، ماده شیمیایی مورد نظر (به صورت پودر جامد) به شیشه ساعت اضافه و وزن هردو توسط ترازوی آزمایشگاهی اندازهگیری میشود. برای آشنایی با نحوه سنجش و محاسبه جرم مواد باید با عدد جرمی و جرم اتمی آشنا بود که مقدار این اعداد به طور معمول در جدول تناوبی مشخص شده است.
تاریخچه اندازهگیری وزن اتمی
در اوایل قرن نوزدهم بود که «جان دالتون» (John Dalton) در بخشی از آزمایشهای خود توانست وزن تعدادی از عناصر را تعیین کند. وزنهای اتمی اساس توسعه جدول مندلیف بود و در حقیقت، تمامی وزنهای اتمی بر اساس مقایسه با وزن اتمی هیدروژن بدست آمده بودند.
بعد از کشف پروتون، در آن زمان دانشمندان فرض کردند که وزن یک اتم برابر با وزن پروتون است و الکترونها نیز نقشی در وزن اتمی یک عنصر ندارند.

عدد جرمی
«ارنست رادرفورد» (Ernest Rutherford) نشان داد که بخش عمده جرم یک اتم در هسته آن متمرکز شده که از پروتون و نوترون تشکیل شده است. عدد جرمی همانطور که گفته شد به صورت مجموع تعداد پروتونها و نوترونها در یک اتم تعریف میشود. به همین دلیل، برای محاسبه این عدد کافی است که تعداد نوترونها را با تعداد پروتونها (عدد اتمی) جمع کنیم.

فرمول عدد جرمی
فرمول محاسبه عدد جرمی نیز به زبان ساده به صورت زیر خواهد بود.
تعداد نوتورنها + عدد اتمی = عدد جرمی
جدول زیر را در نظر بگیرید که در آن، شش عنصر اول جدول تناوبی به همراه عدد اتمی و تعداد پروتون، نوترون و الکترون آنها نشان داده شدهاند.
| نام - عدد اتمی | تعداد پروتون - نوترون - الکترون | عدد جرمی |
| هیدروژن - ۱ | ۱ - ۰ - ۱ | ۱ |
| هلیوم - ۲ | ۲ - ۲ - ۲ | ۴ |
| لیتیوم - ۳ | ۳ - ۴ - ۳ | ۷ |
| بریلیوم - ۴ | ۴ - ۵ - ۴ | ۹ |
| بور - ۵ | ۵ - ۶ - ۵ | ۱۱ |
| کربن - ۶ | ۶ - ۶ -۶ | ۱۲ |
اتم هلیوم را در نظر بگیرید. عدد اتمی آن برابر با ۲ است و بنابراین هسته آن شامل ۲ پروتون خواهد بود. همچنین، در هسته آن ۲ نوترون نیز وجود دارد. بنابراین، مجموع این ۲ عدد برابر با ۴ است. همچنین، این اتم شامل ۲ الکترون هم هست چراکه در یک اتم خنثی، تعداد الکترونها با تعداد پروتونها باید برابر باشند.
با این مثال ممکن است فکر کنید که یک اتم باید همیشه تعداد پروتون و نوترون برابری داشته باشد اما با بررسی و جستجوی بیشتر در میان گروههای جدول تناوبی یا حتی جدول بالا درمییابید که چنین امری صحت ندارد و یک اتم میتواند تعداد پروتون و نوترون متفاوتی داشته باشد. به طور مثال، عنصر لیتیوم شامل ۳ پروتون و چهار نوترون است که عدد جرمی برابر با ۷ را سبب میشود.
فرمول محاسبه تعداد نوترون
با دانستن عدد جرمی و عدد اتمی یک اتم میتوان تعداد نوترونهای یک اتم را به کمک رابطه زیر محاسبه کرد. به زبان سادهتر، برای بدست آوردن تعداد نوترونها باید عدد جرمی را از عدد اتمی کم کنیم.
عدد اتمی - عدد جرمی = تعداد نوترونها
مثال محاسبه تعداد نوترون
اتم کروم با نماد «Cr» را در نظر بگیرید. با نگاهی به جدول تناوبی عناصر میبینیم که عدد اتمی این عنصر برابر با ۲۴ و عدد جرمی آن ۵۲ است. محاسبه کنید که چه تعداد نوترون در هسته اتم کروم وجود دارد؟
برای پاسخ به این سوال میتوانیم از رابطه بالا کمک بگیریم. بنابراین خواهیم داشت:
۲۸ = ۲۴ - ۵۲ = تعداد نوترونها
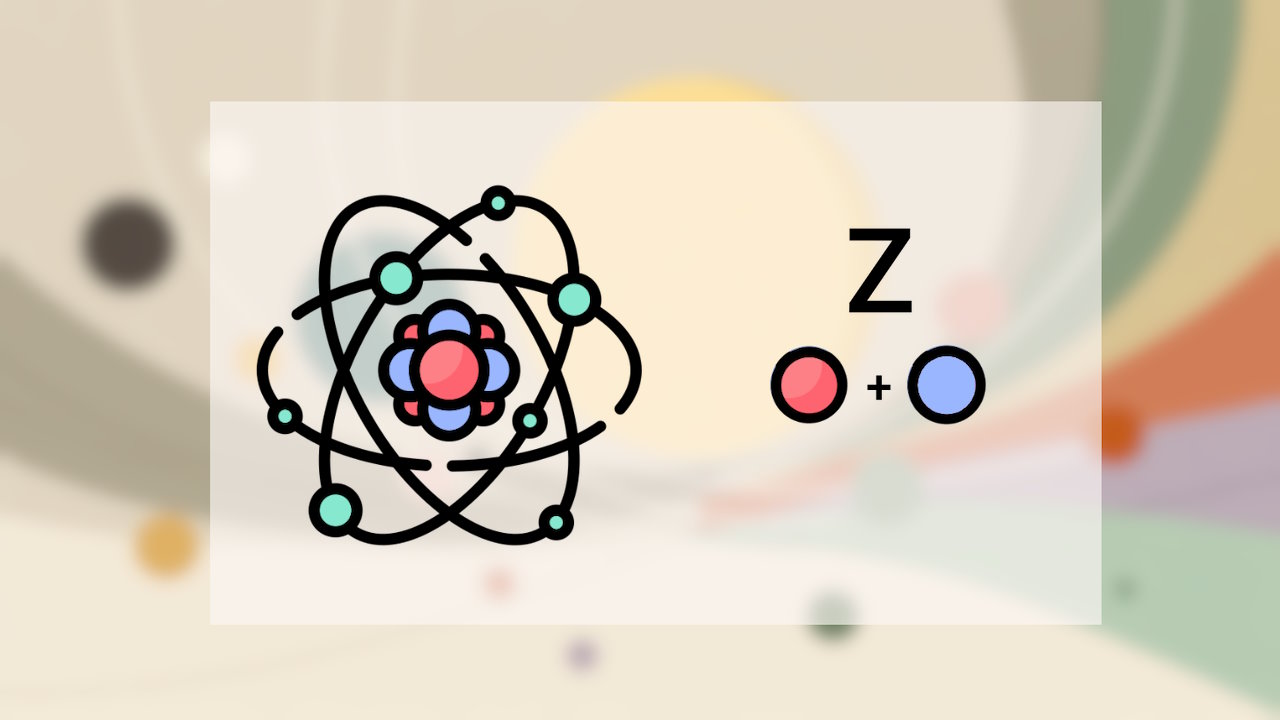
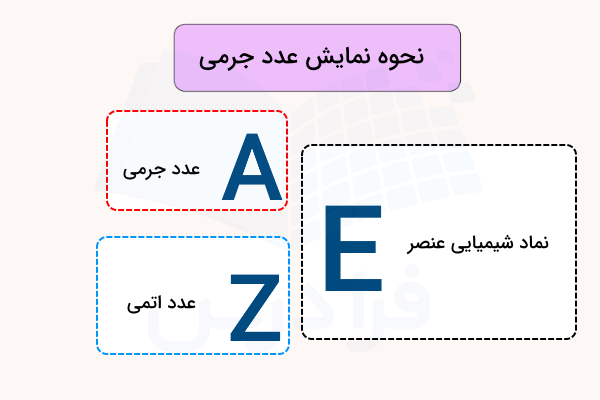
نحوه نمایش یک اتم
هر اتم را میتوان به صورت کوتاه به کمک نماد آن و اعداد اتمی و جرمی نمایش داد. یعنی در حقیقت، اتم به صورت نمایش «AZE» نشان داده میشود که در آن، «A» عدد جرمی، «Z» عدد اتمی و «E» نماد عنصر است. نحوه نمایش اتم را میتوانید در تصویر زیر مشاهده کنید. البته در برخی موارد با توجه به اینکه عدد اتمی را میتوان بر اساس نماد عنصر هم بیان کرد، نیازی به نوشتن عدد اتمی نخواهد بود.
تغییر عدد جرمی در واپاشی پرتوزا
در «واپاشی پرتوزا» (Radioactive Decay) عدد اتمی و عدد جرمی یک عنصر تغییر میکند. به طور مثال، هسته اتم پرتوزا اورانیوم-۲۳۸ توسط واپاشی آلفا، دو نوترون و دو پروتون از دست میدهد. در نتیجه، عدد اتمی و تعداد نوترون آن به میزان ۲ واحد کاهش مییابند. بنابراین، این عدد به میزان ۴ واحد کم میشود. نتیجه این اتفاق در معادله زیر نوشته شده که حاصل آن، توریم-۲۳۴ و ذره آلفا است.
از طرفی دیگر، کربن-۱۴ دچار واپاشی بتا میشود که در آن، یک نوترون به یک پروتون تبدیل و یک الکترون و پاد نوترینو گسیل خواهد شد. در نتیجه، عدد اتمی به میزان ۱ واحد افزایش پیدا میکند اما عدد جرمی ثابت میماند یعنی عدد اتمی برابر با ۷ خواهد شد اما عدد جرمی با وجود کاهش تعداد نوترونها، برابر با ۱۴ باقی میماند. حاصل این اتفاق نیز اتم نیتروژن - ۱۴ با ۷ پروتون و ۷ نوترون است که در معادله زیر مشاهده میکنید.
تفاوت عدد جرمی و جرم اتمی
توجه داشته باشید که عدد اتمی را با جرم اتمی اشتباه نگیرید. عدد جرمی همانطور که گفته شد، مجموع پروتونها و نوترونها در یک اتم است اما جرم اتمی به میانگین تعداد پروتونها و نوترونهای تمامی ایزوتوپهای یک عنصر میگویند که عددی غیرصحیح است. با کشف ایزوتوپهای مختلف عنصرها، جرم اتمی عناصر ممکن است قدری تغییر کند.
معرفی فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی
آنچه که در خصوص مبحث عدد جرمی مطرح شد، از جمله دروس پایهای در مقطع دبیرستان و علوم تجربی پایه هشتم به شمار میآید. به دلیل اهمیت این موضوع، «فرادرس» دورهای آموزشی در مدت زمان ۵ ساعت و در شش درس تهیه کرده است که در ادامه به توضیح این دروس خواهیم پرداخت.
در درس یکم این آموزش با مخلوطها و انواع روشهای جداسازی مواد آشنا میشویم که از جمله دروس مهم آن میتوان به تعاریف محلول، کلوئید، سوپانسیون و همچنین بررسی شناساگرهای اسید و باز و انحلالپذیری مواد اشاره کرد.
درس دوم و سوم به تغییر شیمیایی و تغییر فیزیکی میپردازد که واکنشهای گرماده و گرماگیر، اجزای تشکیلدهنده هوا و واکنش سوختن از جمله مهمترین مباحث آن به شمار میآید و در انتها نیز آنزیمها و کاتالیزورها بررسی میشوند. دروس چهارم، پنجم و ششم به بررسی نظریه اتمی و مدلهای اتم اختصاص دارد که یونها، کاتیون و آنیون و نحوه تشکیل نمک طعام در این دروس آموزش داده میشوند.
جمع بندی
در این مطلب سعی شد با زبانی ساده، عدد جرمی و روابط مربوط به آن توضیح داده شود. در انتها نیز سعی میکنیم به طور خلاصه و کوتاه، این مفهوم را بیان کنیم. عدد جرمی به مجموع تعداد پروتونها و نوترونها در یک اتم میگویند. در نتیجه، برای محاسبه این عدد باید تعداد نوترونها را با عدد اتمی جمع کنیم.
آزمون عدد جرمی
۱. عدد جرمی (A) چیست و چگونه با ساختار هسته اتم ارتباط دارد؟
مجموع تعداد پروتونها و نوترونهای هر اتم را عدد جرمی میگویند.
عدد جرمی برابر با مجموع تعداد پروتونها و الکترونها است.
عدد جرمی همیشه با عدد اتمی برابر است و تغییر نمیکند.
عدد جرمی فقط نشاندهنده تعداد الکترونها در اتم است.
عدد جرمی برابر مجموع تعداد پروتونها و نوترونهای هسته اتم است،
۲. در شیمی، چه تفاوتی میان عدد جرمی (A) و عدد اتمی (Z) وجود دارد و هر یک چه نقشی در ویژگی عناصر دارند؟
عدد جرمی و عدد اتمی همواره برابر هستند و هر دو ویژگی شناسایی عنصر را دارند.
عدد جرمی تعداد کل الکترونها را نمایش میدهد و عدد اتمی مجموع پروتون و نوترون را نشان میدهد.
عدد جرمی نشاندهنده مجموع پروتون و نوترون است و عدد اتمی فقط تعداد پروتون را تعیین میکند.
عدد جرمی تنها برای ایزوتوپها کاربرد دارد، عدد اتمی فقط در ترکیبات.
«عدد جرمی» معیاری است که از جمع تعداد پروتونها و نوترونهای هسته اتم به دست میآید و ویژگی مهم برای تشخیص ایزوتوپهاست، در حالی که «عدد اتمی» فقط بیانگر تعداد پروتونهای هسته است و عنصر را مشخص میکند.
۳. در فرآیند واپاشی آلفا برای یک اتم، چه تغییری در عدد جرمی (A) و عدد اتمی (Z) رخ میدهد؟
عدد جرمی ۴ واحد کم، عدد اتمی ۲ واحد کم میشود.
عدد جرمی ثابت میماند، عدد اتمی ۱ واحد زیاد میشود.
عدد جرمی ۲ واحد زیاد، عدد اتمی ۲ واحد کم میشود.
عدد جرمی ۱ واحد کم، عدد اتمی ثابت میماند.
در واپاشی آلفا، هسته اتم دو پروتون و دو نوترون را از دست میدهد و به همین دلیل «عدد جرمی ۴ واحد کم، عدد اتمی ۲ واحد کم میشود.» این تغییر مطابق توضیحات مثال اورانیوم و توریم در متن است.













سلام تعداد پروتون ها در اتمی نصف عدد جرمی می باشد اگر تعداد نوترون از عدد اتمی 4 تا بیشتر باشد عنصر 20x چه تعداد پروتون دارد ؟
میشه به این سوالم جواب بدین ممنون میشم