شعاع کووالانسی چیست؟ — به زبان ساده

شعاع کووالانسی که آنرا با $$r _ {cov}$$ نشان میدهند، معیاری برای سنجش اندازه اتمی است که بخشی از یک پیوند کووالانسی را تشکیل میدهد. این شعاع را به طور معمول بر اساس پیکومتر یا آنگستروم اندازهگیری میکنند. به لحاظ نظری، مجموع دو شعاع کووالانسی باید با طول پیوند کووالانسی بین دو اتم برابر باشد اما در عمل، طول پیوند به محیط شیمیایی نیز وابسته است. نمودارهایی نیز برای این شعاع در پیوندهای یگانه، دوگانه و سهگانه ارائه شده است. شعاع کووالانسی را به طور معمول برابر با نصف طول پیوند کوولانسی یگانه در نظر میگیرند. به عبارت دیگر، میتوان آنرا به صورت نیمی از فاصله بین مراکز هسته دو اتم مشابه در پیوند کووالانسی یگانه ذکر کرد.
شعاع کووالانسی در پیوندهای چندگانه
همانطور که گفته شد، به لحاظ نظری، مجموع دو شعاع باید با طول پیوند کووالانسی بین دو اتم، برابر باشد.
$$\begin{equation}
R(\mathrm{AB})=r(\mathrm{~A})+r(\mathrm{~B})
\end{equation}$$
علاوه بر این، شعاعهای مختلفی را میتوان برای پیوندهای یگانه و چندگانه در نظر گرفت و بنابراین، چنین روابطی را نمیتوان به شکل دقیق برای این شعاع ذکر کرد چراکه محیط شیمیایی نیز در این رابطه دخیل است. برای هترواتمهایی با پیوندهای یگانه، صورتهای یونی نیز در نظر گرفته میشوند. به طور معمول، پیوندهای کووالانسی قطبی کوتاهتری نسبت به مجموع دو شعاع کووالانسی دارند. مقادیر این شعاع که در جداول ارائه میشوند نیز معمولا مقادیر متوسط هستند.
طول پیوندها به کمک پراش اشعه ایکس اندازهگیری میشود. از روشهای طیفسنجی نیز برای اندازهگیری طول پیوندها بهره میگیرند. برای مولکولهای جورهسته، این شعاع توسط «لینوس پاولینگ» (Linus Pauling) برابر با نصف طول پیوند یگانه تعریف شد. البته در عمل این امکان وجود دارد که با وجود اختلاف کم، مقادیر متوسط طول پیوند را از ترکیبات کووالانسی مختلف بدست آورد.

شعاع کووالانسی و شعاع اتمی
روشهای دیگری برای اندازهگیری اندازه اتمها وجود دارد که همگی، تخمینی از شعاع اتمی هستند. با این وجود، دادههای جداول شعاعهای اتمی بیانگر فاصله بین مراکز هسته اتمهایی است که با یکدیگر پیوند دارند. به عبارت دیگر، داشتن پیوند در اینجا به این معنی است که خارجیترین لایه الکترونی در هر دو اتم با یکدیگر در تماس هستند و در این شرایط، اوربیتالهای مولکولی نیز ممکن است در نظر گرفته شوند.
روش دیگر اندازهگیری اندازه اتم، شعاع یونی است. شعاع یونی به نیمی از فاصله بین اتمهادر یک شبکه بلوری میگویند که پیوندی یونی را تشکیل دادهاند. شعاع کووالانسی و شعاع یونی ممکن است بزرگتر یا کوچکتر از شعاع اتمی در اتم یک عنصر باشند. به طور کلی، شعاع اتمی از یک روند تناوبی در جدول تناوبی پیروی میکند که در هر گروه از بالا به پایین، افزایش و در هر تناوب از چپ به راست کاهش مییابد.
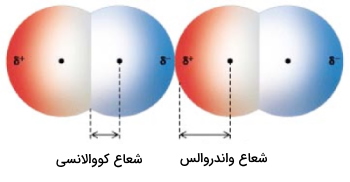
تفاوت شعاع کووالانسی و واندروالس چیست؟
شعاع واندروالس $$(r_w)$$ یک اتم به اندازه اتمی میگویند که به صورت شیمیایی پیوند تشکیل نداده باشد، به این حالت «نیروی واندروالسی» یا «پیوند واندروالسی» گفته میشود.
به طور کلی، شعاع واندروالس را برابر با فاصله دو اتم مشابه میگویند که در نزدیکترین فاصله با یکدیگر قرار داشته باشند اما پیوند کووالانسی بین آنها برقرار نشده باشد. به طور مثال، بلوری شامل مولکولهای $$Cl_2$$ را در نظر بگیرید. شعاع واندروالس در اینجا برابر با نیمی از فاصله دو اتم مجاور کلر است. این شعاع به طور معمول بزرگتر از شعاع کووالانسی است که در آن، دو اتم کلر در مولکول $$Cl_2$$ در کنار یکدیگر قرار گرفتهاند.
مثال محاسبه شعاع کووالانسی
شعاع کووالانسی را در مولکولهای دواتمی میتوان به شکلهای جورهسته و ناجورهسته محاسبه کرد. در ادامه مثالهایی برای محاسبه این شعاع ارائه میشود.
مثال شعاع کووالانسی مولکول جورهسته
زمانی که مولکول دواتمی جورهسته مانند $$F_2$$ و $$Cl_2$$ - به صورت $$A_2$$ - داشته باشیم، طول پیوند $$(\mathrm{d}(\mathrm{A}-mathrm{A}))$$ به شکل زیر محاسبه میشود.
$$\begin{equation}
\begin{array}{l}
\mathrm{d}(\mathrm{A}-mathrm{A})=\mathrm{r}(\mathrm{A})+mathrm{r}(\mathrm{A}) \
\mathrm{d}(\mathrm{A}-mathrm{A})=2 \times (\mathrm{A}) \
\mathrm{r}(\mathrm{A})=\mathrm{d}(\mathrm{A}-mathrm{A}) / 2
\end{array}
\end{equation}$$
رابطه بالا بیان میکند زمانیکه مولکولی دو اتمی داشته باشیم، شعاع کووالانسی یک اتم برابر با نیمی از فاصله بین هستهای در مولکول است. به طور مثال، در مولکول دواتمی کلر، فاصله پیوندی دو اتم کلر در برخی منابع برابر با 198 پیکومتر ذکر میشود. در نتیجه، شعاع کووالانسی اتم کلر را میتوان نصف این مقدار یعنی ۹۹ پیکومتر ذکر کرد.
مثال شعاع کووالانسی مولکول ناجورهسته
زمانی که مولکول ناجورهسته به شکل $$AB$$ داشته باشیم، طول پیوند $$(\mathrm{d}(\mathrm{A}-mathrm{B}))$$ با رابطه زیر یعنی مجموع شعاعهای کووالانسی اتمهای A و B تعریف میشود. به طور مثال، در مولکول $$CCl_4$$ مقدار $$\mathrm{d}(\mathrm{C}-mathrm{Cl})$$ برابر با ۱۷۶ پیکومتر ذکر شده است. بنابراین خواهیم داشت:
$$\begin{equation}
\begin{array}{l}
\mathrm{d}(\mathrm{C}-mathrm{Cl})=\mathrm{r}(\mathrm{C})+mathrm{r}(\mathrm{Cl}) \
\mathrm{r}(\mathrm{C})=\mathrm{d}(\mathrm{C}-mathrm{Cl})-mathrm{r}(\mathrm{Cl}) \
=176-mathrm{r}(\mathrm{Cl})
\end{array}
\end{equation}$$
بنابراین، شعاع کووالانسی اتم کربن را میتوان از کم کردن شعاع کووالانسی اتم کلر از طول پیوند کربن-کلر محاسبه کرد. همچنین اگر شعاع کووالانسی اتم کربن را نیز داشته باشیم، این شعاع در اتم کلر را نیز به طور مشابه میتوان محاسبه کرد.











پس یعنی فرق شعاع واندروانسی و کوالانسی این شد که کوالانسی برای دو اتم که پیوند شیمیایی دادن ولی واندروانسی برای اونایی که هیچ پیوندی ندارند ولی نزدیک همند؟ تعریف درستش چیه؟ فهمیدم تقریباً چیه ولی تعریف چی باید بنویسیم تو امتحان ؟
سلام به شما و روز بهخیر؛
بله، کاملا درست متوجه شدید. در واقع آنچه به عنوان پیوند واندروالسی شناخته میشود، نیروی برهمکنش بینمولکولی است که هیچگونه پیوندی طی آن تشکیل نمیشود. استفاده از واژه «پیوند» به جای «نیرو» غلطی مصطلح در مورد این برهمکنش بینمولکولی ضعیف است.
مقدار شعاع کووالانسی معمولا نسبت به مقدار شعاع واندورالسی کمتر است زیرا در این مورد پیوندی تشکیل خواهد شد که میتواند باعث کاهش شعاع شود.
البته توجه داشته باشید که برای پاسخگویی در امتحان مهمترین منبع کتاب درسی و تعریفی است که استاد مربوطه ارائه دادهاند.
موفق باشید و خوشحالیم که با مجله فرادرس همراه هستید.
سلام
یک سوال دارم
اگه فاصله دو اتم از شعاع واندوالس بیشتر باشه، نیروی واندوالس از جنس جاذبه هستش یا دافعه؟
خیلی ممنون
سلام و روز شما بهخیر؛
اگر فاصله دو اتم از شعاع واندروالسی بیشتر باشد، نیروی واندوالسی بین آن دو اتم از نوع جاذبه خواهد بود. این نیروی جاذبه در جهت جبران این فاصله است.
همچنین در صورتی که فاصله دو اتم از شعاع واندوالسی کمتر باشد، باز برای ایجاد تعادل، نیروی واندوالسی از نوع دافعه خواهد بود.
خوشحالیم که با مجله فرادرس همراه هستید.