روش های تعیین فرمول مولکولی و فرمول تجربی – از صفر تا صد
با داشتن فرمول شیمیایی یک ماده میتوانیم مقدار یک ماده بر حسب مول را به کمک جرم آن حساب کنیم. این فرآیندها را به خوبی در بحث استوکیومتری مورد بررسی قرار دادیم. اما اگر فرمول شیمیایی یک ماده را نداشته باشیم، این محاسبات چگونه انجام میشوند؟ در این بخش قصد داریم تا از طریق اصولی ساده و به کمک سنجشهای آزمایشگاهی، به روشهای تعیین فرمول مولکولی و فرمول تجربی مواد بپردازیم.


ترکیب درصد
آرایش عنصری یک ترکیب، ماهیت شیمیایی آنرا مشخص میکند و فرمول مولکولی سادهترین راه برای نمایش این آرایش عنصری به شمار میآید. زمانیکه فرمول شیمیایی یک ترکیب مشخص نباشد، در اولین مرحله از فرآیند تعیین فرمول مولکولی به صورت آزمایشگاهی باید جرم هر جزء را اندازهگیری کنیم.
نتایج این سنجشها، محاسبات ترکیب درصد را شامل میشوند. به طور مثال، یک ترکیب گازی شامل کربن و هیدروژن را در نظر بگیرید. ترکیب درصد این ماده را میتوان به صورت جرم تقسیم بر جرم ترکیب (Mass Compound) ضربدر 100 بیان کرد.
$$\mathrm{%H=\dfrac{mass\: H}{mass\: compound}times100%}$$
$$\mathrm {%C = \dfrac {mass\: C} {mass\: compound} times100%}$$
اگر آنالیز ۱۰ گرم نمونه از این گاز نشان داده باشد که حاوی 2/5 گرم هیدروژن و 7/5 گرم کربن است، ترکیب درصد به صور ۲۵ درصد هیدروژن و ۷۵ درصد کربن محاسبه میشود:
$$\begin {equation} \begin {array} {l} % \mathrm {H} = \frac{2.5 \mathrm {g} \mathrm {H}} {10.0 \mathrm {g} \text { compound }} \times 100 %=25 % \ % \mathrm {C } = \frac{7.5 \mathrm { g } \mathrm {C } } {10.0 \mathrm { g} \text { compound }} \times 100 %=75 % \end {array} \end {equation}$$
مثال محاسبه ترکیب درصد جرمی
آنالیز 12/04 گرم از یک نمونه مایع شامل کربن، هیدروژن و نیتروژن نشان داد که این ترکیب به ترتیب شامل 7/34 گرم کربن، 1/85 گرم اکسیژن و 2/85 گرم نیتروژن است. ترکیب درصد را برای این مایع محاسبه کنید.
برای محاسبه ترکیب درصد، جرم بدست آمده هر عنصر را بر جرم کلی تقسیم و در نهایت، آنرا به درصد تبدیل میکنیم:
$$\begin {equation} \begin {array} {l} % \mathrm {C}= \frac{7.34 \mathrm {g} \mathrm {C}} {12.04 \mathrm {g} \text { compound }} \times 100 %= 61.0 % \ % \mathrm {H} =\frac {1.85 \mathrm{ g} \mathrm {H} } {12.04 \mathrm {g} \text { compound }} \times 100 %= 15.4 % \ % \mathrm {N}= \frac{2.85 \mathrm {g} \mathrm {N}} {12.04 \mathrm {g} \text { compound }} \times 100 %=23.7 % \end {array} \end {equation} $$
محاسبه ترکیب درصد به کمک جرم مولی
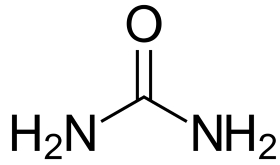
ترکیب درصد همچنین، روش مطمئنی برای پیدا کردن فراوانی نسبی یک عنصر در ترکیبات با فرمولهای مختلف است. به طور مثال، یک کود معمول با ترکیباتی همچون آمونیاک ، آمونیوم نیترات و اوره را در نظر بگیرید. عنصر نیتروژن، از اجزای فعال در کشاورزی به شمار میآید. در نتیجه، درصد جرمی نیتروژن در یک ترکیب، از جمله موضوعات مهم کاربردی و اقتصادی در زمان انتخاب کود به شمار میآید.
ترکیب درصد این ترکیبات را به راحتی و به کمک جرم مولی و «جرم فرمولی» (Formula Mass) میتوان محاسبه کرد. یک مولکول آمونیاک شامل یک اتم نیتروژن با وزن و ۳ اتم هیدروژن با وزن است. جرم فرمولی (معادل جرم مولی) آمونیاک را میتوان به کمک رابطه زیر محاسبه کرد:
ترکیب درصد نیز از طریق رابطه زیر محاسبه خواهد شد:
$$\mathrm {%N= \dfrac {14.01\:a m u\: N }{17.03\:a m u\:N H _3} times100% = 82.27%}$$
$$\mathrm { %H= \dfrac{3.024\: a m u\: N }{17.03\:amu\:N H _ 3 }times100%= 17.76%}$$
از این روش میتوان برای در نظر گرفتن یک جفت مولکول، یک دوجین مولکول یا یک مول مولکول استفاده کرد. بهرهگیری از مول، بسیار سادهتر خواهد بود و به سادگی میتوان به جای کمک گرفتن از جرم اتمی (همچون مثال بالا)، از جرم مولی استفاده کرد که این مورد را در مثال زیر، بررسی خواهیم کرد. اگر فرمول شیمیایی مادهای را در سوال داشته باشیم، به سادگی میتوانیم از طریق جرم مولی یا جرم اتمی، ترکیب درصد آنرا محاسبه کنیم.
مثال تعیین ترکیب درصد به کمک فرمول مولکولی
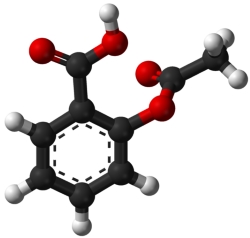
آسپیرین، ترکیبی با فرمول مولکولی است. ترکیب درصد آنرا حساب کنید.
برای محاسبه ترکیب درصد، باید در جرم مشخصی از آسپیرین، جرمهای کربن، هیدروژن و اکسیژن را داشته باشیم. برای سادگی کار، ۱ مول آسپیرین را در نظر میگیریم و برای محاسبه ترکیب درصد هر عنصر، از جرم مولی آسپیرین استفاده میکنیم.
$$\begin{equation}% \mathrm {C} =\frac{9 \mathrm {mol} \mathrm {C} \times \text { molar mass } \mathrm {C}}{\text { molar } \mathrm {mass} \mathrm {C} _{9} \mathrm {H}_{18} \mathrm {O}_{4}} \times 100=\frac{9 \times 12.01 \mathrm {g} / \mathrm {mol}} {180.159 \mathrm {g} / \mathrm {mol} } \times 100 \end {equation}$$
$$\begin{equation}% \mathrm {C} =60.00 % \end {equation}$$
$$\begin{equation}% \mathrm{ H } =\frac{8 \mathrm{ mol} \mathrm {H} \times \text { molar mass } \mathrm {H}}{ \text { molar mass } \mathrm {C}_{9} \mathrm {H}_{18} \mathrm {O}_{4}} \times 100=\frac {8 \times 1.008 \mathrm {g} / \mathrm {mol}} {180.159 \mathrm {g} / \mathrm {mol} } times100 \end{equation}$$
$$\begin{equation}% \mathrm {H} =4.476 % \end {equation}$$
$$\begin {equation} % \mathrm{O}=\frac{4 \mathrm{mol} \mathrm{O} \times \operatorname{molar} \operatorname{mass} \mathrm{O}}{\operatorname{molar} \mathrm{mass} \mathrm{C}_{9} \mathrm{H}_{18} \mathrm{O}_{4}} \times 100=\frac{4 \times 16.00 \mathrm{g} / \mathrm{mol}}{180.159 \mathrm{g} / \mathrm{mol} } \times 100 \end {equation}$$
$$\begin{equation}% \mathrm {O} =35.52 % \end {equation}$$
تعیین فرمول تجربی
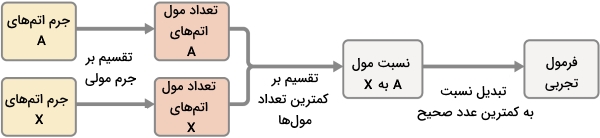
همانطور که پیشتر ذکر شد، معمولترین روش برای تعیین فرمول مولکولی یک ماده این است که در ابتدا، وزن اجزای سازنده آن اندازهگیری شوند. با این وجود باید به این نکته توجه کنیم که فرمولهای شیمیایی، بیانگر اعداد نسبی عناصر هستند و نه جرم اتمهای ماده. بنابراین، هر داده آزمایشگاهی بدست آمده شامل جرم باید جهت محاسبه اعداد متناظر اتمها در ترکیب بکار گرفته شود. به همین منظور، میتوان از جرمهای مولی برای تبدیل جرم هر عنصر به تعداد مول استفاده کرد.
در ادامه نیز تعداد مول هر عنصر نسبت به یکدیگر را در نظر میگیریم. اعداد بدست آمده را به عدد صحیح تبدیل میکنیم تا فرمول تجربی ماده بدست بیاید. نمونهای از یک ترکیب را در نظر بگیرید که حاوی 1/71 گرم کربن و 0/287 گرم هیدروژن باشد. تعداد مولهای متناظر با این جرمها را به صورت زیر حساب میکنیم:
فرمول این ترکیب را به طور دقیق میتوانیم به شکل زیر بیان کنیم:
البته با تقسیم هر زیروند اعداد بالا به کوچکترین عدد و گرد کردن آن، به فرمول تجربی زیر خواهیم رسید:
فرمول تجربی برای این ترکیب، است. این فرمول تجربی امکان دارد فرمول مولکولی ترکیب مورد نظر نباشد. با این وجود، به اطلاعات بیشتری برای تعیین فرمول مولکولی نیاز داریم که در ادامه این متن به بررسی آن خواهیم پرداخت.
مثال دیگری را در نظر بگیرید که در آن، نمونهای از یک ترکیب شامل 5/31 گرم کلر و 8/40 گرم اکسیژن باشد. با استفاده از روش بالا، به فرمول تجربی زیر رسیدیم:
تحت این شرایط، تقسیم کردن زیروندها به کوچکترین عدد نیز در نهایت یک عدد صحیح بدست نمیدهد. برای تبدیل این عدد به عدد صحیح، باید هرکدام از زیروندها را در عدد ۲ ضرب کنیم و به فرمول تجربی برسیم. در زیر، روند کلی برای بدست آوردن فرمول مولکولی را ارائه می دهیم:
روش تعیین فرمول تجربی
به طور خلاصه، فرمولهای تجربی از سنجشهای آزمایشگاهی مواد بدست میآیند که روش تعیین آنها به صورت زیر است:
- تعداد مول هر عنصر را از طریق جرم آن محاسبه کنید.
- مقدار مول بدست آمده را بر کمترین مقدار تقسیم کنید.
- درصورتیکه زیروندها، یک عدد صحیح بدست نداد، همه آنها را در ضریبی مناسب ضرب کنید تا کوچکترین نسبت صحیح بین زیروندها بدست آید.
در تصویر زیر، فلوچارت روش تعیین فرمول مولکولی آورده شده است:
مثال تعیین فرمول تجربی به کمک جرم عناصر
نمونهای از یک ماده معدنی موسوم به هماتیت (اکسید آهن) که در بسیاری از سنگ معدنها یافت میشود حاوی 34/97 گرم آهن و 15/03 گرم اکسیژن است. فرمول تجربی هماتیت را محاسبه کنید.
در این سوال، جرم تمامی عنصر را به گرم داریم. کار خود را با تبدیل این جرمها به مول آغاز میکنیم:
در ادامه، نسبت مولی آهن به اکسیژن را با تقسیم کردن مولها به کوچکترین عدد حاصل بدست میآوریم.
نسبت به دست آمده به صورت ۱ مول آهن به ۱/۵ مول اکسیژن است. در نهایت، با ضرب کردن این نسبت در عدد ۲، به کوچکترین نسبت صحیح بین آهن و اکسیژن میرسیم:
در نتیجه، فرمول تجربی به صورت خواهد بود.

تعیین فرمول تجربی به کمک ترکیب درصد
یکی دیگر از راههای تعیین فرمول تجربی، بکارگیری ترکیب درصد در محاسبات است. شرایطی را در نظر بگیرید که در آن، به جای جرمهای مطلق عناصر، ترکیب درصد آنها را داشته باشیم. در چنین شرایطی، به کمک ترکیب درصد میتوانیم جرم عناصر در یک ترکیب را محاسبه کنیم. در نهایت، به کمک جرمهای محاسبه شده، فرمول تجربی از طریق فلوچارت بالا بدست خواهد آمد.
مثال تعیین فرمول مولکولی به کمک ترکیب درصد
در یک فرآیند، گازی با ترکیب درصد 27/29 درصد کربن و 72/71 درصد اکسیژن به تولید میرسد. فرمول تجربی گاز را محاسبه کنید.
برای سادگی، بهتر است محاسبات را بر اساس ۱۰۰ گرم نمونه انجام دهیم چراکه بر این اساس، هر ترکیب درصدی از نمونه داشته باشیم، به همان میزان جرم آن بر حسب گرم خواهد بود. با این تعریف، ترکیب درصد داده شده را میتوان بر اساس جرم تعیین و به صورت ضریب تبدیل ارائه کرد.
$$\begin{align*} 27.29\,%\, C&\;=\mathrm{\dfrac{27.29\:g\: C}{100\:g\: compound}} \nonumber \ \nonumber \ 72.71\,%\, O&\;=\mathrm{\dfrac{72.71\:g\: O}{100\:g\: compound}} \nonumber \end{align*}$$
با تقسیم جرم هر عنصر به جرم مولی، تعداد مول کربن و هیدروژن را در 100 گرم نمونه بدست میآوریم.
همانند مثال قبل نیز، تعداد مول محاسبه شده را بر کمترین عدد تقسیم میکنیم:
تعیین فرمول مولکولی
به یاد دارید که فرمول تجربی شامل اعداد نسبی عناصر در یک ترکیب بود. تعیین تعداد دقیق اتمهای یک ترکیب یا یک مولکول نیازمند داشتن فرمول تجربی و جرم مولی یا مولکولی ترکیب است. این کمیات را میتوان به کمک روشهای مختلف آزمایشگاهی بدست آورد. به طور مثال، جرم مولکولی را به کمک طیفسنجی جرمی ترکیب بدست میآورند. جرم مولی نیز به کمک سایر روشهای آزمایشگاهی قابل محاسبه خواهد بود.
فرمول مولکولی را به کمک مقایسه جرم مولی یا جرم مولکولی ترکیب با جرم فرمول تجربی آن تعیین میکنند. همانطور که از نام آن مشخص است، جرم فرمول تجربی شامل مجموع متوسط جرمهای اتمی تمامی اتمهای موجود در فرمول تجربی خواهد بود. اگر جرم مولی یا جرم مولکولی ماده را داشته باشیم، با تقسیم آن بر جرم فرمول مولکولی، تعداد «واحد فرمولی تجربی» (Empirical Formula Unit) به ازای هر مولکول، بدست میآید که آنرا با n نشان میدهیم.
در ادامه، با ضرب کردن هر زیروند فرمول تجربی در عدد ، فرمول مولکولی بدست میآید:
به طور مثال، ترکیبی کووالانسی را در نظر بگیرید که فرمول مولکولی آن به صورت تعیین شده باشد. جرم فرمول تجربی برای این ترکیب به طور تقریبی برابر با است (مجموع برای یک اتم کربن، برای اتمهای هیدروژن و برای یک اتم اکسیژن). اگر جرم مولکولی ترکیب، برابر با تعیین شده باشد، نشان میدهد که تعداد اتمهای مولکولهای ترکیب، ۶ برابر بیشتر از تعداد اتمها در فرمول تجربی هستند:
در نهایت، با ضرب کردن ضریب بدست آمده در فرمول تجربی، فرمول مولکولی ترکیب را بدست میآوریم:
از آنجایی که میتوان جرم مولکولی (amu) را با جرم مولی (g/mol) برابر دانست، در نتیجه، اگر جرم مولی عناصر را داشته باشیم نیز میتوانیم از همین روش جهت تعیین فرمول مولکولی استفاده کنیم. در این شرایط، میزان ۱ مول از فرمول مولکولی را به جای تعداد مولکولها و واحد فرمولی در نظر میگیریم.
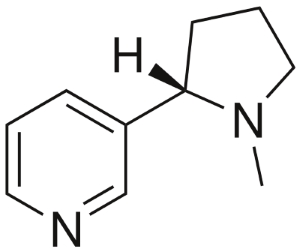
مثال برای تعیین فرمول مولکولی نیکوتین
نیکوتین به عنوان ماده اعتیاد آور در سیگار به شمار میآید و شامل 74/02 درصد کربن، 8/710 درصد هیدروژن و 17/27 درصد نیتروژن است. اگر 40/57 گرم از نیکوتین شامل 0/2500 مول نیکوتین باشد، فرمول مولکولی نیکوتین را محاسبه کنید.
تعیین فرمول مولکولی به کمک اطلاعات داده شده نیازمند مقایسه جرم فرمول مولکولی ترکیب با جرم مولی آن است. در مرحله اول، از ترکیب درصد به منظور بدست آوردن فرمول تجربی ترکیب استفاده و برای سادگی کار نیز فرض کنید ۱۰۰ گرم نیکوتین، مقادیر مولی زیر را نتیجه میدهد:
$$\begin{alignat}{2} &\; \mathrm {(74.02\:g\: C) \left ( \dfrac {1\:mol\: C} {12.01\:g\: C} \right)}&\;&\;= \: \mathrm {6.163\:mol\: C }\ &\; \mathrm{ (8.710\:g\: H) \left ( \dfrac {1\:mol\: H} {1.01\:g\: H } \right )}&\;&\;= \:mathrm {8.624\:mol\: H }\ &\; \mathrm {(17.27\:g\: N) \left (\dfrac {1\:mol\: N} {14.01\:g\: N} \right) } &\;&\;= \:mathrm {1.233\:mol\: N} \end {alignat}$$
در ادامه، نسبتهای مولی این عناصر را نسبت به عنصر با کمترین فراوانی یعنی نیتروژن محاسبه میکنیم:
نسبتهای کربن به نیتروژن و هیدروژن به نیتروژن، بسیار به عدد صحیح نزدیک هستند و درنتیجه، فرمول تجربی برابر با خواهد بود. جرم فرمول تجربی برای این ترکیب نیز برابر با خواهد بود. جرم مولی نیکوتین را نیز به کمک جرم داده شده و مقدار مولی ترکیب محاسبه خواهیم کرد.
مقایسه جرم مولی و فرمول تجربی نشان میدهد که هر مولکول نیکوتین شامل دو واحد فرمولی است:
در نتیجه، برای بدست آوردن فرمول مولکولی نیکوتین به کمک فرمول تجربی باید تعداد اتمهای فرمول مولکولی را در عدد ۲ ضرب کنیم.
جمعبندی
ماهیت شیمیایی یک ماده را به کمک نوع و تعداد نسبی اتمهای تشکیل دهنده آن ترکیب تعیین میکنند. در حقیقت، این ترکیب میتواند شامل ترکیبات کووالانسی یا یونی باشد که به ترتیب توسط مولکولها و یونها مشخص میشوند. در این آموزش، در ابتدا با مفهوم ترکیب درصد آشنا شدیم و یاد گرفتیم که ترکیب درصد، درصد جرمی هر عنصر را در ترکیب به ما نشان میدهد و به طور معمول از روشهای آزمایشگاهی بدست میآید و از آن بمنظور بدست آوردن فرمول مولکولی استفاده کردیم. همچنین، یاد گرفتیم که از مقایسه جرم فرمول تجربی با جرم مولی یا مولکولی ترکیب برای تعیین فرمول مولکولی بهره میگیرند.












