انرژی شبکه – به زبان ساده
جامدات یونی، ترکیبات بسیار پایداری هستند. آنتالپی تشکیل مولکلولهای یونی را نمیتوان به تنهایی عامل چنین پایداری دانست. این پایداری، به دلیل وجود انرژی شبکه در ساختار یک جامد است. البته این انرژی به طور مستقیم قابل اندازهگیری نیست. انرژی شبکه یک بلور جامد، معیاری برای سنجش انرژی آزاد شده به هنگام برهمکنش یونها برای تشکیل یک ترکیب به شمار میآید. به عبارت دیگر، انرژی شبکه را به عنوان نیروهایی ذکر میکنند که یونها را در کنار یکدیگر نگه میدارند و آنرا معمولا با چرخه بورن-هابر تعریف میکنند. به کمک «چرخه بورن-هابر» (Born-Haber Cycle) میتوان انرژی شبکه را درک و آنرا در جامدات یونی مشخص کرد.
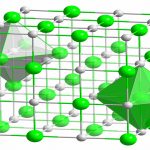
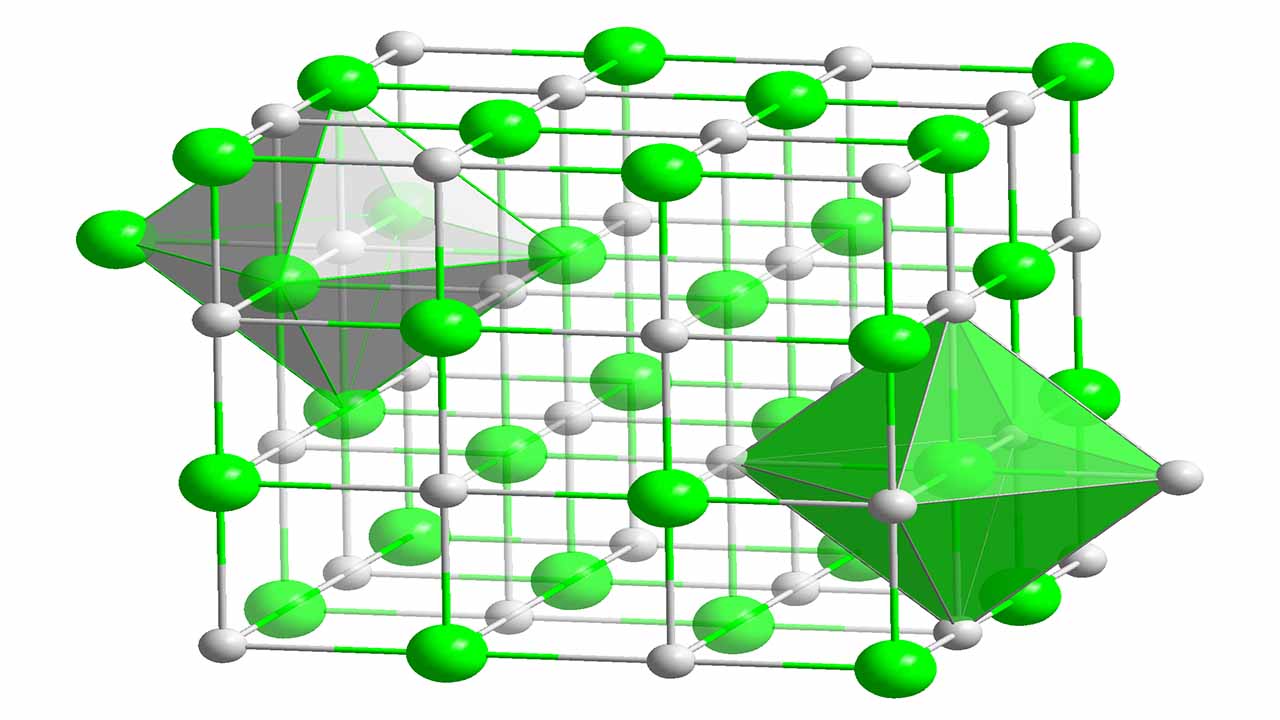
مقدمهای بر انرژی شبکه
انرژی شبکه نوعی از انرژی پتانسیل است که به دو صورت تعریف میشود. در یک تعریف، انرژی شبکه، انرژی مورد نیاز برای شکستن یک جامد یونی و تبدیل اتمهای اجزای آن به یونهای گازی است. این تعریف سبب میشود تا مقدار انرژی شبکه همواره عددی مثبت باشد چراکه چنین فرآیندی، گرماگیر خواهد بود. در تعریف دیگر و در فرآیندی معکوس، انرژی شبکه به انرژی آزاد شده به هنگام برهمکنش یونهای گازی برای تشکیل یک جامد گازی میگویند. در تعریف دوم، چنین فرآیندی، گرماده خواهد بود و بنابراین، مقدار انرژی شبکه عددی منفی است. مقدار این انرژی را با واحد بیان میکنند.
از انرژی شبکه در توضیح پایداری جامدات یونی بهره میگیرند. ممکن است این فرض وجود داشته باشد که یک جامد یونی با توجه به ساختار منظم و به دنبال آن، آنتروپی (بینظمی) پایین، پایداری کمی دارد. ساختار بلوری این جامد سبب میشود تا هر یون با چندین یون ناهمنام، برهمکنش داشته باشد که تغییرات آنتالپی شدیدی را در یک سیستم به همراه دارد. در حقیقت، به هنگام برهمکنش این یونهای ناهمنام، انرژی بسیار زیادی آزاد میشود. به همین دلیل، جامدات یونی، نقطه ذوب و جوش بالایی دارند. در برخی موارد این نقاط به قدری بالا هستند که قبل از رسیدن جامد به آن دما، تجزیه میشوند.
چرخه بورن-هابر و تعاریف اولیه
مفاهیم مهمی را باید قبل از بیان چرخه بورن-هابر بیان کنیم که به کمک آنها بتوان انرژی شبکه یک جامد یونی را توصیف کرد. این مفاهیم عبارتند از:
- انرژی یونش: انرژی مورد نیاز برای حذف یک الکترون از یک اتم یا یون خنثی را انرژی یونش گویند. این فرآیند همواره نیاز به اعمال یک انرژی دارد و در نتیجه، مقدار آن همواره عددی مثبت است. به طور کلی، انرژی یونش در جدول تناوبی از چپ به راست افزایش و از بالا به پایین کاهش پیدا میکند. البته این روند به دلیل پایداری اوربیتالهای نیمهپر، شامل استثناء نیز هست.
- الکترونخواهی: «الکترونخواهی» (Electron Affinity)، انرژی آزاد شده به هنگام اضافه کردن یک الکترون به اتم یا یون خنثی است. به طور معمول، انرژی آزاد شده مقداری منفی خواهد داشت اما به دلیل تعریف الکترونخواهی، مقدار آن را در جداول با عددی مثبت نشان میدهند. بنابراین، باید به یاد داشته باشیم که به هنگام محاسبه انرژی شبکه، مقدار الکترونخواهی را از عبارت مورد نظر کم کنیم. به طور کلی، الکترونخواهی در جدول تناوبی از چپ به راست افزایش و از بالا به پایین کاهش پیدا میکند.
- انرژی تفکیک: به انرژی مورد نیاز برای شکستن یک ترکیب «انرژی تفکیک» (Dissociation Energy) میگویند. تفکیک یک ترکیب همواره فرآیندی گرماگیر است به این معنی که به اعمال انرژی نیاز دارد. بنابراین، تغییرات انرژی همواره مقداری مثبت خواهد داشت. مقدار این انرژی به الکترونگاتیوی اتمهای شرکتکننده وابسته است.
- انرژی تصعید: انرژی مورد نیاز برای تغییر حالت مستقیم از جامد به گاز را «انرژی تصعید» (Sublimation Energy) مینامند. از آنجایی که در این فرآیند نیز به اعمال انرژی نیاز داریم، بنابراین، مقدار انرژی تصعید، عدد مثبتی است. به این انرژی، انرژی «اتمیزه شدن» (Atomization) نیز میگویند.
- گرمای تشکیل: به تغییرات انرژی به هنگام تشکیل یک ترکیب از عناصر سازنده خود میگویند. بسته به اتمهای شرکت کننده در ترکیب و نوع برهمکنش آنها، این انرژی میتواند مقداری مثبت یا منفی داشته باشد.
- قانون هس: این قانون بیان میکند که تغییرات کلی انرژی یک فرآیند را میتوان به کمک تقسیم آن به مراحل مختلف و اضافه کردن مقدار آن به هر مرحله، تعیین کرد. در حقیقت، چرخه بورن-هابر، نوعی قانون هس محسوب میشود که بر یک جامد یونی اعمال شده است.
بکارگیری چرخه بورن-هابر
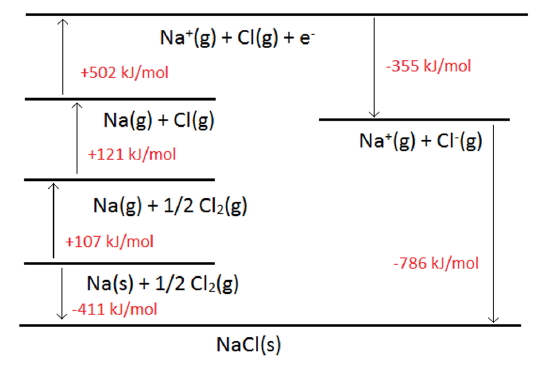
مقادیری که در چرخه بورن-هابر استفاده میشوند، تغییرات آنتالپی هستند. قانون هس نیز به ما برای اضافه و کم کردن این مقادیر کمک می کند و به کمک این موارد، میتوان انرژی شبکه را تعیین کرد. در این بخش میخواهیم به بررسی انرژی شبکه در واکنش زیر بپردازیم. انرژی شبکه را در این فرآیند به صورت نشان میدهیم:
در حقیقت، این فرآیند را میتوان به صورت نمودار نشان داد تا نحوه اضافه شدن هرکدام از موارد بالا قابل مشاهده باشد. دو مسیر برای تشکیل واکنش بالا قابل تصور است. در یک مسیر، جامد یونی به طور مستقیم از عناصر خود در حالت استاندارد تشکیل و به صورت تعریف میشود:
مسیر دیگر شامل مراحلی است که در طی این مراحل، عنصرها از حالت خنثی، به یونهایی در فاز گاز میرسند. این مراحل به طور خلاصه در جدول زیر آورده شدهاند.
| مرحله (انرژی) | واکنش | نماد |
| تصعید | ||
| یونش | ||
| تفکیک | ||
| الکترونخواهی | ||
| شبکه |
در نهایت، با جمع مقادیر بالا، به آنتالپی تشکیل سدیم کلرید میرسیم:
این فرآیند را میتوان به صورت نموداری مطابق با تصویر زیر نشان داد. در این نوع نمایش، از فلشها میتوان برای نشان دادن تغییرات گرماده یا گرماگیر استفاده کرد. این تصویر، نمونهای از چرخه بورن-هابر را برای NaCl نشان میدهد. در مسائل کاربردی به طور معمول، یک مرحله مجهول و بقیه معلوم هستند.
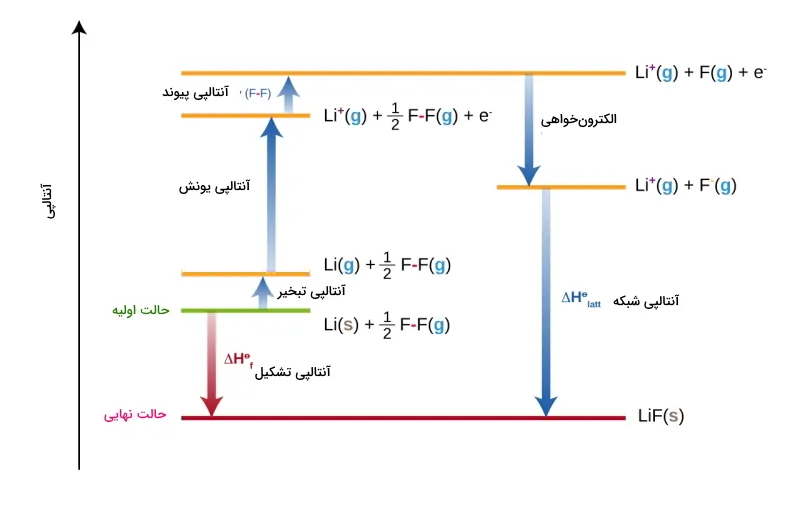
تشکیل LiF
در مثال زیر، آنتالپی تشکیل لیتیوم فلوراید را از عناصر سازنده آن در پنج مرحله توضیح دادهایم. این پنج مرحله عبارتند از:
- تغییر آنتالپی اتمیزه شدن لیتیوم
- آنتالپی یونش لیتیوم
- آنتالپی اتمیزه شدن فلوئور
- الکترونخواهی فلوئور
- آنتالپی شبکه
مجموع انرژیهای هر مرحله باید با آنتالپی تشکیل فلز و نافلز برابر باشد.
- : آنتالپی تصعید برای اتم فلزی (لیتیوم)
- : انرژی تفکیک (پیوند) برای . به ضریب در رابطه توجه داشته باشید چراکه رابطه اصلی واکنش به صورت زیر است:
- : انرژی یونش اتم فلزی
- : الکترونخواهی اتم نافلزی (فلوئور)
- : انرژی شبکه
آنتالپی تشکیل و چهار مورد از پنج مورد انرژی، به صورت آزمایشگاهی تعیین میشوند اما انرژی شبکه را نمیتوان به طور مستقیم اندازهگیری کرد و برای محاسبه آن، چهار انرژی دیگر را از آنتالپی تشکیل در چرخه بورن-هابر کم میکنیم.
عوامل موثر بر انرژی شبکه
در سال ۱۹۱۸، دو دانشمند با نامهای «ماکس بورن» (Max Born) و «آلفرد لانده» (Alfred Lande)، مدل ریاضی زیر را برای انرژی شبکه ارائه دادند:
- : ثابت آووگادرو
- : «ثابت مادلونگ» (Madelung Constant)، وابسته به هندسه بلور
- : عدد بار کاتیون
- : عدد بار آنیون
- : بار الکترون
- : عدد (نما) بورن. عددی بین ۵-12 که به صورت آزمایشگاهی و با اندازهگیری تراکمپذیری جامد تعیین میشود.
- : «گذردهی خلا» (Vacuum Permittivity) برابر با
- : فاصله تا نزدیکترین یون
این مدل، ۲ عامل اصلی بر انرژی شبکه را بیان میکند: بار روی یونها و شعاع آنها. تاثیر این عوامل را میتوان به صورت زیر توضیح داد:
- هرقدر بار یونها افزایش پیدا کنند، انرژی شبکه نیز افزایش پیدا میکند.
- با افزایش اندازه یونها، انرژی شبکه کاهش مییابد.

همچنین، انرژی شبکه اهمیت زیادی در پیشبینی انحلالپذیری جامدات یونی در آب دارد. ترکیبات یونی با انرژی شبکه کم، تمایل بیشتری برای حفظ حالت محلول در آب دارند. جدول زیر، مقادیر آزمایشگاهی و اندازهگیری شده انرژی شبکه را نشان میدهند:
| نام ترکیب | مقدار انرژی شبکه محاسبه شده | مقدار انرژی شبکه تعیین شده با روشهای آزمایشگاهی |
انرژی شبکه و آنتالپی شبکه
انرژی شبکه، گرماده است به این معنی که مقداری منفی دارد زیرا متناظر با تجمع یونهای گازی با فواصل بسیار زیاد برای تشکیل یک شبکه یونی در حالت خلا است در صورتیکه آنتالپی شبکه را به صورت مقداری مثبت گزارشدهی میکنند. برخی از منابع معمول در شیمی، انرژی شبکه را با علامت دیگری تعریف میکنند که این مطلب را در ابتدای بحث، به صورت دو تعریف مجزا ارائه دادیم.

اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- آلکان ها — از صفر تا صد
- گروههای جدول تناوبی — از صفر تا صد
^^













این فرمول هایی که بیان شده، برای دانشگاهه؟!
با سلام؛
از این روابط هم در دانشگاه و هم در دوره متوسطه بهره میگیرند. البته فرمول انتهای مطلب، مدلسازی تخصصی عوامل موثر بر انرژی شبکه است و بسته به سرفصل موردنظر، ممکن است در تدریس استفاده نشود.
با تشکر از همراهی شما با مجله فرادرس
چرا در تشکیل نمک با وجود اینکه سدیم و کلر از حالت گازی به جامد درمیان و ما شاهد کاهش آنتروپی هستیم ولی بازهم این واکنش در طبیعت انجام میشه