واکنش افزایشی – به زبان ساده
در شیمی آلی، یک واکنش افزایشی به واکنشی میگویند که در آن، دو مولکول یا بیشتر با یکدیگر ترکیب شوند و مولکولهایی بزرگتر را تشکیل دهند. واکنش افزایشی به ترکیبات شیمیایی محدود میشود که پیوندهایی چندگانه داشته باشند و از آنجمله میتوان به پیوند دوگانه کربن-کربن در آلکنها یا پیوند سهگانه در آلکینها اشاره کرد. مولکولهای شامل پیوند دوگانه در کربن-اکسیژن (کربونیل) یا پیوند کربن-نیتروژن (ایمین) نیز با توجه به دارا بودن پیوند دوگانه، در واکنش افزایشی شرکت میکنند.


مقدمه
معمولترین شکل تبدیل شیمیایی پیوند دوگانه کربن-کربن، واکنش افزایشی است. ریجنتهای آلی و معدنی بسیاری به این گروه عاملی اضافه میشوند و در این مطلب قصد داریم به چنین واکنشهایی بپردازیم. بیشتر این واکنشهای شیمیایی، گرماده هستند چراکه پیوند پای کربن-کربن، به طور نسبی، در مقایسه با پیوند سیگما تشکیل شده با اتمها یا گروههای ریجنت، پیوندی ضعیف به شمار میآید.
به خاطر داشته باشید که انرژی پیوند یک مولکول، به انرژی میگویند که برای شکستن تمامی پیوندهای کووالانسی در یک مولکول مورد نیاز است. در نتیجه، اگر انرژی پیوند مولکول فرآورده، بیشتر از انرژی واکنش دهندهها باشد، واکنش گرماده خواهیم داشت. در زیر، افزایش به یک آلکن را مشاهده میکنید.
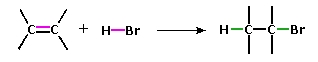
انواع واکنش افزایشی
به طور کلی، دو دسته واکنش افزایشی قطبی وجود دارند:
- واکنش افزایشی الکتروفیلی
- واکنش افزایشی نوکلئوفیلی
برای واکنشهای افزایشی ناقطبی نیز دو دسته واکنش وجود دارند:
- واکنش افزایشی رادیکال آزاد
- واکنش افزایشی «حلقهزایی» (Cycloaddition)
واکنش افزایشی الکتروفیلی
در واکنش افزایشی الکتروفیلی یا واکنش افزایشی الکترون دوستی، پیوند پای در اثر انجام واکنش شکسته میشود و پیوندهای جدید سیگما شکل میگیرند.

واکنش افزایشی نوکلئوفیلی
واکنش افزایشی نوکلئوفیلی واکنشی است که در آن، ترکیبی شیمیایی فقیر از الکترون یا یک پیوند پای، با یک هستهدوست غنی از الکترون واکنش میدهد. در اثر این اتفاق، پیوند پای از بین میرود و دو پیوند سیگما تشکیل میشوند.
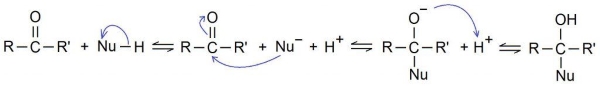
واکنش افزایشی رادیکال آزاد
واکنش افزایشی رادیکال آزاد به واکنش افزایشی میگویند که شامل رادیکال آزاد باشد و ممکن است بین یک رادیکال و غیر رادیکال، یا بین دو رادیکال انجام شود. واکنش رادیکال آزاد به ریجنتی با پیوند ضعیف وابسته است.
افزایش هیدروژن: هیدروژناسیون آلکنها
فرآیند افزایش هیدروژن به پیوند دوگانه کربن-کربن، «هیدروژناسیون» (Hydrogenation) نام دارد. نتیجه کلی چنین واکنش افزایشی در حقیقت، حذف کاهشی گروه عاملی (پیوند دوگانه) خواهد بود. در این فرآیند، مشکلی از بابت «جهتگزینی» (Regioselectivity) نخواهیم داشت چراکه به هر اتم کربن در پیوند دوگانه، گروهی از یک نوع (هیدروژن) متصل شده است. سادهترین منبع دو اتم هیدروژن، هیدروژن مولکولی خواهد بود اما با مخلوط کردن آلکنها و هیدروژن، واکنشی انجام نمیگیرد.
با وجود اینکه واکنش کلی هیدروژناسیون، از نوع گرماده است ولی انرژی فعالسازی بالای این واکنش، از انجام آن در شرایط معمول جلوگیری میکند. برای عبور از این محدودیت، لزوم بکارگیری کاتالیستها بیش از پیش روشن میشود. به طور مثال، اتن با هیدروژن و در حضور کاتالیزور پالادیوم و دمای ۱۵۰ درجه سانتیگراد، اتان تولید میکند. در تصویر زیر، فرآیندهای هیدروژناسیون اتن و سیکلوهگزن را مشاهده میکنید.
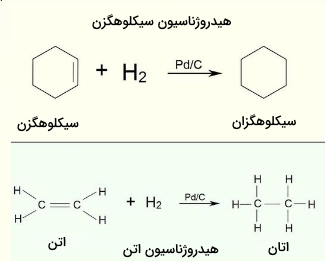
البته هیدروژناسیون اتن، واکنش محبوبی به شمار نمیآید زیرا ترکیب اتن، کابرد بسیار بیشتری نسبت به اتان دارد. با این وجود، آنچه که در این واکنش افزایشی رخ میدهد، روندی مشابه با نمونههای بسیار پیچیدهتر دارد.
افزایش هیدروژن هالیدها به آلکنها
تمامی آلکنها با هیدروژن هالیدها در واکنش افزایشی شرکت میکنند. یک اتم هیدروژن به یکی از اتمهای کربن پیوند دوگانه متصل و به کربن دیگر، یک هالوژن متصل میشود.
به طور مثال، در واکنش اتن و هیدروژنکلرید، کلرواتان تولید میشود.
همچنین، اگر این واکنش با ۲-بوتن انجام شود، ۳-کلروبوتان خواهیم داشت.
![]()
چه اتفاقی میافتد اگر هیدروژن، به سمت راست پیوند دوگانه و کلر به سمت چپ پیوند دوگانه اضافه شود؟ همچنان همان فرآورده قبل به تولید میرسد. اتم کلر، به کربن کنار زنجیره انتهایی متصل خواهد شد و به عبارت سادهتر، مولکول در فضا، معکوس میشود. درصورتیکه آلکنی متقارن نداشته باشیم، باید به شکل دیگری، مولکول را بررسی کنیم.
سرعت واکنش هیدروژن هالیدها، روندی به شکل زیر دارد:
هیدروژن فلوراید نسبت به سایر ترکیبات، با سرعت کمتری در واکنش شرکت میکند و به طور معمول، به هنگام بررسی این نوع از واکنشها در نظر گرفته نمیشود. زمانیکه هیدروژن هالیدها با آلکنها واکنش دهند، پیوند هیدروژن-هالوژن باید شکسته شود. قدرت پیوند نیز از به کاهش پیدا میکند و به همین دلیل، پیوند هیدروژن-فلوئور، پیوندی قوی به شمار میآید. از آنجایی که شکست پیوند بین هیدروژن و فلوئور دشوار است، واکنش افزایشی با ، به آهستگی انجام میگیرد.
این اتفاق، به طور مشابه برای آلکنهای غیرمتقارن نیز صورت میگیرد. برای سادگی درک مطلب، مثالهای ارائه شده به صورت متقارن هستند اما لزومی به وجود تقارن نیست. هرقدر آلکن پیچیدهتری داشته باشیم، سرعت واکنش نیز افزایش پیدا میکند. به عبارت دیگر، اگر تعداد گروههای آلکیل (همچون متیل) متصل به اتم کربن، افزایش پیدا کنند، سرعت واکنش بیشتر میشود.
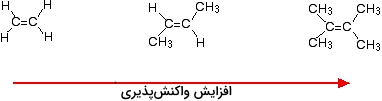
دو راه برای بررسی این حالت وجود دارد که در هرکدام باید با مکانیسم واکنش آشنا باشیم. واکنشپذیری آلکنها به دلیل وجود پیوند پای و جذب ذرات باردارِ مثبت است. هر موردی که سبب افزایش چگالی الکترونی اطراف پیوند دوگانه باشد، به این موضوع کمک میکند. گروههای آلکیل نیز تمایل دارند تا الکترونها را از خود دور و به طرف پیوند دوگانه هدایت کنند.
هرقدر تعداد گروههای آلکیل بیشتری داشته باشیم، محدوده منفیتری در اطراف پیوند دوگانه ایجاد میشود. به همین ترتیب، هر اندازه که محدوده باردار منفی ما بیشتر باشد، مولکولهایی همچون هیدروژن کلرید جذب میشوند. دلیل اصلی و مهمتر این حالت را باید در پایداری ماده واسط تشکیل شده در طول واکنش بررسی کرد. مثالهایی که در تصویر بالا ارائه شدند، در میانه واکنش، کربوکاتیونهایی به شکل زیر تولید میکنند:
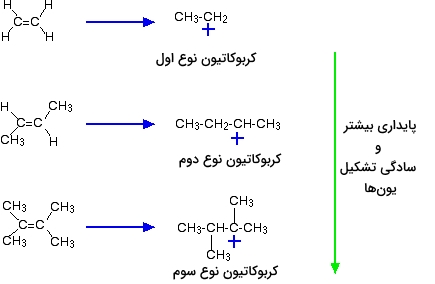
پایداری کربوکاتیونهای ایجاد شده، انرژی اکتیواسیون واکنش را کنترل میکند. هر قدر آلکن پیچیدهتری داشته باشیم، انرژی اکتیواسیون واکنش، کاهش مییابد و به همین دلیل، واکنش با سرعت بیشتری انجام میگیرد.
واکنش افزایشی آلکنهای نامتقارن
در بیان شرایط واکنش و عوامل تاثیرگذار بر سرعت واکنش، تفاوتی بین آلکن متقارن یا نامتقارن وجود ندارد. مشکلی که در اینجا مطرح میشود، با «جهت» (Orientation) واکنش افزایشی ارتباط دارد. اگر هیدروژن، به آلکنی نامتقارن همچون پروپن اضافه شود، دو حالت محتمل برای انجام واکنش افزایشی وجود دارد اما در عمل، تنها یک فرآورده به طور معمول تولید میشود که این مورد در تطابق با «قانون مارکونیکوف» (Markovnikov's Rule) است.

قانون مارکونیکوف
زمانیکه ترکیبی همچون به آلکنی نامتقارن اضافه شود، هیدروژن به اتم کربنی متصل میشود که هیدروژنِ متصل بیشتری داشته باشد.
در مثال بالا، هیدروژن به متصل میشود چراکه گروه ، هیدروژن بیشتری نسبت به گروه دارد. توجه داشته باشید که در این قانون، تنها هیدروژنهای متصل به کربن با پیوند دوگانه را در نظر میگیریم یعنی در مثال بالا، هیدروژن متصل به در نظر گرفته نمیشود.
افزایش هالوژنها: هالوژناسیون آلکنها
زمانیکه یک مولکول هالوژن همچون به پیوند دوگانه یک آلکن نزدیک میشود، الکترونهای پیوند دوگانه، الکترونهای مولکول هالوژن را دفع میکنند و سبب قطبیدگی پیوند هالوژن میشوند. در اثر این اتفاق، گشتاور دوقطبی (ممان دوقطبی) در پیوند مولکول هالوژن ایجاد میشود و «گسست ناجور پیوند» (Heterolytic Bond Cleavage) خواهیم داشت که یکی از هالوژنها بار مثبت پیدا میکند و به صورت یک الکتروفیل (الکتروندوست) وارد واکنش میشود.
واکنش افزایشی به صورت جهتگزین انجام نمیگیرد اما باید «فضاگزینی» (Stereoselectivity) را برای آن در نظر گرفت. شیمی فضایی این نوع از واکنشهای افزایشی را میتوان به کمک مکانیسم واکنش توضیح داد. در مرحله اول، هالوژن الکتروفیل با بار مثبت به پیوند دوگانه کربن نزدیک میشود و با دو اتم کربن پیوند تشکیل میدهد و یونی حلقوی را ایجاد میکند.
در مرحله دوم هالوژن با بار منفی به یکی از دو اتم کربن در یون حلقوی حمله میکند و مکانیسم خواهیم داشت. فرآورده «ویسینال دیهالید» (Vicinal Dihalides) از طریق واکنش افزایش «Anti» ایجاد میشود.
هالوژنهای برم و کلر به طور معمول در این نوع از واکنشها بکار گرفته میشوند. از نگاه ترمودینامیکی، برای این واکنش، ید به دلیل اندازه اتمی، بسیار آهسته و فلوئور بسیار انفجاری و شدید خواهد بود. حلالهایی که برای این نوع از واکنشهای هالوژناسیون الکتروفیلی استفاده میشوند، حلالهایی خنثی همچون هستند. از آنجایی که هالوژنها با بار منفی میتوانند به اتم کربن از روبرو نیز حمله کنند، مخلوطی فضایی ایجاد میکنند.














سلام.درواکنش با هالوژن در مورد برم از کاتالیزور استفاده نمیکنیم ولی در مورد کلر از آهن سه کلرید به عنوان کاتالیزور استفاده میکنیم با این شرایط باز هم سرعت واکنش کلر از واکنش با برم بیشتر؟